Introducción
La cystoisosporosis porcina es una enfermedad causada por Cystoisospora suis, un protozoario con distribución cosmopolita, y que se encuentra en cerdos mantenidos en confinamiento. Los animales que se infectan desarrollan una diarrea amarillenta a partir de la segunda semana de edad, y su prevalencia es muy variada1. La epidemiología de C. suis aún es confusa y se piensa que las cerdas madres pueden jugar un papel importante en la transmisión; sin embargo, algunos investigadores no encontraron cerdas excretando ooquistes, concluyendo que el medio ambiente es la fuente de infección para los lechones1,2. Otros autores señalaron excreción de ooquistes de C. suis en cerdas madres3,4,5, y en lechones destetados6, concluyendo que cerdas madres y lechones de iniciación podrían jugar un rol en la transmisión del parásito.
Con respecto a la prevalencia, en Australia, se determinó 53.8 % de prevalencia en lechones lactantes diarreicos con edades entre 5 y 30 días7, mientras que en EE.UU, señalaron que todas las granjas examinadas estaban contaminadas, con una prevalencia de 62.2 % en lechones lactantes8. En Alemania, se reportó 42.5 % de prevalencia en camadas9, mientras que en la república Checa se señaló 21.8 % de prevalencia10. En Venezuela, se determinó 21.8 % de prevalencia en lechones criados en granjas de los estados Aragua y Carabobo, posteriormente, demostraron 75 % de prevalencia en granjas con manejos eficientes y deficientes, concluyendo que el parásito se presentó en cualquier tipo de explotación11.
El número de partos juega un rol importante sobre el sistema inmune de la cerda, ya que se ha demostrado disminución de anticuerpos contra ciertas infecciones12,13, sobre todo en primerizas, las cuales se pueden ver inmunocomprometidas por efecto del parto y lactancia14,15.
La región central de Venezuela cuenta con más del 70 % del total de granjas intensivas del país y alrededor de 80 mil cerdas en producción, representando 53 % del total de vientres en Venezuela, lo que hace esta región representativa de la producción porcícola nacional16. Por lo tanto se planteó como objetivo del presente trabajo determinar el comportamiento epidemiológico de Cystoisospora suis en granjas porcinas de producción intensiva de la región central de Venezuela.
Material y métodos
Ubicación geográfica del estudio
Las granjas examinadas se encuentran localizadas en la región central de Venezuela, específicamente en los estados Aragua y Carabobo. Las características climatológicas de la región son consideradas como de clima tropical, con registros pluviométricos anuales entre 500 y 1,450 mm, temperaturas medias anuales entre 24.5 y 27 ºC con 70 % de humedad relativa. Los estados están situados entre 600 y 2,400 msnm17.
Selección de las granjas
Se incluyeron únicamente explotaciones porcinas intensivas, con tamaño igual o mayor a 100 vientres en producción, lo que supone una sólida actividad económica de las mismas18. La mayoría de las granjas examinadas presentaban pobres condiciones higiénico - sanitarias y antecedentes de diarrea neonatal. El tipo de animal observado pertenece a mestizos de líneas mejoradoras, con alimentación a base de raciones balanceadas, las cuales son formuladas en plantas de alimentos próximas a las unidades de producción.
Diseño del muestreo
La investigación realizada es de tipo descriptiva y de corte transversal. Para el estudio se diseñó un muestreo aleatorio en dos etapas por conglomerados19, empleando los registros de censos por cinos existentes en el Departamento de Epidemiología del Servicio Autónomo de Sanidad Agropecuaria20. En la primera etapa del muestreo, se seleccionaron 40 % de los municipios de cada estado, los cuales se escogieron al azar utilizando una tabla de números aleatorios. En los municipios seleccionados se visitaron todas las granjas intensivas. Así, en Aragua se visitaron 43 granjas que representan el 60 % del total de explotaciones intensivas del Estado, sin embargo, solamente se examinaron 32 granjas (73.6 %), ya que al momento de la visita no permitieron el ingreso en 11 explotaciones por motivos sanitarios. En el caso de Carabobo se visitaron 45 granjas (58.9 %); sin embargo, 10 granjas fueron excluidas por motivos de bioseguridad, para una proporción de 77.77 % (35 de 45) de explotaciones examinadas. En total se examinaron 67 granjas porcinas intensivas: 32 granjas en el estado Aragua y 35 en el estado Carabobo, de un total de 145 granjas (46.2 % del total de explotaciones de la región central de Venezuela).
En la segunda etapa del muestreo, se tomaron las muestras en cada granja de manera pro porcional al total de camadas y cerdos adultos existentes en cada una19. Para determinar el tamaño de la muestra se empleó la fórmula descrita por Morales y Pino21, n= Z2 (p). (q) / EMA2, y utilizando una prevalencia conocida de 38.9 %6, con 95% de nivel de confian za y un error máximo asociado (EMA) de 5%21 se determinó un total de 370 muestras, sin embargo, se decidió fijar el tamaño total en 2,284 muestras, ya que se contaba con suficientes recursos y logística para la colección, envío y procesamiento de las muestras.
Toma de la muestra fecal
En primer lugar se seleccionaron de forma aleatoria un total de 572 camadas de diferentes edades con signos de diarrea: en Aragua (n= 283) y Carabobo (n= 289). De cada camada se tomaron aleatoriamente de 4 a 5 lechones con la finalidad de realizar un “agrupamiento” de muestra en cada camada (unidad de muestreo). A cada lechón se le introdujo un hisopo por vía rectal con el propósito de estimular la defecación y colectar las heces en tubos de ensayo previamente identificados. En segundo lugar, se colectaron 1,712 muestras fecales en otros grupos de edad, estratificadas y distribuidas proporcionalmente en cada explotación de acuerdo al inventario de animales19. A las cerdas lactantes, gestantes, reemplazos y verracos se les tomó la muestra fecal directamente de la ampolla rectal. En grupos de lechones de iniciación, crecimiento y engorde se tomó una pequeña porción (10 g) recién depuesta directamente del piso en cinco puntos del corral, con la finalidad de hacer un pool de muestra en cada corral. Las muestras se estratificaron de la siguiente manera: corrales de lechones en iniciación (n= 268 agrupamientos), corrales de lechones en crecimiento (n= 172 agrupamientos), corrales de lechones en engorde (n= 137 agrupamientos), cerdas de reemplazo (n= 48), madres gestantes en edad de gestación avanzada (n= 252), madres lactantes de las camadas examinadas (n= 572) y machos reproductores (n= 263). En una planilla de campo se registró la edad de la camada, consistencia de las heces, número de partos de la cerda y grupos de producción, como variables asociadas a la frecuencia. Todas las muestras se colectaron en bolsas plásticas previamente identificadas y se introdujeron en una cava refrigerada para ser trasladadas a la Unidad de Investigación en Parasitología de la Facultad de Agronomía de la Universidad “Rómulo Gallegos”, donde fueron conservadas en refrigeración hasta su procesamiento.
Análisis copro-parasitológico
Las muestras se cultivaron a temperatura ambiente en cápsulas de Petri utilizando 20 ml de una solución de dicromato de potasio al 2.5% durante 24 h (agrupamiento de cada camada), y de dos semanas para el resto de grupos, de manera que exista suficiente tiempo para la esporulación de ooquistes22. Transcurrido ese tiempo, se empleó una técnica de centrifugación - flotación empleando una solución de azúcar - sal (1 L de solución saturada de NaCl más 500 g de azúcar)23. La visualización e identificación de ooquistes se hizo con un microscopio binocular, usando magnificación de 10 y 40X.
Análisis estadísticos
Los resultados obtenidos se analizaron mediante estadísticos descriptivos y test de Ji-cuadrada (X2) para determinar asociacio nes estadísticas entre valores positivos con respecto a la prevalencia. Se utilizó el coeficiente con rangos de Spearman (rho) para de terminar correlaciones entre prevalencia y grupos productivos, y la prueba exacta de Fisher para establecer comparaciones entre valores de prevalencia en edad de las camadas y grupos de cerdos en iniciación. El nivel de significancia para los análisis fue de 5%. Para los cálculos se utilizó el programa estadístico Statistix24.
Resultados y discusión
Se encontró C. suis en 55 de 67 granjas examinadas (82.1 %) con niveles similares de prevalencia entre los dos estados, lo cual reflejó una alta presencia del parásito en las granjas examinadas; sin embargo, no se encontró asociación estadística (P>0.05) entre los valores de prevalencia del parásito con respecto a los dos Estados: 81.3 % (26/32) en el estado Aragua y 82.9 % (29/35) en Carabobo. Estos resultados coinciden con lo señalado por otros autores5, quienes encontraron 93.3 % de prevalencia en granjas de la región centro - occidental de Venezuela, mientras 75 % en granjas de la región central6,11. Al referirlo a los lechones, se determinó 36.7 % de prevalencia (210/572). Estos resultados coinciden con lo señalado en otros estudios5,6,11, donde determinaron valores de prevalencia similares en lechones lactantes, y podría deberse a la falta de programas de higiene y desinfección de las unidades de parición. Sin embargo, estos resultados difieren con lo señalado por Driesen et al7 y Otten et al8, quienes señalaron mayores valores de prevalencia en camadas.
En el Cuadro 1 se muestra la comparación entre los valores de frecuencia de Cystoisospora suis por grupo de edad de las camadas muestreadas. De acuerdo a estos resultados, se encontraron diferencias entre los cuatro grupos examinados (P<0.05), mostrando mayor frecuencia en camadas de 1 a 7 y 8 a 14 días de edad. Estos resultados coinciden con lo reportado en otras investigaciones6,10, donde señalaron mayores valores de prevalencia en camadas de dos semanas de edad. Posiblemente, la contaminación del paritorio en estas granjas provoca una elevada presión de infección, lo que trae como consecuencia que los animales se infecten en sus primeros días de vida. Sin embargo, existen evidencias que indican mayores tasas de frecuencia en lechones de tres y cuatro semanas de edad8,9.
Cuadro 1: Frecuencia de Cystoisospora suis por grupo de edad de las camadas muestreadas
| Edad (días) | Positivas | Total | Frecuencia (%) |
|---|---|---|---|
| 1 a 7 | 55 | 138 | 9.6 a |
| 8 a 14 | 107 | 249 | 18.7 a |
| 15 a 21 | 32 | 138 | 5.5 b |
| > 21 | 16 | 47 | 2.9 b |
| Total | 210 | 572 | 36.7 |
ab Valores con diferente superíndice difieren significativamente (P<0.05).
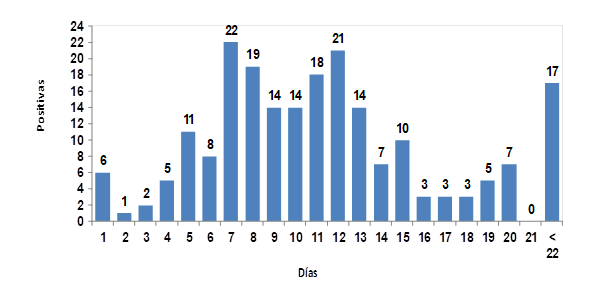
En la Figura 1 se muestra la distribución de frecuencia de muestras positivas en camadas con menos de 7 días de vida. De un total de 55 muestras positivas, nueve muestras pertenecían a camadas menores a tres días de edad, para una frecuencia acumulada de 16.3 %. Igualmente, se determinaron seis camadas (10.9 %) con menos de 24 h de nacidas excretando ooquistes, lo que representa un resultado importante en el comportamiento epidemiológico del parásito. El período prepatente de C. suis es de cuatro días1, por lo tanto, la presencia de ooquistes en camadas menores a tres días de edad podría deberse a varias razones. En primer lugar, el cultivo fecal en solución de dicromato de potasio confirma la presencia de ooquistes de C. suis, ya que la esporulación (100 %) permite diferenciar con respecto a ooquistes de Eimeria spp. En segundo lugar, se podría pensar en la presencia de ooquistes en tránsito intestinal, o bien, que estos lechones recién nacidos se hayan contaminado con heces de camadas previas, de la madre, o de las tetas de la cerda. Sin embargo, esta hipótesis se descarta, ya que tendrían que haber esporulado para poder resistir la temperatura y humedad del paritorio, además, en el caso que la contaminación fuese del ambiente, ooquistes no esporulados en tránsito intestinal no serían capaces de sobrevivir debido a la acción de ácidos y enzimas digestivas. Otra respuesta a este hallazgo sería la existencia de alguna ruta alternativa de infección, probablemente por la existencia de formas evolutivas extra - intestinales, en el que cerdas madres puedan transferir formas evolutivas del protozoario a los lechones, sin embargo, esta hipótesis aún está en discusión25,26.
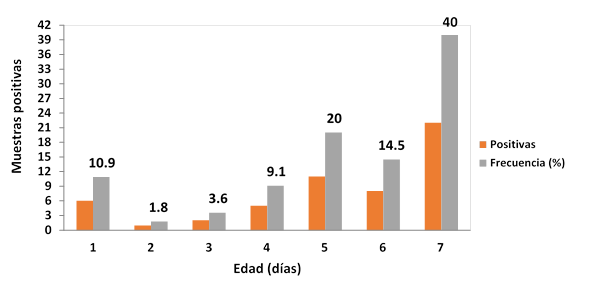
Figura 1 Distribución de frecuencia de muestras positivas a Cystoisospora suis en los primeros 7 días de vida
Algunos investigadores han señalado la posibilidad de la existencia de formas evolutivas en hígado y tejidos linfoides (bazo y ganglios), tomando en consideración la presencia de brotes clínicos de coccidiosis neonatal en granjas con buenas medidas sanitarias26; sin embargo, existen estudios que no comprobaron la existencia de formas evolutivas extra - intestinales en lechones y ratones inoculados experimentalmente con C. suis1. La presencia de formas evolutivas extra - intestinales ha sido comprobada para especies de Cystoisospora en caninos y felinos1,27, así como C. belli en humanos1. Probablemente merozoítos, en vez de continuar con su ciclo normal de desarrollo en el tracto intestinal, dejan el intestino y se diseminan por vía linfática para invadir linfonódulos mesentéricos, así como otros órganos del sistema retículo endotelial1, y especialmente en pacientes inmuno - suprimidos. Por otra parte, la falta de cuerpo de Stieda en los esporoquistes de C. suis sugieren la ocurrencia de formas extra - intestinales en el ciclo de vida del protozoario, tal y como sucede con el grupo de Cystoisosporas que afectan a perros y gatos27. Se podría pensar que cerdas gestantes mantenidas en granjas con pobres condiciones sanitarias y estados de inmuno - supresión ocasionados por efecto del estrés, así como por infecciones como el síndrome respiratorio y reproductivo porcino (PRRS) y circovirus porcino tipo 2 (CPV tipo II), albergan formas evolutivas de C. suis en tejidos extra - intestinales, y de esta manera viajar por vía linfo - hematógena (transplacentaria) e infectar a sus fetos. En el momento del nacimiento, los lechones se infectan por vía transplacentaria y actuarían como agentes multiplicadores y diseminadores del parásito al resto de las camadas.
En la Figura 2 se observa la dinámica de excreción de ooquistes en camadas, y se muestra la formación de una curva trifásica con tres picos de excreción: un primer pico a los 7 días de edad, un segundo y tercer pico de excreción a los 12 y 21 días, respectivamente. Estos resultados difieren con lo señalado por algunos autores, quienes señalaron que en lechones inoculados experimentalmente el ciclo de desarrollo de C. suis es bifásico, con la formación de dos picos de excreción e interrupción en la excreción durante dos o tres días entre el primero y segundo período de eliminación1,28. La presencia de un segundo pico de excreción de ooquistes es causada por un segundo ciclo interno de desarrollo del protozoario (segunda esquizogonia); sin embargo, hay autores que postularon que este segundo pico se debe al retorno de formas extra - intestinales hasta el tracto intestinal, hipótesis que aún no ha sido comprobada28. Existen reportes que demuestran un tercer pico de excreción de ooquistes en lechones experimentalmente infectados29. El tercer pico de excreción refleja un retraso en la resistencia inmunológica contra el parásito, resultado de una pobre estimulación antigénica, e incluso, esto podría explicar el retorno en la excreción de ooquistes en cerdos de 5 a 6 semanas de edad cuando son trasladados a otra unidad de producción o corral, que teóricamente se ven afectados por el estrés causado por el destete.
En la Figura 3 se muestra la frecuencia a C. suis en camadas provenientes de cerdas con diferente número de partos. Los resultados obtenidos se analizaron mediante una prueba de correlación con rangos de Spearman, indicando que a mayor número de partos, menor es la frecuencia en camadas (rho= - 0.77; P<0.05). El efecto del número de partos sobre la frecuencia de C. suis ha sido señalado en otros estudios6; sin embargo, no se demostraron diferencias estadísticas entre valores de frecuencia a C. suis en camadas provenientes de cerdas con diferente número de partos3. El número de partos de la cerda parece ser un factor de riesgo importante que puede afectar el desempeño productivo en las salas de parto, y por eso en muchas empresas porcinas se busca mantener cierta uniformidad en esta variable. Se ha señalado que las cerdas adquieren mejor status inmunitario en la medida que se hacen viejas y esto ha sido comprobado para Micoplasma hyopneumoniae12; así mismo, se han comprobado diferencias estadísticas respecto a infecciones por Haemophilus parasuis en cerdas con diferente número de partos13. Probablemente, los lechones que se crían con cerdas primerizas no reciben la cantidad y calidad de anticuerpos calostrales para combatir infecciones por C. suis, mientras que aquéllos que se crían con cerdas adultas con sistemas inmunológicos más desarrollados, reciben anticuerpos necesarios que permiten al lechón adquirir una mejor inmunidad pasiva y combatir infecciones por C. suis.
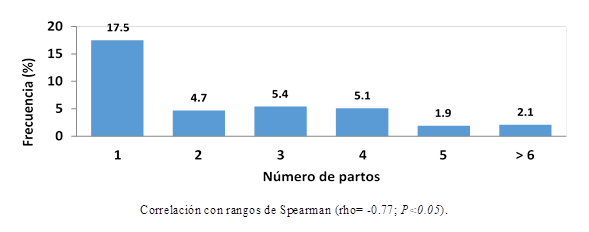
Figura 3: Valores de frecuencia a C. suis en camadas provenientes de cerdas con diferente número de partos
Los lechones neonatos tienen un sistema inmune inmaduro, y la transferencia calostral de células inmunes y anticuerpos es esencial para controlar las infecciones a esa edad; sin embargo, se ha demostrado que los anticuerpos calostrales no protegen contra la enfermedad30,31,32. Algunos autores demostraron la transferencia de células inmunes y anticuerpos específicos contra C. suis a través del calostro, pero estos anticuerpos no proporcionaron protección contra la manifestación clínica de la enfermedad30,31,32. Por otro lado, la inmunidad mediada por células juega un rol muy importante en la resistencia a la enfermedad en los lechones33; sin embargo, cerdas primerizas con bajo estatus inmunológico no son capaces de transferir a sus hijos los elementos necesarios para el desarrollo de mecanismos de respuesta no específicos (activación de complemento, fagocitosis y citoquinas), lo que significa, que los lechones viven sus primeras semanas de vida con un sistema inmune vulnerable, y por tanto no son capaces de contrarrestar la infección.
En cerdas primíparas, la falta de una continua estimulación antigénica pudiera ser un factor que hace vulnerable a sus crías contra la infección por C. suis, a diferencia de cerdas multíparas que han estado en mayor contacto con el protozoario, y por tanto han desarrollado un sistema inmunológico capaz de inducir una mejor respuesta en lechones lactantes. Probablemente, la respuesta inmune ante infecciones primarias (inmunidad innata) en lechones de cerdas primíparas sea muy baja; sin embargo, en la medida que el lechón va creciendo, se activan los mecanismos de inmunidad adaptativa capaces de contrarrestar la infección.
Con respecto a la presencia del protozoario según la consistencia de las muestras, se encontraron diferentes grados de positividad, lo que refleja que hubo asociación estadística (P<0.05) con respecto a la consistencia. Aunque hubo excreción de ooquistes en los tres tipos de consistencia, se observó una frecuencia de 64.8 % en heces de consistencia semipastosa y pastosa. Estos resultados coinciden con lo señalado por otros autores, quienes indicaron mayor frecuencia de C. suis en muestras de consistencia cremosa, que aquellas líquidas3,6. Existen estudios que indican mayor frecuencia del parásito en muestras acuosas (35.2 %), y menor frecuencia en muestras de consistencia pastosa34. La diarrea en lechones se explica, por la acción patógena que causa el parásito en el epitelio intestinal en el transcurso de las diferentes etapas que se cumplen en la fase endógena del ciclo de vida. Durante la esquizogonia se produce diarrea debido a la invasión y multiplicación del parásito dentro de la célula epitelial, sin embargo, la producción de ooquistes es muy baja. En la medida que avanza la infección la diarrea va cediendo, y la consistencia del excremento comienza a hacerse pastosa, e incluso normal, hasta que se cumpla el ciclo de vida del parásito con la debida producción de ooquistes. De acuerdo a esto, es improbable conseguir animales excretando ooquistes y con producción de heces liquidas, por lo que habría que considerar otros copatógenos como E. coli, Rotavirus y Cryptosporidium.
Con respecto a los resultados en cerdos adultos, se determinó que todos los grupos evaluados presentaron excreción de ooquistes, con excepción de las cerdas de reemplazo (Cuadro 2). Los resultados obtenidos se analizaron mediante una prueba de correlación con rangos de Spearman, el cual no arrojó correlación estadística (rho = 0.03; P>0.05), lo que indica que la edad y la frecuencia a C. suis en cerdos adultos actúan de manera independiente. Las cerdas lactantes y machos reproductores mostraron 9.4 y 4.9 % de frecuencia a C. suis, respectivamente, con valores muy similares entre los dos estados. Los hallazgos en cerdas madres difieren con lo señalado por otros autores, quienes no encontraron la infección en cerdas madres, por tanto, concluyen que las cerdas no juegan ningún rol en la cadena de transmisión del parásito1,2. Sin embargo, existen evidencias de infección en cerdas madres3,4,5. La baja presencia de ooquistes de C. suis en excremento de madres y verracos, demuestra que estos grupos pueden excretar cantidades de ooquistes que no son detectables con las pruebas convencionales; sin embargo, esas cantidades bajas de ooquistes pueden tornarse infectivas y diseminarse por toda la paridera, sobre todo cuando existen problemas higiénico - sanitarios y de manejo. Por tal motivo, las cerdas podrían jugar un papel importante en la cadena de transmisión, bien sea por un parasitismo activo no determinado, o por transporte pasivo de ooquistes a sus lechones. Con relación a cerdos después del destete, se determinó excreción de ooquistes en las tres etapas, con especial significancia en iniciación (23.8 %). Posiblemente, lechones destetados y mantenidos en corrales próximos al área de maternidad pueden actuar como fuentes diseminadoras del parásito, sobre todo en aquellas granjas donde no aplican programas de higiene y desinfección de instalaciones.
Cuadro 2: Frecuencia de Cystoisospora suis en grupos de cerdos adultos de la región central de Venezuela
| Grupos | Aragua | Carabobo | Total |
|---|---|---|---|
| Iniciación | 25.1 | 22.5 | 23.8 |
| Crecimiento | 2.2 | 4.7 | 3.4 |
| Engorde | 3.3 | 3.8 | 3.6 |
| Reemplazos | 0 | 0 | 0 |
| Gestantes | 4.1 | 6 | 5.1 |
| Lactantes | 8.8 | 10 | 9.4 |
| Verracos | 4.6 | 5.1 | 4.9 |
Coeficiente de correlación con rangos de Spearman (rho= 0.03), P>0.05.
Al aumentar el número de partos, disminuye la frecuencia en madres (Cuadro 3). Según estos resultados existe asociación estadística, y se observa mayor infección en cerdas primerizas, probablemente debido a factores inmunológicos involucrados. Probablemente, las cerdas durante su crecimiento mantienen y esconden formas evolutivas intra y extra - intestinales del protozoario34, y cuando llega el primer parto comienzan a excretar cantidades suficientes de ooquistes que son detectados por medio de técnicas de concentración - flotación; sin embargo, en la medida que avanzan en edad, sus sistemas inmunológicos se desarrollan hasta el punto de contrarrestar la infección y por tal motivo disminuye la cantidad de ooquistes, los cuales no son detectables por técnicas convencionales de flotación. También se podría pensar que cerdas primerizas se tornan más vulnerables que cerdas viejas a los cambios ocurridos en el traslado a la sala de partos, ruidos, personal y eventos del primer parto, ocasionando un gran estrés a estos animales que pudieran alterar su sistema inmunológico y de esta manera iniciar la excreción de ooquistes de C. suis, y actuar como posibles fuentes de infección. Se ha señalado que los nuevos eventos y cambios que ocurren en el parto de las cerdas (dolor, nerviosismo) son fuente principal de estrés, sobre todo en cerdas primíparas, las cuales también se pueden ver inmunocomprometidas por efecto de la lactancia13,14,15.
Cuadro 3: Frecuencia a Cystoisospora suis en cerdas lactantes de acuerdo al número de partos
| Partos | Positivas | Total | Frecuencia (%) |
|---|---|---|---|
| 1 | 37 | 173 | 6.5 |
| 2 | 7 | 106 | 1.2 |
| 3 | 5 | 117 | 0.9 |
| 4 | 4 | 83 | 0.7 |
| 5 | 1 | 44 | 0.2 |
| > 6 | 0 | 49 | 0 |
| Total | 54 | 572 | 9.4 |
Coeficiente de correlación con rangos de Spearman (rho= - 0.98).
En el Cuadro 4 se muestra la comparación entre valores de frecuencia a C. suis en lechones de diferentes semanas de producción. Según estos resultados existen diferencias (P<0,05) en los seis grupos examinados, los animales con cuatro y cinco semanas de edad mostraron mayores valores de infección (frecuencia acumulada de 16 %). El destete de los cerdos ha sido señalado como el momento de mayor estrés en la etapa productiva del animal, y el estrés ocasionado por el destete se ha asociado con la excreción de ooquistes de C. suis en cerdos de cinco y seis semanas de edad35,36. Indudablemente, la respuesta inmune del lechón ante cualquier agente patógeno puede verse comprometida por situaciones de manejo que desencadenen estrés. Existen suficientes evidencias que señalan que el estrés tiene efectos sobre el sistema inmune del cerdo. En tal sentido, se ha comprobado que el estrés aumenta los niveles sanguíneos de corticosteroides, especialmente cortisol, pudiendo reducir la proliferación de linfocitos, así como el tamaño de los linfonódulos y, por consiguiente, disminución del número de anticuerpos producidos35,36. Esta alteración en los mecanismos inmunes del lechón podría jugar un papel importante en la aparición de ooquistes en cerdos jóvenes; sin embargo, se desconoce el papel que juegan las cerdas madres en la respuesta inmune del lechón.
Cuadro 4: Frecuencia a Cystoisospora suis en cerdos de iniciación de diferentes semanas de edad
| Semana | Positivos | Total | Frecuencia (%) |
|---|---|---|---|
| 4 | 21 | 63 | 7.8 a |
| 5 | 22 | 69 | 8.2 a |
| 6 | 9 | 62 | 3.4 b |
| 7 | 3 | 32 | 1.1 c |
| 8 | 7 | 34 | 2.6 b |
| 9 | 2 | 8 | 0.7 c |
| Total | 64 | 268 | 23.9 |
ab Valores con diferente superíndice difieren significativamente (P<0.05).
Conclusiones e implicaciones
Existe una amplia distribución y frecuencia del protozoario en granjas porcinas ubicadas en la región central de Venezuela, que pudieran ser controladas al mejorarse las condiciones higiénico - sanitarias de las explotaciones. Se determinó infección en cerdas madres y lechones en iniciación, lo que supone que estos grupos podrían actuar como fuentes de infección y diseminación del parásito. La presencia de ooquistes en muestras de camadas menores a tres días de edad, representa un hallazgo importante en el comportamiento epidemiológico del parásito, que presupone la existencia de alguna ruta alternativa de la infección. El número de partos de la cerda tuvo impacto sobre la frecuencia del protozoario en la población muestreada. Probablemente estos hallazgos se asocian con mecanismos inmunológicos desconocidos.











 nova página do texto(beta)
nova página do texto(beta)