La tuberculosis bovina (TBB) es una enfermedad transmisible y crónica, caracterizada por la formación de lesiones granulomatosas causada por Mycobacterium bovis1. Ésta es una de las enfermedades más importantes en la industria pecuaria al ocasionar graves pérdidas económicas, y representar una barrera para la comercialización del ganado y sus subproductos; además de constituir un riesgo para la salud humana2. La incidencia actual de la infección por M. bovis en humanos es subestimada3, pero se cree que el número de casos de tuberculosis en humanos asociada a M. bovis es del 3 al 13 %4. No obstante, algunos reportes muestran porcentajes mayores; por ejemplo, en un análisis retrospectivo de casos de tuberculosis en una comunidad binacional en San Diego California de 1994 a 2005, se identificó a M. bovis en 45 % de los casos en niños y 6 % de adultos, lo que demuestra que M. bovis puede representar un gran riesgo para la salud pública5.
En las infecciones por tuberculosis en humanos y bovinos existe una compleja interacción huésped-patógeno; muchos estudios han demostrado que las células T CD4, CD8 y γδ están implicadas en el progreso de la infección, siendo de particular importancia el desarrollo de una respuesta inmune tipo Th1, donde el IFN-γ tiene un papel significativo en la contención bacteriana a través de la activación de los macrófagos1,6. Datos experimentales y clínicos indican que el IFN-γ es esencial para la defensa del huésped contra M. tuberculosis, por lo que los defectos en la producción de IFN-γ se consideran un factor de riesgo para la infección por M. tuberculosis y la progresión de la enfermedad en humanos7. En bovinos infectados experimentalmente con M. bovis, se observó que la principal población celular productora de IFN-γ son los linfocitos T CD4+ de memoria, aunque los linfocitos T CD8+ también han sido identificados como productores importantes de esta citocina8. Las citocinas pro-inflamatorias IL-12, IL-18, IL-23 producidas por los macrófagos inducen la activación de los linfocitos T, estimulando así la síntesis de IFN-γ, el cual a su vez activa a los macrófagos para producir TNF-α. Los macrófagos así activados limitan el crecimiento de bacterias intracelulares a través de la producción de especies reactivas de oxígeno y nitrógeno, y además contribuyen en el mantenimiento del granuloma9,10. Sin embargo, el papel del macrófago en la tuberculosis es una enigmática dicotomía. Por un lado es la célula huésped de la micobacteria; y por el otro, es la célula efectora para el control y destrucción de dicho patógeno10. Esta célula es capaz de inhibir el desarrollo del bacilo mediante la fagocitosis y de participar ampliamente en la inmunidad celular, en el proceso de presentación de antígeno y el reclutamiento de linfocitos T6,10. De hecho, los macrófagos son considerados como uno de los principales mecanismos inmunes de resistencia. En este aspecto, después de una infección bacteriana se puede observar que una proporción de animales resisten la infección, mientras que otros desarrollan la enfermedad11; fenotipo asociado con la actividad oxidativa y bacteriostática de los macrófagos12. En el caso de infecciones con M. bovis el control al crecimiento intracelular es dependiente de la virulencia bacteriana13,14.
La importancia de las poblaciones de macrófagos y linfocitos T en la tuberculosis bovina se ha estudiado principalmente en ganado infectado experimentalmente8, por lo que el objetivo de este estudio fue identificar la capacidad de los macrófagos en el control de la infección por M. bovis y la producción de IFN-γ de los linfocitos en bovinos naturalmente infectados con este patógeno.
Los animales que se seleccionaron para el presente estudio provenían de una explotación intensiva de bovinos especializados en la producción lechera de la raza Holstein, con una prevalencia de TBB estimada >25 %. Dicho hato se seleccionó debido a la evidencia clínica, patológica y bacteriológica de la presencia de M. bovis reportada en dictámenes oficiales. Con estos antecedentes, se consideró que los animales evaluados estaban naturalmente infectados con M. bovis. Los bovinos utilizados en esta investigación tenían una edad promedio de 3.5 años. Se seleccionaron solamente 11 bovinos que fueron reactores positivos en la prueba de tuberculina doble comparativa, la cual se realizó e interpretó de acuerdo con la Norma Oficial Mexicana contra la Tuberculosis Bovina (NOM 031-Z00-1995). Para evitar la interferencia que se podría ocasionar en la interpretación de los resultados se evitó la evaluación de animales PPDB negativos, que podrían ser anérgicos.
Se obtuvieron muestras de sangre en tubos con heparina de sodio como anticoagulante (BD Vacutainer® Sodium Heparin, USA) de todos los animales para evaluar la producción de IFN-γ a través del kit comercial Bovigam (Prionics, Schlieren-Zurich, Suiza). Las muestras de sangre se transportaron a temperatura ambiente, protegidas de la luz y se procesaron durante las primeras 10 h de haberse obtenido. El estímulo de las células se hizo utilizando placas para cultivo celular de 96 pozos, empleando 250 µl de sangre; las células se incubaron por duplicado con PPD aviar (PPDA) (10 μg/ml), PPD bovino (PPDB) (10 μg/ml), coctel proteico ESAT-6 y CFP-10 (E6-C10) (4 μg/ml), mitógeno (1 μg/ml) (Pokeweed, Sigma Aldrich, CA, EE.UU.) y se incluyó un control sin antígeno. Los cultivos se incubaron durante 20 h en una incubadora de CO2 al 5% humidificada a 37 °C. Los sobrenadantes se recuperaron por centrifugación a 824 xg por 20 min a 4 °C y se depositaron en placas de 96 pozos nuevas, las cuales se almacenaron a -20 °C para la posterior evaluación de la producción de IFN-γ de acuerdo a las instrucciones del fabricante. Los resultados se expresaron usando un índice de densidad óptica (IDO) que se define como el radio de la DO de los cultivos estimulados con un antígeno entre la DO de cultivos estimulados sin antígeno. Para todos los antígenos probados se seleccionó un valor IDO ≥2 como punto de corte para indicar un resultado positivo15. Para confirmar la infección por M. bovis en los bovinos, se identificó el material genómico de la micobacteria en las muestras de exudado nasal, las cuales se colectaron utilizando hisopos estériles sumergidos en 2 ml de PBS 1x estéril. Las muestras se transportaron a temperatura ambiente, se centrifugaron a 12,000 xg durante 10 min y los sedimentos nasales se mantuvieron a -20 °C hasta su procesamiento. El ADN del exudado nasal se extrajo de acuerdo a un método descrito para micobacterias16 adaptado previamente17. La calidad y concentración del ADN se evaluaron por espectrofotometría empleando un Nanodrop (ND-1000 Spectrophotometer, DE. USA). Posteriormente se realizó una PCR como se describió previamente para amplificar una región del gen mpb70 del complejo M. tuberculosis y el gen cyb, que codifica el citocromo b del bovino para descartar la presencia de inhibidores de la PCR17,18.
El análisis de la capacidad microbicida de los macrófagos bovinos se realizó mediante un ensayo bactericida. Los macrófagos derivados de monocitos se obtuvieron de acuerdo a lo descrito por Esquivel-Solís et al19. Estos se infectaron con la cepa M. bovis BCG Danesa durante 4 h a una multiplicidad de infección (MOI) de 10 bacterias por macrófago y se centrifugaron a 200 xg durante 10 min. El ensayo bactericida de macrófagos se realizó con 1x104 células por pocillo en placas Nunc Mini (Nalge Nunc International, Rochester, NY, EE.UU.). Los macrófagos obtenidos de cada animal se colocaron por triplicado, como control negativo se incluyeron tres pocillos con macrófagos no infectados. Después de 4 h, las bacterias no fagocitadas se eliminaron mediante cuatro lavados con medio RPMI (Roswell Park Memorial Institute media). Se evaluó el crecimiento intracelular de las micobacterias después de 24 h de infección; las células fueron lisadas con Tween 20 al 0.5%, se realizaron diluciones seriadas de la suspensión celular y se cultivaron en placas con medio Middlebrook 7H11 a 37 °C durante cuatro semanas para determinar el número de unidades formadoras de colonia (UFC). La supervivencia intracelular micobacteriana se calculó dividiendo el número de UFC al final del ensayo (24 h) por el número de UFC al inicio del ensayo (0 h) expresado como porcentaje13.
Cada experimento se realizó por triplicado independientemente, y los resultados se expresaron como la media en porcentaje. Las comparaciones entre medias se analizaron mediante la prueba de ANOVA. La correlación entre la susceptibilidad y la producción de IFN-γ se evaluó mediante la prueba de correlación de Pearson. Los análisis se llevaron a cabo con el software Prism 7 (GraphPad Inc. La Jolla, CA, EE.UU.). Todos los procedimientos que se realizaron en los animales se aprobaron por el Comité de Bioética de la Facultad de Medicina Veterinaria de la Universidad Nacional Autónoma de México.
Con el objetivo de evaluar animales naturalmente infectados con M. bovis, se seleccionaron 11 animales provenientes de un hato con evidencia clínica, patológica y bacteriológica de la presencia de M. bovis. Dichos animales fueron reactores al PPDB en la prueba de tuberculina. En 10 animales, fue posible identificar la presencia del material genético de la micobacteria por medio de PCR en muestras de exudado nasal (datos no mostrados). Así mismo, se evaluó la producción de IFN-γ en respuesta al PPDB y el cóctel proteico E6-C10 (Cuadro 1). Solo 4 animales (36.3 %) fueron positivos al PPDB, el resto (7 animales) fue negativo. Con el cóctel proteico se identificaron 8 animales (72.7 %) positivos.
Cuadro 1 Bovinos identificados en la prueba de IFN-γ usando el PPDB y el cóctel proteico E6-C10
| Prueba de IFN-γ | Positivo | Negativo | Total |
|---|---|---|---|
| PPDB | 4 | 7 | 11 |
| E6-C10 | 8 | 3 | 11 |
La producción de IFN-γ medida como índice de densidad óptica hacia el PPDB y el cóctel proteico E6-C10 se muestra en la Figura 1. La media del IDO hacia el PPDB fue de 2.5, con un valor mínimo de 0. 847 y máximo de 11.91. Mientras que para el cóctel proteico se obtuvo una media de 2.0 y un valor mínimo y máximo de 0.271 y 8.27, respectivamente.
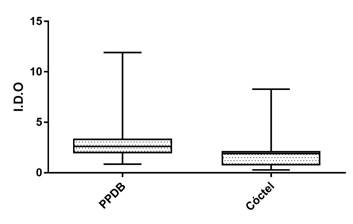
Figura 1 Producción de IFN-γ hacia el PPDB y cóctel proteico E6-CF10 en bovinos naturalmente infectados con M. bovis. Los resultados se expresaron como un índice de densidad óptica (I.D.O.). (P= 0.422).
En la Figura 2 se muestra el porcentaje de sobrevivencia de M. bovis BCG en el ensayo microbicida realizado en los animales evaluados. Se observó un rango de porcentaje de sobrevivencia del 80 a 150 %. De acuerdo a los porcentajes de supervivencia intracelular, todos los animales evaluados se clasificaron como naturalmente susceptibles a la infección por M. bovis. Aunque hubo algunas diferencias en el grado de susceptibilidad de los bovinos, éstas no fueron significativas.
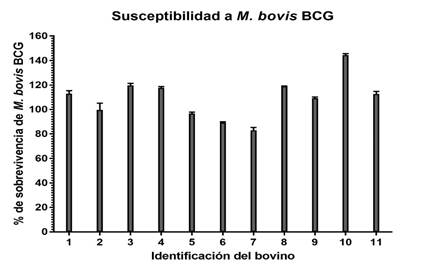
Figura 2 Porcentaje de supervivencia de M. bovis BCG en el ensayo bactericida de macrófagos en bovinos naturalmente infectados con M. bovis. Los resultados se expresan como la media y la desviación estándar de tres experimentos independientes. (P= 0.6980).
Posteriormente, se comparó el IDO del PPDB y cóctel proteico E6-C10 con el índice de supervivencia de M. bovis BCG, pero no hubo correlación entre la susceptibilidad hacia M. bovis BCG y la producción de IFN-γ en bovinos naturalmente infectados con M. bovis (Figura 3).
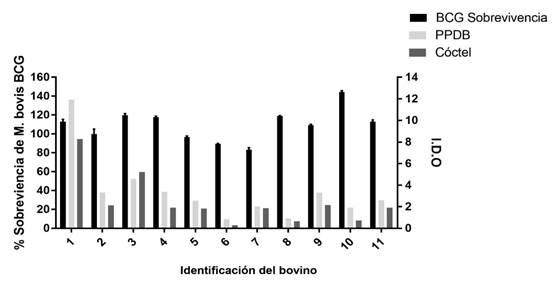
Figura 3 Comparación del porcentaje de supervivencia de M. bovis BCG con la producción de IFN-γ hacia el PPDB y al cóctel proteico E6-C10 en bovinos naturalmente infectados con M. bovis. Los resultados se expresaron como un índice de densidad óptica (IDO). (P= 0.723).
El objetivo de este estudio fue identificar la capacidad de los macrófagos en el control de la infección por M. bovis y la producción de IFN-γ de los linfocitos en bovinos naturalmente infectados con M. bovis; para satisfacer este objetivo se tomaron diferentes precauciones, por ejemplo se seleccionaron animales provenientes de un hato con alta prevalencia de TBB donde se tuviera la certeza de la presencia del agente en el ambiente. Además, se evitó el empleo de animales negativos a la prueba de tuberculina, para no incluir animales anérgicos. En condiciones de campo existe la dificultad de establecer la etapa de infección en la que se encuentra cada animal, por lo que la inclusión de bovinos PPD negativos podría impedir la evaluación de la respuesta inmune celular (producción de IFN-γ). Así mismo, se analizaron animales en la misma etapa de producción con 3.5 años en promedio. Por otra parte, se corroboró que los bovinos incluidos en el estudio tuvieran evidencias del contacto con M. bovis.
La prueba de oro de la infección por TBB es el aislamiento bacteriano a partir de tejidos con lesiones sugestivas a la infección; no obstante, la eliminación de animales en producción sin signos clínicos de la enfermedad representa una pérdida económica de consideración para los hatos lecheros. Es por eso que se han desarrollado diversas herramientas de biología molecular que permiten una identificación rápida de la infección, una de ellas es el PCR a partir de la extracción de ADN de exudados nasales. A pesar de ser una herramienta muy útil es necesario que el animal esté excretando la micobacteria para que ésta pueda ser detectada. Los períodos de excreción son intermitentes y varían de un animal a otro debido al estado de infección, por lo que un resultado negativo en la PCR no significa que el animal no está infectado, sólo que no está en un periodo de eliminación20. En este estudio, a excepción de un animal, en todos los animales se identificó el ADN de la micobacteria mediante PCR. Existen otros factores que afectan los resultados de cualquier PCR, como la presencia de inhibidores, el método de extracción de ADN y el límite de detección. En este estudio se empleó PCR anidada para aumentar el límite de sensibilidad17,18; empero un animal resultó negativo a dicha prueba, aunque no se detectó la presencia de inhibidores, por lo que es posible que dicho animal estuviera en un estado de no excreción de la micobacteria, o su presencia estuviera lejos del límite de detección de la PCR. El éxito de la PCR a partir de exudados nasales observado en el presente estudio puede estar influenciado por la alta prevalencia de la infección en el hato; no obstante, es una demostración de su utilidad en casos donde el sacrificio de los animales no pueda realizarse.
Otra de las herramientas utilizadas para caracterizar a los bovinos del estudio fue mediante la prueba de IFN-γ. Diferentes autores han demostrado que esta prueba es más sensible y especifica que la prueba intradérmica17,21,22. Sin embargo, la exposición a otras micobacterias o la co-infección con M. avium subsp paratuberculosis, afecta la especificidad de las pruebas basadas en el uso del PPD, incrementando el número de reacciones falsas positivas, fenómeno que puede ser evitado usando antígenos altamente inmunogénicos como ESAT-6 y CFP-1023. En el presente estudio se observó que el cóctel proteico E6-C10 identificó más animales infectados que el PPDB en la prueba de IFN-γ, el 72.7 % (n= 8) de los animales se identificaron positivamente por el cóctel proteico E6-10, mientras que solo el 36.3 % (n= 4) por el PPDB15,24. Estas diferencias se atribuyen principalmente a la pobre definición de antígenos presentes en el PPDB, pues aunque éste proporciona una excelente sensibilidad, su especificidad es limitada, debido a que muchos antígenos presentes en el PPDB también se encuentran presentes en micobacterias ambientales. Por otro lado, el coctel proteico E6-C10 está formado por dos antígenos que solo están presentes en bacterias del complejo M. tuberculosis, pero están ausentes en todas las cepas de M. bovis BCG y micobacterias ambientales, por lo que la especificidad de este cóctel es mucho mayor15,17,24.
Para evaluar la sobrevivencia de M. bovis BCG en los macrófagos provenientes de animales naturalmente infectados se utilizó un ensayo bactericida. El principal hallazgo de este reporte indica que existe una variación en la susceptibilidad a M. bovis por parte de los bovinos naturalmente infectados con este patógeno. Las diferencias en el grado de sobrevivencia del M. bovis o susceptibilidad a la infección reflejan principalmente el desempeño de los macrófagos frente a M. bovis, aunque también podría significar diferencias en el estado de infección, nutrición, salud del bovino u otros factores ambientales12,13,25. Estudios con macrófagos provenientes de bovinos resistentes han mostrado que estos poseen una mayor actividad bacteriostática, producen mayores concentraciones de óxido nítrico y tienen una mayor expresión de genes de citoquinas pro-inflamatorias que los macrófagos de individuos susceptibles14,19,25. En este estudio no se encontraron bovinos con el fenotipo de animales resistentes que permitiría una comparación de los resultados. Sin embargo, la variación amplia de la susceptibilidad encontrada permite evaluar la asociación de esta capacidad inmunológica con la producción de IFN-γ por cada individuo.
Es importante puntualizar que la respuesta inmune contra la tuberculosis es un proceso muy complejo1,8,26. Como se mencionó al inicio, después de la exposición inicial a M. bovis, se desarrolla una respuesta inmune celular T, pero para controlar la proliferación bacteriana se requiere un equilibro muy fino entre la producción de citocinas pro y antiinflamatorias. La producción de IFN-γ inducida por IL-12 es la vía de citocinas más estudiada y posiblemente mejor validada que regula la infección por M. bovis27. Esta vía es crítica en el desencadenamiento de funciones antimicobacterianas por los macrófagos, en particular la activación de la sintasa inducible de óxido nítrico (iNOS)28. Sin embargo, a pesar de los datos que respaldan el papel esencial del IFN-γ en el control de la progresión de la tuberculosis, investigaciones recientes indican que el aumento de los niveles de IFN-γ durante la infección micobacteriana puede reflejar el estado inflamatorio y la progresión de la enfermedad más que una respuesta inmune protectora29. Es probable que la variación del IDO observado en el presente estudio sea un reflejo de las distintas etapas de infección en la que se encuentran los animales evaluados; empero, es imposible confirmar dicha conclusión por la falta de la evaluación de la patología de la infección en los tejidos de los bovinos infectados.
Estudios previos indican que los bovinos con mayor número de lesiones producen más óxido nítrico, TNF-α e IFN-γ, por lo que es posible plantear la hipótesis de que los animales identificados en este estudio no pudieron controlar la infección por M. bovis a pesar de la fuerte respuesta inmunitaria proinflamatoria que en este caso, solo aumentó la patología de la enfermedad21. Por otra parte, estudios previos han mostrado que los macrófagos de bovinos resistentes producen más óxido nítrico que los macrófagos de bovinos susceptibles19. Por lo tanto, es posible que una de las razones de la incapacidad para controlar el crecimiento de M. bovis por los macrófagos de los bovinos susceptibles identificados en este estudio sea la pobre producción de óxido nítrico por las células25. Así mismo, se sabe que diferentes tipos de subpoblaciones de linfocitos T participan en la respuesta inmune contra las micobacterias. Diversos estudios han demostrado que personas con una infección latente de tuberculosis muestran mayores frecuencias de linfocitos T CD4+ trifuncionales, capaces de producir IFN-γ, TNF-α e IL-2, con una mayor capacidad efectora y proliferativa30, en contraste con personas con la enfermedad activa que muestran frecuencias elevadas de linfocitos T CD4+ con función simple o doble26. Por lo tanto, es posible que la polifuncionalidad pueda correlacionarse con la resistencia a la tuberculosis en humanos y bovinos31.
No hay duda de que la resistencia a la infección por M. bovis es un fenómeno multifactorial, por lo que es importante vincular las respuestas inmunes innatas y adaptativas, con el fin de buscar biomarcadores que ayuden a discriminar entre bovinos susceptibles y resistentes. Este reporte, es una aproximación de la evaluación de la actividad microbicida de macrófagos provenientes de animales naturalmente infectados, aunque los datos no apoyan una correlación entre la susceptibilidad de M. bovis y la producción de IFN-γ en bovinos naturalmente infectados con M. bovis, no se descarta la hipótesis de que las limitaciones en el funcionamiento de los macrófagos y los linfocitos T desempeñan un papel muy importante en la diseminación de la enfermedad.











 nueva página del texto (beta)
nueva página del texto (beta)


