INTRODUCCIÓN
En las hembras bovinas, la presentación temprana de la pubertad tiene especial importancia en la fertilidad1,2 y productividad de por vida3. En los sistemas de producción de carne y leche de bovino en el trópico, las vaquillas presentan la pubertad tardíamente y por ello tienen su primer parto entre los tres y cuatro años de edad4, cuando el ideal zootécnico desde el punto de vista de productividad es de aproximadamente dos años5. La tardía edad y bajo peso al primer parto de las vaquillas de trópico, determinan una baja producción de becerros y de leche durante su vida6. Consecuentemente es importante conocer los mecanismos fisiológicos reguladores de la pubertad y los factores que los afectan, lo cual potencialmente conducirá al desarrollo de nuevas estrategias de manejo para reducir la edad a la pubertad de las vaquillas, mejorar la eficiencia reproductiva y la rentabilidad de las unidades de producción ganadera.
Se ha establecido7 que la pubertad es precedida por un incremento progresivo en la secreción pulsátil de la hormona liberadora de las gonadotropinas (GnRH), siendo este cambio el componente clave de control para iniciar la pubertad8. Varios grupos de investigadores señalan a la kisspeptina como el elemento estimulador preponderante que gobierna la actividad de las neuronas productoras de GnRH9. A su vez, la kisspeptina es el principal intermediario entre las sustancias señalizadoras de origen somático y ambiental que modulan la función reproductiva y las neuronas productoras de GnRH, determinando tanto la liberación tónica como la secreción fásica de las gonadotropinas hipofisiarias10.
La kisspeptina (KISS) o kisspeptinas es una familia de péptidos que, según el número de aminoácidos, son denominados como: KISS-54, -14, -13 y -1011. Algunos autores11,12 consideran a las neuronas productoras de KISS como integradoras de señales que actúan modulando el tono de operación de los ejes somatotrópico y gonadal. En ratas12 y cerdas prepúberes13, la concentración sérica de la hormona luteinizante (LH) y hormona folículo estimulante (FSH) aumentan de seis a ocho veces, simulando una oleada preovulatoria de dichas gonadotropinas, en respuesta a una aplicación de KISS-10. En ratas prepúberes14, la inyección del péptido provoca un aumento en la LH sérica que varía con la edad. En becerras de siete meses de edad, una aplicación de KISS-10 (5 µg/kg) evoca un aumento en la LH y hormona del crecimiento (GH) circulantes15. En contraste, en becerras de cinco meses16 de edad la misma dosis de KISS-10 no altera la liberación de GH pero induce la liberación de LH y de FSH, esta última no estudiada en las becerras de 7 meses15; por tanto se desconoce si la KISS puede o no estimular la liberación de LH en becerras prepúberes mayores de 7 o menores de 5 meses de edad. Asimismo, se ignora si la liberación de FSH y GH posterior a la administración de KISS puede ser diferente en becerras prepúberes de edad variable dentro de este rango, de menor o de mayor edad. La edad a la pubertad está estrechamente asociada con el peso17,18 y la composición corporal19; sin embargo, las concentraciones sanguíneas de metabolitos y hormonas relacionados con estas variables presentan interacciones complejas17,19,20, por lo que las señales de origen metabólico que conducen hacia el inicio de la pubertad no se conocen con exactitud. El factor de crecimiento similar a la insulina-I (IGF-I)19,20 y la leptina21 aumentan en sangre periférica antes de la pubertad, pero su perfil de liberación con relación al inicio de la misma difiere22,23. El IGF-I circulante19 aumenta antes que la leptina23 durante las etapas de crecimiento acelerado de los animales y la deposición de grasa en el tejido adiposo19,21,22 que anteceden el inicio de la pubertad. Tanto el IGF-I23 como la leptina24, señalizan el estado nutricional y el grado de madurez de los individuos y ejercen varias funciones en la actividad reproductiva. Los ovarios también participan en el proceso de la pubertad, ya que se observa un incremento prepuberal simultaneo en la frecuencia de pulsos de LH, el diámetro del folículo ovárico dominante y las concentraciones circulantes de E225,26. Por lo anterior, el tema central del presente trabajo fue evaluar el efecto de la edad en becerras prepúberes sobre el patrón de liberación de LH, FSH y GH en respuesta a la KISS-10 exógena. La hipótesis de trabajo fue que una aplicación intravenosa de KISS-10 a becerras prepúberes induce un aumento de LH, FSH y GH cuyas características varían con la edad de los animales y sus concentraciones circulantes de E2, IGF-I y leptina.
MATERIAL Y MÉTODOS
Animales y manejo general
Los procedimientos aplicados fueron aprobados por el Subcomité Institucional para el Cuidado de Animales en Experimentación (Programa de Posgrado, Facultad de Medicina Veterinaria y Zootecnia, UNAM). Se utilizaron 21 becerras de raza Holstein y Suizo Pardo, las cuales se alojaron individualmente en corrales de 2.5 x 4.5 m, con piso de cemento, área techada (2.5 x 2.7 m), comederos y bebederos. Para la adaptación al manejo, las becerras se introdujeron a los corrales un mes antes del experimento. La alimentación consistió en forraje picado a libertad (heno de avena; 95 % MS, 6.5 % PC y 2.42 Mcal de EM/kg), 4 kg de concentrado proteínico (93.8 % MS, 16.53 % PC y 2.43 Mcal de EM/kg) y sales minerales y agua a libertad. Los animales se asignaron de acuerdo con su edad a tres grupos homogéneos desde el punto de vista de la raza: 4 meses (4.8 ± 0.15 meses; media+ee); 7 meses (7.5 ± 0.15 meses) y 11 meses (11.4 ± 0.15 meses). Un día antes del experimento, el peso corporal promedio de los animales en los grupos de 4, 7 y 11 meses de edad fue 106.3 ± 6.7, 114.3 ± 6.7 y 139.4 ± 6.7 kg respectivamente; mientras que la condición corporal fue, en el mismo orden de 2.2 ± 0.2, 2.3 ± 0.20 y 2.3 ± 0.20, en una escala del 1 al 527.
El día del experimento, a cada becerra se le aplicó un bolo i.v. de 5 µg de KISS-10 (3.75 nmol) por kilo de peso corporal. En el presente estudio se usó KISS-10 bovina (YNWNSFGLRY-NH2; Proimmune, Oxford, UK) diluida en solución salina fisiológica (1:125) y administrada i.v. a través de un catéter insertado en una de las venas yugulares. Antes de cateterizar, la zona peri-yugular fue rasurada y se aplicó analgesia en un área de 5x5 cm (lidocaína al 2%, 2 mg/cm2). El catéter fue utilizado para el muestreo sanguíneo que se describe posteriormente.
Muestras y mediciones
Durante el mes previo a la aplicación de KISS-10, se tomaron muestras de sangre cada tercer día por punción de la vena coccígea para comprobar la condición anovulatoria de las becerras (progesterona sérica <1 ng/ml). El día de la administración de KISS-10, a través de la cánula se tomaron muestras de sangre cada 15 min durante 8 h, cuatro previas y cuatro posteriores a la aplicación de KISS-10. En el suero de las muestras obtenidas cada 15 min se determinaron las concentraciones de LH, FSH y GH, y en el suero obtenido de muestras de sangre tomadas antes (muestras 1, 2 y 3) y después de la aplicación de KISS-10 (muestras 18 a 20 y 26 a 28), se cuantificaron E2, leptina e IGF-I.
Análisis de laboratorio
La progesterona se determinó mediante estuches de radioinmunoanálisis (RIA; Coat a Count, Diagnostic Product Corporation, DPC, Los Ángeles, CA, EUA); la sensibilidad fue de 0.02 ng/ml, con un coeficiente de variación (CV) intraensayo de 6.15 %. La leptina se cuantificó mediante estuches multiespecies (RIA, Linco Research Inc. Sigma, St. Louis, MO, EUA); en dos ensayos, la sensibilidad fue de 1.0 ng/ml y el CV interensayo e intraensayo fue de 6.93 % y 2.63 % respectivamente. El IGF-I se determinó mediante estuches comerciales (ELISA, Alpco Immunoassays, Salem, NH, EUA); en dos ensayos la sensibilidad fue de 0.9 ng/ml, mientras que el CV intraensayo fue de 3.66 % e interensayo de 3.79 %. Las concentraciones de E2 se determinaron mediante RIA con un antisuero altamente específico para E2-17β, marcado con 125I, previamente descrito28; su sensibilidad fue de 0.21 pg/ml y el CV intraensayo de 9.18 %. LH, FSH y GH se cuantificaron por RIA; los procedimientos fueron validados y descritos anteriormente29,30,31. En tres ensayos de LH, el límite mínimo y máximo fue de 0.27 ng/ml y 57.91 ng/ml; los valores medios de los controles bajo, medio y alto fueron respectivamente de 2.3, 14.55 y 33.88 ng/ml; mientras que los correspondientes CV fueron: intraensayo de 5.31, 1.07 y 8.10 %, e interensayo de 9.64, 6.56 y 8.70 %. En el caso de FSH la sensibilidad fue de 0.0479 ng/ml, el CV intraensayo fue de 6.34 % y el CV interensayo de 10.12 %. En dos ensayos de GH el límite mínimo y máximo fue de 1.6 y 87.42 ng/ml respectivamente, mientras que los valores medios de los controles bajo y alto fueron respectivamente de 2.22 y 4.63 ng/ml; por su parte, los CV intraensayo fueron en el primer ensayo de 4.56 y 5.21 %, mientras que en el segundo fueron de 3.67 y 4.38 %. Los CV interensayo fueron 10.31 y 9.45 %.
Variables de respuesta
Para cada animal, se consideró como respuesta de LH, FSH y GH inducida por la administración de KISS-10, cuando al menos en dos muestras consecutivas la concentración hormonal posterior a KISS-10 fue mayor al promedio más dos desviaciones estándar (DE) de la concentración basal de la hormona, y que posteriormente, en al menos una muestra, la concentración de la hormona descendiera a valores similares a la media de la concentración basal más dos DE. La concentración basal para cada animal, fue la media de los tres valores hormonales más bajos del periodo de muestreo previo a la aplicación de KISS-10. Con relación al incremento de LH, FSH y GH inducido por KISS-10 se generaron dos variables: Duración de la respuesta (DUR) y valor máximo (VMAX). La DUR fue el periodo comprendido entre la primera muestra que excedió al promedio más dos DE de la concentración basal, y la primera muestra cuya concentración descendió a un valor menor o igual a la concentración basal. VMAX fue la concentración máxima de cada hormona durante el período posterior a la aplicación de KISS-10, dentro del segmento considerado como respuesta. Con respecto a IGF-I, leptina y E2, la variable de respuesta de cada una de ellas fue la media de la concentración obtenida en las nueve muestras analizadas.
Diseño y análisis estadísticos
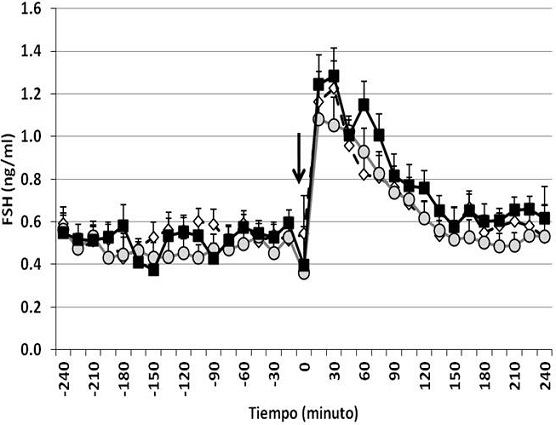
El diseño base fue un completamente al azar para modelos unifactoriales de efectos fijos (edad de las becerras). Para ello, de un total de 67 becerras bloqueadas por edad, se tomaron al azar siete de cada grupo (4, 7 y 11 meses), mismas que constituyeron la muestra experimental. Para el análisis del perfil de los datos provenientes de las muestras sanguíneas colectadas a intervalos de 15 min (LH, FSH y GH), se utilizó un ANDEVA para diseños de medidas repetidas en tiempo32; en este caso, el modelo estadístico incluyó los efectos de edad, muestra, periodo (pre y post KISS-10), sus interacciones y el error experimental. La proporción de animales que mostró respuesta de LH, FSH y GH a KISS-10 se analizó mediante pruebas de tablas de contingencias (χ2). Para los datos relacionados con la concentración media de IGF-I, leptina y E2, así como para VMAX y DUR del incremento de LH, FSH y GH, se utilizó un ANDEVA de una vía para modelos de efectos fijos32, en el cual se incluyó únicamente el efecto de edad de las becerras. La separación de medias se realizó por el procedimiento de medias de cuadrados mínimos (LSMEANS). Además, mediante el procedimiento CORR32 se examinaron las correlaciones del VMAX de LH, FSH y GH determinados en los animales que respondieron a KISS-10, entre ellas y con el valor medio de las concentraciones de IGF-I, E2 y leptina, así como con la edad, peso corporal y CC de las becerras. También se determinó la correlación de IGF-I, E2 y leptina, entre ellas y con las variables de tipo zoométrico.
RESULTADOS
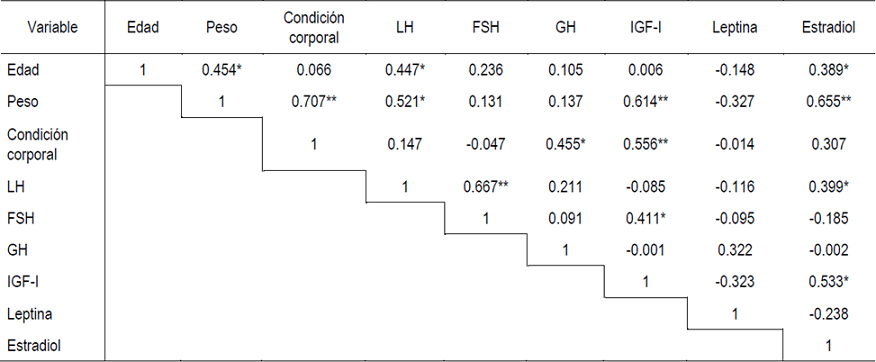
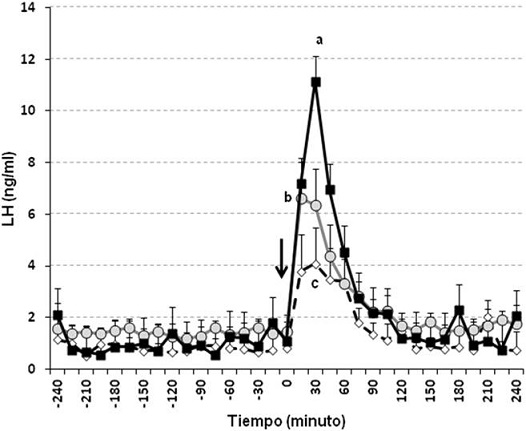
Los niveles séricos de progesterona en todas las muestras colectadas durante el mes de adaptación fueron <1 ng/ml, indicando la condición prepuberal de todas las becerras del experimento. Así mismo, durante el periodo previo a la aplicación de KISS-10 las concentraciones séricas de las hormonas estudiadas no difirieron entre los grupos de becerras de 4, 7 y 11 meses de edad (P>0.05). Todas las becerras respondieron a KISS-10 con un incremento de LH. Las concentraciones séricas promedio de LH (Figura 1) aumentaron (P<0.01) por efecto del tratamiento de KISS-10, independientemente de la edad de las becerras. Sin embargo, VMAX de LH fue mayor (P<0.01) en las becerras de 11 meses de edad (Figura 1; Cuadro 1); por su parte, la DUR de LH solo fue mayor (P<0.05) en los animales de 11 meses con respecto a los de 4 meses.
a,b,c Distintas literales indican diferencia entre medias (P<0.01).
Figura 1 Respuesta de LH (media ± ee) en becerras de 4 (rombo blanco), 7 (círculo gris) y 11 (cuadro negro) meses de edad, a una aplicación intravenosa de KISS-10 (flecha; 5 µg/kg)
*En paréntesis (animales que respondieron/animales expuestos).
Distintas literales dentro de variable de respuesta indican diferencias entre grupos de edad (a,b P<0.01; c, d P<0.05).
Cuadro 1 Valor máximo y duración de la respuesta de LH, FSH y GH (media ± ee) y proporción de becerras que respondieron a kisspeptina-10
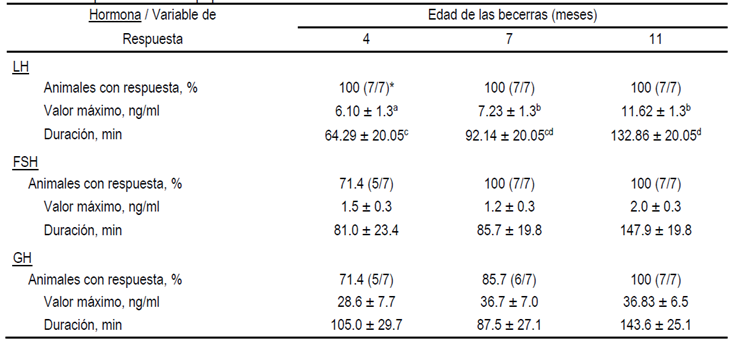
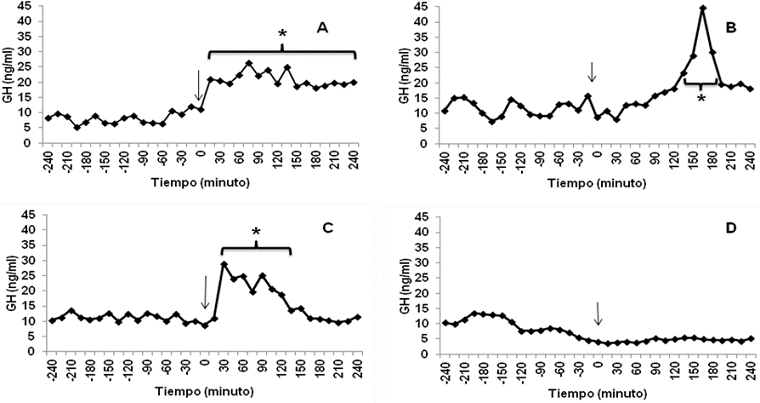
Con relación a FSH, 71.4, 100 y 100 % de las becerras de 4, 7 y 11 meses respectivamente, respondieron a KISS-10; situación que para GH fue 71.4, 85.7 y 100 %, respectivamente (Cuadro 1). No hubieron diferencias (P>0.05) adjudicables a la edad de los animales en ninguna de las características de la respuesta de FSH (Figura 2; Cuadro 1) y GH (Cuadro 1) a KISS-10. El patrón de FSH post KISS-10 fue similar al de LH, en el sentido de que en los animales donde se registró respuesta, ésta se inició dentro de la primera hora, y finalizó durante el transcurso de la segunda o tercer hora posterior a la aplicación del péptido. En cuanto a la respuesta de GH a KISS-10 (Figura 3), no se observó un patrón definido de liberación como en el caso de las gonadotropinas. Al respecto, se observó que algunas becerras no respondieron (14.3 %), otras mostraron un incremento de GH durante todo el periodo de muestreo posterior a KISS-10 (9.5 %), unas más respondieron durante las primeras dos horas (23.8 %), mientras que otras becerras mostraron la respuesta durante las últimas dos horas de muestreo post KISS-10 (52.4 %).
(P>0.05).
Figura 2 Respuesta de FSH (media ± ee) en becerras de 4 (rombo blanco), 7 (círculo gris) y 11 (cuadro negro) meses de edad a una inyección intravenosa de KISS-10 (flecha; 5 µg/kg)
* Difiere de la media de las muestras colectadas antes de la aplicación de KISS-10 (P<0.05).
Figura 3 Perfil de GH en becerras representativas de cuatro tipos de respuesta a una aplicación intravenosa de KISS-10 (flecha). A: respuesta durante la mayor parte del periodo posterior a KISS-10. B: respuesta tardía, registrada durante las últimas horas (2 a 4) del periodo post KISS-10. C: respuesta temprana, durante las primeras 2 horas post KISS-10. D: sin respuesta
Las concentraciones séricas de IGF-I (Figura 4) fueron mayores (P<0.05) en las becerras de 11 meses; en cambio, los niveles de E2 fueron mayores (P<0.05) únicamente en las becerras de 11 con respecto a las de 4, pero no difirieron de las de 7 meses. Por su parte, los niveles séricos de leptina fueron menores en las becerras de 11 meses. Dentro de cada grupo de edad, las muestras de suero previas a KISS-10 no difirieron (P>0.05) de las colectadas después de la aplicación del péptido en cuanto a IGF-I, leptina y E2 se refiere. Los coeficientes de correlación (Cuadro 2) indicaron una asociación entre la edad y el peso (P<0.05), sin embargo la CC presentó una correlación positiva únicamente con el peso de las becerras (P<0.01) mas no con la edad. La VMAX de LH estuvo correlacionada significativamente (P<0.05) con edad, peso, E2 y con VMAX de FSH (P<0.01). Por su parte, VMAX de FSH no se correlacionó (P>0.05) con ninguna de las variables analizadas, con excepción de la citada VMX de LH y con IGF-I (P<0.05), mientras que VMAX de GH solamente lo hizo con CC (P<0.05). Leptina no estuvo asociada (P>0.05) con ninguna de la variables examinadas. Por el contrario, IGF-I mostró una correlación con peso, CC (P<0.01) y VMAX de FSH (P<0.05), mientras que E2 se asoció con peso (P<0.01), edad, CC, VMAX de LH e IGF-I (P<0.05).
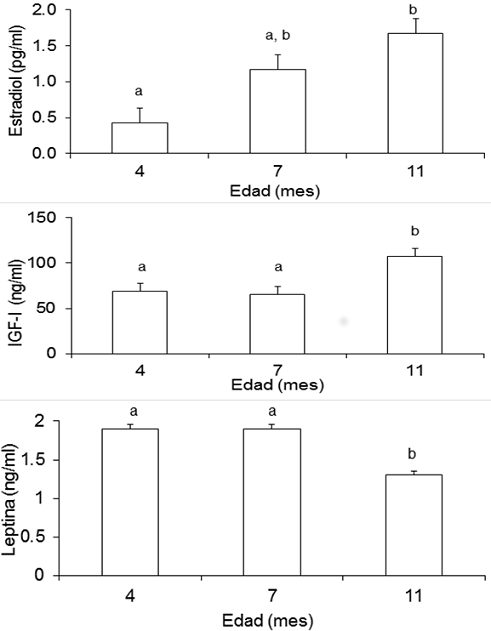
Figura 4 Concentraciones de estradiol, IGF-I y leptina en suero (media + ee) de becerras prepúberes de diferentes edades. Para cada hormona, distintas literales indican diferencia entre medias ( a, b P<0.05)
DISCUSIÓN
El 100 % de las becerras respondió a la administración de KISS-10 con un incremento de LH, observación que no es posible comparar con datos derivados de investigaciones previas, ya que en los estudios efectuados en hembras prepúberes de ratas33, cerdas13 y becerras15,16, no se indica la proporción de animales que respondió a KISS-10. En este trabajo, la magnitud de la respuesta de LH a KISS-10 difirió con la edad, lo que concuerda con datos generados en ratas34, ya que también en ellas la KISS induce una mayor liberación de LH cuando los animales están cercanos a la pubertad, sin un aumento en la secreción de GnRH, observación que permite sugerir que el mecanismo mediante el cual las becerras de 11 meses son más sensibles a KISS que animales más jóvenes, podría deberse a un aumento en la expresión de los receptores de GnRH en los gonadotropos conforme se aproximan a la pubertad. Independientemente del mecanismo que determina el nivel de respuesta de LH a KISS-10, la información aquí producida indica que existen agentes señalizadores que cambian con la edad, modulando la respuesta a KISS-10; algunos de ellos podrían ser E2 e IGF-I, cuyas concentraciones circulantes fueron mayores en las becerras que mostraron la máxima respuesta de LH. Entre las evidencias que soportan la posible intervención de E2 se puede mencionar un trabajo realizado in vivo35 en el que vacas ovariectomizadas, inyectadas con KISS-10 y E2, aumentaron las concentraciones plasmáticas de LH, en comparación con vacas en similar condición ovárica e inyectadas únicamente con el péptido. Otras evidencias a favor de esta idea fueron generadas en hembras de roedores y ovinos36,37, las cuales muestran que la acción de E2, es a través de sus receptores ERα presentes en las neuronas productoras de KISS encargadas de regular la liberación fásica de GnRH y consecuentemente de LH, lo que concuerda con los datos presentados en este trabajo, que indican que la KISS-10 estimuló un incremento fásico de LH sin alterar su frecuencia de pulsos. Un mecanismo adicional del E2 podría ser a nivel de los gonadotropos, ya que en hembras adultas de ovinos, ratas y papiones, así como en becerros lactantes9, dichas células aumentan la liberación de LH en respuesta a KISS-10, al adicionar E2 al medio de cultivo. Lo anteriormente discutido permite sugerir la existencia de un mecanismo de interacción positiva entre E2 y KISS a tres niveles: en las neuronas productoras de KISS, en las neuronas productoras de GnRH y en los gonadotropos.
En cuanto a la posibilidad de que IGF-I funja como indicador de un ambiente metabólico favorable para el inicio de la pubertad en becerras, se ha documentado que en dichos animales aumenta el IGF-I circulante unos días antes o al momento de la primera ovulación17,19, mientras que en ratonas la administración de IGF-I adelanta la pubertad38. De manera similar a la propuesta para E2, la acción del IGF-I podría ser la de potenciar el efecto de la KISS-10 en la secreción fásica de LH, mas no en la secreción tónica, ya que existen evidencias de ello en primates no humanos38, en roedores12 y en becerras prepúberes39. El IGF-I podría actuar en al menos dos niveles: directamente en las neuronas productoras de GnRH40 y en los gonadotropos41. Los hallazgos de que el IGF-I circulante atraviesa la barrera hematoencefálica en ratas y que se acumula en el núcleo anteroventral-periventricular y la eminencia media42, le da significancia fisiológica a la acción del IGF-I en hipotálamo y adenohipófisis para modular la secreción fásica de LH inducida por KISS-10. Finalmente la mayor respuesta de LH a KISS-10 en becerras de 11 meses, pudo ser el resultado de una acción conjunta de IGF-I y E2, como fue demostrado en ratas prepúberes43.
Los datos aquí generados respecto a que los menores niveles de leptina se observaron en las becerras con la mayor respuesta de LH, así como la ausencia de correlación de leptina con las variables zoométricas y hormonales examinadas, resultaron sorprendentes en vista de reportes previos relacionados con los incrementos en leptina circulante observados al aproximarse la pubertad, tanto en ratas44 como en niñas45 y becerras46. No obstante, concordando con nuestra observación, en un trabajo47 se determinó que la leptina exógena no acelera la pubertad en becerras ni incrementa la secreción de LH espontánea o estimulada por GnRH exógena. En ése47 y en otros estudios efectuados en bovinos y ovinos48,49,50, se propuso que la respuesta del eje gonadotrópico a leptina depende del estado metabólico de los animales, de su balance de energía o de la calidad y cantidad de alimentos que consumen. El presente trabajo se suma a aquéllos que ponen en duda la intervención de la leptina como modulador de los efectos de KISS en la pubertad. De hecho, en un estudio reciente, se informó que las becerras que presentaron una oleada preovulatoria de LH y la formación de un cuerpo lúteo en respuesta a KiSS-10 fueron las que presentaron las menores concentraciones de leptina39.
No se registraron efectos de edad en la respuesta de FSH a KISS-10, quizá porque el patrón de liberación de esta hormona depende además de la GnRH, de la actividad de otros factores tales como la activina51,52, la inhibina y la folistatina52,53. Los datos aquí presentados permiten sugerir que el nivel de regulación de los factores antes citados sobre la pulsatilidad de FSH no varía entre los 4 y los 11 meses de edad, por lo que el efecto de KISS-10 en la secreción de FSH es similar en becerras prepúberes que se encuentran dentro de dicho rango. Lo anterior es apoyado por trabajos de análisis longitudinal en niñas, en las que se determinó la ausencia de variaciones consistentes o significativas en concentraciones séricas de inhibina, activina y folistatina54. Con respecto a la respuesta de GH a KISS-10, no se detectaron diferencias atribuibles a la edad. Al respecto, se ha documentado en niñas que las variaciones en cuanto a la tasa de crecimiento e inicio de la pubertad, se deben en parte a los efectos individuales de los estrógenos, la GH, el IGF-I y otros efectores no evaluados en el presente estudio, tales como el cortisol y las hormonas tiroideas55; así mismo se ha propuesto que además de las interacciones de IGF-I y E2, existe una acción permisiva56 de la leptina para que la influencia de las demás hormonas involucradas en el inicio de la pubertad, ejerzan sus acciones tanto independientes como conjuntas. También se ha observado que los niveles séricos de GH, IGF-I e insulina varían entre individuos prepúberes por influencia de su genética, de la dieta que reciben y su estado nutricional55,56. Con relación a la respuesta de GH a KISS-10 en animales prepúberes, en la literatura únicamente se encontraron tres trabajos: dos en becerras y uno en cerdas; en estas últimas, la KISS-10 no indujo un aumento de las concentraciones séricas de GH13; en cuanto a las becerras, los resultados son contrastantes, ya que mientras unos autores15 demostraron una marcada respuesta de GH a las KISS-10, otros16 no la detectaron; por lo tanto los resultados aquí obtenidos se suman a los reportados en becerras que respondieron a KISS-10, sin aportar elemento alguno que aclare por qué algunos animales responden y otros no. Como fue el caso de LH y FSH, aparentemente este es el primer trabajo donde se registra la proporción de hembras prepúberes que responden a KISS-10 con una respuesta de GH.
CONCLUSIONES E IMPLICACIONES
La primera conclusión es que una aplicación i.v. de KISS-10 en la dosis empleada es suficiente para evocar un aumento significativo de LH en todas las becerras de 4 a 11 meses de edad; sin embargo, la magnitud de la respuesta de LH parece depender de otros agentes señalizadores que varían con la edad de las hembras bovinas prepúberes. Debido a que se registró una mayor concentración sérica de IGF-I y E2 en las becerras con mayor respuesta de LH, también se concluye que dichos elementos pueden ser algunos de los efectores implicados en la magnitud de respuesta de LH a la KISS-10. Otra conclusión es que ni la edad ni la variación en las concentraciones séricas de IGF-I, E2 y leptina están asociadas con la magnitud de respuesta de GH y FSH a KISS-10. Una implicación de los resultados del presente estudio, es que el uso potencial de KISS ya sea con fines terapéuticos o de manejo para resolver problemas asociados con anovulación o pubertad tardía en becerras, puede ser acompañando el tratamiento de KISS-10 con IGF-I, E2 o ambos, para incrementar la respuesta del eje gonadotrópico.











 nueva página del texto (beta)
nueva página del texto (beta)