Introducción
El 65 % de los pastizales nativos de la región centro y norte de México presentan erosión y desaparición de especies forrajeras de importancia ganadera1. En el estado de Chihuahua el sobrepastoreo y la fuerte invasión de especies exóticas, han sido las principales causas de este deterioro 2. Por lo anterior, es importante recolectar y conservar materiales forrajeros nativos en los centros de origen, ya que constituye la base para asegurar la alimentación del ganado3.
El pasto banderita [Bouteloua curtipendula (Michx.) Torr.] es una especie nativa presente en planicies y lomeríos rocosos, produce abundante forraje apetecido por el ganado, se adapta a diferentes tipos de suelo y condiciones climáticas y es resistente a la sequía4. Presenta buen valor forrajero y es considerado como excelente forraje para pastoreo y fauna silvestre5; sin embargo, el sobrepastoreo ha provocado la reducción y desaparición de grandes poblaciones de esta especie6. El pasto banderita es una especie que se adapta a diversos ambientes y puede dar lugar a diferentes ecotipos con diferencias morfológicas, motivo por el cual es importante hacer evaluaciones ex situ, donde todos los ecotipos se colocan en un mismo ambiente para detectar características de importancia dentro de la especie7. De esa manera, se pueden identificar características sobresalientes evaluando descriptores morfológicos en la diversidad de poblaciones nativas8.
Las caracterizaciones morfológicas se han llevado a cabo en gramíneas nativas dentro de los géneros Andropogon9, Panicum10,11, Hymenachne12, Bouteloua13, entre otros. Además, en la caracterización morfológica se han detectado correlaciones significativas y no significativas entre la diversidad de características morfológicas y localidad de sitios muestreados14. Por lo tanto, es importante evaluar características morfológicas y genéticas, ya que las características morfológicas son influenciadas por el ambiente. El uso de marcadores moleculares como es el polimorfismo en la longitud de fragmentos amplificados (AFLP), no son afectados por el ambiente. Además estos pueden detectar diversidad a nivel del genotipo y han sido empleados en pastos15,16 para conocer su variabilidad genética17. El objetivo del presente trabajo fue caracterizar la diversidad morfológica y molecular en poblaciones de pasto banderita, recolectadas en varias localidades de Chihuahua para detectar poblaciones con alto potencial forrajero.
Material y métodos
Durante el año 2006 se recolectaron 135 ecotipos de pasto banderita en ranchos ganaderos del estado de Chihuahua y se agruparon en 51 poblaciones (29 municipios), las cuales se utilizaron para las evaluaciones y para conocer y definir la estructura poblacional. En el Cuadro 1 se enlistan los municipios y algunas variables ambientales de los sitios de recolecta. En cada sitio de muestreo se extrajeron cuatro plantas, con un diámetro de 2.5 cm y provistas de raíz. La parte aérea se cortó a una altura de 15 a 20 cm y cada planta se identificó con un número de colecta, donde cada población se consideró como ecotipo diferente. Las plantas se colocaron en cajas de plástico, provistas con suelo húmedo para su transporte y trasplante en el Campo Experimental La Campana del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias.
Cuadro 1 Características ambientales de sitios de recolecta de 51 poblaciones de pasto banderita (135 ecotipos) en Chihuahua, México
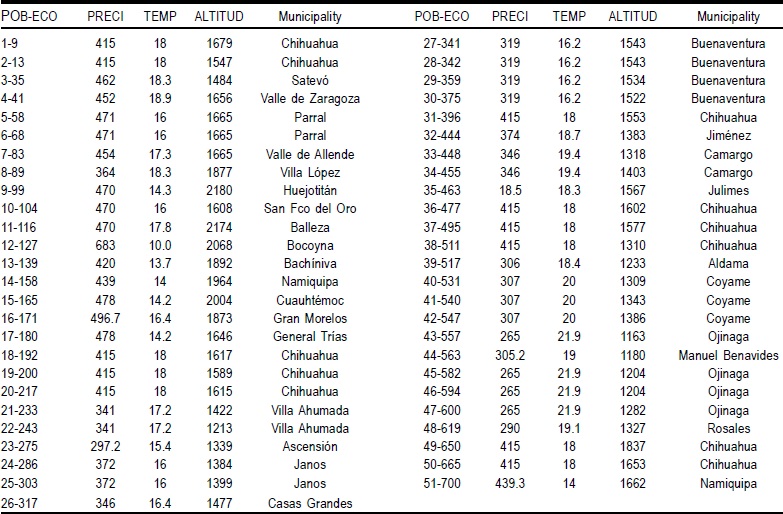
POB=population; ECO=ecotype: PRECI=precipitation; TEMP=temperature.
La topografía del sitio donde se trasplantó el material es plana con suelos de origen aluvial, textura franco arenoso y pH de 6.5. El clima es seco templado con veranos cálidos BWk, temperatura media anual de 15 a 18 °C y precipitación promedio de 355 mm anuales18. Se aplicó un riego de auxilio al momento del trasplante para asegurar su establecimiento. Posteriormente, las plantas se dejaron bajo condiciones de temporal (sin riego).
Caracterización morfológica
Durante la floración y dos años después del establecimiento, se evaluaron los siguientes descriptores morfológicos: altura total de la planta (AP), altura de follaje (AF), densidad de tallos (DT), grosor de tallos (GT), ancho de hoja (AH), largo de hoja (LH), longitud de inflorescencia (LI), diámetro del macollo (DM) y rendimiento de materia seca (RMS). La AP se midió desde el nivel del suelo hasta la punta de la inflorescencia más alta. La AF se midió desde el suelo hasta la altura de las hojas. El GT se midió con un vernier, tomando un tallo al azar de la parte central de la planta. Para medir LH y AH se tomó una hoja al azar de la parte central de la planta. La LI se midió tomando una inflorescencia al azar y midiendo de la base hasta la punta de la misma. El DM se midió en la base, a nivel del suelo. El RMS se obtuvo cortando las plantas a 5 cm sobre el nivel del suelo y el forraje se colocó en bolsas de papel y se secó en una estufa de aire forzado a 70 °C por 48 h.
Caracterización molecular
Los ecotipos se agruparon en 51 poblaciones para su análisis. La extracción de ADN se realizó siguiendo el método de Doyle y Doyle19 y para el análisis AFLP el protocolo de Vos et al20 que incluye los siguientes componentes:
Digestión: se añadieron 1.5 µl de solución amortiguadora de reacción (RL) 10X, 2 µl de templado de DNA a 50 ng/µl, 0.5 µl de enzima Eco RI (10 U/µl), 0.5 µL de enzima Mse I (10 U/µl) y se llevó la reacción hasta un volumen de 12.5 µl con agua desionizada estéril. La mezcla se centrifugó e incubó a 37 ºC durante 2 h y por 15 min a 70 ºC para inactivar las enzimas de restricción. Se corroboró en un gel de agarosa al 1% teñido con bromuro de etidio.
Ligación de adaptadores: a la reacción de digestión se añadieron 0.3 µl de adaptador Eco RI (50 pmol), 0.3 µl de adaptador Mse I (50 pmol), 1.2 µl de ATP (10 mM, pH 7.0), 1.0 µl de solución amortiguadora de reacción (RL) 10X, 1.0 µl de T4 DNA ligasa (5U/µl) y 6.2 µl de agua desionizada estéril, se mezcló, centrifugó e incubó por 2 h a 16 ºC.
Preamplificación: se añadieron 2.5 µl de DNA digerido, ligado y diluido 1:10, 1.15 µl de Oligo Eco RI + A (50 ng/µl), 1.15 µl de Oligo Mse I + A (50 ng/µl), 0.5 µl de dNTPs (10 mM), 2.5 µl de solución amortiguadora de reacción de la enzima Taq DNA polimerasa, para PCR (10X), 0.65 µl de MgCl2 (50 mM), 0.2 µl de enzima Taq DNA polimerasa (5 U/µl) y 16.85 µl de agua desionizada estéril. Se mezcló, centrifugó y se puso en un termociclador a 20 ciclos a 94 ºC por 30 seg, un min a 56 ºC y 1 min a 72 ºC, y mantenimiento final a 4 ºC.
Amplificación selectiva: se añadieron 2.0 µl de DNA preamplificado y diluido 1:40, 4.9 µl de agua desionizada estéril, 1.1 µl de solución amortiguadora de reacción de la enzima Taq DNA polimerasa, para PCR (10X), 0.3 µl de MgCl2 (50 mM), 0.5 µl de enzima Taq DNA polimerasa (5 U/µl), 1.0 µl de Oligo Mse I + 4 bases selectivas (30 ng/ µl), 0.2 µl de dNTPs (10 mM), 0.5 µl de Oligo Eco RI + 3 bases selectivas marcado a 700, 0.5 µl de Oligo Eco RI + 3 bases selectivas marcado a 800. Se programó el termociclador con 1 ciclo a 94 ºC por 30 seg, 30 seg a 65 ºC y 1 min a 72 ºC. Doce ciclos en donde subsecuentemente se disminuye la temperatura de hibridación (65 ºC) 0.7 ºC por ciclo, mientras las otras temperaturas se mantienen igual. Seguido de 23 ciclos a 94 ºC por 30 seg, 30 seg a 56 ºC y un minuto a 72 ºC, al final, se mantuvo la reacción a 4 ºC. La electroforesis se realizó en gel de acrilamida al 6.5%, con urea 8M y TBE 1X (Tris 1M, ácido bórico 1M, EDTA 20 mM, pH 7.0). La separación de los fragmentos amplificados se hizo en el analizador de DNA LI-COR, cargando 0.8 µl de muestra en un pozo y utilizando el marcador de peso molecular de 50 a 700 pb. Se utilizaron oligos o primers, marcados con fluorescencia, a diferentes longitudes de onda (700 nm y 800 nm)20. Los marcadores de AFLP utilizados fueron del tipo quimioluminiscentes21.
A los datos morfológicos se les realizó un análisis de componentes principales (ACP) y un análisis de conglomerados (AC), mediante el método de Ward22. Para obtener la gráfica de dispersión se utilizó el programa PC-ORD y el MINITAB v15 para obtener el dendrograma. Con el patrón de bandeo de los datos moleculares se realizó una matriz binaria de presencia y ausencia de bandas. Estos datos moleculares se analizaron con el paquete estadístico NTSysPC (v 2.1). También, se estimó la similitud genética entre los ecotipos, utilizando el programa SIMQUAL con el coeficiente Dice y como método de agrupamiento, se utilizó el de Promedio Aritmético por Grupos de Pares No Ponderadas (UPGMA).
Resultados y discusión
Caracterización morfológica
La altura de planta varió de 40 hasta 104 cm y la del follaje de 25 hasta 62 cm. La densidad y grosor de tallos tuvo un rango de 20 a 352 y de 1.0 a 3.0 mm, respectivamente. El ancho de hoja fue de 2.0 a 8.0 cm y la longitud de hoja de 6.0 a 25 cm. La longitud de inflorescencia mantuvo una variación de 12 a 37 cm y el rango del diámetro de macollo fue de 4 a 20 cm. Finalmente, los valores de rendimiento de materia seca fueron de 4 a 260 g/planta. Algunas de estas variables morfológicas como altura de follaje, altura de planta, densidad de tallos por planta, entre otros, coinciden con las reportadas por Schellenberg et al23, al evaluar la variación fenotípica de colecciones de pasto banderita en Canadá.
El análisis de componentes principales (ACP) mostró que los tres primeros componentes principales (CP), explican el 73.83 % de la variación. Las variables fenotípicas que más contribuyeron con el CP1 fueron rendimiento de materia seca (0.430), densidad de tallos (0.414) y diámetro de macollo (0.402). Estas variables están relacionadas con potencial para producción de forraje. Para el CP2 las variables ancho de hoja (0.68 y grosor de tallos (0.64) fueron las de mayor contribución y pueden estar relacionadas con calidad de forraje. Resultados similares mencionan Schellenberg et al23, quienes reportan correlaciones positivas en densidad de tallos (0.51) y diámetro del macollo (0.50) con el CP1 (Cuadro 2).
Cuadro 2 Vectores característicos de las variables de mayor valor descriptivo respecto a su componente principal en 51 poblaciones de pasto banderita
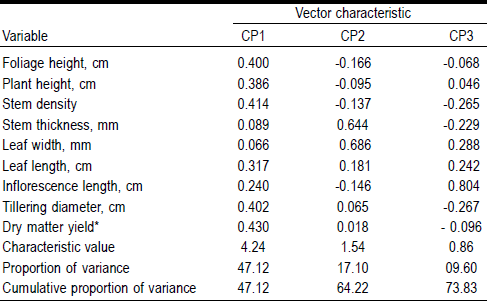
* (g/plant/35 d).
Al correlacionar el rendimiento de materia seca con las otras variables originales, se presentaron correlaciones significativas con las variables densidad de tallos (r= 0.81; P<0.0001), diámetro de macollo (r= 0.71; P<0.0001), altura de follaje (r=0.68; P<0.0001) y altura de planta (r= 0.56; P<0.0001). Además, se correlacionaron las nueve variables con los tres primeros componentes principales. El CP1 presentó una correlación significativa (P<0.0001) con rendimiento de materia seca (88 %), densidad de tallos (85 %), diámetro de macollo (83 %), altura de follaje (82 %), altura de planta (79 %) y longitud de hoja (65 %). El CP2 presentó una correlación significativa (P<0.0001) solo con ancho de hoja (85 %) y grosor de tallos (80 %). Por último, el CP3 presentó solo correlación significativa (P<0.0001) con longitud de inflorescencia (74 %). Considerando lo anterior, se encontró que la colección ex situ de pasto banderita presentó amplia diversidad morfológica, debida probablemente a las condiciones ambientales de los sitios de origen24, por lo que algunos de estos ecotipos (B444, B359, B563, B557 y B455) tienen características importantes para ser considerados en la restauración de pastizales.
A partir de las correlaciones obtenidas se pueden seleccionar los ecotipos B444, B359 y B563, considerando el potencial que tienen para protección y estabilidad de suelo. Estas correlaciones y varianzas observadas, son congruentes con las obtenidas por Schellenberg et al23, al evaluar el comportamiento en la variación fenotípica de varias colecciones de pasto banderita, recolectas en varias localidades de Canadá, donde reporta que los primeros dos CP explicaron el 91 % de la varianza entre colección. Además, se han realizado otros estudios en pastos del género Lolium25, Panicum10, Bromus26 y Bouteloua24, los cuales concluyen que la evaluación de la variabilidad morfológica constituye la base para seleccionar material para diversos usos en la rehabilitación o restauración ecológica; producción forrajera, materiales con potencial para retener suelo, ecotipos resistentes a sequía, entre otros propósitos.
La Figura 1 muestra la amplitud de la diversidad morfológica existente en las poblaciones de pasto banderita. Las variables que más contribuyeron fueron rendimiento de materia seca, densidad de tallos, altura de forraje, altura de planta y diámetro de macollo. Esta variabilidad morfológica y genética encontrada es de gran utilidad en la búsqueda y selección de caracteres como rendimiento de forraje y de semilla, además de la calidad; ya que el pasto banderita tiene la cualidad de ser una especie apomíctica, lo cual permite heredar a su descendencia estas características. Con esta variación observada, se puede establecer un banco de germoplasma para conservar y evaluar dicha variación en programas de mejoramiento genético y crear ecotipos mejorados de acuerdo a estos descriptores y con potencial para su uso en programas de rehabilitación de pastizales.
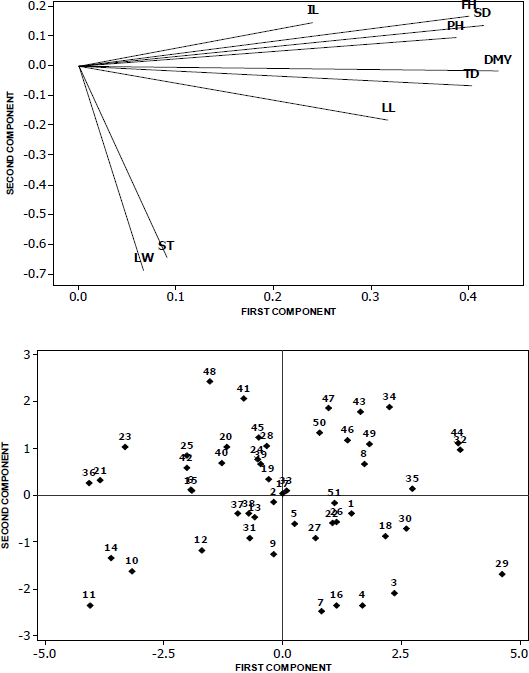
Figura 1 Distribución de la diversidad morfológica de 51 poblaciones de pasto banderita en función de los dos primeros componentes principales, obtenidos con la matriz de correlación de las nueve variables
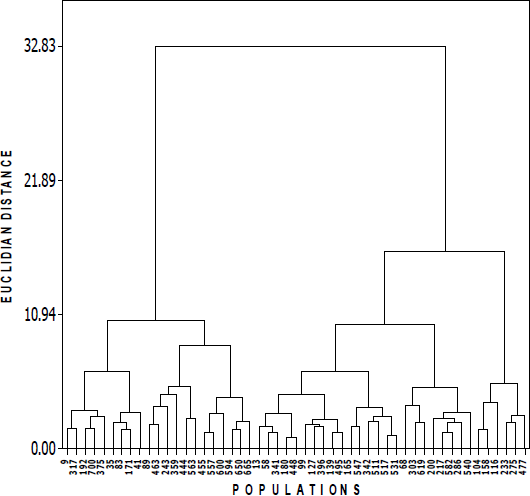
El análisis de conglomerados integró a tres grupos basados en el método de ligamiento WARD (Figura 2). El grupo I (G-I) integró 21 poblaciones originarias de 15 municipios (Chihuahua, Casas Grandes, Namiquipa, Buenaventura, Satevó, Valle de Allende, Gran Morelos, Valle de Zaragoza, Villa López, Julimez, Villa Ahumada, Jiménez, Manuel Benavides, Camargo y Ojinaga). Estos ecotipos se caracterizan por presentar los valores más altos de todas las nueve variables evaluadas. El subgrupo I-a integró nueve poblaciones y se caracterizó porque presentaron las mayores alturas de planta (96 cm). El subgrupo I-b integró a las seis poblaciones que presentaron en promedio los valores más altos de densidad de tallos (271), longitud de hojas (20 cm), longitud de inflorescencia (32 cm), diámetro de macollo (16 cm) y rendimiento de materia seca (176 g/planta). El subgrupo I-c agrupó también a seis poblaciones con las mayores alturas de follaje (60 cm), originarias de los municipios de Ojinaga y Chihuahua. El grupo II (G-II) integró 24 poblaciones originarias de 15 municipios y en general este grupo presentó valores intermedios de las variables morfológicas evaluadas. Por último, el grupo III (G-III) integró seis poblaciones originarias de los municipios de San Francisco del Oro, Namiquipa, Balleza, Villa ahumada, Ascensión y Chihuahua. Estas poblaciones se caracterizaron porque presentaron los valores más bajos de altura de follaje (29 cm), altura de planta (58 cm), densidad de tallos (30), longitud de hoja (12 cm), longitud de inflorescencia (23 cm), diámetro de macollo (6.2 cm) y rendimiento de materia seca (8.7 g/planta).
Caracterización molecular
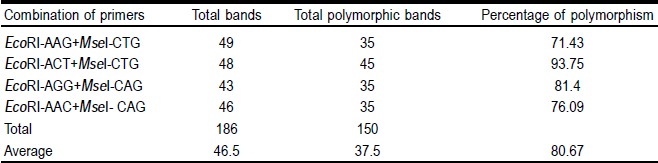
El análisis de AFLP, con los cuatro pares de iniciadores, detectó 186 bandas; 80.67 % (150 bandas) presenta polimorfismo (Cuadro 3). El número de bandas polimórficas fue de 35, 45, 35 y 35 para las combinaciones de iniciadores EcoRI-AAG+MseI-CTG, EcoRI-ACT+MseI-CTG, EcoRI-AGG+MseI-CAG y EcoRI-AAC+MseI-CAG, respectivamente. El mayor porcentaje de polimorfismo (93.75 %) y bandas polimórficas (48) se obtuvo con la combinación de iniciadores EcoRI-ACT+MseI-CTG. Estos resultados en el número de bandas obtenidas son congruentes con otras investigaciones realizadas, con relación a la eficiencia para utilizar esta técnica para generar mayor número de polimorfismo27. Para estudios futuros de diversidad genética en poblaciones de pasto banderita, se recomienda utilizar la combinación EcoRI-ACT+MseI-CTG, ya que detectó la mayor variabilidad. Trabajos realizados en Agrostis stolonifera, obtuvieron de 100 a 150 bandas con 22 a 94 bandas polimórficas28. Sin embargo, en Schizachyrium scoparium reportan 854 fragmentos en tallo y 653 en semilla con 158 bandas bien definidas. En general, detectan un polimorfismo mayor a 91 % en estas poblaciones29.
Cuadro 3 Nivel de polimorfismo detectado en 51 poblaciones de pasto banderita para cada combinación de iniciadores, empleados en el análisis de AFLP
Los valores de similitud obtenidos al utilizar el coeficiente de Dice en las comparaciones pareadas de las 51 poblaciones del pasto banderita, variaron entre 0.267 y 0.96 (datos obtenidos de matriz de similitud genética). Considerando estos valores de similitud, nos indican que existe alta diversidad genética en esta especie, requisito indispensable para iniciar programas de mejoramiento genético. Los rangos obtenidos en el coeficiente de similitud de las poblaciones de pasto banderita, son congruentes con los reportados en especies del género Festuca y en Cynodon transvaalensis30.
El análisis de conglomerados, basado en datos moleculares utilizando el coeficiente de Dice (Figura 3), separó aparentemente en un número mayor de grupos, en comparación al dendrograma basado en variables morfológicas mostrado en la Figura 2. Hay algunos nodos que agrupan poblaciones de municipios cercanos, por ejemplo: analizando en la Figura 3 el árbol de arriba hacia abajo, inicia un nodo con B104 y B99 que son de 2 municipios colindantes (San Francisco del Oro y Huejotitán), ubicados al sur del estado de Chihuahua, pero no siempre ocurrieron estas agrupaciones. Más abajo, el nodo que agrupa las poblaciones B200 y B217 (también en ubicación hacia la derecha), es el nodo más cercano a 1 en la escala del dendrograma, coincide obviamente con el valor mayor de similitud que se presentó en las poblaciones (96 %, dato obtenido de matriz de similitud genética). Estas poblaciones con similitud genética alta, son originarias del mismo municipio: las de Chihuahua, son las de mayor homogeneidad genética, ya que presentaron similitud en cinco de los descriptores evaluados. Estas poblaciones fueron recolectadas a una altitud aproximada de 1,589 y 1,615 m, respectivamente y provenientes de este mismo municipio, Chihuahua. Además se observa más abajo en el árbol otro subgrupo donde se integran las poblaciones B495, B511, B477 y B665, cuyas altitudes de recolecta van de 1,577, 1,310, 1,602 y 1,653 m, respectivamente. Algo similar sucede con las poblaciones provenientes del municipio de Buenaventura, donde se agruparon B341 y B342 con un valor bootstrap alto (96), también presentan prácticamente iguales cinco descriptores fenotípicos de los caracteres evaluados. Las poblaciones B359 y B375 con un valor bootstrap aceptable (64) con altitudes de recolecta prácticamente iguales 1,522 a 1,543 m, con mínimas oscilaciones, comparten similares características fenotípicas en los descriptores de las hojas (ancho y largo) y alturas de follaje cercanas. Del municipio de Camargo, también sus dos poblaciones analizadas, B448 y B455 se agruparon, también compartieron algunos descriptores fenotípicos similares, aunque sus altitudes varían un poco (1,318 vs 1,403 m). Otro ejemplo que se observa es el grupo de las tres poblaciones de Ojinaga (B594, B600 y B582), también con algunas características similares fenotípicas entre ellas quienes a su vez, se agrupan con otras poblaciones de municipios cercanos, B463 de Julimes, B650 de Chihuahua y B619 de Rosales que están colindando dentro del estado hacia el centro. Esto indica que algunas poblaciones cercanas genéticamente también están correlacionadas con su morfología y ubicación geográfica, aunque no es una situación general. También, esta representación gráfica indica la existencia de diversidad genética, lo cual se requiere para trabajos sustentables del recurso filogenético. Estos resultados son congruentes con relación a la efectividad del uso de la técnica AFLP para estudios de diversidad genética en pastos, similar a lo descrito por Roldán-Ruiz et al31. Además, se muestra que esta técnica facilita valoraciones rápidas y eficientes de la diversidad genética en este tipo de poblaciones nativas32.
Conclusiones e implicaciones
Los recursos genéticos de pasto banderita recolectados en el estado de Chihuahua, presentaron alta variabilidad morfológica y molecular. Las variables morfológicas con mayor variación fueron rendimiento de materia seca, densidad de tallos, diámetro de macollo, altura de follaje, altura de planta y longitud de hoja. La combinación de iniciadores EcoRI-ACT+MseI-CTG detectó el mayor polimorfismo, revelando los niveles de variación genética más elevados. Se pueden elegir a los ecotipos B444, B359 y B563 por su alto potencial y atributos sobresalientes.











 texto en
texto en