INTRODUCCIÓN
La respuesta de estrés se desencadena en un animal cuando él mismo percibe un estresor. Luego se activan en forma simultánea la respuesta del sistema nervioso autónomo simpático y la endocrina (eje-hipotálamo-hipófiso-adrenal)1. En conjunto, ambas producen cambios fisiológicos y de comportamiento agudos, que ayudan al organismo a adaptarse y responder al estresor1. En roedores, los tratamientos con progesterona (P4) reducen la respuesta de estrés o ansiedad, básicamente a través de algunos metabolitos de la P4 llamados metabolitos neuroactivos, como la allopregnanolona y la pregnanolona2,3. Estos metabolitos pueden reducir la percepción y reacción al estresor, teniendo un efecto ansiolítico4, y por tanto actuar mitigando la respuesta del eje-hipotálamo-hipófiso-adrenal2,5,6, generando como efecto global una disminución de la respuesta de estrés3,7,8.
Aunque su aplicación tiene un potencial importante en sistemas productivos, en rumiantes existen pocos trabajos que hayan estudiado los efectos de la P4 sobre el comportamiento reactivo y la respuesta de estrés. Se ha reportado que el tratamiento sostenido con P4 reduce la respuesta de estrés al destete en ovejas9. Además, la respuesta de estrés de ovejas gestantes (situación fisiológica en que los animales presentan altas concentraciones de P4), al aislamiento social10 y a la esquila, es menor que la de ovejas vacías. Por otro lado, recientemente se determinó que el tratamiento con P4 afecta la reactividad de terneros frente al manejo humano11. En este contexto, el tratamiento con P4 puede ser una alternativa práctica para reducir el estrés generado por manejos estresantes en rumiantes, mejorando así su bienestar. Además, sería importante considerar las concentraciones fisiológicas de P4 que tienen los animales a la hora de seleccionarlos por su comportamiento reactivo, para así optimizar los resultados de los procesos de selección.
El objetivo de esta revisión fue sintetizar información básica sobre la respuesta de estrés en mamíferos, y los principales mecanismos estudiados en roedores por los que la P4 mitiga la respuesta de estrés. Además, se presenta información sobre los efectos del tratamiento con P4 en el comportamiento reactivo y la respuesta de estrés en rumiantes.
RESPUESTA DE ESTRÉS
Respuesta aguda
Cuando un individuo percibe un estresor (agente capaz de desencadenar la respuesta de estrés) de corta duración (desde minutos hasta horas), se activan en forma simultánea dos respuestas: la del sistema nervioso autónomo simpático, y la endocrina1,12,13. La del sistema simpático es la que se visualiza más rápidamente, a los pocos segundos o hasta minutos después de que se expone el animal al estresor13. Sin embargo, aunque la respuesta endocrina demora un poco más en visualizarse, presenta efectos más sostenidos en el tiempo (minutos a horas). La mayor demora del sistema endocrino se debe al tipo de mecanismos que se ponen en juego, y no al momento en que se desencadena la respuesta, ya que los glucocorticoides no se acumulan y se deben producir en el momento, requiriendo de más tiempo12,14. En conjunto, ambas producen cambios fisiológicos y comportamentales que ayudan al organismo a adaptarse y responder al estresor1. La magnitud de estas respuestas puede depender de factores del animal como ser la experiencia previa con ese estresor, el temperamento, y la percepción del estresor por parte del individuo15,16.
Respuesta simpática
Cuando el sistema nervioso autónomo simpático es estimulado, se liberan los neurotransmisores adrenalina y noradrenalina en las sinapsis adrenérgicas. Se les denomina también catecolaminas, y son liberadas al torrente sanguíneo por células ubicadas en la médula de las glándulas adrenales17. De manera general, los efectos generados por las catecolaminas son un aumento de la frecuencia cardiaca y respiratoria, elevación de la temperatura, aumento de la glucemia por estimulación de la glucogenólisis, midriasis, vasodilatación en la musculatura esquelética y vasoconstricción periférica14,17. También aumenta el estado de alerta, la vigilancia y la excitación del animal18.
Respuesta endocrina
Cuando se activa el eje hipotálamo-hipofiso-adrenal, el hipotálamo libera la hormona liberadora de corticotropina (CRH), y vasopresina, las que estimulan la liberación de la hormona adrenocorticotrófica (ACTH) por parte de la adenohipófisis14. La ACTH estimula la secreción de glucocorticoides en la corteza de la glándula adrenal, fundamentalmente el cortisol y la corticosterona14, siendo el cortisol el glucocorticoide predominante en los rumiantes19. Los glucocorticoides estimulan la gluconeogénesis, la lipólisis y el catabolismo de las proteínas, elevando la glucemia, con lo que se dispone de energía para que el organismo pueda responder al estresor20. Además, los glucocorticoides aumentan la perfusión cerebral, la utilización de glucosa, la presión arterial y el rendimiento cardíaco21. Los glucocorticoides también tienen una acción en el sistema inmune, provocando linfopenia, eosinopenia y neutrofilia22. Con el cese de la acción del estresor ocurre la inactivación del eje hipotálamo-hipófiso-adrenal a través de una retroalimentación negativa, donde los propios glucocorticoides inhiben la secreción de CRH, vasopresina y ACTH18.
RESPUESTA CRÓNICA
La respuesta crónica de estrés se da cuando un animal es expuesto de forma continua o intermitente a estresores durante periodos de tiempo más prolongados (desde días hasta semanas)23. Este tipo de respuesta de estrés es frecuente en los sistemas de producción de rumiantes, ya que los estímulos estresantes generalmente se mantienen activos durante horas o semanas. La exposición sostenida a los glucocorticoides produce efectos deletéreos sobre los resultados productivos, la salud y bienestar animal. De manera general las altas concentraciones de glucocorticoides afectan negativamente el sistema inmune, pudiendo inmunosuprimir el animal, y por tanto dejarlo más susceptible a enfermedades22. Los glucocorticoides también promueven cambios comportamentales como la expresión de estereotipias, la reducción del comportamiento sexual y del apetito21,24. Como consecuencia de estos cambios es común que el animal pierda peso, reduzca la calidad y cantidad de pelo o lana, y tenga afectado negativamente su estatus reproductivo.
En síntesis, en general la respuesta de estrés es beneficiosa para el animal, porque una adaptación rápida a una nueva situación permite que el animal mejore su estado, o incluso sobreviva cuando los efectos negativos pudieran ser más importantes25. Sin embargo, cuando el estresor se sostiene en el tiempo, o la intensidad de su efecto sea tan importante para generar una respuesta intensa o de duración sostenida, el resultado final de la respuesta de estrés puede ser negativo para el animal. En muchas situaciones vinculadas a la producción animal, las respuestas indicadoras de estrés no logran modificar la situación que las generó25. Esto sucede, por ejemplo, luego del destete, en que los animales no logran juntarse nuevamente26, durante el transporte en que el animal no puede evitar su traslado, o durante el reagrupamiento social27, en que el animal debe adaptarse a convivir con nuevos individuos previamente desconocidos. En estos casos, las respuestas son costosas para el animal, pero no se modifica la situación, por lo que el resultado final es deletéreo en lugar de ventajoso. En estos casos puede ser importante disminuir la percepción de la intensidad del estresor, o de la respuesta que se desencadena para mejorar el bienestar del animal.
PROGESTERONA Y RESPUESTA DE ESTRÉS: MECANISMOS DE ACCIÓN
La P4 actúa a través de mecanismos genómicos: a partir de la unión a receptores intracelulares induce cambios en la expresión de los genes, lo que estimula o inhibe la transcripción génica y la síntesis de proteínas, generando así la respuesta celular28. Este mecanismo es de respuesta lenta, necesitándose desde minutos hasta días para que se visualice su efecto29. Sin embargo, tanto la P4 como sus metabolitos neuroactivos actúan de forma no genómica a partir de la unión a receptores ionotrópicos en el sistema nervioso central. Estos receptores son miembros de la superfamilia de canales iónicos que regulan la neurotransmisión rápida, promoviendo cambios inmediatos, en el orden de los milisegundos a segundos30.
La P4 atraviesa fácilmente la barrera hematoencefálica pudiendo alterar la excitabilidad neuronal en el sistema nervioso central (SNC), al antagonizar receptores de neurotransmisores serotoninérgicos e inhibir receptores nicotínicos31,32. Además presenta una baja afinidad a los receptores neuronales inhibitorios como el receptor ácido γ-aminobutiricoA (GABAA), receptor inhibitorio encontrado en la mayoría de las neuronas del SNC de los mamíferos33, y receptor de la glicina34. Basado en lo anterior, la P4 puede promover efectos inhibitorios o reduce efectos excitatorios en el SNC.
Adicionalmente, en mamíferos a partir de la P4 se generan metabolitos que circulan en sangre, como la dihidroprogesterona, la allopregnanolona y la pregnanolona35,36, que también atraviesan la barrera hematoencefálica37. La P4 y la dihidroprogesterona también pueden ser metabolizadas en el propio cerebro hasta allopregnanolona y pregnanolona38. De esa manera, los metabolitos neuroactivos de la P4 alcanzan concentraciones elevadas en el cerebro39. Una vez en el SNC, la allopregnanolona y la pregnanolona también pueden unirse a receptores GABAA y receptores de la glicina40, o a receptores de la nicotina, de la serotonina y del glutamato41,42,43. Por lo tanto, la allopregnanolona y la pregnanolona pueden reducir la excitabilidad neuronal en el SNC a partir de la interacción con receptores de algunos neurotransmisores. En este sentido, la afinidad y efectos de los metabolitos de la P4 sobre el receptor GABAA han sido los más estudiados entre los receptores mencionados4. La alloapregnanolona y la pregnanolona presentan alta afinidad por el receptor GABAA, modulando positivamente de manera alostérica el mismo44. Esta acción modula preferencialmente la apertura de canales de Cl, lo que resulta en una hiperpolarización de la célula, pudiendo generar efectos ansiolíticos, sedativos y analgésicos45.
La acción clásica de la P4 sobre receptores intracelulares podría estar relacionada a efectos en la reducción de la respuesta de estrés, pero este mecanismo todavía no está bien establecido en la literatura. Algunas evidencias utilizando ratones knock-out para receptores intracelulares de P4, indican que la reducción de la respuesta de estrés o de la ansiedad podría no requerir una acción directa de la P4 sobre sus receptores, aunque en dichos animales se observó una mayor sensibilidad a la P446. Además, Bitran et al7 utilizando ratas pre-tratadas con antagonistas del receptor de P4, no encontraron afectados los efectos de la P4 en la reducción de la respuesta de estrés. Sin embargo, otros estudios realizados en ratas plantean la existencia de un efecto de la P4 o de la dihidroprogesterona sobre los receptores intracelulares de la P447,48,49, ya que se identificó una disminución de la respuesta de estrés en ratas tratadas con medroxiprogesterona (progestina que no puede ser metabolizada hasta los metabolitos neuroactivos de la P4) o pre-tratadas con antagonistas del receptor de P4. La P4 podría estar actuando sobre sus receptores intracelulares en el cerebro, ya que los mismos se encuentran expresados en la amígdala y los núcleos del lecho de la estría terminal49, que son áreas relacionadas con la respuesta de estrés, miedo o ansiedad50. Por lo tanto, la P4 o la dihidroprogesterona podrían actuar directamente uniéndose a estos receptores intracelulares, reduciendo la respuesta de estrés. Sin embargo, hay que considerar que en algunos de estos trabajos que especulan con la existencia de una acción directa de la P4 o de la dihidroprogesterona, utilizaron como indicador de estrés la frecuencia de lordosis47,48,49, comportamiento que también es indicativo de receptividad sexual, lo que no permite discriminar totalmente los efectos.
Más aún, en ratas machos se determinó que la allopregnanolona reduce la expresión de RNAm de CRH, vasopresina, y la secreción de ACTH y por tanto de glucocorticoides2,5,6; y en consecuencia las respuestas fisiológicas2,44 y comportamentales7 indicadoras de estrés. Por lo tanto, los efectos generales de estos metabolitos de la P4 son la reducción de las respuestas fisiológicas y de comportamiento indicadoras de estrés. En la Figura 1 se propone un posible modelo para explicar los mecanismos por los que la P4 mitiga la respuesta de estrés.
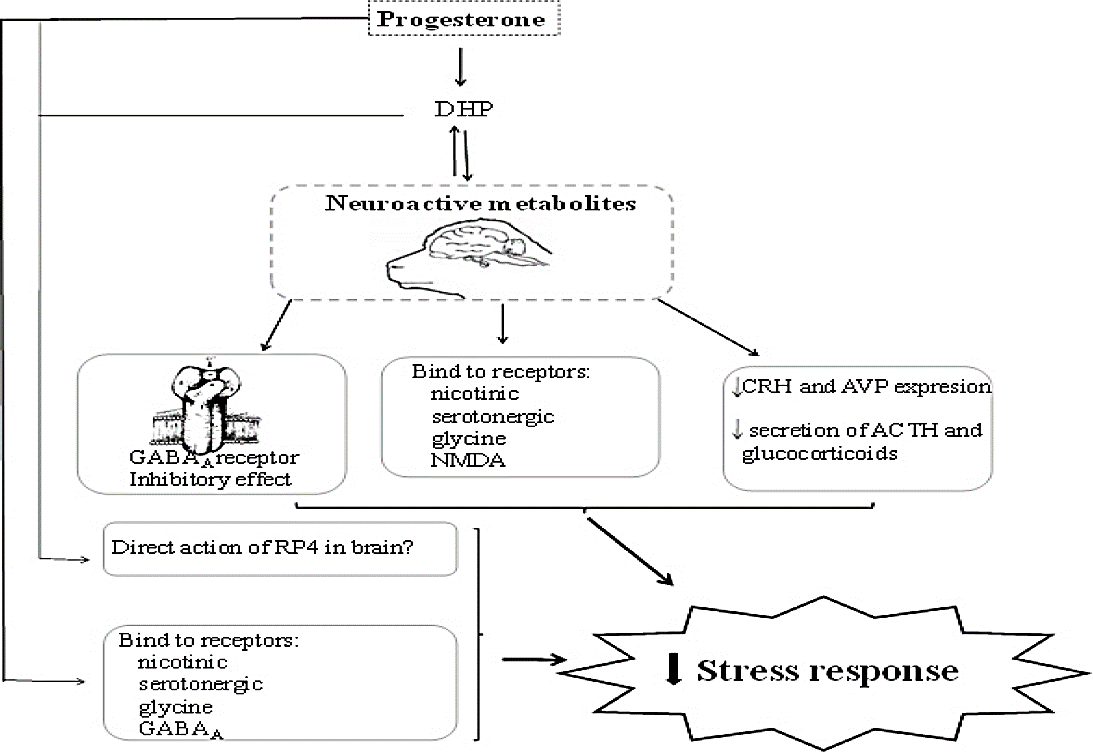
ACTH= Adrenocorticotropic hormone; AVP= arginine vasopressin; CRH= Corticotropin-releasing hormone; DHP= dihydroprogesterone; GABAA= ã-aminobutyric acid type A receptor; RP4= progesterone receptor.
Figura 1 Mecanismos planteados a través de los que la progesterona mitiga la respuesta de estrés
La P4 y sus metabolitos neuroactivos afectan el comportamiento reactivo en diferentes modelos animal. Si bien hay pocos trabajos en rumiantes, se ha reportado que las ovejas gestantes (por tanto, con altos niveles de P4), presentan menor reacción de miedo que las ovejas vacías10. Además, el tratamiento con P4 produce efectos ansiolíticos y analgésicos en ratas8,51, y disminuye el comportamiento agresivo en hamsters52.
EFECTOS DE LA PROGESTERONA DURANTE MANEJOS ESTRESANTES
Destete artificial en ovinos
El vínculo oveja-cordero se establece al parto, y cambia a lo largo del periodo de lactación hasta el destete espontáneo del cordero53,54,55. En los establecimientos de producción ovina es frecuente la realización de un destete artificial, el que implica una separación completa antes del destete espontáneo del cordero, cuando todavía existe un fuerte vínculo madre-cría.
La remoción permanente de los corderos antes de la edad del destete natural es una situación estresante para la oveja y para el cordero, la cual produce respuestas fisiológicas y de comportamiento indicadoras de estrés. Luego de la separación de su cordero, la oveja aumenta la frecuencia de comportamientos relacionados con la búsqueda de la cría, como las vocalizaciones, y el tiempo que pasa parada y caminando, a costa de reducir su tiempo de descanso y alimentación56,57. Asimismo, el destete provoca cambios fisiológicos indicadores de estrés en las ovejas, como el aumento en la concentración sérica de cortisol58, la disminución en la concentración de proteínas séricas totales y globulinas y un aumento en la concentración de albúmina9.
La administración sostenida de P4 mediante dispositivos intravaginales utilizados para sincronizar celos (CIDR, Pfizer, NZ), reduce los cambios fisiológicos y de comportamiento indicadores de estrés en las ovejas3. En este estudio, las ovejas tratadas con P4 presentaron una menor frecuencia de comportamientos energéticamente costosos, como costear y vocalizar, desplegados por la oveja para localizar a sus crías al día del destete. Además, este tratamiento con P4 evitó la reducción en las concentraciones de proteínas totales luego del destete, y provocó una menor disminución en las concentraciones de globulinas. Los valores de globulinas séricas luego del destete en las ovejas no tratadas alcanzaron niveles de hipoglobulinemia59, que podría indicar un estado de inmuno-deficiencia60.
El destete es un manejo estresante, pudiendo dejar el animal más susceptible a enfermedades; por ejemplo, corderos destetados presentan un aumento de la susceptibilidad a parasitosis gastrointestinales56. Recientemente se determinó que un tratamiento con progesterona inyectable administrada solamente el día del destete, reduce la respuesta de estrés en las ovejas, lo que permitiría generar alternativas de aplicación práctica. Este tratamiento redujo la frecuencia en que se observó a las ovejas trasladándose y caminando durante el día del destete, y una tendencia a vocalizar menos que el grupo control (A. Freitas-de-Melo, R. Ungerfeld y R. Pérez-Clariget, datos no publicados). En resumen, el tratamiento con P4 reduce la respuesta crónica de estrés al destete en ovejas, lo que genera un menor efecto negativo sobre el sistema inmune y bienestar animal.
Esquila preparto en ovinos
En los sistemas de producción ovina, la cosecha de lana se realiza mediante la esquila, un manejo estresante para una oveja61,62. El estrés generado por la esquila tiene varios componentes: el movimiento de los animales al corral, ruidos y movimientos vinculados a la esquila de los otros animales, manipulación e inmovilización durante la esquila en un entorno desconocido y la esquila en sí misma63. Por otro lado, también se suma el estrés térmico generado por la pérdida de la capa naturalmente aislante del ovino, especialmente cuando se realiza en invierno64. La respuesta de estrés es similar en ovejas esquiladas a mano o con máquina de esquilar65. Como parte de la respuesta inmediata de estrés se ha reportado un aumento en las concentraciones sanguíneas de cortisol62 y de glucosa63, y un aumento importante de la temperatura corporal66. En algunos trabajos se ha reportado que la temperatura corporal se mantiene alta durante varias semanas, e incluso desaparecen sus variaciones circadianas normales67.
Otras respuestas agudas indicadoras de estrés son la disminución en la cantidad de neutrófilos y de la relación neutrófilos/linfocitos y la eosinofilia67. Durante el período inmediato de la esquila, aumenta el despliegue de comportamientos de confort y el consumo de alimento, disminuye la frecuencia de ingesta de agua, y no son afectados los comportamientos sociales68. La esquila realizada durante el invierno, disminuye la temperatura corporal69. Durante los días siguientes a la esquila el animal se adapta a la falta de lana, activando mecanismos termorreguladores, como la disminución en la frecuencia respiratoria, el aumento de la frecuencia cardiaca, y un menor consumo de agua70. Estos cambios generan mayores demandas de energía y por tanto un aumento en el consumo de alimento71. Esto se ve asociado con un aumento de proteínas totales en sangre, aumento que se mantiene durante un período prolongado, el que es independiente de posibles cambios en el peso de la oveja72. Recientemente se demostró (R. Ungerfeld, J.P. Damián, A. Freitas-de-Melo y R. Kremer, datos no publicados) que el aumento de las concentraciones de cortisol es menor si se esquilan ovejas preñadas que ovejas vacías. Además, los cambios de comportamiento generados por la esquila fueron menores en las ovejas preñadas (A. Freitas-de-Melo, R. Ungerfeld, J.P. Damián, y R. Kremer, datos no publicados). En síntesis, la esquila es un manejo estresante, y este estrés puede reducirse realizando una esquila en el final de la gestación, lo que abre también la posibilidad de especular con el uso de tratamientos exógenos con P4.
Pruebas para determinar el temperamento animal a partir de la interacción con el humano
El temperamento del individuo puede ser determinado a partir de los cambios de comportamiento del animal que resultan del miedo generado por el hombre o por un ambiente novedoso73. En bovinos, los resultados de las pruebas que evalúan el temperamento pueden variar de acuerdo con la raza, género, experiencia y genética74. Se ha reportado que los animales Bos indicus y sus cruzas son más temperamentales que los Bos taurus73, y los novillos son más tranquilos que las vaquillonas75. El temperamento nervioso se refiere a animales que reaccionan violentamente cuando son manejados por humanos, siendo este tipo de temperamento más difícil de manejar que los animales de temperamento dócil75. Existen varios métodos para determinar el temperamento en bovinos76. Algunas pruebas como la puntuación de la balanza son consideradas parcialmente subjetivas, pero otras pruebas como la distancia de fuga son pruebas objetivas que evalúan el desplazamiento del animal frente a la presencia humana77.
El temperamento de los bovinos es una característica cuantificable y heredable78, siendo utilizado para seleccionar animales de temperamento calmo mejorando las condiciones de manejo79. A la hora de medir el temperamento es importante utilizar métodos objetivos y considerar los factores que pueden afectar los resultados de estas pruebas. En grandes hatos bovinos el temperamento presenta una baja heredabilidad80,81, pero esto puedo estar relacionado con la manera de obtener los resultados de las pruebas de temperamento. Comúnmente la evaluación del temperamento se realiza en forma simultánea en todo el hato bovino de un predio, o en parte de éste de acuerdo a los hatos que se manejen82. Normalmente sistemas pastoriles, presentan vacas con una gran variedad de estados reproductivos83, pudiendo coexistir vacas gestantes, en anestro y ciclando84,85. Los diferentes estados reproductivos de las vacas determinan variaciones en las concentraciones de P4; por lo tanto, los diferentes estados reproductivos de las hembras podrían afectar el comportamiento reactivo del animal al manejo humano. Recientemente se comprobó que variaciones en la concentración de P4 afectan los resultados de las pruebas de temperamento en terneras11, las cuales al ser tratadas con P4 administrada a partir de un CIDR, presentaron menor distancia de fuga al humano que las terneras no tratadas, lo que indica menor reactividad al humano cuando los niveles de P4 están elevados. Por lo tanto, se sugiere que el estado reproductivo de los animales puede afectar la evaluación del temperamento, lo que debería ser considerado al trabajar en explotaciones en que pueda haber vacas en diferentes estados fisiológicos.
CONCLUSIONES
Como se verificó, los tratamientos con P4 reducen la respuesta de estrés mediante varios mecanismos. Aunque los resultados de diversos estudios son consistentes, la mayoría de ellos se realizaron en animales de laboratorio, siendo aún escasa la información generada en animales de producción. La disminución de la respuesta de estrés en situaciones que no pueden ser modificadas por el animal, como son la mayoría de las que surgen como consecuencia de manejos productivos, es beneficiosa para el animal. Estas respuestas son costosas e inefectivas, por lo que es importante disminuir la percepción del estresor o los costos de la respuesta. En este sentido, si bien los primeros resultados son auspiciosos, es necesario realizar más investigación relacionada a los efectos de la P4 sobre la repuesta de estrés en rumiantes, cuáles son los mecanismos por los que actúa en estas especies, y cómo podría ser utilizada para mejorar los resultados productivos y el bienestar animal.





![Caracterización de variedades de pasto banderita [Bouteloua curtipendula (Michx.) Torr.] recomendadas para rehabilitación de pastizales](/img/pt/next.gif)





 texto em
texto em 


