Introducción
El cultivo celular se precisa como la forma de propagar y mantener fuera del organismo, en condiciones in vitro, células de origen animal o vegetal; que pueden formar monocapa o mantenerse en suspensión manteniendo sus funciones1. Las líneas celulares son aquellas células que lograron diferenciarse genética y morfológicamente de las estirpes de las que se derivaron, se han mantenido en cultivos continuos y pueden crecer de manera indefinida2. La línea celular RF/6A3 cuyo origen es el mono Macaca mulatta ha sido ampliamente utilizada tanto en estudios toxicológicos para evaluar la efectividad de algunos fármacos4, así como en infecciones con la rickettsia Anaplasma marginale debido a sus propiedades de células endoteliales5. No obstante, los datos publicados son insuficientes debido a que no se indican condiciones y características específicas de las células en cultivo, los ensayos son de corto plazo y sus datos no son homogéneos o sólo muestran el número de pases6. La línea DH82 se deriva de un perro (Canis lupus familiaris) de raza Labrador dorado (Golden retriever) de 10 años de edad que padecía histiocitosis maligna6,7,8 y ha sido utilizada para la multiplicación del microorganismo Ehrlichia canis9,10 y en su interacción con eritrocitos infectados con Anaplasma marginale11; recientemente se describió una caracterización inmunológica parcial de la línea celular DH82, en la que se acentuaba la necesidad de generar más información relativa a las propiedades de las líneas celulares12.
El interés que tiene el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias de conocer las características de propagación de estas líneas celulares en cultivo, radica en establecer un modelo de estudio para el cultivo in vitro de la rickettsia Anaplasma marginale, agente causal de la anaplasmosis bovina, enfermedad que representa un impacto negativo para la economía ganadera de zonas tropicales de México y el mundo13,14. Ocupados en dicha se plantea la realización de experimentos que nos permitirán estudiar el comportamiento de las células de las líneas DH82 y RF/6A en cultivo antes de la infección con el microorganismo. El objetivo de la investigación fue conocer el crecimiento y desarrollo de ambas líneas celulares en condiciones normales de laboratorio, para definir un patrón de su comportamiento.
Materiales y métodos
Líneas celulares: Ambas líneas, DH82 (Canis lupus familiaris) y RF/6A (Macaca mulatta), utilizadas en esta investigación se obtuvieron comercialmente en forma congelada de “American Type Culture Collection” (ATCC), CRL-10389™ y CRL-1780™, respectivamente. Cada una fue rápidamente descongelada en baño maría a 37 °C y suspendida en medio mínimo esencial (MEM) según formulación de “Eagle”, con 2.0 mM L-glutamina (Sigma-ALDRICH QUÍMICA, SA. de CV Edo. de México; México. No. de Cat. MO643-10x1L) suplementado con 1.0 mM piruvato de Na, 1.5 g/l de NaHCO3 y 15 % (v/v) suero fetal bovino inactivado a 56 °C para la línea DH82 (MEM 15i); para RF/6A se utilizó 10% (v/v) de suero fetal bovino sin inactivar (MEM 10). Ambas líneas celulares se adicionaron en una columna de 2 mm de altura, equivalente a un volumen de 2 μl/mm2 y mantenidas por pases sucesivos en botellas de 25 cm2 (Corning Inc. Corning, NY; EE.UU.; No. de Cat. 430372), con tapón flojo, hasta el momento de su uso experimental. Tanto en el proceso de su mantenimiento como en los ensayos experimentales, los cultivos se incubaron a 37 °C en una atmósfera de 5.0 % (v/v) de CO2 en aire, saturado de humedad15.
Experimento de la dosis mínima inicial de DH82
Para dilucidar la cantidad mínima de células requeridas para iniciar los cultivos, se partió de una concentración de 5.0 x 105 células en su 3er pase, suspendidas en 350 μl de medio de cultivo completo MEM15i; realizando diluciones dobles, para reducir el inóculo a 2.5 x 105, 1.25 x 105 y 6.25 x104 células suspendidas en 350 μl de MEM15i. Las células se sembraron por cuadruplicado inoculando 350 μl/pozo, utilizando dos placas de 24 pozos (CORNING Inc. Corning, NY; EE.UU. No. de Cat. 35249). El cambio del medio se realizó cada 72 h, hasta el momento de la cosecha. Ésta tendría lugar cuando cualquiera de los pozos de cualquier tratamiento llegara a ≥95 % de confluencia, cosechándose la totalidad de los pozos mediante disgregación enzimática con 180 μl/pozo de solución 1X de Tripsina-EDTA (Sigma- ALDRICH QUÍMICA, S.A. DE C.V. Toluca, Edo. de México. No. de Cat. 3924) parando la reacción con un volumen igual de medio completo con suero, transfiriendo las células a un microtubo eppendorf de 1.5 ml estéril. Se realizó un lavado por centrifugación a 250 xg durante 15 min a temperatura ambiente (microcentrífuga Hermle Mod. Z230MA), decantando el sobrenadante y resuspendiendo el paquete celular en un volumen de 180 μl de medio completo, empleando un agitador de vórtice. La concentración y viabilidad celular se midió utilizando una muestra de 20 μl adicionada con 20 μl de una solución 0.15 % (p/v) de azul de tripano estéril en solución 0.11 M de NaCl; empleando la cámara de Neubauer®. Para el conteo celular se utilizó un microscopio Leica® de campo claro bajo el objetivo 40X, determinándose los valores promedio, error estándar e intervalo de confianza al 95 %, aplicando el programa Microsoft Office Excel 200716.
Experimento de la dosis mínima inicial de RF/6A
Para identificar la cantidad mínima de células requeridas para iniciar un cultivo de RF/6A, se contaron 5.0 x105 células en su pase 543, suspendidas en 350 μl de medio de cultivo completo MEM10; realizando diluciones dobles seriadas, para tener una suspensión celular de 2.5 x 105, 1.25 x 105 y 6.25 x 104, en una primera fase. Para la segunda fase, el experimento se inició con una concentración celular de 7.07 x 104 células en su pase 551, realizando igualmente diluciones dobles seriadas para obtener una suspensión celular de 3.53 x 104, 1.77 x 104 y 8.84 x 103 en 350 μl del medio MEM10, previamente descrito. En ambas fases, las células se inocularon por duplicado en dos placas de 24 pozos de 350 μl/pozo de la suspensión celular. El cambio del medio se realizó cada 48 h, hasta el momento de la cosecha, misma que se realizó al observarse ≥95% de confluencia en algún pozo, cosechándose la totalidad de los pozos de cada fase. Para realizar el conteo de células, la monocapa de células confluente se disgregó por acción enzimática utilizando 200 μl/pozo de la solución 1X de Tripsina-EDTA. Después de un lavado por centrifugación, se determinó la concentración y viabilidad celular por la exclusión de azul de tripano, registrándose la descripción y los valores obtenidos, según lo descrito para el primer ensayo.
Experimento de la densidad de siembra de DH82
El objetivo fue conocer el intervalo de tiempo para alcanzar el máximo crecimiento, iniciando los cultivos con diferentes concentraciones celulares. Las células en el 4° pase se crecieron por duplicado en dos placas de 24 pozos adicionando 350 μl/pozo de la suspensión celular, con una densidad de 5, 10, 20 y 40 células/mm2. Como en el primer experimento, el cambio del medio se realizó cada 72 h, hasta el momento de la cosecha (≥95 % de confluencia) en cada tratamiento. La concentración y viabilidad celular se determinaron por exclusión del azul tripano, de acuerdo a lo ya descrito y se registraron los valores promedio, error estándar e intervalo de confianza al 95 %.
Experimento de la densidad de siembra de RF/6A
Las células del pase 547 se crecieron en dos placas de 24 pozos empleando el mismo volumen, con densidades de 5, 10, 20 y 40 células/mm2 por duplicado. El cambio del medio se realizó cada 48 h hasta el momento de la cosecha, con el mismo criterio de alcanzar ≥95 % de confluencia. La disgregación enzimática se realizó con 200 μl/pozo de la misma solución 1X de Tripsina-EDTA, lavando las células por centrifugación. En forma similar, se midió la viabilidad y número de células, mediante el método de exclusión de azul tripano.
Ensayo de cinética de desarrollo de DH82
Este experimento se inició con una expansión celular que alcanzó al pase 6. Para ello, se preparó una suspensión celular suficiente para sembrar con el mismo lote 64 cajas Petri de 35 mm Ø x 10 mm alto, marca Costa® (Corning Inc. Bellerica, NY, EE.UU. No. de Cat. 14831), en volúmenes de 2,000 μl/caja, con una densidad de siembra previamente determinada en los ensayos del tercer experimento15, en términos de 20 células/mm2 c/u y se formaron dos grupos. A la mitad de las cajas, 32 unidades, no se les hizo cambio de medio alguno, mientras que a las 32 unidades restantes el cambio de medio se realizó a intervalos regulares de 63 h. Cada 21 h y hasta las 336 h de iniciados los cultivos, se tomaron aleatoriamente dos cajas de cada grupo, cosechando su contenido de la misma manera ya descrita. Al finalizar, se resuspendió el paquete celular en 300 μl de medio completo y determinando su concentración y viabilidad, según lo indicado previamente, tabulando los resultados como valores promedio.
Ensayo de cinética de crecimiento de RF/6A
Este experimento se inició con una expansión celular hasta el pase 551. De la misma manera que en el experimento previo, se preparó una suspensión celular suficiente para sembrar 92 cajas Petri de 35 mm Ø con el mismo pase, en volúmenes de 2,000 μl/caja, con una densidad de siembra determinada en el cuarto experimento, igualmente en células/mm2 y divididos en dos grupos de 46 cajas c/u. A un grupo no se le hizo cambio de medio. A la otra mitad de las cajas, se realizó el cambio de medio a intervalos regulares de 45 h. Aleatoriamente se cosecharon un par de cajas de cada grupo, cada 15 h y hasta las 345 h de iniciados los cultivos, procesando su contenido según lo señalado anteriormente para cosechar la línea RF/6A, resuspendiendo el paquete celular en 300 μl de medio completo y determinando su concentración y viabilidad, tabulando los resultados como valores promedio según lo mencionado.
Determinación del intervalo de duplicación
Con los datos de los dos experimentos anteriores, se aplicó la fórmula de intervalo de duplicación (DT) sugerida por el ATCC17 que toma en consideración la fase de crecimiento logarítmico:
Donde T= tiempo de incubación= intervalo [Tfinal - Tinicial] en horas; Xb= valor inicial del número de células; Xe= valor final del número de células.
Resultados
No se presentaron problemas por contaminación debido al estricto manejo de la asepsia, antisepsia y esterilidad de los componentes utilizados en el cultivo de ambas líneas celulares. La morfología observada al microscopio de contraste de fases fue aparentemente normal. El número de células se determinó por el conteo total de células vivas y muertas.
Dosis mínima inicial de DH82
Este experimento tuvo una duración de siete días a partir del día 0, mismo periodo que tuvo el primer tratamiento en llegar a ≥95 % de confluencia, que correspondió al iniciado con 5.0 x 105 células; cuya concentración máxima promedio alcanzada fue 1.07 x 107 células, esto es un crecimiento de 20.4 veces la concentración inicial. Las concentraciones máxima promedio para los tratamientos restantes fueron: 4.5 x 106, 2.49 x 106 y 7.38 x 105 células, lo que equivale a un crecimiento de 18, 19.9 y 11.8 veces, respectivamente para los cultivos iniciados con 2.5 x 105, 1.25 x 105 y 6.25 x 104 células/pozo. Ninguno de ellos demostró ser estadísticamente significativo. En el Cuadro 1 se muestran los valores de crecimiento obtenidos, las desviaciones estándar y los límites superior e inferior del intervalo de confianza al 95 % (IC95 %).
Dosis mínima inicial de RF/6A
El ensayo tuvo una duración de 10 días en cualquiera de sus dos fases, en que el tratamiento 1 de la primera fase y el tratamiento 5 de la segunda fase, alcanzaron ≥95 % de confluencia. Fue notorio que en todos los tratamientos de la primera fase, hubo un decremento. La mayor caída representada con una reducción del número de células se dio en el tratamiento 1 alcanzando un valor de -4.21 x 105 células seguido de los tratamientos 2, 3 y 4 con reducciones de 1.7 x 105, 5.8 x 104 y 4.5 x 103 células totales. Estos datos, junto con las variables estadísticas pueden observarse en el Cuadro 2.1. La cosecha en el primer ensayo, alcanzó un total de 7.9, 8.0, 6.7 y 5.8 x 104 células totales promedio, respectivamente para los tratamientos 1, 2, 3 y 4. La segunda fase experimental implementada con una concentración menor de células, arrojó resultados positivos. La máxima concentración celular obtenida fue con el tratamiento 8, alcanzando un total de 1.12 x 105 células promedio. Siguieron en rendimiento, los tratamientos 7, 5 y 6, obteniendo respectivamente en promedio 1.03 x 105, 8.48 x 104 y 8.35 x 104 células totales. El IC95 % junto con la evaluación estadística, que no resultó significativa, aparecen en el Cuadro 2.2.
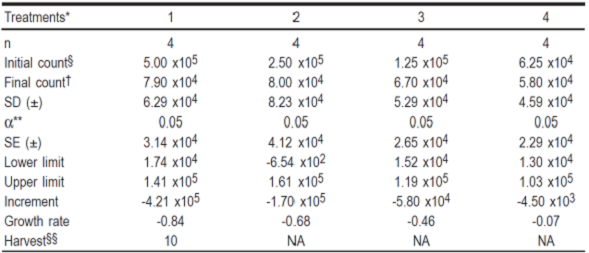
Cuadro 2.1 Valores obtenidos del primer ensayo para la determinación de dosis mínima inicial de la línea celular RF/6A.
Densidad de siembra de DH82
A los 14 días de iniciado el cultivo se obtuvo el primer pozo que llegara a confluencia ≥95 %, que correspondió al inóculo de 40 células/mm2, seguido del inóculo de 20 células/mm2 en el día 15; el día 16 lo fue para el inóculo de 10 células/mm2 y el de 5 células/mm2, el día 17. La mayor concentración celular promedio, al momento de la cosecha se obtuvo con el inóculo de 10 células/mm2 alcanzando un valor de 3.46 x 106 al día 17, seguido del inóculo iniciado con 20 células/mm2 con 3.08 x 106 al día 15, mientras que para los inóculos de 40 y 5 células/mm2 se obtuvieron cuentas de 2.9 x 106 en ambos, a los 14 y 17 días respectivamente. Los valores resultantes de este experimento se resumen en el Cuadro 3, en el que aparecen el error estándar y el IC al 95%, ya que los valores promedio de cada tratamiento resultaron ser no significativos estadísticamente.
Densidad de siembra de RF/6A
Los cultivos fueron alcanzando confluencia progresivamente en relación directa a la densidad del inóculo, en los días 8, 9, 10 y 11 después del inicio del cultivo a los inóculos de 40, 20, 10 y 5 células/mm2. El valor de concentración celular máxima promedio fue de 1.04 x 105 y se obtuvo en el inóculo 10 células/mm2; el valor mínimo promedio de 5.6 x 104 se obtuvo con 5 células/mm2, mientras que los inóculos restantes de 20 y 40 células/mm2, alcanzaron ambos la concentración intermedia de 9.3 x 104 en promedio. Como en el experimento anterior, los valores resultantes de este experimento, mismos que resultaron ser estadísticamente no significativos se resumen en el Cuadro 4.
Cinética de crecimiento DH82
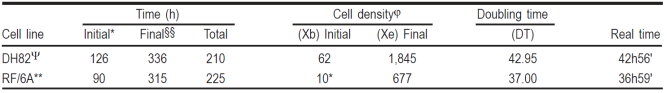
Este experimento tuvo una duración de 336 h o 14 días. La fase de latencia o adaptación tuvo una duración de 126 h en ambos grupos. En el primero sin cambio de medio, alcanzó una concentración celular promedio de 47,025; mientras que en el segundo grupo, con cambio de medio periódico, 59,875 células totales, equivalentes a una densidad de 49 y 62 células/mm2, respectivamente. El crecimiento logarítmico duró hasta las 315 h con un valor de concentración celular promedio máxima de 538,250 células por pozo en el grupo sin cambio de medio; pero en el segundo, la fase logarítmica continuó hasta las 336 h, cuando se alcanzó una concentración celular máxima promedio de 1.77 x 106 (1’774,750 células) y se dio por terminado el experimento. Las densidades máximas alcanzadas fueron de 559 y 1,845 células/mm2 para los tratamientos sin y con cambio de medio. La Figura 1 ilustra las diferencias de crecimiento entre los dos grupos, así como la fase logarítmica y el tiempo en cultivo.
Cinética de crecimiento RF/6A
Este experimento tuvo una duración de 345 h, un poco más de 14 días. Para ambos tratamientos, sin y con cambio de medio, el intervalo de adaptación tuvo una duración de 90 h, a partir del cual se observó el crecimiento logarítmico. Éste fue muy leve en el primer caso, alcanzando su valor máximo promedio de 8.4 x 104 (83,950 células) a las 300 h de iniciado el cultivo; equivalentes a una densidad promedio de 87 células/mm2. En forma similar, el segundo tratamiento alcanzó su valor máximo a las 315 h con una concentración máxima promedio de 6.52 x 105 (651,600 células) equivalentes a una densidad promedio de 677 células/mm2. Mediciones posteriores, revelaron una disminución paulatina en el número de células. En la Figura 2 se ilustran las diferencias de crecimiento entre los dos grupos, así como la fase logarítmica y el tiempo en cultivo.
Intervalo de duplicación
Con base en los datos obtenidos de los dos experimentos anteriores, se tabularon los resultados, como se muestra en el Cuadro 5, quedando como sigue:
DT DH82 = 42.95 h equivalentes en tiempo real a 42 h 56’.
DT RF/6A= 37.00 h equivalentes en tiempo real a 36 h 59’.
Discusión
Se cubrió la expectativa de definir características y propiedades de cultivo de las líneas celulares DH82 de origen canino y la línea RF/6A, derivada de un mono Rhesus. Aunado a ello, ambas líneas se comportaron de manera muy diferente entre sí, lo que incrementa el valor de este trabajo, al destacar sus desigualdades. Esto es conforme a lo esperado, ya que DH82 es de origen mieloide, tipo monocito-macrófago6,7, en contraste con RF/6A que es de tipo endotelial2,5.
Para el primer experimento con la línea DH82, se estableció una primera dosis de 5.0 x 105 células, que es dos veces menor a la de 1.0 x 106 con la que tradicionalmente se inician cultivos en botellas de 25 cm2 en nuestro laboratorio. Con la determinación de la dosis de 6.25 x 104, se resolvió que se pueden iniciar cultivos aún a dosis que son 16 veces menores. Es más, los cultivos que se inician en botellas de cultivo con la dosis mayor 1.0 x 106, tiene una densidad de 400 células por unidad de superficie (mm2); en contraste las que se inician con la dosis menor 6.24 x 104 la densidad es de 354 células por unidad de superficie, lo que no es en sí, una gran diferencia. Ello tampoco es indicativo de la ventaja de iniciar cultivos con dosis tan altas, comparativamente. Ello condujo a definir que las líneas celulares, una vez adaptadas a las condiciones del laboratorio, los cultivos deberán iniciarse con base en una determinación de su densidad, la cual indicará la dosis a utilizar independientemente del tamaño del contenedor.
Aunque en el caso de la línea celular RF/6A, cuyo experimento inicial tenía las mismas expectativas del ensayo anterior, los resultados resultaron ser muy diferentes. Para empezar las concentraciones antes definidas y consideradas altas, resultaron ser limitativas, para las condiciones ensayadas, y es por ello que ninguno de los tratamientos establecidos consiguió incrementar sus valores, al contrario, disminuyeron. Con esos resultados, entonces se definió la segunda fase, reduciendo aún más la concentración celular inicial total, hasta poco más de 141 veces. Con ese resultado se comprueba que para esta estirpe celular, la dosis inicial de inóculo de siembra puede partir de cantidades menores a las recomendadas tradicionalmente. Igualmente en este experimento se refleja que posiblemente cantidades de inóculo tan grandes, fallen en su adaptación a las condiciones de cultivo, que pudiesen estar asociadas a una insuficiencia de nutrientes para satisfacer a la totalidad de la población. Aunque esto más bien debería referirse a algún nutriente clave para el momento del adosamiento o anclaje a la pared del contenedor. Cabe recordar que el criterio de elección para definir el término del experimento es la confluencia casi total. Ello es una medida subjetiva visual y no siempre arrojará los mismos resultados, basados precisamente en su grado de subjetividad. Áreas cercanas a los bordes de los pozos, parecían no tener la misma densidad celular, en comparación con las áreas centrales, en las que las células aparecen con mayor contacto entre sí, y más uniformes en apariencia. Como reflejo de la disparidad, tomamos lo indicado por Kasai et al18 y Shen et al19, quienes utilizaron 4.8 x 103 y 1.0 x 105 células por pozo, en placas de 96 pozos, para iniciar cultivo con la línea celular RF/6A, respectivamente. Ello representa una diferencia entre sí de 20 veces la concentración. Derivado de lo anterior, queda la duda de la confiabilidad de esos resultados, ya que al iniciar cultivos con altas concentraciones celulares, estas conglomeraciones no serán óptimas para un ensayo celular, pues en lugar de estar creciendo y multiplicándose, su concentración está disminuyendo.
Con base en la experiencia de los ensayos previos, se diseñaron los experimentos de densidad de siembra, en principio orientados a dilucidar si la cercanía entre sí de las células, pudiera ser una condicionante para su desarrollo. La concentración inicial de 1.0 x 106 células en botellas de cultivo de 25 cm2, equivale a una densidad de 400 células/mm2. Así que para el siguiente par de experimentos se iniciarían con cantidades que variaban desde 80 veces menos, esto es 5 células/mm2, anotado como tratamiento 1; hasta 10 veces menos, lo que es igual a 40 células/mm2, descrito como tratamiento 4. Para el caso de la línea DH82 se encontró que los valores máximos de crecimiento alcanzados en cada uno de los tratamientos no son diferentes estadísticamente entre sí, lo que se interpreta como que fueron uniformes aunque no iguales. En parte, porque el criterio subjetivo de confluencia para su cosecha, fue coincidente en todos los casos, con la discrepancia del intervalo que corresponde al tiempo de incubación, que sí fue diferente.
En lo que respecta a la densidad de siembra de la línea RF/6A los resultados fueron discordantes con los de la línea celular de origen canino. Los valores fueron mucho menores, tanto en rendimiento celular, como en el intervalo requerido para alcanzar la confluencia. Una explicación simple es que el tamaño de las células tiende a ser mayor, indicado por la densidad obtenida, que en ningún caso fue en promedio mayor a las 645 células/mm2. De la misma manera, alcanzaron confluencia en intervalos de incubación más cortos, pues el máximo valor alcanzado fue de 11 días. El crecimiento promedio alcanzado con el inóculo de 5 células/mm2 difiere, aunque no es estadísticamente significativo del obtenido con los otros tres tratamientos. Considerando, como explicación igualmente sencilla, la necesidad de proximidad en las células, ya que esta línea es de origen endotelial, lo que contribuiría a pensar que es un tejido que requiere cierto grado de organización y estructura, para operar eficientemente17,18, especulando que la comunicación entre las células se favorece por estar más cercanas entre sí, físicamente. Los monocitos-macrófagos, que se expresan en la línea celular DH82, tienden a operar en forma individual, y sus interacciones célula-célula son más bien con otras estirpes celulares, como lo serían células presentadoras de antígeno en la respuesta inmune. Sin embargo, este trabajo no pretende comparar las líneas celulares utilizadas, sino descubrir sus diferencias para encontrar sus propiedades.
Los experimentos de cinética de la línea DH82 se basaron en el uso de una densidad celular específica de 20 células/mm2, que estaba asociada a una expectativa determinada, en términos de alcanzar la confluencia esperada en un plazo de 15 días, previsto de antemano. Ello confirmaría lo especulado de obtener un crecimiento preestablecido, sin importar el tamaño del contenedor. El intervalo de muestreos intermedio cada 21 h se basó en una estimación aritmética de periodo generacional, según los datos calculados (no mostrados) del primer ensayo; y, con base en esa estimación se propuso el recambio de medio cada 63 h, que es tres veces ese periodo. El cumplimiento de la premisa de alcanzar confluencia a los 15 días, representaba 360 h en cultivo, habiendo quedado cortos por un día, cuando se agotó el material biológico dispuesto para ello. La observación individual de los gráficos permite distinguir que el periodo de adaptación fue coincidente entre ambos tratamientos, sólo destacando la fase de crecimiento logarítmico, que mientras en el grupo sin recambio de medio, fue declinando, no sucedió lo mismo, para el grupo con cambio de medio, que pareciera seguir creciendo aunque ya no a la misma tasa reproductiva.
Siguiendo el mismo raciocinio para el ensayo de la cinética de desarrollo de la línea RF/6A derivada del mono Rhesus, se estableció como densidad inicial de siembra 10 células/mm2, para alcanzar la confluencia esperada a los 10 días o 240 h, igualmente independientemente del tamaño del contenedor. Como en el ensayo previo, se calculó (datos no mostrados) el intervalo de 30 h, que corresponde al periodo de una generación, con base en los datos obtenidos en la segunda fase del experimento de dosis inicial de siembra. Los muestreos se programaron cada 15 h, considerando como la mitad del tiempo entre generaciones. Para el recambio de medio, se consideró el intervalo de 45 h, 1.5 veces el calculado para el periodo generacional, pero muy similar al de 48 h empleado en cultivos continuos y experimentos previos. Ahora, la experiencia resultó diferente, puesto que el crecimiento celular rebasó el periodo esperado de 10 días, al extenderse la fase de crecimiento logarítmico hasta las 315 h, equivalente a 13.125 días. La densidad celular alcanzada en esa fecha fue de 677 células/mm2, cantidad similar o cercana a los 645 células/mm2 obtenidas en el ensayo de densidad de siembra a los 10 días. Este fenómeno es biológicamente compatible con la funcionalidad de la línea celular, considerando que posiblemente no se forme una sola capa, sino un poliestrato; característica ésta, del tejido de donde se derivó esta línea celular8.
Es universalmente aceptado que en todo cultivo celular existen los periodos de adaptación y de crecimiento logarítmico1. Este estudio destaca que ambas líneas celulares hayan mostrado un comportamiento similar en lo que al periodo de adaptación se refiere, pues independientemente de que hayan recibido o no, medio de cultivo fresco, los intervalos coinciden, ya que los altibajos mostrados (datos no presentados) al principio de los cultivos previos, a la definición del intervalo, así lo confirman.
Los resultados de determinación del DT resultaron sorprendentes, pues dan la apariencia de ser muy altos. El DT para DH82 de casi 43 h, así como el de 37 h para RF/6A, parecen ser coincidentes dadas las condiciones de cultivo empleadas. Igualmente difieren de los periodos de duplicación de 21 y 30 h respectivamente, calculados inicialmente. Con esta información verificada se daría pie a estudios para disminuirlos e inclusive incrementar su eficiencia, mediante el ensayo con nuevas fórmulas de medios de cultivo. El medio utilizado, MEM, es de los que tiene la formulación más sencilla, comparados con los componentes de otros medios químicamente definidos, como el Medio 199 o el RPMI 1640, accesibles comercialmente; por lo que sería hasta deseable realizar los ensayos para identificar algunos componentes que pudieran ser limitantes para su crecimiento.
Inferencias indirectas obtenidas mediante la obtención y tinción de improntas (datos no presentados), permiten aseverar que las células de la estirpe RF/6A son polimórficas; en contraste a la descripción de las células reportada por Luna Castro et al.14, quienes mencionan que las células RF/6A presentan formas de “mosaico”. Adicionalmente se observó, que las células de esta línea celular muestran diversos tamaños. No obstante, las células en general son muy grandes, en comparación con otras líneas celulares, como lo son BUVEC E6E715,20 y DH827,8, mismas que tienen una forma uniforme y un tamaño inferior al de las células de la línea RF/6A.
Conclusiones e implicaciones
Los datos obtenidos permitieron generar un modelo patrón de cultivo, para estudios futuros. De esta manera será más práctico y sencillo, el predecir tiempos y fechas, eventualmente para obtener cultivos con alto grado de confluencia en un día determinado. Igualmente relevante es el hallazgo de cultivos celulares que tienen poco crecimiento cuando se inician con cantidades grandes de células, en contraste con la opinión generalizada de iniciar con el mayor número posible de células.











 texto en
texto en