Introducción
La hormona luteinizante (LH) es una glicoproteína presente en el lóbulo anterior de la hipófisis. La LH participa en la maduración folicular1, la ovulación2 y la formación y mantenimiento del cuerpo lúteo3.
Durante el proceso de síntesis, la LH sufre modificaciones post-traduccionales como la incorporación de residuos de oligosacáridos del tipo N-unidos con diferente porcentaje de sulfato y ácido siálico4. Esta variación específica se considera la principal base bioquímica de la diferenciación entre las isoformas de carga de la LH intrahipofisaria y circulante5.
El polimorfismo de las gonadotropinas se ha documentado en rumiantes6,7,8 y mediante el cromatoenfoque se han identificado isoformas de la LH en el suero9,10 como en la hipófisis11,12 y cuya proporción relativa es diferente6. Incluso se sabe que la proporción de estas isoformas en la circulación es distinta en diversas etapas del ciclo estral9,10.
La actividad biológica in vivo de distintas isoformas de LH de rumiantes ha generado resultados inconsistentes, sin embargo se establece que la mayor bioactividad la presentan las isoformas ácidas13,14,15. Esta inconsistencia en la respuesta biológica se ha atribuido a la tasa de depuración de cada isoforma, a la baja sensibilidad del ensayo (se requieren cantidades de microgramos de proteína) y a la variabilidad biológica de los animales empleados. En contraste, con el empleo de bioensayos in vitro, la mayor actividad biológica se presenta en las isoformas básicas16,17, cuyo resultado no siempre es consistente debido al origen de las células de Leydig (rata o ratón) y que cuestiona la especificidad de especie cuando se utilizan ligandos de otras especies. Una alternativa relativamente reciente ha sido el desarrollo de bioensayos basados en la clonación de receptores para gonadotropinas18,19. Con la línea celular estable derivada de células embrionarias de riñón humano (HEK-293) y transfectada con el cDNA para el receptor de la LH de rata se ha logrado evaluar producción de AMPc asociada con distintos extractos hipofisarios de rata obtenidos a pH básico20,21; así mismo, con este modelo biológico se ha determinado la constante de afinidad de la LH bovina al receptor de la LH de rata22.
Durante la última década, nuestro grupo de investigación se ha enfocado a aislar y caracterizar distintas isoformas de la LH de rumiantes para conocer la relación estructura-función, su patrón de secreción en diferentes estadios fisiológicos y su actividad biológica. Sin embargo, debido al bajo rendimiento de las isoformas de tipo ácido y neutro, su caracterización biológica ha sido muy limitada. Es por esto que con la disposición del bioensayo basado en la clonación del receptor para LH, se abre la posibilidad de cuantificar la bioactividad de este grupo de isoformas, que por su bajo rendimiento es difícil de monitorear.
Por lo tanto, el presente estudio se encaminó a evaluar el patrón de producción de AMPc por las células HEK-293 transfectadas con el cDNA para el receptor de LH de rata en respuesta a distintas isoformas de la LH bovina hipofisaria.
Material y métodos
Para el desarrollo de este estudio fue necesario aislar y purificar las distintas isoformas de LH bovina en cantidades suficientes; determinar por medio del cromatoenfoque el punto isoeléctrico de cada isoforma, el peso molecular en SDS-PAGE y su caracterización inmunológica por medio de un radioinmunoensayo específico para LH y mediante el análisis por inmunotransferencia.
Colección de hipófisis
Se obtuvieron hipófisis de animales adultos sin considerar edad, sexo, ni condición fisiológica. Antes del sacrificio, cada animal se aturdió con una pistola de perno cautivo y después se separó la cabeza y se extrajo la hipófisis que se colocó en amortiguador de fosfatos (0.05 M, pH 7.2). De cada glándula se retiró el exceso de tejido, se descartó el lóbulo posterior y el lóbulo anterior se liofilizó. Cada paso de extracción y purificación de la LH y sus isoformas se realizó a 4 °C.
Obtención del extracto glicoprotéico (EGP) del lóbulo anterior de la hipófisis
El extracto glicoprotéico se obtuvo de 375 lóbulos anteriores de acuerdo al procedimiento descrito para rumiantes13. En breve, los lóbulos anteriores liofilizados se hidrataron con acetato de amonio al 10%, pH 7.0 que contenía 0.001 M de fenilsulfonilmetilfluoruro durante un período de 48 h. Al término se licuaron y se homogeneizaron con la misma solución, y el extracto obtenido se conservó en agitación mecánica por 24 h; al término, el extracto se centrifugó a 10,000 xg por 45 min; el precipitado (R0) se almacenó y el sobrenadante se ajustó a pH 7.0 y recibió gota a gota en agitación constante un volumen de etanol que correspondió al 40 % del volumen total. Después de 16 h de agitación, la mezcla se centrifugó y la fracción de proteína presente en el precipitado (R1) se almacenó y el sobrenadante recibió un volumen de etanol de forma idéntica a lo previamente indicado, que correspondió al 85 % del volumen total. Esta mezcla permaneció en reposo por 48 h y al término, las proteínas precipitadas se recuperaron por centrifugación. Este grupo de proteínas se identificó como el extracto glicoprotéico (EGP), que se resuspendió en agua desionizada, se dializó (Spectra/Por # 4, cut off 12-14 kDa) durante 24 h con cambio de agua cada 8 h y después se liofilizó. Una segunda extracción se realizó a partir del R0 de la primera extracción repitiendo el proceso antes descrito. El segundo extracto glicoprotéico se mezcló con el primero para su purificación.
Purificación de EGP para la obtención de la LH
La LH se obtuvo por la purificación del extracto glicoprotéico en el intercambiador iónico, CM-Sepharosa13. Un gramo de extracto que contenía 256 mg de proteína se resuspendió en acetato de amonio 0.005 M, pH 5.1 (amortiguador de elución), se agitó durante 24 h y se centrifugó (10,000 xg por 30 min). La proteína en solución se aplicó a una columna (27.0 cm X 1.5 d.i.) pre-empacada con el intercambiador catiónico, equilibrada previamente con el amortiguador de elución y conservada a 4 °C. La fracción de proteína se eluyó con un flujo de 23 ml/h a través de un gradiente de acetato de amonio (0.005 M, pH 5.1; 0.1 M, pH 6.8 y 1.0 M-glicina 0.1 M, pH 9.5) y durante la corrida cromatográfica se colectaron fracciones de 2 ml. El patrón de elución de la proteína se monitoreó a 280 nm. Cada cambio de amortiguador se realizó cuando la densidad óptica del efluente fue cercana a cero. Una vez concluida la elución, la columna recibió una solución NaCl 1 M.
Los distintos picos de proteína en que se distribuyó la elución del extracto glicoprotéico se identificaron de acuerdo a su amortiguador; las fracciones que eluyeron con acetato de amonio 0.005M, pH 5.1 se denominaron CM-1ab, CM-1cd y CM-1ef, respectivamente; el pico de proteína que eluyó con 0.1 M, pH 6.8 se denominó CM-2ab y la proteína que eluyó con 1.0 M-glicina 0.1 M, pH 9.5 se identificó como CM-3ab y correspondió a la LH cruda. La fracción de proteína recuperada después de NaCl se denominó pico de sal. Los distintos picos de proteína, se dializaron y liofilizaron para su análisis.
Purificación de la fracción CM-3ab para la obtención de las isoformas de la LH
Las isoformas de la LH se obtuvieron después de la purificación de la fracción CM-3ab; esta proteína recuperada durante la purificación del EGP en CM-Sepharosa se caracterizó por su alto contenido de LH y un patrón electroforético similar al estándar de LH bovina, USDA-bLHB5. La fracción se sometió a un proceso de separación de acuerdo a carga eléctrica8,11. En breve, la proteína (56 mg) se resuspendió en Pharmalyte (pH 8.0-10.5, Pharmalyte 0.36 meq/ml pH, Pharmacia Biotech Piscataway, NY), diluido 1:45 con agua desionizada, el que se ajustó con HCl a pH 7.0 y a la suspensión se aplicó a una columna (27 cm x 0.7 cm d.i.) pre-empacada con el intercambiador iónico PBE-118 (Polybuffer exchanger for chromatofocusing, capacity: 50.4 μmol. pH unit-1 ml-1, Pharmacia, Biotech, Piscataway, NY), equilibrada con 0.025 M trietilamina-HCl, pH 11.0 y conservada a 4 °C. Previo a la elución de la proteína, la columna recibió 3 ml de amortiguador Pharmalyte, pH 7.0 para evitar la exposición de la muestra a un pH extremo.
La fracción de proteína se eluyó con un flujo de 7 ml/h y se colectaron fracciones de 2 ml. El pH de cada fracción se midió, y cuando se detectó el pH de 7.0 en más de 10 fracciones consecutivas, el amortiguador de elución se cambió por el polybuffer 74 (Pharmacia, Biotech), diluido 1:8 con agua desionizada y ajustado a pH 3.5 para obtener proteínas eluídas entre un pH 7.0 a 3.5. La proteína unida a la columna después de la elución a pH 3.5 se recuperó por la adición de 1.0 M NaCl. Con el registro de pH y conocido el patrón de elución de la proteína a 280 nm, se procedió a neutralizar cada fracción; las fracciones colectadas entre pH 11.0 y 7.0 recibieron Tris-HCl, 1.1M, pH 7.4 y las fracciones eluídas entre pH 6.99 y pH 3.5 así como las proteínas colectadas con NaCl 1 M se neutralizaron con Imidazol 1.1 M. Una vez neutralizadas el total de las fracciones de proteína, las fracciones se agruparon en el rango de pH de elución del pico de proteína: básicas (A, pH, 10.75-9.75; B, pH, 9.58-8.41), neutra (C, pH, 7.98-6.89) y ácidas (D, pH, 6.88-5.41; E, pH, 5.36-3.46). Los distintos picos de proteínas se dializaron de forma independiente y se liofilizaron hasta su análisis.
Análisis electroforético (SDS-PAGE)
El patrón electroforético y el peso molecular se determinaron mediante una electroforesis en placa con geles de poliacrilamida al 12.5 % a pH 8.6 en presencia de dodecil sulfato de sodio23 en aquellas fracciones de proteína obtenidas durante la purificación de la LH y sus isoformas. El patrón electroforético se comparó con la LH de referencia (USDA-bLH-B5). Una vez concluida la electroforesis, el gel se tiñó con plata siguiendo las especificaciones del estuche comercial (Silver Stain Kit, Bio-Rad, Laboratories, Inc). Como referencia se utilizaron marcadores preteñidos de bajo peso molecular (Bio-Rad Laboratories, Inc).
Cuantificación de proteínas totales
La concentración de proteína se determinó en cada fracción obtenida durante la purificación de la LH y sus isoformas por el método de Bradford24. Se utilizó como estándar a la albúmina sérica bovina (BSA).
Análisis inmunológico de la LH y sus isoformas
Identificación de proteínas inmunoreactivas a LH
El peso molecular de las proteínas inmunoreactivas a LH se determinó por medio de la inmunotransferencia25. El análisis se inició después de concluida la electroforesis en placa con geles de poliacrilamida al 12.5% a pH 8.6 en presencia de dodecil sulfato de sodio (SDSPAGE). En breve, 100 ng de proteína del patrón de referencia USDA-bLH-B5 o de las distintas fracciones obtenidas durante la extracción y purificación de la LH y sus isoformas se transfirieron (Trans-Blot Semi-Dry (Bio-Rad, USA), 200 mA/75 min) a una membrana de nitrocelulosa (0.45 μm trans, blot, Bio-Rad). Transferidas las proteínas a la membrana de nitrocelulosa se incubó a 4 °C durante 16 h con el anticuerpo primario generado en conejo (antioLH-26) a una dilución 1:1000. Al término, la membrana se incubó durante 60 min a temperatura ambiente con el anticuerpo secundario (anti IgG de conejo generado en cabra y conjugado a peroxidasa, Jackson Immuno Research) diluido 1:20,000. El revelado se realizó por quimioluminiscencia (ImmobilonTM Western Chemiluminescent HRP Sustrate, Millipore Corporation, Billerica, MA, USA).
Cuantificación de la LH inmunoreactiva (irLH)
La determinación cuantitativa de la LH inmunoreactiva se determinó con un radioinmunoensayo (RIA) en fase líquida, validado previamente para la LH bovina11. Cada fracción obtenida durante la purificación de la LH y sus isoformas se analizó a las dosis de 0.2, 0.4, 0.8, 1.6, 3.2 y 6.4 ng de proteína/tubo en cuatro réplicas y como estándar se utilizó al USDA-bLH-B5 a las dosis de 0.01, 0.1, 0.25, 0.5, 1.0, 2.5, 5.0 y 10 ng/tubo. El trazador se formó con la incorporación del NaI125 al USDA-bLH-B5 mediante el método del IODO-GEN11. El anticuerpo primario (anti-oLH-26) generado en conejo se utilizó a una dilución de trabajo 1:40,000 en presencia de suero normal de conejo, 1:1600 y la precipitación del complejo antígeno-anticuerpo se obtuvo después de 24 h de incubación a 4 °C con el anticuerpo secundario (anti-IgG de conejo generado en burro, 1:80). Finalmente, la fracción inmunoprecipitada se separó de la fracción no unida por centrifugación (1,500 xg por 15 min a 4 °C) previa adición de 1 ml de amortiguador PBS 0.05M, pH 7.2 que contenía BSA al 0.1 %. La fracción inmunoprecipitada se analizó en un contador de radiaciones gamma. La sensibilidad del ensayo fue de 0.1 ng/tubo y el coeficiente de variación intra e interensayo tomando como parámetro el valor de la dosis al EC50 de la curva de referencia correspondió al 2 y 5 %, respectivamente.
La concentración cuantitativa de la LH se determinó a partir del cálculo del parámetro IC50, definido como la concentración de proteína (ng de proteína o LH/tubo) que causó el 50 % de inhibición en la respuesta del %B/Bo. Para lo anterior se utilizó el programa estadístico Prism 6.0 (GraphPad Software, Inc., USA) que incluyó la ecuación de Hill. Ambos parámetros, IC50 y la pendiente de Hill se compararon con la prueba F de la suma de cuadrados, probando como hipótesis nula que estos parámetros son idénticos entre cada par de hormonas evaluadas; si se obtiene un valor de P>0.05, se concluye que el parámetro es el mismo para los dos ajustes26. Adicionalmente, se utilizó ANOVA de una vía seguida de la prueba de comparación múltiple de Tukey para determinar diferencias significativas (P<0.05) entre las isoformas ensayadas27,28.
Determinación de la actividad biológica de las isoformas de la LH
La actividad biológica se determinó midiendo la producción de AMPc en tres réplicas por dosis en tres ensayos independientes. En breve, las células HEK-29320 transfectadas con el cDNA del receptor recombinante de LH de rata (proporcionadas por el Dr. Mario Ascoli, Iowa University, Iowa City, IA), se estimularon con el patrón de referencia (USDA-bLH-B5) o con cada isoforma, que por su punto isoeléctrico (pI) representó el polimorfismo de la LH y cuyo pI se encontró lo suficientemente alejado entre proteínas; con base en estos criterios se analizaron las isoformas, básica (B, pH; 9.58-8.41), neutra (C, pH; 7.98-6.89) y ácida (E, pH; 5.36-3.46).
Para ello, las células HEK-293 transfectadas se cultivaron en caja de cultivo de 162 cm2 (Costar, Cambridge, MA, EUA) que contenía el medio DMEM (Dulbecco´s Modified Eagle Medium) alto en glucosa, suplementado con 5 % de suero fetal de ternera, 0.002 M de L-glutamina, 100 μg/ml de geneticina 50 UI/ml de penicilina y 100 μg/ml de estreptomicina. Las células confluentes en un 90 % se resembraron en cajas de 24 pozos (Gibco, BRL) con una densidad de 5 X 104 células por pozo y se incubaron en una atmósfera de 5 % de CO2 por 24 h a 37 °C. Al término, se retiró el medio y las células se expusieron durante 24 h a dosis crecientes de LH inmunoreactiva del USDAbLH-B5 o de cada isoforma (6.25, 12.5 25.0, 50.0, 100.0 y 200.0 ng/ml). Cada hormona se diluyó en medio de cultivo que contenía 0.0125 M de 3-isobutil-1-metilxantina (inhibidor de la fosfodiesterasa).
El contenido de AMPc total se midió en el medio de cultivo a través de radioinmunoensayo en fase líquida21. Para ello el trazador 2-0-monosuccinil tirosil-metil éster de AMPc (Sigma) se radiomarcó con Na125I (Amersham International Limite, Reino Unido) mediante el método de la Cloramina-T29. El anticuerpo primario (anti-AMPc, CV-27, NIADDK, Bethesda, MD, USA) se utilizó a una dilución de 1:70,000 en presencia de acetato de sodio 0.005M y albúmina sérica bovina al 0.1 %, pH 6.1. Cada tubo de reacción se incubó por 24 h a 4 °C y al término el anticuerpo unido se separó del AMPc libre después de agregar etanol frío y seguido de una centrifugación a 1,500 xg durante 30 min a 4 °C. La fracción inmunoprecipitada se analizó en un contador de radiaciones gamma. La sensibilidad del ensayo fue de 2.0 pmol/ml y el coeficiente de variación intra e interensayo fue de 2 y 5 %, respectivamente. La producción de AMPc se calculó por interpolación de los resultados en la curva de referencia de 2-0-monosuccinil tirosil-metil éster de AMPc.
La actividad biológica para cada isoforma se determinó a través del cálculo del parámetro EC50, definido como la cantidad requerida de LH (ng/ml) que generó una respuesta al 50 % de la respuesta máxima, bajo las condiciones establecidas en el ensayo26,27. Para ello, los datos experimentales se ajustaron en curvas dosis-respuesta de estimulación de cuatro parámetros, en el rango de la dosis de LH inmunoreactiva probada del estándar y de cada isoforma, utilizando el programa estadístico Prism 6.0 (GraphPad Software, Inc., USA).
A partir de las curvas de ajuste se realizaron comparaciones estadísticas de los parámetros EC50 y la pendiente de Hill (h). Para lo anterior se utilizó la prueba F de la suma de cuadrados, probando como hipótesis nula que los parámetros son idénticos entre cada par de hormonas evaluadas; si se obtiene un valor de P>0.05, se concluye que el parámetro es el mismo para los dos ajustes27. Además, se utilizó ANOVA de una vía seguida de la prueba de comparación múltiple de Tukey para determinar diferencias significativas (P<0.05) entre la biopotencia relativa de las isoformas ensayadas.
Resultados
Durante el proceso de extracción de los lóbulos anteriores se generaron tres fracciones. El R0 que correspondió al 63.2 % (77.16 g) del peso original; el R1, que se obtuvo con el 40 % de etanol, con un rendimiento del 9.03 % (11.02 g) y el extracto glicoprotéico (EGP) que se recuperó con el 85 % de etanol, con un rendimiento del 8.24 % (10.06 g) y una concentración de 226 μg de LH/mg de proteína.
Del EGP purificado en el intercambiador iónico se obtuvieron cinco fracciones de proteína (Figura 1(I)). La fracción CM-3ab mostró el mayor contenido de proteína y un alto contenido de LH inmunoreactiva (Figura 1(II)); en contraste, las fracciones CM-1cd y CM-1ef mostraron un bajo contenido de LH y cantidad de proteína, por lo que se excluyeron del estudio y no se analizaron electroforéticamente. El patrón electroforético de aquellas fracciones con mayor contenido de proteína y LH se ejemplifica en la Figura 1(II).

Figura 1 I) Patrón de elución del extracto glicoprotéico (GPE) en CM-Sepharosa. II) Concentración de proteína (mg) y LH inmunoreactiva para cada fracción. III) Patrón electroforético del USDA-bLH-B5, el (CPE) y de las fracciones con actividad inmunológica de LH. NR, condiciones no reductoras; R, reductoras.
De acuerdo al patrón electroforético, en ausencia de β-mercaptoetanol (condiciones no reductoras, NR), la fracción CM-3ab y el patrón de referencia presentaron un patrón similar que consistió de dos proteínas con un peso molecular de 36.5 y 23.4 kDa, respectivamente (Figura 1(III)). A pesar de la presencia de estas dos proteínas en el extracto glicoprotéico y en las fracciones CM-1ab, CM-2ab, el patrón electroforético en estas últimas fracciones resultó más heterogéneo, y se observó una proteína predominante de mayor peso molecular (56.0 kDa). En presencia de β-mercaptoetanol (condiciones reductoras, R), el patrón electroforético de la fracción CM-3ab se caracterizó por la presencia de tres proteínas con un peso molecular de 23.4, 20.8 y 17.0 kDa, respectivamente; las fracciones CM-1ab y CM-2ab presentaron un patrón similar, sin embargo en ellas se observó una proteína muy intensa de peso molecular de 72.0 kDa. Con base en este patrón electroforético se decidió que ambas fracciones de proteína se excluyeran del estudio, por lo tanto el grupo de isoformas de carga de LH se aislaron únicamente de la fracción CM-3ab (pH 9.5).
El patrón de elución de la fracción CM-3ab en el intercambiador iónico, PBE118, se distribuyó en cinco picos de proteína a través del gradiente de pH; cada pico correspondió a una isoforma (Figura 2(I)). Del total de LH inmunoreactiva recuperada, el 72.8 % se obtuvo a pH básico (≥7.5, fracciones A y B), mientras que a pH neutro (7.4 a 6.6, fracción C) se recuperó el 6.3 % y a pH ácido (≤6.5, fracciones D y E) el 20.1 %. La cantidad de proteína y de LH inmunoreactiva para cada isoforma se resume en la Figura 2(II).

Figura 2 I) Patrón de elución de la fracción CM-3ab en el cromatoenfoque. Cada pico de proteína se identificó con una letra, comenzando con la proteína de elución a pH básico (A) y finalizando con la proteína que eluyó a pH ácido (E). La fracción S se obtuvo con 1.0M NaCl. II) Cuadro de rendimiento y concentración de LH/mg de proteína para cada isoforma.
En el patrón electroforético en condiciones no reductoras (Figura 3(I), panel superior) cada isoforma de la LH mostró un patrón homogéneo con dos bandas de proteínas predominantes de peso molecular de 36.5 y 23.4 kDa respectivamente, patrón similar al USDA-bLH-B5 y a la fracción CM-3ab. A pesar que el extracto glicoprotéico (EGP) y la isoforma E (pH; 5.36-3.46) mostraron un patrón similar en ellos, se observó una proteína de 55.0 kDa. Asimismo, en condiciones reductoras, cada isoforma mostró el mismo patrón electroforético que el extracto glicoprotéico, la fracción CM-3ab y el USDAbLH-B5. Interesantemente, se presentó una banda de proteína de 17 kDa particularmente en la fracción CM-3ab y en las isoformas B, C y D (Figura 3(I), panel inferior).

Figura 3 Patrón electroforético (I) y análisis por inmunotransferencia (II) de cada isoforma de LH bovina. USDA-bLH-B5, patrón de referencia; GPE, extracto glicoprotéico; fracción CM-3ab; isoformas, A (pH 10.75-9.75); B (pH 9.58-8.41); C (pH 7.98-6.89); D (pH 6.88-5.41); E (pH 5.36-3.46).
Del análisis por inmunotransferencia en condiciones no reductoras (Figura 3(II), panel superior) se desprende que las distintas isoformas conservan un patrón de proteína inmunoreactiva a LH similar al USDA-bLH-B5, siendo la proteína de 36.5 kDa una de las bandas de proteína importantes, que en condiciones reductoras prácticamente desaparece y se incrementan las proteínas de menor peso molecular (23.4 y 20.8 kDa).
Las curvas de desplazamiento que se obtuvieron con el radioinmunoensayo para las diferentes isoformas de la LH y la fracción CM-3ab en comparación con el estándar de referencia se presentan en la Figura 4. La actividad inmunológica referida como el parámetro IC50 mostró un valor similar entre el USDA-bLH-B5 y la fracción CM-3ab (Figura 4(II)). En contraste, el valor de IC50 del estándar fue significativamente menor al de las isoformas, que indica que el estándar es inmunológicamente más activo ante el anticuerpo utilizado. Las pendientes de las curvas dosis-respuesta del estándar y las de las isoformas no fueron estadísticamente diferentes, lo que denota la identidad de las proteínas (Figura 4(III)).

Figura 4 Curva dosis-respuesta en el sistema de RIA específico para LH. I) USDA-bLH-B5 y la fracción CM-3ab. II) USDA-bLH-B5 e isoformas básicas (A, pH, 10.75-9.75; B, pH, 9.58-8.41); USDA-bLH-B5 e isoforma neutra (C, pH, 7.98-6.89); USDA-bLH-B5 e isoformas ácidas (D, pH, 6.88-5.41 y E, pH 5.36-3.46). III) Parámetros de análisis de la relación B/Bo vs dosis.
La cantidad de AMPc producido por las células HEK-293 después de 24 h de tratamiento con las diferentes dosis de LH inmunoreactiva del estándar o con cada isoforma de LH se ejemplifica en la Figura 5(I). La producción de AMPc fue dependiente de la dosis y el cálculo del parámetro EC50 como indicativo de actividad biológica sobre la curva dosis-respuesta normalizada (Figura 5(II)) resultó diferente entre las isoformas y el estándar, con la isoforma neutra más activa biológicamente con un EC50 menor; en contraste, la isoforma ácida mostró la menor actividad biológica con un EC50 mayor (Figura 5(III)). El valor de la pendiente (h) del estándar con respecto a la isoforma básica y la ácida denotó diferencias significativas, en tanto que al comparar la pendiente del estándar con la isoforma neutra no se observó diferencia (Figura 5(III)).
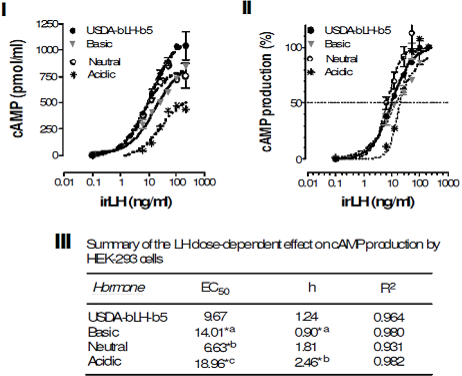
Figura 5 Producción de AMPc por las células HEK-293 con el estímulo de bLH y sus isoformas. I) Dosis-respuesta para la isoforma básica (B), neutra (C) y ácida (E). II) Respuesta normalizada en la producción de AMPc por dosis de LH inmunoreactiva. III) Análisis de las curvas dosis-respuesta. Los resultados presentan el promedio de tres ensayos independientes por isoforma.
Discusión
El polimorfismo de la LH de mamíferos se refleja en sus propiedades fisicoquímicas, inmunológicas y biológicas. La actividad biológica de distintos aislados de la LH hipofisaria de rumiantes se ha determinado con bioensayos in vivo13,14,15 e in vitro16,17 con resultados que indican que las isoformas básicas son las proteínas más bioactivas in vitro, en tanto que la mayor respuesta in vivo lo generan las isoformas ácidas. En años recientes el desarrollo de bioensayos usando líneas celulares que expresan receptores para gonadotropinas ha permitido evaluar proteínas biológicamente funcionales20,30.
El presente estudio evaluó la actividad biológica de distintas isoformas de carga de LH de la hipófisis bovina utilizando por primera vez el bioensayo in vitro de las células HEK-293 transfectadas con el cDNA para el receptor de la LH de rata20 con resultados que mostraron diferencias significativas en la producción cuantitativa de AMPc por unidad de LH inmunoreactiva, siendo la isoforma de tipo neutro la que resultó la más activa al comparar su efecto con su análoga básica y ácida.
En este estudio, y bajo las condiciones del bioensayo, el patrón de respuesta con los diferentes aislados de LH bovina fue dependiente de la dosis en el rango de 6.5 a 100 ng de LH inmunoreactiva, mientras que la producción de AMPc a dosis mayores no se modificó, más aún se presentó una caída en la producción. Este patrón de respuesta en el bioensayo podría ser un indicativo de la desensibilización del número limitado de receptores presentes en las células HEK-29322 a través de un proceso relativamente lento de regulación a la baja del número de receptores presentes en cada célula, o bien mediante el proceso relativamente rápido de la disminución en la capacidad del receptor de la LH de interactuar y activar a sus proteínas G afines31. Aunque en este estudio no se analizó la producción de AMPc dependiente del tiempo, 24 h de estímulo permitió evaluar el cambio diferencial en la producción de AMPc entre isoformas.
El patrón de respuesta mayor entre la isoforma básica con respecto a su análoga ácida de la LH bovina coincidió con el efecto biológico que se generó después de colocar diferentes dosis de extractos de hipófisis de rata diabética y obesa eluídos a pH básico o ácidos en las células HEK-29320,21. Estos resultados también coincidieron con el patrón de respuesta generado in vitro en cultivos primarios de células de Leydig después del estímulo con isoformas hipofisarias de la LH humana32; de rata33; ovina17, así como con las isoformas básicas presentes en la circulación16.
La causa de la discrepancia en la actividad biológica entre las isoformas ensayadas no es del todo conocida, sin embargo, el o los mecanismos de esta diferencia biológica, se atribuye en parte al tipo de oligosacáridos que integran a cada isoforma4, dado que la remoción total o parcial de algunos de los componentes de los oligosacáridos por medios químicos o enzimáticos modifican su actividad biológica34,35. La LH bovina que contiene únicamente oligosacáridos con terminaciones de N-acetilgalactosamina sulfatada36, y la remoción del grupo sulfato que expone a la N-acetilgalactosamina resulta en una mayor depuración de la hormona de la sangre, debido a su alto reconocimiento de la LH desulfatada por el receptor específico presente en el hígado (Gal/GalNAc-receptor específico), reduciendo proporcionalmente la actividad biológica in vivo de la proteína36,37.
Por otro lado, la remoción total del oligosacárido de la LH, ha confirmado que las hormonas deglicosiladas pierden su acción estimuladora sobre la actividad de la adenilato ciclasa, sin que se aprecie un cambio en su afinidad por el receptor38. Con ello, se ha observado que las hormonas deglicosiladas presentan funciones antagónicas en la inducción de la formación y producción de segundos mensajeros39 y por ende sobre la producción de hormonas esteroides40. Finalmente, no se puede descartar la posible participación del receptor por diferencias en la afinidad por cada isoforma. Estudios de unión en células HEK-293 transfectadas con el cDNA para el receptor de la LH de rata22, demostraron que existe una constante de asociación con diferente orden de magnitud entre distintas LH de mamíferos, siendo la LH bovina la que presentó la menor afinidad por el receptor de LH, a pesar de contar con las regiones repetidas ricas en leucina (LRR) 3, 7, 8 y 9 en el dominio extracelular del receptor, específicas para el reconocimiento de esta hormona22.
Con base en este estudio se puede inferir que la producción de AMPc después del tratamiento con los diferentes tipos de isoformas depende también de la afinidad diferenciada del receptor. Por lo tanto, basados en esta serie de resultados se puede establecer que el patrón diferencial en la respuesta biológica sobre la producción de AMPc por las células HEK-293 a través del estímulo con las distintas isoformas de la LH está regulado por el patrón de glicosilación de la LH, que puede dar origen a proteínas con distinta afinidad por su receptor, y cuya interacción se refleje en un cambio en la respuesta biológica medida como la producción de AMPc por las células.
Adicionalmente, hasta donde se sabe, la caracterización inmunológica y biológica para la isoforma de tipo neutro en rumiantes y otras especies no se ha reportado, debido posiblemente a su bajo contenido en la adenohipófisis13,40,41 y en el suero6, lo que genera dificultad para su caracterización y purificación. Con el resultado de la bioactividad de la isoforma neutra se complementa la valoración biológica del espectro de isoformas de LH bovina. Por otra parte, el resultado de la actividad biológica reportado en este estudio para la isoforma básica complementa a lo reportado en la LH ovina17, bovina13 y de rata33 en donde la isoforma básica muestra una mayor actividad biológica in vitro con relación a la isoforma ácida. A pesar de que bajo las condiciones de desarrollo del bioensayo in vitro se observó un efecto diferencial en la actividad biológica entre isoformas, es deseable contar con un bioensayo homólogo de este tipo, que permita un mejor análisis para las isoformas de la LH de rumiantes.
La concentración cuantitativa de LH inmunoreactiva se determinó en las distintas isoformas de LH aisladas de la adenohipófisis bovina, tomando como referencia al USDA-bLHB5; el patrón de respuesta en el RIA fue dependiente de la cantidad de proteína ensayada. El valor entre pendientes fue similar, lo que denotó identidad entre proteínas. De forma interesante, el cálculo de la dosis al 50 % de inhibición (IC50) como un referente de la actividad inmunológica fue similar entre proteínas de elución en el rango básico (USDAbLH-B5, fracción CM-3ab y la isoforma básica B, pH 9.58-8.41), en tanto que en la isoforma neutra y las isoformas ácidas, el valor de IC50 se incrementó significativamente, lo que se interpretó como proteínas con menor actividad inmunológica de LH.
Esta discrepancia en la actividad inmunológica entre isoformas se puede atribuir a que para el desarrollo del RIA se utilizó un anticuerpo policlonal dirigido específicamente contra la oLH nativa (NIDDK-oLH-26), proteína que se obtuvo con un procedimiento similar al descrito en este estudio. Diversos estudios han demostrado que formas puras de la LH contienen diferentes componentes. El patrón de referencia USDAbLH-B5 radiomarcado con Na125I y analizado en el cromatoenfoque mostró un patrón de distribución de tipo básico, en donde el 80 % de la LH eluyó en este rango de pH, y el resto de la proteína radiomarcada eluyó en el rango de pH neutro y ácido del gradiente9, resultado que puede ser un indicativo que el anticuerpo generado para oLH y que se utilizó para el inmunodiagnóstico está dirigido en su mayoría para isoformas básicas, y escasamente para proteínas neutras y ácidas de la LH, lo que le genera una ventaja de inmunodetección sobre aquellas isoformas recuperadas a pH extremadamente básico, como resulta con la isoforma A, por lo que neutras y ácidas requirieron mayor cantidad de proteína requerida para ser identificadas por el anticuerpo.
El incremento en la cantidad de proteína para cada isoforma podría interferir en la respuesta biológica debido a la presencia de posibles contaminantes de proteínas estructuralmente relacionadas con la LH, y que como se sabe durante la purificación, están presentes hasta los productos finales; sin embargo, esta posibilidad se puede descartar dado que se demostró previamente la alta especificidad del anticuerpo anti-oLH para cuantificar LH del suero y de extractos de hipófisis de rumiantes sin generar ninguna reacción cruzada con proteínas como la FSH y TSH estructuralmente emparentadas9,11.
Todas las isoformas se reconocieron por el mismo anticuerpo, sin embargo, la mayor especificidad se presentó con el grupo de isoformas básicas que se reflejó en la cantidad de proteína requerida para alcanzar la dosis IC50 en el sistema, y que fue significativamente inferior con el resto de las isoformas analizadas. Aunque podemos inferir que el cálculo de la actividad inmunológica para cada isoforma con el ensayo heterólogo específico para LH es adecuado, se debe considerar que para una mejor valoración inmunológica se requiere del desarrollo de un sistema homólogo y específico para cada isoforma.
Durante el proceso de extracción de los lóbulos anteriores de la hipófisis se generó el extracto glicoprotéico, a partir del cual y después de su purificación en el intercambiador CM-sepharosa dio origen a la fracción CM-3ab, fracción de proteína que agrupó a la mayor cantidad de LH inmunoreactiva. Esta fracción de proteína mostró características fisicoquímicas, inmunológicas y biológicas similares al patrón de referencia, además su patrón de distribución en el cromatoenfoque se asemejó al patrón observado del tejido adenohipofisario de esta especie42,43,44, la especie caprina14 y humana45. Adicionalmente, con el empleo del cromatoenfoque, el rendimiento de LH (μg de LH/mg de proteína) resultó superior a lo reportado en otras especies que aislaron a esta proteína con diferentes procedimientos15,17,44.
Las isoformas aisladas a partir de la fracción CM-3ab mediante el cromatoenfoque representaron diferentes proporciones, donde predominaron las proteínas inmunoreactivas a LH que eluyeron en el rango de pH básico. Este patrón de distribución resultó similar aunque no idéntico al observado en la especie ovina42, así como al patrón de elución que se observó durante el análisis de extractos hipofisarios ovinos46 y bovinos11,47, en donde las isoformas aisladas de tipo básico predominaron. Por lo tanto, se puede asumir que el procedimiento desarrollado para la obtención del grupo de isoformas de la LH bovina no interfiere en el patrón particular de distribución de isoformas que muestra la LH en esta especie.
El grupo de isoformas aisladas del lóbulo anterior de la hipófisis tuvo el mismo peso molecular que el estándar de referencia en condiciones no reductoras, correspondiente al heterodímero de 36.5 kDa. La presencia de proteínas predominantes con peso molecular de 20.8 kDa y 23.0 kDa en el gel electroforético en condiciones reductoras, corresponde a las subunidades alfa y beta de la LH, respectivamente, lo que coincide con los valores reportados para la forma nativa de esta hormona y sus subunidades13,14,15. El análisis del patrón electroforético en condiciones no reductoras de la isoforma ácida, presentó una serie de proteínas con alto peso molecular, que después del tratamiento con el agente reductor, β-mercaptoetanol, desaparecieron, lo que hace pensar en agregados moleculares de la LH.
El análisis electroforético en condiciones reductoras de la fracción CM-3ab, isoforma C e isoforma D se caracterizó por la presencia de una proteína de 17 kDa, ausente en la isoforma A y ligeramente presente en la isoforma B. Esta proteína durante el análisis por inmunotransferencia no se identificó, lo que sugiere que se trata de una proteína contaminante que se concentró entre el pH 7.98 a 5.41 y que puede corresponder a alguna de las isoformas de la FSH bovina11, que eluyen en este rango de pH. La otra posibilidad es que se trate de una forma inmadura de alguna de la subunidades. Estudios electroforéticos en condiciones reductoras con LH ovina deglicosilada48 han identificado una proteína con un peso molecular similar al descrito en este estudio. No se descarta la posibilidad de un rompimiento proteolítico de alguna de las subunidades, como se ha descrito para proteínas fraccionadas de LH humana que presentan un peso molecular similar49. Por lo tanto, aunque existe la presencia de este tipo de proteína en aislados de determinadas isoformas, su presencia no corresponde a LH, aunque probablemente pueda interferir en la interacción de la hormona con su receptor, modificando la estimación de su potencia biológica.
Conclusiones e implicaciones
Los resultados de este estudio indican que las isoformas de la hormona luteinizante bovina tienen diferente potencia biológica. El hallazgo de un cambio en la potencia biológica in vitro entre isoformas de la LH sugiere la posibilidad que durante el proceso de síntesis de las isoformas en la especie bovina, ocurran cambios para una mayor o menor proporción de algunas de ellas, y que éste pueda representar un mecanismo fino de regulación a nivel de la adenohipófisis sobre la función gonadal. Aunque en este estudio la actividad biológica de las isoformas de la LH bovina se determinó con un bioensayo heterólogo in vitro, que no es el verdadero reflejo de la respuesta fisiológica de cada isoforma en un organismo entero, se pudo constatar que la respuesta biológica a las distintas isoformas es diferencial; sin embargo, es necesario contar con células HEK-293 transfectadas con el cDNA para el receptor de la LH bovina (homólogo) y confirmar la afinidad y especificidad selectiva de cada isoforma.











 texto en
texto en 


