El sector ganadero en Asia se encuentra bajo presión para adaptarse y ampliarse1. Estas adaptaciones se refieren esencialmente a un cambio en el tipo de especies y características de la ganadería, con el mayor cambio dirigido al aumento en el número de especies de monogástricos (cerdos y aves de corral). La industria avícola nunca ha estado bajo una presión mayor que en el momento presente2. La producción de aves de corral en Irán ha ido en aumento cada año a una tasa del 8 % en la última década, alcanzando 1’589,000 cabezas y producción de 1.9 t en 20113, que es la más grande de Oriente Medio.
El champiñón común (Agaricus bisporus) con un alto contenido en polifenoles, ergotioneina, vitaminas, minerales y polisacáridos4 ha demostrado que posee propiedades biológicas valiosas, incluyendo actividad antitumoral, antiaromatasa, antimicrobiana, inmunomoduladora, anti-inflamatoria y antioxidante5-11. A pesar de los efectos positivos conocidos sobre la salud humana12,13, hay poca información sobre el efecto del consumo de hongos en pollos. Sin embargo, en pavos, se ha demostrado que A. bisporus, debido al contenido en polisacáridos, tiene un efecto similar al de un probiótico y que mejora la eficiencia en la digestibilidad y la utilización de forrajes14,15.
La producción Iraní de setas y trufas ha aumentado de 10,000 t en 1997 a 82,000 t en 2011 (estimación de la FAO), manteniendo en este año el octavo lugar en la producción mundial3. La industria de producción de hongos genera cantidades significativas de desperdicios que se eliminan durante el proceso de producción. El reciclaje de este subproducto como aditivo alimentario para la producción de pollos de engorda podría aumentar la eficiencia de la industria alimentaria de Irán mediante la reducción de costos de producción.
El impacto positivo del uso de antibióticos como promotores del crecimiento (AGP, por sus siglas en inglés) debido a la supresión de microorganismos dañinos16 y a la inhibición de efectos inflamatorios es bien conocido en la industria de aves de corral17. La asociación del aumento de la resistencia bacteriana a los antibióticos con la adición de AGP en el alimento para pollos puede ser cuestionable18,19 y parece que es el principio de precaución la principal razón para la prohibición de estos en varios países20,21. En este sentido, el uso de antibióticos que no se utilizan en medicina humana y que todavía no causan resistencia podría ser una buena alternativa. Este es el caso del flavofosfolipol, un antimicrobiano fosfoglicolipídico producido por varias cepas de Streptomyces, que no se utiliza para el tratamiento de las infecciones humanas, por lo que todavía se puede agregar legalmente en dietas de aves de corral en muchos países16.
Resultados previos de nuestro grupo han demostrado que la adición de harina de champiñón (HC) y flavofosfolipol tienen un efecto beneficioso sobre el rendimiento en pollos de engorda, ya que incrementa la ganancia de peso, el índice de conversión y el peso corporal a los 42 días de crecimiento (Shamsi et al. comunicación personal). El objetivo de este estudio fue demostrar que estos efectos positivos sobre la productividad del pollo están directamente relacionados con el rendimiento de la canal. Adicionalmente se pretendía también evaluar el efecto sobre el peso de las vísceras y las medidas del tracto digestivo.
Este estudio se llevó a cabo en la granja de aves de corral de la Facultad de Agricultura de la Universidad Islámica Azad, Rasht Branch, en la ciudad de Ramsar, Irán (50° 40' N y 36° 54' E) durante la temporada de verano (cálida), entre julio-septiembre de 2013, a lo largo de un total de 42 días. El experimento se aprobó por el Consejo Científico de la Universidad Islámica Azad, y se llevó a cabo de acuerdo con las Directrices Internacionales para la investigación con animales22.
Trescientos (300) pollos de engorda machos Ross 308 de un día de edad23 se asignaron aleatoriamente a 10 grupos de tratamientos con tres réplicas por tratamiento. Cada réplica consistió en 10 pollitos alojados en corrales de 1.2 m2. Antes de que los animales fueran colocados en sus corrales, todas las instalaciones estaban completamente limpias y desinfectadas con 1:125 y 1:250 de solución multifenólica. Otros equipos, incluyendo bebederos y comederos, se desinfectaron con 20% de cloruro de benzalconio - Germo Killer. Todas las ventanas y los ventiladores se gasificaron con solución Formalex®.
La temperatura ambiente se ajustó a aproximadamente a 33 ºC en el día 1, y luego se redujo gradualmente a 24 ºC. Los corrales se equiparon con calentadores eléctricos. La iluminación contaba con un programa de 23L:1O (1900-2000 h). La humedad se mantuvo entre 55 y 65 % en el periodo de crecimiento inicial, por pulverización de agua en el suelo. Los pollos se vacunaron contra la enfermedad de Newcastle y de Gumboro. Para reducir el estrés, a las 24 h después de la vacunación, se suministró un multi-vitamínico y solución electrolítica (1:1000) a través del agua potable.
El agua y el alimento se suministraron ad libitum durante todo el período experimental. Los requerimientos nutricionales se basaron en el catálogo para la crianza de la estirpe Ross23. La alimentación se formuló para que fuera isoprotéica e isoenergética para todos los tratamientos. La composición de las dietas y su contenido nutricional se presentan en el Cuadro 1. Se utilizaron tres formulaciones de alimento durante el período de cría: el periodo de iniciación 1-14 días de edad (dde), crecimiento (15-28 dde) y de finalización (29-42 dde). El alimento sobrante en los comederos se pesó y se registró semanalmente.

Cuadro 1 Ingredientes y análisis de nutrientes de dietas utilizadas durante los periodos de inicio (1-4 días de edad), crecimiento (15-28 días) y finalización (29-42 días)
Los champiñones (A. bisporus) se obtuvieron de un productor local (Compañía Pars, Ramsar, Irán), se secaron a 60 ºC, seguido de molienda, y se añadieron a las dietas experimentales. Los tratamientos se seleccionaron para determinar cinco niveles de harina de champiñón (0, 0.5, 1.0, 1.5 y 2.0 g/kg), y dos niveles de flavofosfolipol (Teif Azmoon Pars, Co., Teherán, Irán), 0 o 5.0 mg/kg.
Al final del estudio, se seleccionó un ave por corral (un total de tres aves por tratamiento) basada en el peso promedio del grupo, sobre las que se obtuvo el peso corporal vivo, tras lo cual fueron sacrificadas y desangradas completamente. Se eliminó la cabeza, vísceras y patas. Las aves se diseccionaron para apartar y determinar el rendimiento de diferentes vísceras, tracto digestivo y partes de la canal. Se pesaron el buche vacío, proventrículo vacío, molleja vacía, grasa abdominal, timo, bazo, bolsa de Fabricio, hígado, riñones, páncreas, pulmones, corazón y cerebro. El intestino delgado vacío se dividió en duodeno (del inicio de la molleja al final de la curva del páncreas), yeyuno (desde la curva del páncreas al divertículo de Meckel) e íleon (del divertículo de Meckel a la unión íleo-intestino-ciego). El intestino grueso vacío se dividió en ciego derecho e izquierdo, colon y recto. Estas partes se pesaron y midieron, obteniéndose longitud, anchura y diámetro.
Los pesos relativos se calcularon como un porcentaje del peso vivo al sacrificio: la canal se dejó reposar durante una hora para eliminar el exceso de agua y posteriormente durante toda la noche en un refrigerador a 4 ± 1 ºC, y se utilizó la relación entre el peso eviscerado y el peso vivo x 100. Posteriormente la canal se diseccionó, obteniendo la pechuga, muslos, alas, cuello y notarium, los cuales se pesaron. Estas mediciones se utilizaron para calcular el porcentaje de estas partes del peso de la canal.
Modelos lineales generales (GLM, SPSS 15.0, Chicago, IL, EE.UU.) examinaron los efectos de HC y flavofosfolipol en la canal, pesos de vísceras y sobre las medidas del tracto digestivo, en un arreglo factorial 2 × 5 usando: Yijk=ì+Aj+Bk+ AjBk+eijk. Las variables que resultaron significativas con los GLM se analizaron con ANOVA de una vía para encontrar diferencias entre los tratamientos, (diferentes niveles de adición de HC o antibiótico vs grupos de adición de antibióticos). El test de Tukey se utilizó para determinar las diferencias entre los grupos.
El efecto de alimentar a los pollos con distintos niveles de harina de champiñón junto a la adición o no de flavofosfolipol sobre el peso canal, pechuga, muslos, alas, órganos comestibles, órganos relacionados con la inmunidad y las diferentes partes del tracto digestivo se muestran en los Cuadros 2 a 4. El peso de la canal fría fue influido tanto por la inclusión del antibiótico como de la HC (Cuadro 2). Las mismas variables afectaron positivamente el peso de la canal eviscerada (Modelo F3.26= 10.70, P<0.001, R2= 56.8 %; coeficientes: HC= 7.4 ± 36.2, P<0.001, antibiótico= 212.4 ± 62.6, P<0.01, interacción= -196.7 ± 51.1, P<0.01). La inclusión de flavofosfolipol en la dieta mejoró algunas de las características de la canal: aves con mayor peso de pechuga, así como un mayor peso relativo de la misma (Modelo F3,26= 6.23, P<0.05, R2= 18.2 %; coeficiente: antibiótico= 2.0 ± 0.8, P<0.05). En contraste, el flavofosfolipol mostró un efecto negativo sobre el peso relativo de las alas (Modelo F3.26= 3.79, P<0.05, R2= 31.3 %; coeficientes: antibiótico= -0.7 ± 0.2, P<0.01, la interacción entre HC y antibiótico= 0.03 ± 01, P<0.05) y el cuello (Modelo F3.26= 4.98, P<0.05, R2= 15.1 %; coeficiente: antibiótico= -0.2 ± 0.1, P<0.05).

Cuadro 2 Efecto de flavofosfolipol (Ab), añadido a las dietas que contienen harina de champiñón (MP) sobre pesos de componentes de la canal (g) de pollos de engorda los 42 días de edad.
Las raciones de alimentación con HC mejoraron los pesos de pechuga, muslo y cuello (Cuadro 2). El efecto de las dos variables estudiadas sobre el peso de las distintas vísceras se muestra en el Cuadro 3. La inclusión de flavofosfolipol al 5.0 % en la dieta no logró mejorar el peso de ningún órgano. Por otro lado, la harina de champiñón mostró un efecto positivo sobre el peso del timo, bazo, bolsa de Fabricio, hígado y cerebro. Por último, los efectos de la adición a la dieta del antibiótico y la HC en las medidas gastrointestinales se muestran en los Cuadros 4.1, 4.2 y 4.3. No hubo efecto del antibiótico en ninguna de las mediciones gastrointestinales tomadas y la HC mostró diferencias estadísticamente significativas en sólo 6 de los 27 rasgos medidos.

Cuadro 3 Efecto de flavofosfolipol (Ab) añadido a las dietas que contienen harina de champiñón (MP) en los pesos de las vísceras (g) de pollos de engorda a los 42 días de edad.

Cuadro 4.1 Efecto de flavofosfolipol (Ab) añadido a dietas que contienen harina de champiñón (MP) en el peso (g) y medidas (mm) del sistema digestivo de pollos de engorda machos a los 42 días de edad.

Cuadro 4.2 Efecto de flavofosfolipol (Ab) añadido a dietas que contienen harina de champiñón (MP) en los pesos (g) y medidas (mm) del sistema digestivo de pollos de engorda machos a los 42 días de edad.
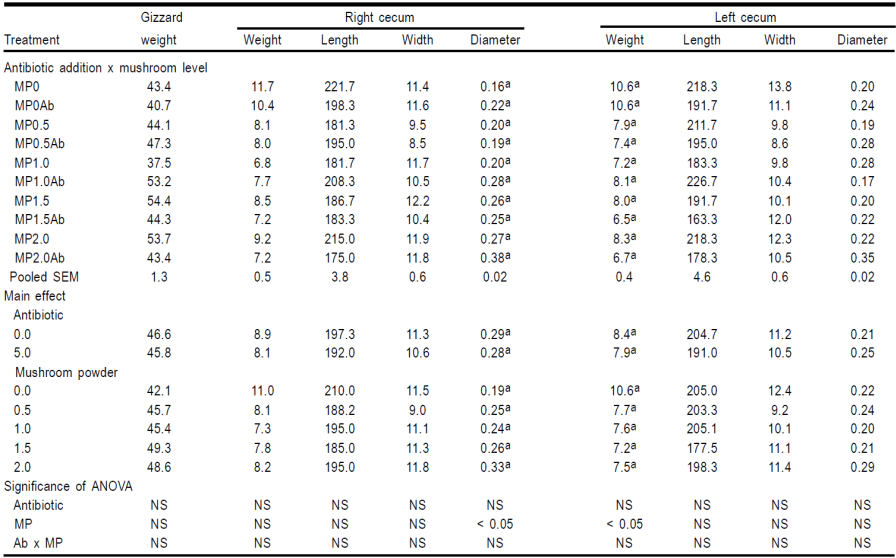
Cuadro 4.3 Efecto de flavofosfolipol (Ab) añadido a dietas que contienen harina de champiñón (MP) en los pesos (g) y medidas (mm) del sistema digestivo de pollos de engorda machos a los 42 días de edad.
Los resultados del presente estudio muestran un efecto positivo del antibiótico y la HC en el peso de la canal en frío. Aunque la adición de flavophopholipol mostró un efecto negativo en el peso relativo del cuello y las alas, tuvo un efecto positivo sobre el peso de la canal eviscerada. Por otro lado, la adición de HC tuvo un efecto positivo en el peso de partes de la canal que son económicamente importantes, como la pechuga y los muslos; sin embargo la combinación del antibiótico y la HC no ejercieron un efecto acumulativo en la canal a pesar de sus efectos individuales.
El mayor peso de los órganos inmunológicos (timo, bazo y bursa) al añadir HC sugiere un mejor estado inmune de los pollos, ya que el peso de los órganos linfoides refleja la capacidad del cuerpo para proporcionar linfocitos durante una respuesta inmune. En este sentido, las aves inmunodeprimidas o estresadas suelen tener órganos linfoides más pequeños, mientras que el mayor peso de la bursa refleja un mejor estado de salud. La bolsa de Fabricio tiene un papel extremadamente importante en la integridad morfológica y funcional del sistema inmune. El peso de la bursa en los pollos de engorda también refleja la respuesta anatómica a la alteración del sistema inmune debido al estrés24. En concordancia con nuestros resultados, otros autores también han mostrado beneficios ligados a la inmunología en pollos de engorda alimentados con diferentes suplementos de hongos25. Puesto que la composición de los mismos es compleja e incluye diferentes componentes, tales como proteínas inmunomoduladoras (FIPS, por sus siglas en inglés)26, los hongos comestibles no deben ser considerados sólo como un simple alimento.
Así, la actividad inmunoestimulante de A. bisporus ha sido plenamente demostrada; sus extractos de polisacáridos tienen un efecto inmunoestimulante induciendo la síntesis de IFN-𝛿, que altera la transcripción de hasta 30 genes que a su vez producen variedad de respuestas fisiológicas y celulares27. Además, A. bisporus es también una buena fuente de selenio28, que se ha demostrado que mejora la actividad inmune humoral(29).
El mayor peso del hígado de los pollos tratados con HC podría reflejar el efecto antioxidante del champiñón común7,8,9. En este sentido, se ha observado que la administración de extracto etanólico de A. bisporus mejora de manera significativa la actividad de enzimas antioxidantes en hígado de ratones25.
En términos generales, la suplementación de HC mostró un efecto muy débil en las diferentes medidas del tracto gastrointestinal. Se esperaban mayores diferencias, ya que se ha demostrado que los hongos afectan la morfología intestinal. Algunos investigadores han encontrado que el consumo de hongos modifica la conformación de la mucosa intestinal produciendo una mayor altura de las vellosidades en duodeno, yeyuno e íleon, cambios que afectan la capacidad de las aves para absorber nutrientes de la alimentación15. Más sorprendente es el hecho de que no se encontró ningún efecto positivo al incluir flavofosfolipol, ya que el uso de AGP provoca cambios en la estructura del sistema gastrointestinal; la mayoría de los cuales son el resultado de la reducción en el peso total del intestino delgado debido más a los cambios en el espesor de la pared intestinal, que a cambios en su longitud30,31,32. Algunos autores han indicado que la inclusión en la dieta de antibióticos, como promotores del crecimiento, reduce el peso del intestino por el adelgazamiento de la pared intestinal33 y otros han encontrado un menor peso del intestino delgado y el acortamiento del intestino en pavitos tratados con virginiamicina34. Una explicación plausible es que los efectos negativos de AGP y los efectos positivos de los componentes de A. bisporus podrían estar traslapados. En cualquier caso, se requiere más investigación para llegar a una conclusión definitiva.
El uso de flavofosfolipol y HC tuvo efectos positivos en el crecimiento de los polluelos. Estos efectos se tradujeron en mayores pesos de partes de la canal con relevancia económica, como la pechuga y muslos. Los resultados muestran también un incremento general en los órganos relacionados con la inmunidad, lo cual refleja un mejor estado inmunológico de los pollos alimentados con harina de champiñón. Un incremento en el peso del hígado también se asoció con propiedades antioxidantes del champiñón común. Por último, en cuanto al efecto sobre los parámetros gastrointestinales, a pesar de la débil influencia observada, es necesaria una posterior investigación para una conclusión definitiva.











 texto en
texto en 


