Introducción
Un gran número de las vacunas contra la rabia se han desarrollado utilizando diferentes sistemas, incluyendo baculovirus y plantas1-7. Una de las principales ventajas del sistema de expresión de células de insecto-baculovirus es el alto rendimiento de la proteína recombinante producida por litro de cultivo celular8. Aunque se ha informado de la expresión de la proteína G del virus de la rabia en diferentes sistemas vegetales7,9 el desarrollo de una vacuna oral contra la rabia reduciendo el costo de producción y distribución sería muy útil, especialmente para los países en desarrollo, donde la enfermedad es endémica en humanos y animales domésticos. La glicoproteína es el antígeno principal del virus de la rabia, es una proteína transmembrana, que consiste en un dominio citoplásmico, un dominio transmembranal y un ectodominio expuesto como trimero. El ectodominio está involucrado en la inducción de anticuerpos neutralizantes y linfocitos T citotóxicos y cooperadores10,11. Muchos estudios han demostrado que los extractos crudos del antígeno recombinante purificado de los extractos puros de las plantas o la planta entera pueden inducir respuestas inmunes locales o sistémicas1,7,12. En la literatura existen pocos estudios que han evaluado el tipo de citocinas inducidas por las vacunas antirrábicas de nueva generación13.
El objetivo de este estudio fue comparar la respuesta de IFN-γ e IL-4 en ratones inoculados con proteína G recombinante del virus de la rabia (rGpRV) que se expresó tanto en células de insecto infectadas con baculovirus como en maíz transgénico. Para este propósito, la transformación y regeneración de plantas de maíz para la producción de maíz transgénico utilizado para la inmunización se realizó como se ha descrito previamente por Loza-Rubio et al14.
Materiales y métodos
Proteínas recombinantes
Para baculovirus recombinante, el fragmento que codifica la glicoproteína soluble de virus de la rabia se amplificó por RT-PCR (SuperScriptTM One-Step RT-PCR, Invitrogen, Carlsbad, CA, EE.UU.), utilizando un virus de murciélago hematófago cepa CASS-88. Los iniciadores: 5'- GTGTGGATCCTATGAAATTCCCCATC-3 ‘y 3’-5- GAGACTCTAGA TCCCCAGTTAGGGAG’ (sitios de restricción BamHI y XbaI incluidos en los iniciadores están subrayados) se utilizaron para amplificar el gen G. El producto de PCR se insertó en los sitios XbaI-BamHI del vector digerido pFastBacMel-B2 bajo el control del promotor constitutivo de la polihedrina como se ha descrito previamente15.
Para la detección de la glicoproteína G recombinante en ambos sistemas de expresión, se realizó una prueba de Western blot utilizando un suero de conejo hiperinmune preparado en nuestro laboratorio14. Las concentraciones de proteína se determinaron utilizando el método de Bradford (Bio-Rad, EE.UU.) y el nivel de expresión de rGpRV se determinó por densitometría usando una curva estándar de albúmina de suero bovino. Los geles se tiñeron con azul de Coomassie y las señales se digitalizaron y se cuantificaron por análisis Kodak 1D Imagen Software (Kodak Company Este, New Haven, EE.UU.).
Evaluación de la respuesta inmune
Para evaluar la respuesta inmune, se adquirieron en el Bioterio México (México, DF) ratones CD1 machos de 21 días de edad (n= 90) y se mantuvieron en condiciones de limpieza con comida y agua ad libitum. Todos los experimentos con animales se aprobaron y realizaron de acuerdo con las directrices de la Norma Oficial Mexicana NOM-062-ZOO-1999. Los animales se dividieron en cinco grupos: el grupo 1 recibió una dosis intramuscular (im) de vacuna antirrábica inactivada comercial (Derriplus, PRONABIVE, México, DF); en el grupo 2, los ratones se alimentaron con un gramo de granos de maíz que contenían 100 μg de proteína del virus G de la rabia; el grupo 3 recibió una dosis im de 100 μg de proteína G recuperada a partir de células de insecto infectadas con BacGrabMel; en el grupo 4 los ratones se inocularon por vía oral con la proteína G, 100 μg expresada por BacGrabMel; en el grupo 5, los ratones se alimentaron con maíz no transformado. Los ratones restantes se sangraron antes de la inmunización y a los 10, 15, 30, 45 y 60 días post inoculación (dpi) para detectar anticuerpos específicos anti-proteína G. A los 60 dpi, cada ratón se desafió con 106.1 DL50/ ml de virus de rabia cepa CASS-88. Los animales que presentaron signos de rabia se sacrificaron (15 días), y sus cerebros se retiraron y se realizaron la pruebas de inmunofluorescencia (FAT)16. Los sueros se evaluaron para detectar anticuerpos neutralizantes de virus de rabia (VNA) mediante la prueba rápida de inhibición de focos fluorescentes (RFFIT, por sus siglas en inglés), como se ha descrito previamente17.
Respuesta celular
Por otra parte, se usaron 12 ratones de cada grupo para la detección de citocinas. Tres ratones de cada grupo se sacrificaron humanitariamente a los 5, 10, 15 y 20 días después de la inmunización y se retiraron los bazos para evaluar la secreción de citocinas. En primer lugar, se preparó una cinética para determinar el mejor momento para la proliferación de esplenocitos. Por lo anterior, se prepararon suspensiones de esplenocitos y las células muertas se eliminaron utilizando Lympholyte® (Cedarlane, Ontario, Canadá). El tiempo óptimo (72 h) para tomar los sobrenadantes de esplenocitos después de la vacunación de cultivo de bazo se determinó mediante una curva13. Los sobrenadantes se utilizaron para determinar la presencia de IL-4 e IFN-γ usando los kits comerciales ELISA ReadySET-G ELISA (eBioscience, San Diego CA, EE.UU.) según las instrucciones del fabricante. Brevemente, las placas ELISA Maxisorp® se bloquearon incubando a temperatura ambiente durante 1 h. Posteriormente, se recubrieron con 100 μl por pozo con anticuerpo de captura y se incubaron durante la noche a 4 °C y se lavaron tres veces. Los estándares se diluyeron a concentraciones apropiadas y se adicionaron 100 μl por pozos a un número de pozos apropiados. Se añadieron 100 μl por pozo de cada muestra y se incubaron las placas a temperatura ambiente durante 2 h. Posteriormente, se añadió anticuerpo de detección. Finalmente, se añadió el sustrato Avidina-HRP y se incubaron a temperatura ambiente durante 15 min. Las placas se leyeron a 450 nm.
Análisis estadístico
Se utilizó un análisis repetido de varianza (ANOVA) para probar las diferencias en los resultados entre todos los grupos que recibieron diferentes esquemas de inmunización. Los niveles de IFN-γ e IL-4 se analizaron por ANOVA de dos vías con Dunnett y comparaciones múltiples de las medias de Bonferroni. El nivel de significancia utilizado fue 0.05. Los cálculos estadísticos se realizaron utilizando el paquete estadístico SPSS 19 de IBM ®.
Resultados
Los extractos de proteína de plantas transformadas y no transformadas y células Sf9 transfectadas con BacGrabMel se evaluaron por Western blot. El inmunoensayo demostró la expresión con éxito del monómero de la proteína G de 65 kDa (Figura 1). Esta banda no fue detectable en los controles negativos. Por densitometría se determinó que un gramo de maíz contenía 50 μg de glicoproteína de la rabia. Mientras tanto, en baculovirus se determinó que se podrían obtener 2 a 7 mg de proteína recombinante por litro de sobrenadante de células infectadas con el baculovirus recombinante. El IFN-γ se detectó en los esplenocitos de los ratones de todos los grupos inmunizados a partir de cinco días después de la vacunación, hasta 20 días después de la inmunización. Los niveles de IFN-γ fueron similares en animales inmunizados im con la vacuna inactivada (grupo 1) a los que se inmunizaron con la proteína G expresada en baculovirus (grupo 3) y significativamente mayor (P<0.01) que aquéllos en los grupos inmunizados por vía oral (grupos 2 y 4) (Figura 2A). Asimismo, aunque en menor medida, se observó la inducción de IL-4 en los ratones de todos los grupos inoculados. La concentración máxima de IL-4 se detectó 15 días después de la inmunización, y los niveles fueron similares en todos los animales vacunados (Figura 2B). Como se esperaba, no se detectaron IFN-γ e IL4 en los ratones testigos no inmunizados (grupo 5).
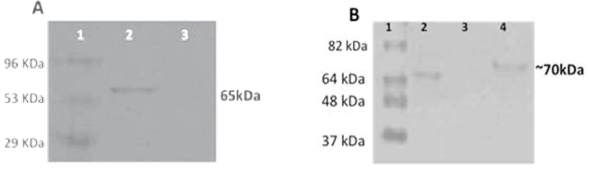
Figura 1 Identificación de la proteína del virus G de la rabia en dos sistemas de expresión eucariotas: baculovirus (A) y maíz (B) de transferencia por Western blot.
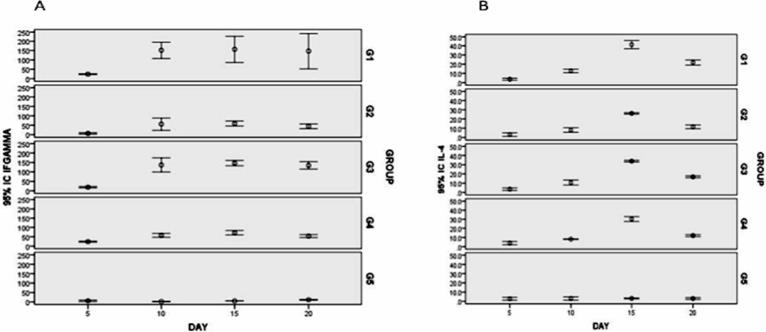
Figura 2 A) Niveles de INF-g en ratones inmunizados. B) Cuantificación de IL-4 de citoquinas por ELISA.
La Figura 3, muestra los anticuerpos neutralizantes específicos en los grupos vacunados, los cuales se detectaron a partir de 15 dpi hasta el día del desafío (60 dpi). No se detectaron anticuerpos específicos en los animales del grupo control (grupo 5). Los ratones en el grupo 3, inmunizado por la vía im con el baculovirus que expresó la proteína G, indujo niveles de anticuerpos similares a los del grupo 1 hasta 30 dpi. Estos niveles fueron significativamente mayores (P<0.01) que los de los otros dos grupos inmunizados (2 y 4). El 100 % de los ratones inmunizados con la vacuna inactivada sobrevivió al desafío en el día 60 pi, 83 % de los ratones del grupo 2 (rGpRV comestible de origen vegetal) y el grupo 3 (expresada en baculovirus proteína G im administrada) sobrevivieron a la infección. En contraste, ninguno de los ratones no vacunados (0 %) o los inoculados por vía oral con la proteína recombinante G (0 %) fueron protegidos (Figura 4). La presencia de virus de la rabia en los cerebros de todos los animales muertos se demostró por la prueba de inmunofluorescencia directa (FAT, por sus siglas en inglés).
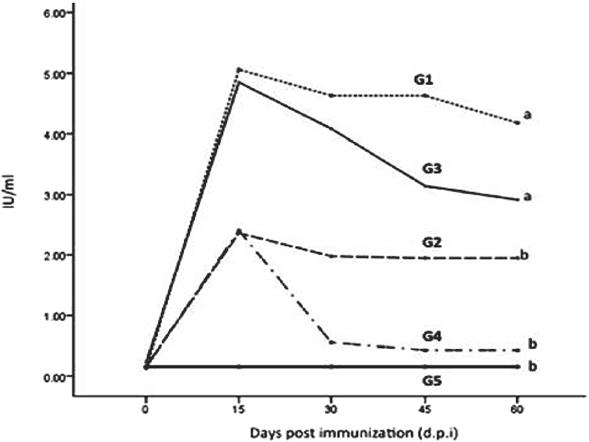
Figura 3 Niveles de anticuerpos neutralizantes inducidos por la glicoproteína de la rabia recombinante (rGpRV) expresada en diferentes sistemas de expresión.
Discusión
La producción de proteínas recombinantes en líneas celulares de mamíferos, insectos y plantas y animales transgénicas se están incorporando progresivamente en las actividades de producción18. El objetivo de este estudio fue analizar la respuesta de IFN-γ e IL4 en ratones inoculados con la proteína G del virus de la rabia (GpRV) expresada en baculovirus y maíz. En este trabajo, sólo se utilizó la región soluble del GpRV con el fin de obtener una proteína soluble en los dos sistemas de expresión. En estudios previos se ha demostrado que la glicoproteína soluble mantiene propiedades antigénicas e inmunogénicas que inducen anticuerpos neutralizantes del virus y provocar así una protección completa ante un desafío19. El análisis del Western blot mostró la correcta expresión de la glicoproteína tanto en maíz como en baculovirus. Sin embargo, el peso molecular de la proteína recombinante expresada en el maíz fue ligeramente superior. Esto probablemente refleja diferentes modificaciones post-traduccionales, como se ha observado previamente9. El dominio de GpRV tiene tres sitios potenciales de N-glicosilación en Asn37, Asn247 y Asn319, de los cuales los dos últimos son eficientemente glicolisados20. En el caso de las plantas, en general, el péptido señal se escinde de acuerdo a las mismas reglas en plantas y mamíferos. Además, un precursor oligosacárido en el residuo Asn de un tripéptido Asn-X-Ser/Thr de la proteína es el mismo en las células vegetales21. Los baculovirus permiten múltiples modificaciones post-traduccionales que son similares o idénticas a las que se producen en células de mamífero, tales como oligomerización, fosforilación, glicosilación y escisión proteolítica8.
La proteína G expresada conservó sus propiedades inmunogénicas nativas, como se demostró por reactividad contra el suero hiperinmune específico. El análisis del Western blot reveló la generación de la glicoproteína recombinante del virus de la rabia con propiedades antigénicas e inmunogénicas. Los resultados de los ratones inmunizados por vía im u oral indican que la presencia de citocinas (IFN-γ e IL4) resulta en una tendencia a desarrollar una respuesta de células Th1 después de la inmunización con las dos proteínas recombinantes ensayadas, como se evidencia por la detección de IFN-γ hasta 20 días después de la vacunación. Resultados similares se observaron por Tesoro-Cruz et al15,22 utilizando una vacuna de ADN contra la rabia y Hu et al23 con una vacuna con adyuvante tradicional. Este resultado apoya la hipótesis de Drings24, que sugiere que las vacunas subunitarias (tales como vacunas comestibles o derivadas de baculovirus) preferentemente desarrollan una respuesta Th1.
Sin embargo, después de 15 días, se observó un ligero aumento en la concentración de IL-4, una citocina típica de respuesta Th2. Esta respuesta está relacionada con la presencia de anticuerpos. La detección de IL-4 fue previamente informada por Perrin et al25 después de la administración de una vacuna de ADN desnudo contra la rabia en perros. Por otra parte se ha demostrado la producción de IFN-γ y altos títulos de anticuerpos en ovejas vacunadas con un adenovirus recombinante y con una vacuna comestible que expresa GpVR2.
La inmunización de ratones con cada una de las proteínas recombinantes ensayadas, ya sea producida en plantas o células de insecto, indujeron anticuerpos protectores específicos cuando se administraron por vía oral o im respectivamente. Estos resultados son consistentes con los obtenidos en trabajos anteriores en los que GpRV se expresó en diferentes sistemas vegetales7.
En esta investigación se observó que el nivel de anticuerpos neutralizantes se relaciona con la protección; sin embargo, estos comenzaron a descender a 45 dpi. En cuanto al ensayo de protección, en el caso de los grupos 2 y 3, los niveles de protección eran más altos que el requisito mínimo establecido por la Norma Mexicana (NOM-067-ZOO-2007), en la que se establece que más del 80 % de protección es suficiente para vacunas tradicionales. Los niveles de protección (83 %) observados en los ratones alimentados con el maíz transgénico que expresa la proteína G, puede deberse a la degradación parcial por parte de los jugos gástricos, aunque en otros casos, no se observó este efecto. En este estudio, se desafió al día 60 debido a que se quería evaluar la presencia de anticuerpos a largo plazo utilizando una dosis única sin adyuvantes o refuerzo, ya que esto sería muy útil en el ganado. Por otra parte, cabe destacar que los animales del grupo 2 inmunizados por vía oral con el maíz mostraron una protección superior en comparación con el grupo 4, que había sido inmunizado por la misma ruta pero con proteínas derivadas de baculovirus. Es posible que esto se deba a que la proteína utilizada en el grupo 4 que se administró en solución, se expuso a la acción de proteasas y pH presentes en el sistema gástrico, y podrían haber degradado esta proteína más rápido que cuando se expresa en el maíz. Este último habría servido como un protector de la proteína recombinante.
Conclusiones e implicaciones
Este estudio demuestra que la proteína G derivada de células de insecto infectadas con baculovirus o de plantas protege contra un desafío letal con el virus de la rabia a un nivel similar a la de una vacuna inactivada; ambos sistemas pueden ser una buena alternativa como vacuna termoestable, lo que sería muy útil para prevenir y controlar la enfermedad en los países tropicales y subtropicales. Basados en esta evidencia, se concluye que la proteína G de la rabia recombinante expresada en baculovirus promovió IFN-γ y anticuerpos de una manera similar a la vacuna de rabia inactivada. A pesar de esto los ratones alimentados con maíz transgénico sobrevivieron al desafío en el mismo porcentaje que en el grupo 3. Estos antígenos promueven las respuestas Th1 y Th2.











 text in
text in 



