Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.6 no.3 Mérida jul./sep. 2015
Artículos
Caracterización epidemiológica de las áreas endémicas de estomatitis vesicular en México (1981-2012)
Epidemiological characterization of vesicular stomatitis in Mexico (1981-2012)
Roberto Navarro Lópezª, Lauro Vázquez Salinasb, Susana Arellano Chávezc, Irene López Gonzáleza, César Luis Villarreal Chávezª, Juan Antonio Montaño Hiroseª
a Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria / Dirección General de Salud Animal. Avenida Municipio Libre 377, Piso 7 Ala B, Col. Santa Cruz Atoyac, Deleg. Benito Juárez. 03310, México DF. México. clviHarrealch02@yahoo.com.mx Correspondencia al quinto autor.
b USDA/ARS Plum Island Animal Disease Center, Greenport, NY. USA.
c Universidad Autónoma de Chiapas. Tuxtla Gutiérrez, Chiapas, México.
Resumen
El presente estudio se diseñó para mejorar el sistema de vigilancia de las enfermedades vesiculares en México, bajo el sistema de planeación estratégica, identificando las zonas endémicas a través de la estabilidad de linajes virales del serotipo Nueva Jersey, y analizando epidemiológicamente la información generada en 32 años de vigilancia e investigación. Se presentan los resultados que permitieron caracterizar epidemiológicamente las áreas donde se mantiene el virus de estomatitis vesicular de manera secular en México, y con ello, los componentes necesarios para la construcción de la Matriz de Indicadores para Resultados (MIR) para el programa de vigilancia de las enfermedades vesiculares en México, que pueden también servir para otros países afectados por esta enfermedad. Adicionalmente se aportan elementos para la prevención de la enfermedad, así como mejorar el comercio internacional de animales de países endémicos de estomatitis vesicular.
Palabras clave: Linajes, Exportación de caballos, Vectores, Estomatitis vesicular, MIR.
Abstract
The present study aims to improve the surveillance system of vesicular diseases in Mexico, using the strategic planning system, by identifying endemic areas in which the New Jersey serotype viral lineages are stable and by analyzing the information generated during 32 yr of monitoring. We show the necessary elements for building the Matrix of Results Indicators (MRI) that could be used on the vesicular diseases surveillance program in Mexico and in other affected countries. The results that allowed the characterization of the epidemiological areas where the virus of vesicular stomatitis (VS) remains in a secular way in Mexico are presented. Elements for disease prevention are also provided in order to improve the live animal international trade.
Kye words: Vesicular stomatitis, Horse export, Endemic stomatitis, Vectors.
INTRODUCCIÓN
En México, la estomatitis vesicular (EV) es una enfermedad endémica transmisible, de notificación inmediata obligatoria a las autoridades de salud animal por su importancia estratégica y por sus efectos en la producción pecuaria y comercio internacional(1). Las mayores pérdidas en producción se presentan en brotes fuera de las zonas endémicas(2,3). La Organización Mundial de Sanidad Animal (OIE) la retiró de las enfermedades de importancia económica en el año 2014(4). Sin embargo, la Unión Europea (UE) mantiene sus restricciones en el comercio de animales provenientes de países infectados(5). La EV es causada por un virus del género Vesiculovirus de la familia Rhabdoviridae, orden Mononegavirales. Se identifican dos serotipos, denominados Nueva Jersey (NJ) e Indiana (IN)(2,6). El serotipo NJ es responsable del 90 % de los casos clínicos(2,7) identificándose por primera vez en 1947, en el estado de Aguascalientes durante la epizootia de fiebre aftosa (FA)(8,9,10). Se reconoce que ambos serotipos NJ e IN se mantienen de manera endémica en múltiples linajes virales, en reservorios desconocidos ubicados en diversas zonas tropicales del continente americano, y que ambos son responsables de la presentación anual de casos clínicos fuera de las zonas endémicas(11,12). Existen diversas hipótesis para explicar este fenómeno, la más sólida plantea que se debe al movimiento de vectores(2,12,13). En el serotipo NJ, por medio de análisis filogenéticos, se han reconocido seis clados, siendo el clado I el que abarca los virus circulantes en Norteamérica incluyendo México(2,12), asimismo, se han logrado identificar escapes del clado II de Centroamérica en el centro y sur de México(12). Para el virus IN, se reconocen dos clados, los virus mexicanos se comparten con los identificados en los de USA(2).
La EV es una arbovirosis; los vectores incriminados son las moscas areneras Lutzomias spp (Diptera, Psychodidae)(14,15,16) y las moscas negras Simulidos spp (Díptera: Simulidae)(3,17), en las que se ha comprobado experimentalmente transmisión horizontal y transovárica(2,14,17). Otras especies de vectores pueden estar involucradas(18,19). Se ha planteado que los virus de EV afectan primariamente a los insectos y que ocasionalmente infectan a los mamíferos(20). La EV afecta de manera clínica a los bovinos, porcinos y equinos, sin embargo, existen infecciones subclínicas que se detectan por serología en una amplia gama de especies animales(2,21). En humanos, es considerada una zoonosis menor(22) y no se reconoce que exista el estado de portador(23,24). El virus se transmite por vía transcutánea o transmucosa(17), y los animales afectados clínicamente presentan vesículas en labios, lengua, encías, narinas, pezones, banda coronaria y espacio interdigital de las pezuñas, pudiendo afectar al 90 % de los animales expuestos(25). Estos elementos se utilizan como indicador para la vigilancia de la FA. Ambas enfermedades son indistinguibles clínicamente, por lo que la vigilancia de enfermedades vesiculares es de alta prioridad, considerando, que una baja en la sensibilidad del programa de vigilancia, puede ocasionar que no se detecte oportunamente la FA.
El presente estudio fue diseñado para caracterizar epidemiológica y molecularmente las áreas endémicas de EV y con ello, generar los Indicadores y la línea base necesarios para la construcción de la Matriz de Indicadores para Resultado (MIR)(26) a fin de coadyuvar a mejorar el sistema de vigilancia de las enfermedades vesiculares en México.
MATERIALES Y MÉTODOS
Los registros de casos presentados de EV corresponden a bases de datos de la Dirección General de Salud Animal, del Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA), generados por la Comisión México - Estados Unidos para la Prevención de la Fiebre Aftosa y otras Enfermedades Exóticas de los Animales (CPA) durante 32 años, en el período 1981 a 2012. Esta información contiene datos epidemiológicos y geográficos. Se incluye información generada en los proyectos de colaboración entre Agricultural Research Service - United States Department of Agriculture (ARS - USDA) y CPA-SENASICA 2000 - 2004, no publicados, cuyo objetivo principal fue caracterizar las zonas endémicas de EV en México, donde se obtuvieron registros precisos de cada investigación por enfermedad vesicular en los estados de Chiapas, Tabasco, el sur de Veracruz y el Istmo de Oaxaca. El total de registros en este proyecto fueron 207 investigaciones en hatos confirmados con EV (310 animales promedio/investigación).
El estudio epidemiológico es descriptivo(27), con información oficial de SENASICA de los casos confirmados, donde caso confirmado de EV, es una explotación pecuaria en la que se ha demostrado en animales enfermos la presencia del virus de EV, mediante una prueba oficial de muestras de epitelios y líquidos vesiculares, procesados por las técnicas de fijación de complemento y aislamiento viral (hasta 2005). A partir de 2006, por las técnicas de ELISA-DAS (Double Antibody Sandwich) y RT-PCR.
La serología positiva no es confirmatoria de un caso, los resultados de laboratorio de los sueros sanguíneos reportados en este estudio, fueron producto de las investigaciones en los hatos infectados de EV analizados por la técnica de seroneutralización.
El análisis estadístico se realizó con el programa SPSS for Windows Versión 15.0, SPSS Inc, Chicago Ill, USA, 2006, para el cálculo de proporciones y desviaciones estándar.
Para generar indicadores estratégicos y una línea base para el programa de vigilancia de las enfermedades vesiculares, se utilizó la guía propuesta por la Secretaria de Hacienda y Crédito Público y otros(26).
Se calculó la Incidencia de EV por 100 mil bovinos, considerando todos los casos por cada año. El algoritmo utilizado fue IEV= (CCEV/PT) 100,000, donde IEV es igual a la incidencia de la estomatitis vesicular en el año t, CCEV es igual al número de casos confirmados de estomatitis vesicular en el año, y PT es igual a la población total de bovinos en el año t.
Para determinar si la densidad animal influye en la persistencia viral, se calculó la proporción (P), que es el número de casos confirmados de EV por año, dividido entre el número de hatos de bovinos en cada entidad federativa de acuerdo al INEGI(28) multiplicado por 10 mil.
Para determinar la ubicación espacial de los casos de EV por tipo de clima, se usó la desarrollada por Koppen(29,30). En esta clasificación, el clima Af corresponde a cálido húmedo con lluvias todo el año, Am corresponde a cálido húmedo con lluvias en verano, y Aw cálido sub-húmedo con lluvias en verano. Los datos estadísticos y de precipitación pluvial se obtuvieron en los sitios oficiales del Instituto Nacional de Estadística y Geografía(28), la Comisión Nacional del Agua(31) y la Secretaría de Medio Ambiente y Recursos Naturales (32).
Con la finalidad de describir la variabilidad genética del virus de estomatitis vesicular serotipo Nueva Jersey en México, por ser el de mayor prevalencia, se realizó el análisis filogenético de 27 cepas (Cuadro 1), todas ellas disponibles en la base de datos de secuencias genéticas del NIH (National Institute of Health de los EUA) conocida como GenBank. Estas cepas se colectaron entre 1982 y 2004 de bovinos en los estados de Chiapas (n=15), Tabasco (n= 4) y Veracruz (n=8) y fueron secuenciadas previamente por otros autores(33,34,35). Para el análisis filogenético se utilizaron 408 nucleótidos que forman parte de la región hipervariable del gen P del virus EV. Esta región del genoma tiende a acumular una gran cantidad de mutaciones a lo largo del tiempo, y puede reflejar lo que sucede en otras partes del genoma, por lo que ha sido usada en trabajos de caracterización filogenética(33,34,35).

El análisis filogenético se llevó a cabo con el software MEGA 5.03(36). Los parámetros de reconstrucción filogenética incluyen máxima verosimilitud como método de reconstrucción filogenética(37), Tamura de 3 parámetros con distribución gamma(38) como método de substitución nucleotídica, y como soporte estadístico se utilizaron 100 réplicas del método de Bootstrap(39). Adicionalmente, con la finalidad de calcular la diversidad genética total y por Estado, utilizando el software Mega 5.03, se realizaron comparaciones pareadas entre las secuencias tomando en cuenta el número de diferencias nucleotídicas.
RESULTADOS
Análisis de la información 1981-2012
El total de casos confirmados de EV en el período 1981-2012 fue de 1,561. El año con mayor registro fue 1983 (n= 124) y el mínimo en 2012 (n= 7). El promedio por año fue de 48.78 ± 27.1 casos registrados por el sistema en el periodo. El estado que mostró mayor promedio de casos por año fue Veracruz con 12.06 ± 7.8, seguido por Chiapas 11.56 ± 11.01 y Tabasco con 5.31 ± 7.2. En el 80.72 % de los casos registrados (n= 1,260), no se especifica el serotipo de EV. El 18.78 % de los casos (n= 293) corresponden al serotipo NJ y el 0.5 % (n= 8) son del serotipo IN. La relación NJ-IN es de 37 a 1. Con respecto a la frecuencia de casos totales en el periodo, el 59.3 % se registró en los estados de Veracruz (24.7 %), Chiapas (23.7 %) y Tabasco (10.9 %) (Figuras 1, 2).
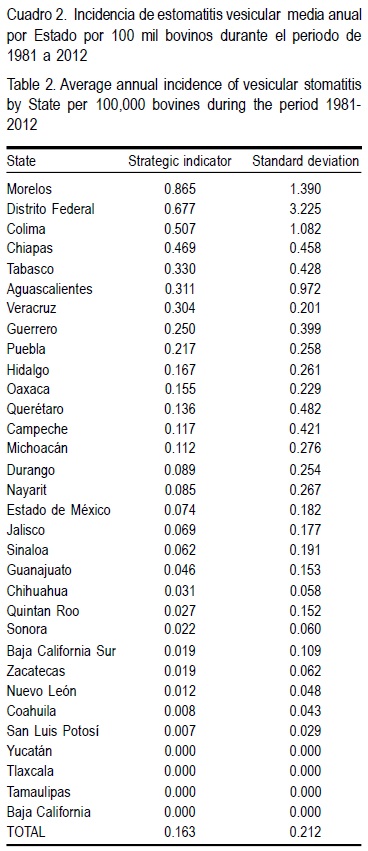
La incidencia de estomatitis vesicular (IEV) a nivel nacional en este periodo fue de 0.163 ± 0.212 por 100 mil bovinos. Para Chiapas fue de 0.469 ± 0.45, Tabasco 0.330 ± 0.42 y Veracruz 0.304 ± 0.20 por 100 mil bovinos (Cuadro 2).
La proporción de casos de EV por 10 mil hatos (PCEV/10 mil hatos) fue muy variable en el país, detectando una mayor PCEV para estados con pocos hatos ganaderos como el estado de Morelos, que tuvo una proporción 1.5/10 mil hatos (DE ± 2.9), o Colima, con 1.8/10 mil hatos (DE ± 4.3). Para los estados de Chiapas, Tabasco y Veracruz, que presentan casos de EV todos los años y tienen una alta densidad ganadera, la proporción fue de 1.3 ± 1.3; 1.4 ± 2.0 y 1.0 ± 0.7 respectivamente (Figura 2, Cuadro 3).

Al contrastar los porcentajes de casos por entidad federativa, contra la PCEV/10 mil hatos, sobresalen los estados de Veracruz, Chiapas, Tabasco, y en menor medida, pero por arriba de los promedios, el estado de Guerrero, indicando las zonas de mayor actividad viral (Figura 2). Estados con altas densidades de ganado bovino como Jalisco, Chihuahua y Sonora, se localizan por debajo del 5 % de los porcentajes de presentación y con proporciones de morbilidad menores al 0.4/10 mil hatos. Estados como Colima y Morelos presentan proporciones superiores a Tabasco, Chiapas y Veracruz, pero también por debajo del porcentaje de presentación del 5 %.
La especie más afectada por su frecuencia, fue la bovina con el 91 % de los casos, siguiendo en orden de importancia los ovinos, porcinos, equinos y caprinos. Con respecto a la temporalidad, la presencia de casos es directamente proporcional al ciclo de lluvias en México (mayo - octubre) (Figura 3). El pico de casos de EV se registra en el mes de octubre, con 276 casos en los períodos descritos.

Al analizar el comportamiento de la enfermedad en el tiempo y el espacio, se detectó un ciclo de presentación anual para los estados de Chiapas, Veracruz y Tabasco, afectando municipios aledaños de los estados de Oaxaca, Puebla y Campeche (Figura 4). Es posible la existencia de una zona endémica en el estado de Guerrero con influencia en municipios de los estados de Michoacán, oeste y costa de Oaxaca, Morelos y sur de Puebla. A nivel municipal, los municipios con mayor actividad viral en el tiempo y el espacio, corresponden a los ubicados en la zona central de Chiapas, los límites de Tabasco con Chiapas y el sur de Veracruz. De igual forma, sobresalen los municipios de los límites de Tabasco y Chiapas con la región del Petén en Guatemala.
Cuando se analizaron los casos de la zona endémica (Veracruz, Chiapas y Tabasco) en relación a los tipos de clima y precipitación pluvial, se observó que el período de menos casos de EV, corresponde a la temporada más seca del año, que es abril, con el 3 % (Figura 3). Conforme inicia el período de lluvias en mayo, se registra un incremento de casos, que continúa hasta alcanzar el máximo en el mes de octubre, con el 21 %, disminuyendo conforme el temporal de lluvias decrece. Para octubre, el 80 % del agua de lluvia ha caído, y se detectan diferencias en el acumulado de casos de EV por tipo de clima: en el clima Af, 68.9 % de los casos se registraron al término del período de lluvias, en el clima Am, el 56.6 % y en el Aw 51.4 %.
En el Proyecto Agricultural Research Service -United States Department of Agriculture (ARS -USDA) y CPA-SENASICA en el año 2003 se registraron 207 investigaciones confirmadas con la identificación del virus de EV, con un promedio de 310 animales por investigación. Por las técnicas de fijación de complemento y aislamiento viral se confirmó la presencia del serotipo NJ en 545 animales, de una población de 6,495 en riesgo (0.8 %). En los 545 animales con lesiones vesiculares, se encontraron un total de 627 lesiones. El 56 % correspondió a la boca, incluyendo la lengua, encías y labios. La segunda lesión en importancia se localizó en los pezones. El mayor número de animales con lesiones vesiculares encontradas correspondió al clima Aw con el 53.9 %, siguiendo en importancia el clima Am con 32.1 % y Af con 13.9 %. A nivel serológico, durante la investigación de campo, se recuperó suero sanguíneo a 480 animales infectados clínicamente de EV. La prueba de seroneutralización demostró que el 62.3 % tenía anticuerpos neutralizantes contra EV del serotipo Nueva Jersey (T 1:801:2560), el serotipo Indiana el 0.4 % (T 1:101:320) y el 25.2 % contra ambos serotipos Nueva Jersey e Indiana; el 9.5 % resultaron negativos.
Diversidad Genética
La diversidad nucleotídica del virus de estomatitis vesicular Nueva Jersey en México fue estimada sobre 4 %. Valores similares fueron encontrados para cada uno de los tres estados. Esta alta diversidad nucleotídica de correlación se muestra en la Figura 5, donde fue posible distinguir la presencia de por lo menos nueve diferentes linajes virales, los cuales circulan en Chiapas, Veracruz y Tabasco. Asimismo, fue posible estimar el tiempo que algunos de estos linajes han estado circulando; por ejemplo, en el linaje número VIII se agrupan las secuencias NJ1182VCB2 (recuperada en Veracruz en 1982) con las secuencias NJ0903CPB y NJ0803CPB3 (recuperadas en Chiapas en 2003) con una diferencia entre ellas en el tiempo de aislamiento de 21 años. Otros ejemplos son las secuencias de linaje II NJ0589VCB con la secuencia NJ1003TBB, y las secuencias del linaje V NJ1103TBB2 y NJ0789CB4, en estos casos con 14 años de diferencia. Estos resultados indican que estos virus han logrado establecerse en diferentes nichos ecológicos en los estados de Chiapas, Tabasco y Veracruz y que mantienen una gran estabilidad genética, siendo responsables de la presentación de casos anualmente.
DISCUSIÓN
Los resultados muestran que el serotipo NJ se mantiene secularmente de manera endémica con una estabilidad genética en nichos ecológicos de municipios de los estados de Chiapas, Veracruz y Tabasco. Estos municipios se ubican en el trópico húmedo, con climas Af y Am y en trópico seco Aw. Esta situación es similar a la encontrada por otros autores para zon as ecológicas de trópico seco Aw, donde se demuestra estabilidad genética de más de 30 años(2). La manifestación clínica generalmente se considera benigna dentro de las zonas endémicas, con una incidencia menor al 1 %. Esto parece ser consecuencia a la exposición constante al virus, que ocasiona infecciones subclínicas, que se reflejan en los estudios serológicos(7). El análisis de la información epidemiológica en México hace evidente que cuando se presentan casos de EV en los estados limítrofes con la unión americana, como son Sonora, Chihuahua, Coahuila y Nuevo León, se presentan también brotes en los EUA en un ciclo de 5 a 10 años(6,12,34).
Se pueden presentar brotes explosivos, muy localizados dentro de las zonas endémicas en explotaciones tecnificadas de cerdos y bovinos estabulados, que deben alertar al sistema de vigilancia. Esta población, posiblemente no está expuesta al virus, como lo están los animales de libre pastoreo. Como ejemplo, en la región de Villaflores, Chiapas, en donde está plenamente demostrada la actividad viral(7), se comprobó un brote de EV-NJ en una explotación de cerdos integrada y tecnificada, afectando a más del 90 % de los animales; este brote se asoció a la presencia de bovinos dentro de las unidades de producción, lo cual ocasionó severas pérdidas económicas. Esto es importante estudiar, debido a que los insectos transmisores posiblemente son atraídos por los bovinos(40); esto es factible, ya que después de que fueron retirados los bovinos, no se han presentado nuevos casos en más de 15 años.
En 2003, se confirmaron dos brotes de EV-NJ en cerdos de traspatio en los municipios de Minatitlán, Veracruz y Comalcalco, Tabasco; a los animales infectados se les tomó, además de los epitelios, muestra de sangre, presentando títulos neutralizantes para los dos serotipos NJ (T 1:280) e IN (T 1:20-1:360). Fuera de la zona endémica, en el norte del país, en el municipio de Navojoa, Sonora, región lejana a las zonas endémicas, en el año 2009 se presentó un brote en una granja tecnificada de porcinos por el serotipo NJ confirmado por aislamiento viral en ratón lactante. La población era de 4,174 animales, y al momento de la investigación había 200 enfermos con vesículas en diferentes partes del cuerpo y 10 muertos por causa desconocida. Los anticuerpos neutralizantes en seis animales afectados clínicamente tuvieron un título de 1:1024 al serotipo NJ.
Los datos serológicos que se presentan, obtenidos en el período 1981-2012, demuestran que los animales clínicamente afectados con vesículas y confirmada la enfermedad, tenían anticuerpos neutralizantes en un 62.3 %, contrastante con otros artículos que refieren que esta serología oscila entre el 9 a 11 %(2).
Los estudios de comportamiento epidemiológico de esta enfermedad en los diferentes países donde se manifiesta de manera endémica, coinciden con el presente estudio, donde los casos clínicos y subclínicos están asociados a la presencia permanente del agente infeccioso, el clima tropical húmedo o seco (Aw, Af y Am), la presencia de vectores y el estado inmunitario de los animales. Un factor de riesgo lo representan los insectos hematófagos, debido a su demostrada participación en la transmisión de la enfermedad, principalmente en la época de lluvias donde incrementan su población, por lo que se ha recomendado el baño insecticida y repelente cuando se presentan casos o brotes confirmados de EV, aunado a restricciones para impedir la movilización de animales clínicamente afectados(2). A nivel espacial, se consideró en 1978(41) que las áreas endémicas se encontraban en los llanos costeros alrededor de Veracruz y a lo largo del bajo Istmo de Tehuantepec, y aunque se reconocía que en los estados de Chiapas, Tabasco y sur de Veracruz se mantenía el virus de la EV, el presente estudio lo comprueba a nivel de municipio y tipo de clima, encontrando aún dentro de estos estados, áreas libres de la enfermedad (Figura 4).
No obstante que las pérdidas económicas pudieran ser significativas dentro de las áreas endémicas a causa de la EV, normalmente no genera en los productores ganaderos una preocupación permanente por esta enfermedad, por tanto, no se notifican los casos de EV. Esto puede ser la causa de que no se hayan realizado estudios formales en México para cuantificar su impacto, por pérdidas de leche y peso, o por tratamiento de animales infectados. En los EUA se considera que la EV es económicamente muy importante, principalmente por la restricción en la movilización de equinos(6,33).
Debido a la gran capacidad de difusión y destrucción del virus de la FA, presente en algunos países sudamericanos y otras regiones del mundo, se ha establecido un programa de detección temprana de FA tomando como base la investigación inmediata de casos de enfermedad vesicular, representada en México exclusivamente por la EV. El presente trabajo señala con claridad los lugares donde la EV es endémica en México y la frecuencia en la que se ha presentado en latitudes fuera de las zonas endémicas.
Por su importancia, se debe mantener y mejorar la vigilancia de la EV para detectar en tiempo y forma, posibles casos de FA u otra enfermedad exótica. Para ello se requiere de indicadores, que son las herramientas para clarificar y definir, de forma más precisa, objetivos e impactos de un programa, en este caso de las enfermedades vesiculares. En este estudio, se construyeron dos indicadores estratégicos, como es la IEV/ 100 mil bovinos y la PCEV/10 mil hatos por entidad federativa (Cuadros 2, 3), que constituyen elementos necesarios para la construcción de la Matriz de Indicadores para Resultados en los programas oficiales, que pueden servir como línea base para los servicios veterinarios oficiales responsables de esta vigilancia.
Además de que la EV puede ser confundida con FA, la EV ha sido considerada de importancia para el comercio, especialmente de equinos, donde aparentemente se difundió el virus por movilización de caballos de Norteamérica a Europa durante la primera guerra mundial. La Unión Europea ha elaborado estudios, que en teoría, explican como un virus de EV pudiera eventualmente llegar a Europa y diseminarse(5,42). Ante este escenario, en 2012 se generó un debate en la OIE para retirar a la EV de la lista de las enfermedades limitantes del comercio internacional(43). En la reunión anual de la OIE de 2013 fue un tema de debate(44) y se consolidó su retiro con la publicación del Código de los Animales Terrestres 2014(4).
CONCLUSIONES E IMPLICACIONES
Al crear un indicador basado en la IEV o la PCEV-hato, se tiene una medida verificable de cambio o resultado, diseñada para contar con un estándar contra el cual evaluar, estimar o demostrar el progreso del sistema de vigilancia con respecto a metas establecidas, facilitando además, el reparto de insumos, produciendo productos y alcanzando objetivos que pueden servir entre otras cosas para estudios de regionalización y análisis de riesgo. Cabe recordar que todos los programas sociales, como es el caso de la vigilancia de las enfermedades animales, requieren de la construcción de una MIR. Los indicadores que se proponen, son específicos, porque se encuentran perfectamente vinculados al problema, explícitos, porque están utilizando la incidencia y la proporción, y relevantes por sus implicaciones al comercio y la economía. Sin embargo, análisis posteriores a su utilización serán necesarios para su valoración. Es posible que a través de los años, al intensificarse y tecnificarse la producción en las zonas endémicas de EV, se registren brotes con cuantiosas pérdidas de producción sobre todo en explotaciones lecheras y de producción porcina, que además deben ser investigados para descartar que se trata de FA. Adicionalmente, nos enfrentamos a un fenómeno de cambio climático mundial que puede favorecer la expansión de los artrópodos vectores y el movimiento o amplitud de las zonas endémicas reconocidas en este estudio.
LITERATURA CITADA
1. SAGARPA. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Acuerdo mediante el cual se enlistan las enfermedades y plagas de los animales, exóticas y endémicas de notificación obligatoria en los Estados Unidos Mexicanos. Diario Oficial de la Federación. México. 2007. [ Links ]
2. Rodriguez LL. Emergence and re-emergence of vesicular stomatitis in the United States. Virus Res 2002;85(2):211-219. doi:10.1016/S0168-1702(02)00026-6. [ Links ]
3. Bridges VE, McCluskey BJ, Salman MD, Hurd HS, Dick J. Review of the 1995 vesicular stomatitis outbreak in the western United States. J Am Vet Med Assoc 1997;211:556-560. [ Links ]
4. OIE. Organización Mundial de Sanidad Animal. Código sanitario de los animales terrestres. Recomendaciones aplicables a las enfermedades de la lista de la OIE y a otras enfermedades importantes para el comercio internacional. 23ª ed. Francia. 2014. ISBN Vol. II 978-92-9044-941-6. http://www.oie.int/es/normas-internacionales/codigo-terrestre/acceso-en-linea/. [ Links ]
5. EFSA. European Food Safety Authority. Scientific opinion on swine vesicular disease and vesicular stomatitis. EFSA J 2012;10(4):2631. [ Links ]
6. Rodríguez LL. Vesicular stomatitis. USAHA Foreign animal diseases. Boca Publications Group, Inc. 7th ed. Boca Ratón, USA. 2008:423-429. ISBN 978-0-96595 83-4-9. [ Links ]
7. Adell AA, Pérez AM, Navarro LR, López GI, Paz RP, Rodríguez LL. Estimation of the time of seroconversion to the New Jersey serotype of vesicular stomatitis virus in sentinel cattle of dairy herds located at high and low elevations in southern Mexico. AJVR. 2010;71(12):1-6. [ Links ]
8. Hanson RP. The natural history of vesicular stomatitis. Bacteriol Rev 1952;16:179-204. [ Links ]
9. Brooksby JB. Differential diagnosis of vesicular stomatitis and foot and mouth disease, examination of virus samples from Mexico with especial reference to complement fixation. J Hyg 1949;47(4):384-389. [ Links ]
10. Mexico-United States Commission for the Prevention of Foot-and-Mouth Disease. Proc Inter Conf Vesicular Stomatitis. La Comission. México. 1984. [ Links ]
11. Arroyo M, Perez AM, Rodríguez LL. Characterization of the temporal and spatial distribution and reproductive ratio of vesicular stomatitis outbreaks in México in 2008. Am J Vet Res 2011;72(2):233-238. [ Links ]
12. Vázquez SL, Pauszek SJ, Zarate S, Basurto-Alcántara FJ, Verdugo-Rodríguez A, Pérez AM, et al. Phylogeographic characteristics of vesicular stomatitis New Jersey viruses circulating in Mexico from 2005 to 2011 and their relationship to epidemics in the United States. Virology 2014;449:17-24. [ Links ]
13. Perez AM, Pauszek SJ, Jimenez D, Kelley WN, Whedbee Z, Rodríguez LL. Spatial and phylogenetic analysis of vesicular stomatitis virus over-wintering in the United States. Prev Vet Med 2010;93:258-264. [ Links ]
14. Tesh RB, Chaniotis BN, Johnson KM. Vesicular stomatitis virus (Indiana serotype): transovarial transmission by phlebotomine sand-flies. Science 1972;175:1477-1479. [ Links ]
15. Shelokov A, Peralta PH. Vesicular stomatitis virus, Indiana type: an arbovirus infection of tropical sandflies and humans. Am J Epidem 1967;86(1):149-157. [ Links ]
16. Tesh RB, Chaniotis BN, Peralta PH, Johnson KM. Ecology of viruses isolated from Panamanian Phlebotomine sandflies. Am J trop Med Hyg 1974;23(2):258-269. [ Links ]
17. Mead DG, Gray EW, Noblet R, Murphy MD, Howerth EW, Stallknecht DE. Biological transmission of vesicular stomatitis virus (New Jersey serotype) by Simulium vittatum (Diptera: Simuliidae) to domestic swine (Sus scrofa). J Med Entomol 2004;41:78-82. [ Links ]
18. CFSPH. IICAB. The Center for Food Segurity & Public Health. Institute for International Cooperation in Animal Biologics. Vesicular stomatitis. Iowa State University. USA. 2008. http://www.cfsph.iastate.edu/Factsheets/pdfs/vesicular_stomatitis.pdf. Accessed May 24, 2013. [ Links ]
19. Sudia WD, Fields BN, Calisher CH. The isolation of vesicular stomatitis virus (Indiana strain) and other viruses from mosquitoes in New Mexico 1965. Amer J Epidem 1967;68:698-602. [ Links ]
20. Letchworth GJ, Rodríguez LL, Barrera DC. Vesicular stomatitis. The Vet J 1999;157:239-260. [ Links ]
21. OIE. Organismo Mundial de Sanidad Animal. Estomatitis Vesicular. Código Sanitario para los Animales Terrestres. Vol II. 22a ed. Francia. 2013:504-506. ISBN 978-92-9044915-7. www.oie.int/doc/ged/D12826.pdf. [ Links ]
22. Hanson RP, Rasmussen AF, Brandly CA, Brown JW. Human infection with the virus of vesicular stomatitis. J Lab Clin Med 1950;36:754-758. [ Links ]
23. Mason J, Gay GJ. Preliminary report. Vesicular stomatitis field study. Mexico United - States Commission for the Prevention of Food - and - Mouth Disease. Proc Intern Conf Vesicular Stomatitis. La Commission. México. 1984. [ Links ]
24. Smith PF, Howerth EW, Carter D, Gray EW, Noblet R, Smoliga G, et al. Domestic cattle as a non-conventional amplifying host of vesicular stomatitis New Jersey virus. Med Vet Entomol 2011;25(2): 184-191. [ Links ]
25. OIE. Organismo Mun di al de Sanidad Animal. AO20 Estomatitis vesicular. Ficha técnica. http://web.oie.int/esp/maladies/fiches/e_A020.htm. Accessed Jul 4, 2013. [ Links ]
26. SHCP. SFP. Secretaría de Hacienda y Crédito Público. Secretaría de la Función Pública. Consejo Nacional de Evaluación de la Política de Desarrollo Social. Guía para la construcción de la Matriz de Indicadores para Resultados. México. SHCP. 2011. http://www.shcp.gob.mx/EGRESOS/pef/sed/guíaMIR.pdf. Accessed Jun 1, 2013. [ Links ]
27. Jaramillo ACJ. Investigación epidemiológica. En: Tovar SMA editor. Epidemiología veterinaria. México: Manual Moderno; 2010:83-97. [ Links ]
28. INEGI. Instituto Nacional de Estadística y Geografía. Censo Agrícola, Ganadero y Forestal 2007. INEGI. 2013. http://www3.inegi.org.mx/sistemas/TabuladosBasicos/Default.aspx?c=17177&s=est. Accessed Jun 8, 2013. [ Links ]
29. Köppen W. Versuch einer Klassification der Klimate, vorzugsweise nach ihren Beziehungen zur Pflanzenwelt. Geographische Zeitschrift. 1900;6. Jahrg, 11. H.:593-611. [ Links ]
30. Kottek M, Grieser J, Beck C, Rudolf B, Rubel F. World Map of the Kóppen-Geiger climate classification updated. E Schweizerbart'sche Verlagsbuchhandlung. 2006;15(3):259-263. http://docserver.ingentaconnect.com/deliver/connect/schweiz/09412948/v15n3/s1.pdf?expires=1367511549&id=74037549&titleid=1292&accname=Guest+User&checksum=042B6CFFB72AC0EB8311120F00162288. Accessed May 02, 2013. [ Links ]
31. Servicio Meteorológico Nacional. Conagua. Normales Climatológicas. SMN. CNA. México. 2010. http://smn.cna.gob.mx/index.php?option=com_content&view=article&id=103&Itemid=80. Accessed Apr 29, 2013. [ Links ]
32. SEMARNAT. Secretaría del Medio Ambiente y Recursos Naturales. Consulta Temática. Precipitación mensual (milímetros). SEMARNAT. México. 2012. http://dgeiawf.semarnat.gob.mx:8080/ibi_apps/WFServlet?IBIF_ex=D3_AGUA01_10&IBIC_user=dgeia_mce&IBIC_pass=dgeia_mce. Consultado Apr 25, 2013. [ Links ]
33. Rainwater-Lovett K, Kelley W, Rodriguez LL. Molecular epidemiology of vesicular stomatitis New Jersey virus from the 2004-2005 US outbreak indicates a common origin with Mexicans strains. J Virol 2007;88(Pt7):2042-2051 [ Links ]
34. Rodriguez LL, Bunch T, Fraire M, Lleweliyn Z. Re-emergence of vesicular stomatitis in the Western United States is associated with distinct viral genetic lineages. Virology 2000;271:171-181. [ Links ]
35. Bilsel P, Rowe J, Fitch W, Nichol S. Phosphoprotein and nucleocapsid protein evolution of vesicular stomatitis virus New Jersey. J Virol 1990;64(6):2498-504. [ Links ]
36. Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. Molecular evolutionary genetics analysis using Maximum Likelihood Evolutionary Distance, and Maximum Parsimony Methods. Mol Biol Evol 2011;28(10):2731-2739. [ Links ]
37. Tamura K, Nei M, Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joning method. Proc Nat Acad Sci (USA). 2004;101:11030-11035. [ Links ]
38. Tamura K. Estimation of the number of nucleotide substitutions when there are strong transition-transversion and G + C content biases. Mol Biol Evol 1992;101:11030-11035. [ Links ]
39. Nei M, Kumar S. Molecular evolution and phylogenetic. New York, USA: Oxford University Press; 2000. [ Links ]
40. Smith PF, Howerth EW, Carter D, Gray EW, Noblet R, Berghaus R, et al. Host predilection and transmissibility of vesicular stomatitis New Jersey virus strains in domestic cattle (Bos taurus) and swine (Sus scrofa). BMC Vet Res 2012;8: 183. [ Links ]
41. Mason J. La epidemiología de la estomatitis vesicular. Una revisión de la literatura y propuestas para estudios de campo. Bltn Centro Panamericano Fiebre Aftosa. USA. 1978;29-30:13-33. [ Links ]
42. Consejo de la Unión Europea. Directiva 2009/156/CE del Consejo. Diario Oficial de la Unión Europea. 23.7.2010:1-24. [ Links ]
43. OIE. Organización Mundial de Sanidad Animal. Informe de la Reunión de la Comisión de las Normas Sanitarias de la OIE para los animales terrestres. Francia. 2012. www.oie.int/doc/ged/D12157.pdf. Accessed May 17, 2014. [ Links ]
44. Antúnez P. Estomatitis vesicular está en el debate de la OIE. Noticias El País. Uruguay. 2013. http://www.noticiasuy.com/Noticia/Economia/20130610/635063955432271310/Estomatitis_vesicular_esta_en_el_debate_de_la_OIE. Accessed May 8, 2014. [ Links ]














