Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.3 supl.1 Mérida sep. 2012
Revisiones
Resistencia a los acaricidas en Rhipicephalus (Boophilus) microplus: situación actual y mecanismos de resistencia
Acaricide resistance in Rhipicephalus (Boophilus) microplus: Current status and mechanisms of resistance
Roger Iván Rodríguez-Vivasa, Jane E.Hodgkinsonb, Alexander J.Treesb
a Departamento de Parasitología, Facultad de Medicina Veterinaria y Zootecnia. Universidad Autónoma de Yucatán. Km 15.5 carretera Mérida-Xmatkuil. C.P. 97100 Mérida, Yucatán, México. Tel.: +52(999)942-3200; Fax: +52(999)942-3205. rvivas@tunku.uady.mx. Correspondencia al primer autor.
b Department of Veterinary Pathology. Faculty of Veterinary Science. University of Liverpool. Liverpool, UK.
RESUMEN
Rhipicephalus (Boophilus) microplus es una plaga endémica de ganado en las regiones tropicales y subtropicales del mundo, causando grandes pérdidas económicas a los productores de ganado. Acaricidas químicos han desempeñado un papel fundamental en el control de R. (B). microplus; sin embargo, como consecuencia de su uso extensivo, esta especie ha desarrollado resistencia a todas las clases principales de acaricidas en todo el mundo. Resistencia a organofosforados, piretroides sintéticos y amitraz se ha observado principalmente en Australia y Latinoamérica. La resistencia acaricida en garrapatas se confiere principalmente por dos mecanismos fisiológicos importantes: insensibilidad del sitio y desintoxicación metabólica. Solo o en combinación, estos mecanismos confieren resistencia a todas las clases disponibles de acaricidas. En la presente revisión presentamos el Estado de R. (B. ) microplus resistente a acaricidas en todo el mundo (con énfasis en México), y los mecanismos más importantes implicados en este fenómeno.
Palabras Clave: Resistencia; Rhipicephalus (Boophilus) microplus; Acaricidas, Mecanismos de resistencia.
ABSTRACT
Rhipicephalus (Boophilus) microplus is an endemic cattle pest in tropical and subtropical regions of the world, causing major economic losses to cattle producers. Chemical acaricides have played a pivotal role in the control of R. (B.) microplus; however, as a consequence of extensive use of acaricides, this tick specie has developed resistance to all major classes of acaricides worldwide. Resistant to organophosphates, synthetic pyrethroids and amitraz has been reported mainly in Australia and Latinoamerica. The acaricide resistance in ticks is conferred primarily by two major physiological mechanisms: target site insensitivity and metabolic detoxification. Alone and or in combination these mechanisms confer resistance to all of the available classes of acaricides. In the present review we present the current status of R. (B.) microplus resistant to acaricides worldwide (with emphasis in Mexico) and the most important mechanisms involved in this phenomenon.
Key words: Resistance, Rhipicephalus (Boophilus) microplus, Acaricides, Mechanisms of resistance.
INTRODUCCIÓN
Las garrapatas son artrópodos hematófagos pertenecientes a la clase de los arácnidos. Las garrapatas son ectoparásitos obligados, alimentándose de sangre de los vertebrados, especialmente mamíferos y aves. Son relativamente grandes y de estadios longevos, de alimentación periódica, teniendo grandes ingestas de sangre. Las mordeduras de garrapata pueden dañar directamente a animales, causando irritación, inflamación o hipersensibilidad, y cuando se presenta en grandes números hay anemia y pérdidas en la producción. Las secreciones salivales de algunos ácaros pueden causar toxicosis y parálisis; Sin embargo, más importante aún, cuando se adhieren y alimentan son capaces de transmitir una serie de enfermedades virales, bacterianas, rickettsiales y protozoarios patógenos(1). Aproximadamente mil millones de cabezas de ganado, la mayoría de los cuales están en los trópicos, están expuestos a diversas especies de garrapatas o enfermedades que transmiten(2), causando pérdidas de producción. Rhipicephalus (Boophilus) microplus (Notar cambio del nombre genérico de Boophilus a Rhipicephalus, Murrell et al(3)Beati y Keirans(4)) es una plaga endémica de ganado en las regiones tropicales y subtropicales del mundo, causando grandes pérdidas económicas a los productores de ganado a través de efectos físicos directos en los animales parasitados e indirectamente a través de la transmisión de la enfermedad de agentes infecciosos como Babesia bovis, B. bigemina y Anaplasma marginale(561). Además de los costos de los productos químicos, mano de obra, equipamiento y pérdidas de producción asociadas con el tratamiento, es muy caro el costo de mantener las garrapatas bajo control(8). Se ha demostrado que cada garrapata adulta ingurgitada es capaz de reducir la ganancia de peso en 0.6 g en ganado bovino(9) de la cual el 65 % fue atribuido a la infestación por las garrapatas (estrés y anorexia de la irritación que causan) y 35 % por la pérdida de sangre(10). En Australia, las pérdidas causadas por R. (B). microplus se estima en 100 millones de dólares australianos por año, aunado a que la ganancia de masa corporal o rendimiento lechero también se sabe que disminuyen(11). En el último estudio en México el costo estimado de las pérdidas de producción, mortalidad, daños indirectos y por control de R. (B). microplus y las enfermedades que transmite fue estimado en 48 millones de dólares americanos por año(12).
Los métodos actuales para el control de la garrapata implican el uso de métodos químicos y no químicos, y la aplicación sistemática de dos o más métodos (manejo integrado de plagas). Aunque el control de las garrapatas se basa principalmente en el uso de productos químicos, el desarrollo de resistencia a estos compuestos es una grave amenaza para la sostenibilidad de este enfoque. El desarrollo de resistencia en artrópodos depende de la frecuencia de aplicación de los insecticidas, así como ciclos de vida de los insectos. La resistencia de R. (B. ) microplus a organofosforados (OPs), piretroides sintéticos (SPs) y amitraz se ha descrito alrededor del mundo, principalmente en Australia y Latinoamérica(13-16). Esta resistencia de las garrapatas a los acaricidas es conferida principalmente por dos importantes mecanismos fisiológicos: Insensibilidad del sitio y el incremento en la actividad de enzimas metabólicas, tales como esterasas, oxidasas mixtas y glutation-S-transferasas(13). El objetivo de este trabajo es presentar una revisión del estado actual de R. (B.) microplus resistente a los acaricidas en todo el mundo (con énfasis en México) y los mecanismos más importantes implicados en este fenómeno.
Estado actual de la resistencia a acaricidas Resistencia de la garrapata Rhipicephalus (Boophilus) a los acaricidas alrededor del mundo
Desde el primer informe del desarrollo de resistencia de R. (B. ) microplus a arsenicales en Australia en 1937(17), la evolución progresiva de la resistencia de las garrapatas a casi todos los acaricidas disponibles que afectan el ganado, ha frustrado los esfuerzos de los productores de ganado para manipularla y controlar la enfermedades que transmite y que afectan a sus animales. La historia de la resistencia de garrapatas a acaricidas corre en paralelo, con un retraso relativo en algunos años, con la introducción de nuevos productos acaricidas que representan diferentes clases de substancias químicas(18). En el Cuadro 1 se presentan registros seleccionados de la distribución geográfica y el año de la documentación del primer informe de resistencia acaricida en R. (B. ) microplus en todo el mundo.
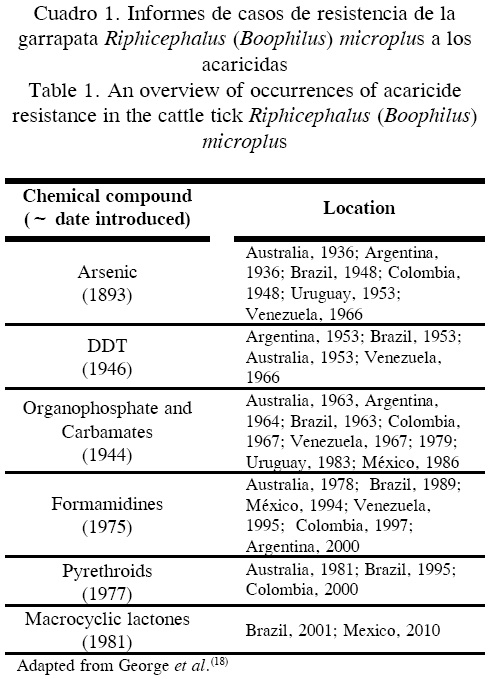
En los últimos años, la resistencia al amitraz ® también se ha encontrado en poblaciones de R. (B). microplus de Colombia(19), Brasil(20,21) y México(15,16). Rresistencia de R. (B. ) microplus a Lactonas Macrocíclicas (MLs) en Brasil contra doramectina y moxidectina fue descrita en las garrapatas de un predio. Recientemente, Pérez-Cogollo et al(22) informaron por primera vez de la resistencia a la Ivermectina en poblaciones de R. (N.) microplus de México. El uso generalizado de la MLs para control de parásitos (endo y ectoparásitos) y una opción limitada de acaricidas alternativos es motivo de preocupación de que la resistencia de MLs se convierta en un problema grave. Como en el caso de la resistencia emergente en R. (B.) microplus a los productos OPs, SPs, amitraz y MLs en Australia y América Latina no significa que algunos de los productos que contengan este tipo de ingredientes activos, no tengan más validez. Existen poblaciones de garrapatas que son susceptibles a una gran variedad de acaricidas y que pueden ser controladas, pero ahora es más importante que nunca utilizar las herramientas de diagnóstico existentes y mejoradas para determinar en qué sitio, esos productos son útiles todavía y emplear estrategias de control de garrapatas que minimicen la tasa de selección de resistencia(18).
Resistencia a los Acaricidas en Rhipicephalus (Boophilus) microplus en México
Los acaricidas organofosforados fueron profusamente utilizados en la Campaña Nacional de erradicación de la garrapata entre 1974 y 1984 en México(23). Los OPs empleados durante ese período incluyen coumaphos, chlorpyriphos, chlorfenvinphos, diazinón y Etión. El primer caso de resistencia a OPs se detectó en garrapatas R. (B). microplus de un rancho en el sur de México (Tuxpan, Veracruz) en 1983. La cepa de garrapatas establecida a partir de esa ubicación demostró 10 a 14 veces (esto es, necesita de 10 a 14 veces más concentración del acaricida en comparación con la cepa susceptible de referencia) la resistencia a coumaphos, chlorpyriphos y Etión(24). La resistencia a los OPs pronto se generalizó en las regiones central, oriental y meridional de México. A continuación, se introdujeron en México en 1986 los acaricidas Piretroides sintéticos, para aliviar los problemas de resistencia a OPs. La resistencia a SPs fue detectada por primera vez en 1993 y pronto se difundió de manera extensiva(25). Los niveles de resistencia a SPs fueron generalmente en la escala de 10 - a 350 veces, con la excepción de dos poblaciones de garrapatas en las se detectó un incremento de la resistencia en más de 1,000 veces(26). Como resultado de la intensa presión de selección por el uso de OPs y SPs. se encontró que R. (B). microplus ha desarrollado resistencia a ambas clases de acaricidas en por lo menos 15 Estados de la república mexicana(27).
Junto con los SPs también se introdujo en 1986, el amitraz, pero su uso fue inicialmente limitado debido a un costo mayor. El uso de amitraz se volvió más frecuente después de 1993, cuando empezaron los problemas de resistencia a SP y obstaculizaron los esfuerzos para controlar la garrapata en el país. El primer caso de resistencia de amitraz en México se informó en 2002(28). Más recientemente, Rodríguez Vivas et al(16) estudiaron 217 poblaciones de campo de R. (B). microplus y determinaron la prevalencia (medida por bioensayos) de los ranchos con resistencia a SPs, OPs y amitraz en el sur de México y encontraron que la resistencia a SP como la cipermetrina, deltametrina y flumethrin fue uno de los problemas más graves en el trópico mexicano (de 66 a 96% granjas mostraron resistencia a SPs). Además, Rodríguez Vivas et al.14) estudiaron otras 98 poblaciones de campo de R. (B). microplus en Yucatán, México y encontraron que el 63, 61 y 59 % de las poblaciones de garrapatas eran resistentes a flumethrina, deltametrina y cipermetrina, respectivamente. La resultante de R. (B). microplus resistente a las tres clases de acaricidas en México, pone de relieve la gravedad de la condición de resistencia y la importancia de tener una estrategia de manejo en México(16).
Mecanismos de resistencia a los acaricidas en Rhipicephalus (Boophilus) microplus
La resistencia se define como la capacidad de soportar dosis mayores de un tóxico, que normalmente serían letales para la mayoría de los individuos en una población típica de la misma especie(29). Los mecanismos de la resistencia en la mayoría de las garrapatas puede dividirse en dos grupos, insensibilidad del sitio de destino y metabólicas(30,31). Solos o en combinación, estos mecanismos confieren resistencia a todas las clases disponibles de acaricidas.
Insensibilidad del sitio de destino
Canal de sodio: Resistencia a SPs se observó en una cepa resistente al DDT de la mosca común, Musca domestica y se denominó resistencia de derribe o kdr(32). Análisis posteriores identificaron también un tipo de resistencia a SP-mayor llamado super-kdr(33). Vinculada genéticamente con el locus de gen del canal de sodio, las bases moleculares de la resistencia kdr han sido investigadas en muchos insectos incluyendo las garrapatas(34).
Mutaciones de resistencia Knock-down confieren una reducida sensibilidad neuronal a SPs y DDT en insectos(35). Kdr mutaciones están vinculadas a los para-genes homólogos, descubiertos en varias especies de insectos(36). Primero fue adoptado el término para referirse a la resistencia por parálisis en Drosophila melanogaster. Hay múltiples mutaciones puntuales en los para-genes homólogos asociados con la resistencia kdr y tipo-kdr a SPs en muchos insectos(37). Ambas mutaciones, las comunes y las únicas en los genes del canal de sodio, se consideran como las responsables de la resistencia de SP en diferentes plagas, sean especies de insectos o arácnidos. Hasta la fecha, se han confirmado diez mutaciones de canal de sodio responsables de la resistencia kdr y tipo-kdr en muchos artrópodos(38,39):
1. valina → metionina (V → M) en el gusano cogollero, Heliothis virescens.
2. metionina → isoleucina (M → I) en el piojo, Pediculus capitis.
3. leucina → fenilalanina (L → F) en el piojo Pediculus capitis.
4. leucina → fenilalanina/histidina/serina (L → F/H/S) en muchos insectos.
5. fenilalanina → isoleucina (F → I) en la garrapata R. (B). microplus.
6. leucina → isoleucina (L → I), en la garrapata R. (B). microplus
7. leucina → prolina (L → P) en el ácaro de las abejas, Varroa destructor.
8. treonina → isoleucina/cisteína/valina (T → I/C/V) en la polilla diamante Plutella xylostella; en piojos Pediculus capitis; el piojo de la flora occidental, Frankliniella occidentalis y la pulga del gato, Ctenocephalides felis.
9. metionina → treonina (M → T) en la mosca común, Musca domestica y la mosca del cuerno, Haematobia irritans.
10. cisteína → arginina (C → A) en la cucaracha alemana, Blatella germanica.
11. ácido aspártico → glicina, ácido glutámico → lisina, cisteína → arginina y prolina → leucina (E → K) en la cucaracha alemana Blatella germanica.
La Figura 1 muestra la localización de mutaciones kdr que han sido confirmadas por reducir la sensibilidad a SPs del canal de sodio en artrópodos. Información más completa sobre kdr mutaciones que confieren sensibilidad neuronal reducida a SPs se encuentra publicada(36,38,39). Dong(38) indicó que nuevas mutaciones kdr probablemente serán identificadas en otras importantes plagas de artrópodos agrícolas o de animales, según se sigan utilizando SPs como la principal estrategia de control de plagas.
He et al(42) investigaron el mecanismo molecular de la resistencia a los SPs en R. (B. ) microplus, obtuvieron y secuenciaron parcialmente el cDNA del gene para- homólogo del canal de sodio de cepas de garrapatas susceptibles y resistentes a SP. La secuencia parcial del gene del canal de sodio se compone de 3599 bp (ADNc) (número de acceso del GenBank: AF134216). Una mutación puntual que da como resultado el cambio de un aminoácido F → I, que fue identificada en un dominio III segmento 6 (IIIS6) altamente conservada del canal de sodio homóloga de garrapatas, que fueron altamente resistente a SPs (Figura 1, No. 5). Como la sustitución este aminoácido es causada por un cambio en un nucleótido de T → A(42) es conocido como un polimorfismo de nucleótido único (SNP). El nucleótido que es sustituido, es el primero del codón (TTC → ATC)(42). Los autores concluyeron que IIIS6 del canal de sodio de R. (B. ) microplus son sitios de destino de los SPs. Aunque existen otras mutaciones, esta mutación puntual parece ser la más importante asociada a la resistencia a SPs en México(43). En otro estudio llevado al cabo en el trópico mexicano Rosario Cruz et al (44) consideraron que la presencia de la sustitución F → I en el canal de sodio de R. (B. ) microplus se puede asociar a la resistencia a flumethrina, deltametrina y cipermetrina. Recientemente, Morgan et a (41) identificaron otra mutación en el vinculador de S4 II-5 dominio del canal de sodio de R. (B. ) microplus de Australia (L→I), que se asocia también con resistencia a SPs.
Acetilcolinesterasa (AChE): esta enzima tiene un papel clave en el sistema nervioso, para la terminación de impulsos nerviosos al catalizar la hidrólisis del neurotransmisor acetilcolina. Los OPs son inhibidores irreversibles de AChE, provocando la falla del sistema nervioso central y la muerte del insecto(45). Se ha informado que un importante mecanismo de resistencia a OPs en insectos(46,47,48), son las mutaciones puntuales en el gen estructural que codifica la AChE que dan por resultado la producción de una enzima alterada. En estos últimos años se ha evidenciado que algunos artrópodos poseen varios genes que codifican por la AChE o productos como-AChE(49). Estos genes -como parecen caber en grupos con cierta homología(50). El papel de estos genes múltiples aún no está claro; sin embargo, generalmente se ha asociado solo un gen con la resistencia de OPs en cada organismo, sugiriendo que es el sitio clave para la inhibición de OPs y los trastornos funcionales del sistema nervioso. El gen asociado con este papel neuronal en diferentes organismos puede clasificarse en grupos de variada homología, así que no es posible predecir con certeza, que AChE desempeña el papel funcional crítico en la función neuronal(50).
Baxter y Barker(51) aislaron el primer gene putativo de AChE (AChE1) en larvas R. (B). microplus de Australia. Este fue el primer informe del corte alternativo al extremo 5' de la región de codificación de proteínas de un gen de AChE y el primer informe de cualquier tipo de corte alternativo en un gen de AChE de R. (B). microplus. Otros dos supuestos genes putativos de AChE (AChE2 y AChE3) de R. (B.) microplus se han descubierto desde entonces(47,52). Análisis de la secuencia de estos tres genes putativos de AChE de R. (B). microplus no mostraron ningún homología importante, sugiriendo que sólo estaban lejanamente relacionados entre sí(47). Lamentablemente, no se ha encontrado ninguna mutación que podría haber explicado la base genética del mecanismo de resistencia del sitio de destino(53).
Ácido ⌈-aminobutírico (GABA): en artrópodos, GABA es un neurotransmisor inhibitorio en uniones neuromusculares y sinapsis del sistema nervioso central. Uno de los principales agentes actuales en el control de la garrapata es fipronil, un antagonista de los canales de cloruro GABA-gated(54). Ya se ha informado de la presencia de mutaciones del gen GABA de Drosophila melanogaster(46), sin embargo al presente, ningún gen GABA ha sido aislado de R. (B. ) microplus.
Receptor de Octopamina: existe una fuerte evidencia de que el sitio de destino de las formamidinas (esto es, amitraz) es el receptor octopamina. El receptor putativo octopamina fue secuenciado de Australia a partir de dos cepas R. (B). microplus: una cepa amitraz susceptible y -resistente. Ambas secuencias fueron idénticas(51). Dos explicaciones posibles para este hallazgo son que puede haber más de un gen del receptor de octopamina en R. (B). microplus, o que la resistencia al amitraz puede ser debido a un proceso metabólico(51,55). Recientemente, Chen et al(31) fueron los primeros en describir las mutaciones de un gen putativo del receptor octopamina en R. (B). microplus resistente al amitraz. El descubrimiento de estas mutaciones sólo en garrapatas resistentes al amitraz proporciona la primera evidencia de la posibilidad de un sitio de destino del plaguicida alterado, como un mecanismo de resistencia al amitraz en R. (B. ) microplus.
Mecanismo de resistencia metabólica
Carboxylesterasas: estructuralmente, estas enzimas pertenecen a una superfamilia de proteínas con dobleces α/β, que consisten en hélices α y pliegues β alternados conectadas por rizos de una longitud variable(56). Estas enzimas hidrolizan las sustancias químicas que contienen grupos funcionales, tales como ácido carboxílico, éster, amida y tioéster(57). Estudios sobre carboxylesterasas en gran medida se centran en la desintoxicación de plaguicidas y el metabolismo de fármacos y otros xenobióticos(57). Carboxylesterasas son estructuralmente similares a la acetilcolinesterasa, un sitio de destino bien establecido de los OPs y durante la exposición aguda a insecticidas a base de carbamato(58). Por lo tanto, se considera que el enlace de carboxylesterasas a estos insecticidas es una vía de desintoxicación(59).
Riddles et al(60) describieron la purificación parcial de una enzima con actividad tipo-carboxylesterasa en R. (B). microplus, que podría hidrolizar la permetrina, proporcionando las primeras evidencias que enzimas metabólicas también pueden participar en la resistencia a los piretroides. Hay muchos informes de actividad incrementada de esterasa en artrópodos, incluyendo mosquitos(46). Desintoxicación metabólica incrementada mediada por carboxylesterasa se ha descrito como indicativo de resistencia en OP y SP en garrapatas R. (B). microplus(34M). Jamroz et al(34) identifican una cepa de R. (B). microplus (Cz) resistente a piretroides, que mostraba tener alta actividad hidrolítica de esterasa (CzEST9), en comparación con una cepa susceptible de R. (B). microplus. La misma alta actividad hidrolítica se encontró tras la purificación de CzEST9 y por lo tanto, se postuló que CzEST9 estaba asociada con la resistencia de la CEPA Cz a permetrina(62). Una mutación puntual de un gen esterasa fue identificado en una cepa mexicana de R. (B). microplus resistente a piretroides(63); investigaciones subsecuentes encontraron que la aparición de resistencia no estaba asociada con la presencia de la mutación(64). Recientemente, otros investigadores(65) trabajando con cepas brasileñas de R. (B). microplus resistentes a OP y SP, encontraron que la desintoxicación metabólica causada por dos acetilcolinesterasas, contribuyó al desarrollo de la resistencia en estas poblaciones de garrapatas. Sin embargo, en un trabajo(44) con nueve poblaciones de campo de R. (B). microplus en Yucatán, México, no encontraron alguna correlación positiva entre la actividad de la esterasa y supervivencia de larvas expuestas a cipermetrina, deltametrina y flumethrina.
Recientemente, seis cepas de R. (B. ). microplus recolectadas al norte de México resultaron ser resistentes a fipronil. Selección con fipronil por tres generaciones indujo resistencia a un rango de entre 8.3 y 9.4 en los estimadores de LC50 y LC99, respectivamente(66). Los autores concluyeron que la resistencia a fipronil parece ser debido en parte a la actividad de la esterasa elevada (CZEST9), que fue preseleccionado por el uso generalizado de permetrina en la década de 1980 en México. Sin embargo, se deben realizar más trabajos para conocer los verdaderos mecanismos de resistencia del fipronil.
Monooxygenasas P450: enzimas P450 (oxidasas mixtas, citocromo P450 monooxigenasa) son una familia compleja de enzimas que contiene heme, que se encuentran en la mayoría de los organismos. Las enzimas P450 enlazan oxígeno molecular y reciben electrones del NADPH (fosfato de nicotinamida adenina dinucleotide) para introducir un átomo de oxígeno dentro del sustrato. En los insectos, las diversas funciones de las enzimas P450 van desde la síntesis y degradación de los ecdisteroides y las hormonas juveniles al metabolismo de los xenobióticos(67). Enzimas P450 desarrollan papeles importantes en la adaptación de los insectos a los compuestos tóxicos de las plantas huéspedes, y participan en el metabolismo de todos los insecticidas utilizados comúnmente. Bioactivación de OPs por P450 monoxygenasa, es un requisito para desarrollar el efecto altamente tóxico de OP sobre la acetilcolinesterasa, su sitio de destino(67,68). Sin embargo, en general, las enzimas P450 intervienen en la desintoxicación metabólica de los insecticidas, especialmente de SPs(69). La diversidad es conferida por la existencia de múltiples isoformas de P450, diferentes patrones de expresión y un espectro amplio de sustratos(70). Hay muchos informes demostrando elevada actividad de P450 en mosquitos resistentes a los insectos, frecuentemente de manera conjunta con la alteración de otras enzimas(46).
Li et al(71) llevaron al cabo estudios de sinergia con coumaphos y butóxido de piperonilo (PBO), un inhibidor de la oxidasa mixta citocromo P450; para estudiar mecanismos de resistencia a OPs en las cepas Muñoz (sensible) y San Román (resistente) de R. (B). microplus. Los estudios mostraron que la toxicidad de coumaphos en presencia de PBO se redujo 2-veces en la cepa Muñoz susceptible a OP, pero se incrementó 3-veces en la cepa San Romano resistente a OP. En estudios paralelos con el diazinón OPs, PBO nuevamente se redujo significativamente la toxicidad de OPs en la cepa Muñoz susceptible. Sin embargo, en la cepa San Román resistente a OPs, la toxicidad de diazinón no fue afectada por PBO, un contraste con los resultados del coumaphos. Li et al(71) lanzaron la hipótesis de que la actividad del citocromo P450 responsable para bioactivación del coumaphos o el diazinón es perjudicada por el PBO en todas las cepas, y por consecuencia, en la disminución de la toxicidad de coumaphos o diazinón cuando se aplican junto con PBO. Recientemente, Miller et al(22) encontraron una cepa mexicana de de R. (B). microplus altamente resistente al diazinón pero no muy resistente a coumaphos. Cuando se expuso a coumaphos y PBO o triphenylphosphate (otro inhibidor del citocromo P450), la toxicidad se redujo entre 3.5- y 6.3-veces, respectivamente; sugiriendo que mono oxigenasas o esterases participaron en la resistencia a coumaphos. Otro estudio reciente(72) demostró la vinculación entre una mayor actividad de monooxigenasa y resistencia al acaricida piretroide en R. (B). microplus de México.
Glutatión S-transferasa (GSTs): GSTs son un grupo de enzimas que catalizan la conjugación entre glutatión (GSH) y otras moléculas. Estas enzimas tienen un papel central en la desintoxicación de compuestos xenobióticos y endógenos. En poblaciones con una larga historia de exposición a productos químicos, se asocia una alta actividad de GST con resistencia a los insecticidas(73). Resistencia a los OCs y OPs está asociada específicamente con una mayor actividad de GST(74,75). Estos hechos sugieren que la conjugación del insecticida al glutatión, que es catalizada por GST, puede ser un mecanismo de desintoxicación en artrópodos(76). He et al.(77) informaron de la purificación, caracterización y clonación molecular de GST de una larva R. (B. ) microplus. Bioensayos sinergistas con varias cepas resistentes a amitraz de México y una cepa brasileña de R. (B). microplus indican alguna intervención de esterasa y glutatión S-transferasa(79).
CONCLUSIONES
Los métodos actuales para el control de garrapatas, implican el uso de métodos químicos y no químicos. Aunque el control de garrapatas está basado fuertemente en el uso de productos químicos, el desarrollo de R. (B. ) microplus resistente a estos compuestos es una grave amenaza en todo el mundo. El desarrollo de resistencia a los acaricidas en una población de garrapatas depende de la frecuencia de aparición de individuos resistentes en la población, y la intensidad de la presión de selección química. La aparición de R. (B. ) microplus resistente a OPs, SPs y el amitraz ha sido descrita alrededor del mundo, principalmente en Australia y Latinoamérica. La resistencia a las MLs fue descrita en Brasil; sin embargo, el uso generalizado de las MLs para control de parásitos puede conducir a un problema importante en el futuro. La resistencia a los acaricidas en garrapatas está soportada principalmente por dos mecanismos fisiológicos importantes: Insensibilidad en el sitio de destino (mutaciones en el canal de sodio, acetilcolinesterasa, ácido ![]() aminobutirico y genes de receptores de octopamina) y metabólicos (alteraciones en el nivel o actividad de proteínas de desintoxicación). Estos mecanismos, solos o en combinación, confieren la resistencia a todas las clases conocidas de acaricidas disponibles.
aminobutirico y genes de receptores de octopamina) y metabólicos (alteraciones en el nivel o actividad de proteínas de desintoxicación). Estos mecanismos, solos o en combinación, confieren la resistencia a todas las clases conocidas de acaricidas disponibles.
AGRADECIMIENTOS
A la Asociación Mexicana de Parasitólogos Veterinarios A.C. por su gentil invitación para presentar este trabajo.
LITERATURA CITADA
1. Taylor MA, Coop RL, Wall RL. Vet Parasitol. Thrid edition. Oxford, U.K: Blankwell; 2007. [ Links ]
2. Pegram RG, Tatchell RJ, de Castro J. Tick control, new concepts. World Anim Rev 1993;74/75:2-11. [ Links ]
3. Murrell AN, Campbell JH, Barker SC. Phylogenetic analysis of the rhipicephalinai ticks indicates that the genus Rhipicephalus is paraphyletic. Mol Phylogenetics Evolution 2000;16:1-7. [ Links ]
4. Beati L, Keirans JE. Analysis of the systematic relationships among ticks of the genera Rhipicephalus and Boophilus (Acari: Ixodidae) based on mitochondrial 12S ribosomal DNA gene sequences and morphological characters. J Parasitol 2001; 87:32-48. [ Links ]
5. Solorio-Rivera JL, Rodríguez-Vivas RI, Pérez-Gutierrez E, Wagner G. Management factors associated with Babesia bovis seroprevalence in cattle from eastern Yucatán, Mexico. Prev Vet Med 1999;40:261-269. [ Links ]
6. Rodríguez-Vivas RI, Quiñones AF, Fragoso SH. Epidemiología y control de la garrapata Boophilus en México. En: Enfermedades de importancia económica en producción animal. Rodríguez-Vivas, R.I. editor. México D.F: McGraw- Hill-UADY; 2005: 571-592. [ Links ]
7. Rodríguez-Vivas RI, Mata MY, Pérez GE, Wagner G. The effect of management factors on the seroprevalence of Anaplasma marginale in Bos indicus cattle in the Mexican tropics. Trop Anim Hlth Prod 2004;36:135-143. [ Links ]
8. Nari A, Hansen HJ, Hedi C, Martins JR. Control de la resistencia a los antiparasitarios a la luz de los conocimientos actuales. Congreso Mundial de Buiatría. Montevideo, Uruguay. 2000:1-19. [ Links ]
9. Sutherst RW, Maywald GF, Kerr JD, Stegeman DA. The effect of cattle tick (Boophilus microplus) on the growth of Bos indicus x Bos taurus steers. Aust J Agric Res 183;34:317-327. [ Links ]
10. Seebeck RM, Springell PH, O'Kelly JC. Alterations in host metabolism by the specific and anorectic effects of the cattle tick (Boophilus microplus), I Food intake and bodyweight growth. Aust J Biol Sci 1971;24:373-380. [ Links ]
11. Norval RAI, Sutherst RW, Jorgenson O, Gibson JD, Kerr JD. The effect of the brown ear-tick Rhipicephalus appendiculatus on the growth of Sanga and European breed protein tipE and toxin pharmacology. J Gen Physiol 1988;110:119-133. [ Links ]
12. Vega M. Currrent importance of cattle haemoparasite diseases. In: Seminario Internacional de Parasitología Animal. Garrapatas y enfermedades que transmiten. Morelos, México. 1991:144-150. [ Links ]
13. Guerrero FD, Pruett JH. Status and future prospects for molecular diagnosis of acaricide resistance in Boophilus microplus. Trends Entomol 2003;3:97-103. [ Links ]
14. Rodríguez-Vivas RI, Alonso-Díaz MA, Rodríguez-Arévalo F, Fragoso-Sánchez H, Santamaria VM, Rosario-Cruz R. Prevalence and potential risk factors for organophosphate and pyrethroid resistance in Boophilus microplus ticks on cattle ranches from the State of Yucatan, Mexico. Vet Parasitol 2006;136:335-342. [ Links ]
15. Rodríguez-Vivas RI, Rodríguez-Arévalo F, Alonso-Díaz MA, Fragoso-Sánchez H, Santamaria VM, Rosario-Cruz R. Amitraz resistance in Boophilus microplus ticks in cattle farms from the state of Yucatan, Mexico, prevalence and potential risk factors. Prev Vet Med 2006;75:280-286. [ Links ]
16. Rodríguez-Vivas RI, Rivas AL, Chowell G, Fragoso SH, Rosario CR, García Z, Smith SD, Williams JJ, Schwager SJ. Spatial distribution of acaricide profiles (Boophilus microplus strains susceptible or resistant to acaricides) in south eastern Mexico. Vet Parasitol 2007;146:158-169. [ Links ]
17. Newton LG. Acaricide resistance and cattle tick control. Aust Vet J 1967;43:389-394. [ Links ]
18. George JE, Pound JM, Davey RB. Chemical control of ticks on cattle and the resistance of these parasites to acaricides. Parasitol 2004;129:S353-S366. [ Links ]
19. Benavides E, Rodríguez JL, Romero A. Isolation and partial characterization of the Montecinos strain of Boophilus microplus (Canestrini, 1877) multi-resistant to different acaricides. Ann NY Acad Sci 2000;916:668-671. [ Links ]
20. Furlong J. Diagnóstico de la susceptibilidad de la garrapata del ganado Boophilus microplus a los acaricidas en el estado de Minas Gerais, Brasil. Seminario Internacional de Parasitología Animal. Puerto Vallarta, Jalisco, México. 1999:41-46. [ Links ]
21. Miller RJ, Davey RB, George JE. Modification of the food and agriculture organization larval packet test to measure amitraz-susceptibility against Ixodidae. J Med Entomol 2002;39:645-651. [ Links ] Mex Cienc Pecu 2012;3(Supl 1):9-24
22. Perez-Cogollo LC, Rodríguez-Vivas RI, Ramirez-Cruz GT, Miller RJ. First report of the cattle tick Rhipicephalus microplus resistant to ivermectin in Mexico. Vet Parasitol 2010;168:165-169. [ Links ]
23. Trapapa BJ. The campaign against Boophilus microplus in Mexico, benefit, problems and prospects. In: Garcia-Vasquez, Z. editor. Animal production and health. Food and Agricultural Organization, Mexico City, Mexico. 1989:50-75. [ Links ]
24. Aguirre EJ, Santamaría VM. Purificación y caracterización toxicológica de garrapatas B. microplus resistentes a ixodicidas organofosforados y organoclorados. Reunión Anual de la Asociación Mexicana de Parasitología Veterinaria A.C. Ciudad Victoria, Tamaulipas, México. 1986. [ Links ]
25. Fragoso H, Soberanes N, Ortiz M, Santamaría M, Ortiz A. Epidemiología de la resistencia a ixodicidas piretroides en garrapatas Boophilus microplus en la República Mexicana. En: Rodríguez, S., Fragoso, H. editores. Seminario Internacional de Parasitología Animal-Resistencia y Control en Garrapatas y Moscas de Importancia Veterinaria. Acapulco, Guerrero, México. 1995:45-57. [ Links ]
26. Miller RJ, Davey RB, George JE. Characterization of pyrethroid resistance and susceptibility to coumaphos in Mexican Boophilus microplus (Acari: Ixodidae). J Med Entomol 1999;36:633-538. [ Links ]
27. Santamaria VM, Soberanes CN, Ortiz NA, Fragoso SH, Osorio MJ, Martínez IF, Franco BL, Delabra VG, Quezada DR, Giles HI, Ortiz EM. Análisis de la situación actual mediante el monitoreo de susceptibilidad a ixodicidas en Boophilus microplus de 1993 a 1999 y medidas preventivas para retardar la resistencia al amitraz en México. Seminario Internacional de Parasitología Animal, Control de la Resistencia en Garrapatas y Moscas de Importancia Veterinaria y Enfermedades que transmiten. Puerto Vallarta, Jalisco, México. 1999:103-117. [ Links ]
28. Soberanes NC, Santamaría MV, Fragoso HS, García VZ. First case reported of amitraz resistance in the cattle tick Boophilus microplus in Mexico. Téc Pecu Méx 2002;40:81- 92. [ Links ]
29. WHO (World Health Organization) Expert Committee on Insecticides. Seventh report, Geneva, World Health Organization. Technical Report Series No. 125. 1957. [ Links ]
30. Nolan J. Current developments in resistance to amidine and pyrethroid tickicides in Australia. In: Whitehead GB, Gibson JD editors. Tick biology and control. University Rhodes-Grahamstown, South Africa. 1985:109-114. [ Links ]
31. Chen AC, He H, Davey RB. Mutations in a putative octopamine receptor gene in amitraz-resistant cattle ticks. Vet Parasitol 2007;148:379-383. [ Links ]
32. Milani R. Compertamento medxeliano della resistenza alla azione abbattante del DDT, Correlazione abbattimento e mortalia in Musca domestica L. Rivista e Parasitologia 1954;15:513-542. [ Links ]
33. Sawicki RM. Unusual response of DDT-resistant houseflies to carbinol analogues of DDT. Nature 1978;275:443-444. [ Links ]
34. Jamroz RC, Guerrero FD, Pruett JH, Oehler DD, Miller RJ. Molecular and biochemical survey of acaricide resistance mechanisms in larvae from Mexican strain of the southern cattle tick, Boophilus microplus. J Insect Physiol 2000;46:685-695. [ Links ]
35. Soderlund DM, Bloomquist JR. Molecular mechanisms of insecticide resistance. In: Roush RT, Tabashnik BE (eds) Pesticide resistance in arthropods. Chapman and Hall, New York. 1990:58-96. [ Links ]
36. Soderlund DM, Knipple DC. The molecular biology of knockdown resistance to pyretrhoid insecticide. Insect Biochem Mol Biol 2003;33:563-577. [ Links ]
37. Soderlund D. Sodium channels. In: Gilbert LI, Iatrou K., Gill SS. editors. Comprehensive insect science. Pharmacology, vol 5. Amsterdam: Elsevier B.V; 2005:124. [ Links ]
38. Dong K. Insect sodium channels and insecticide resistance. Invertebrate Neurosci 2007;7:17-30. [ Links ]
39. Soderlund DM. Pyrethroids, knockdown resistance and sodium channels. Pest Manage Sci 2008;64:610-616. [ Links ]
40. Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. Molecular cell biology. Fifht edition. Freeman and Company. New York. 2004:277-281. [ Links ]
41. Morgan JAT, Corley SW, Jackson LA, Lew-Tabor AL, Moolhuijzen PM, Jonsson NN. Identification of a point mutation in the para-sodium channel gene of the cattle tick Rhipicephalus (Boophilus) microplus associated with resistance to synthetic pyrethroid acaricides. Int J Parasitol 2009. [In press] [ Links ].
42. He H, Chen AC, Davey RB, Ivie GW, George JE. Identification of a point mutation in the para-type sodium channel gene from a pyrethroid-resistant cattle tick. Biochem Biophys Res Commun 1999; 261:558-561. [ Links ]
43. Foil LD, Coleman P, Eisler M, Fragoso-Sánchez H, Garcia-Vazquez Z, Guerrero FD, Jonsson NN, Langstaff IG, Li AY, Machila N, Miller RJ, Morton J, Pruett JH, Torr S. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet Parasitol 2004;125:163-181. [ Links ]
44. Rosario-Cruz R, Guerrero FD, Miller RJ, Rodríguez-Vivas RI, Dominguez-Garcia DI, Cornel AJ, Hernández-Ortiz R, George EJ. Roles played by esterase activity and by a sodium channel mutation involved in pyrethroid resistance in populations of Boophilus microplus (Canestrini) (Acari: Ixodidae) collected from Yucatan, Mexico. J Med Entomol 2005;42(6):1020-1025. [ Links ]
45. Fournier D, Mutero A. Modification of acetylcholinesterase as a mechanism of resistance to insecticides. Comparative biochemistry and physiology: Toxicol Pharmacol 1994;108:19-31. [ Links ]
46. Hemingway J, Hawkes NJ, McCarroll L, Ranson H. The molecular basis of insecticide resistance in mosquitoes. Insect Biochem Mol Biol 2004;34:653-666. [ Links ]
47. Temeyer KB, Davey RB, Chen AC. Identification of a third Boophilus microplus (Acari: Ixodidae) cDNA presumptively encoding an acetylcholinesterase. J Med Entomol 2004; 41:259-268. [ Links ]
48. Temeyer KB, Li AY, Lohmeyer KH, Chen AC, Olafson PU, Sanson DW, Foil LD. Acetylcholinesterase mutation in diazinon-resistant Haematobia irritans (L.) (Diptera: Muscidae). Vet Parasitol 2007;154:300-310. [ Links ]
49. Ranson H, Claudianos C, Ortelli F, Abgrall C, Hemingway J, Sharakhova MV, Unger MF, Collins FH, Feyereisen R. Evolution of supergene families associated with insecticide resistance. Science 2002;298:179-181. [ Links ]
50. Weill M, Fort P, Berthomieu A, Dubois MP, Pasteur N, Raymond M. A novel acetylcholinesterase gene in mosquitoes codes for the insecticide target and is non-homologous to the ace gene in Drosophila. Proc Royal Soc Biol Sci 2002:2007-2016. [ Links ]
51. Baxter GD, Barker S. Isolation of a cDNA for an octopamine-like, G-protein coupled receptor from the cattle tick, Boophilus microplus. Insect Biochem Mol Biol 1999;29:461-467. [ Links ]
52. Hernandez R, He H, Chen AC, Waghela SD, Ivie GH, George JE, Wagner G. Cloning and sequencing of a putative acetylcholinesterase cDNA from Boophilus microplus (Acari: Ixodidae). J Med Entomol 1999; 36:764770. [ Links ]
53. Baxter GD, Barker SC. Acethylcholinesterase cDNA of the cattle tick Boophilus role in organophosphates resistance. Insect Biochem Mol Biol 1998; 28:581-589. [ Links ]
54. Taylor MA. Recent developments in ectoparasiticides. Vet J 2001;161:253-268. [ Links ]
55. Jonsson NN, Hope M. Progress in the epidemiology and diagnosis of amitraz resistance in the cattle tick Boophilus microplus. Vet Parasitol 2007;146:193-198. [ Links ]
56. Oakeshott C, Claudianos C, Russell RJ, Robin GC. Carboxyl/cholinesterases, a case study of the evolution of a successful multigene family. BioEssays 1999; 21:1031. [ Links ]
57. Satoh T, Hosokawa M. The mammalian carboxylesterases, from molecules to functions. Ann Rev Pharmacol Toxicol 1998;38:257-288. [ Links ]
58. Sussman JL, Harel M, Frolow F, Oefner C, Goldman A, Toker L, Silman I. Atomic structure of acetylcholinesterase from Torpedo California, a prototypic acetylcholine-binding protein. Science 1991;253:872-879. [ Links ]
59. Xie M, Yang D, Liu L, Xue B, Yan B. Human and rodent carboxylesterases, immunorelatedness, overlapping substrate specificity, differential sensitivity to serine enzyme inhibitors, and tumor-related expression. Drug Metabolism and Disposition 2002;30(5):541-547. [ Links ]
60. Riddles PW, Davey PA, Nolan J. Carboxylesterases from Boophilus microplus hydrolyze trans-permethrin. Pesticide Biochem Physiol 1983;20:133-140. [ Links ]
61. Rosario-Cruz R, Miranda-Miranda E, Garcia-Vazquez Z, Ortiz-Estrada M. Detection of esterase activity in susceptible and organophosphate resistant strains of the cattle tick Boophilus microplus (Acari: Ixodidae). Bull Entomol Res 1997;87:197-202. [ Links ]
62. Pruett JH, Guerrero FD, Hernandez R. Isolation and identification of an esterase from a Mexican strain of Boophilus microplus (Acari: Ixodidae). J Econ Entomol 2002; 95:1001-1007. [ Links ]
63. Hernandez R, He H, Chen AC, Waghela SD, Ivie GW, George JE, Wagner GG. Identification of a point mutation in an esterase gene in different populations of the southern cattle tick, Boophilus microplus. Insect Biochem Mol Biol 2000;30:969-977. [ Links ]
64. Guerrero FD, Li AY, Hernandez R. Molecular diagnosis of pyrethroid resistance in Mexican strains of Boophilus microplus (Acari: Ixodidae). J Med Entomol 2002; 39:770776. [ Links ]
65. Baffi MA, de Souza GRL, de Sousa CS, Ceron CR, Bonetti AM. Esterase enzymes involved in pyrethroid and organophosphate resistance in a Brazilian population of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Mol Biochem Parasitol 2008;160:70-73. [ Links ]
66. Miller RJ, Li AY, Tijerina M, Davey RB, George JE. Differential response to diazinon and coumaphos in a strain of Boophilus microplus (Acari: Ixodidae) collected in Mexico. J Med Entomol 2008;45(5):905-911. [ Links ]
67. Feyereisen R. Insect P450 enzymes. Ann Rev Entomol 1999; 44:507-533. [ Links ]
68. Sams C, Mason HJ, Rawbone R. Evidence of the activation of organophosphate pesticides by cytochromes P450 3A4 and 2D6 in humans liver microsomes. Toxicological Letter 2000;116: 217-221. [ Links ]
69. He H, Chen AC, Davey RB, Ivie GW. Molecular cloning and nucleotide sequence of a new P450 gene, CYP319A1, from the cattle tick, Boophilus microplus. Insect Biochem Mol Biol 2002;32:303-309. [ Links ]
70. Scott JG, Wen Z. Cytochromes P450 of insects: The tip of iceberg. Pest Manage Sci 2001;57:958-967. [ Links ]
71. Li AY, Chen AC, Miller RK, Davey RB, George JE. Acaricide resistance and synergism between permethrin and amitraz against susceptible and resistant strains of Boophilus microplus (Acari: Ixodidae). Pest Manage Sci 2003;63:882- 889. [ Links ]
72. Cossio-Bayugar R, Miranda-Miranda E, Ortiz-Najera A, Neri-Orantes S. Boophilus microplus pyrethroid resistance associated to increased levels of monooxygenase enzymatic activity in field isolated Mexican ticks. J. Biol Sci 2008;8(2):404-409. [ Links ]
73. Ketterman AJ, Prommeenate P, Boonchauy C, Chanama U, Leetachewa S, Promtet N, Prapanthadara L. Single amino acid changes outside the active site significantly affect activity of glutathione S-transferases. Insect Biochem Mol Biol 2001;31:65-74. [ Links ]
74. Vontas JG, Small GJ, Hemingway J. Glutathione S-transferase as antioxidant defence agents confer pyrethroid resistance in Nilaparvata lugens. Biochem J 2001; 357:6572. [ Links ]
75. Vontas JG, Small GJ, Nikou DC, Ranson H, Hemingway J. Purification, molecular cloning and heterologous expression of a glutathione S-transferase involved in insecticide resistance from the rice brown planthopper, Nilaparvata lugens. Biochem J 2002;362:329-337. [ Links ]
76. Wei SH, Clark AG, Syvanen M. Identification and cloning of a key insecticide-metabolizing glutathione S-transferase (MdGST-6A) from a hyper insecticide-resistant strain of the housefly Musca domestica. Insect Biochem Mol Biol 2001;31:1145-1153. [ Links ]
77. He H, Chen AC, Davey RB, Ivie GW, George JE. Characterization and molecular cloning of a glutathione S-transferase gene from the tick, Boophilus microplus (Acari: Ixodidae). Insect Biochem Mol Biol 1999;29:737-743. [ Links ]
78. Li AY, Davey RB, Miller RJ, George JE. Detection and characterization of amitraz resistance in the southern cattle tick Boophilus micoplus (Acari: Ixodidae). J Med Entomol 2004;41(2):193-200 [ Links ]














