Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias pecuarias
On-line version ISSN 2448-6698Print version ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.3 n.2 Mérida Apr./Jun. 2012
Artículos
Caracterización molecular y biológica del virus de la Rabia que circula en zorrillos de México enfocado a la variante del gen de la fosfoproteína (P)
Molecular and biological properties of rabies viruses circulating in Mexican skunks: focus on P gene variation
Elizabeth Loza–Rubioa, Susan A. Nadin–Davisb, Elizabeth Morales Salinasc
a Centro Nacional de Investigaciones Disciplinarias en Microbiología Animal, INIFAP. Carretera México Toluca Km. 15.5, Colonia Palo Alto. CP 05110. México. eli_rubio33@hotmail.com. Correspondencia al primer autor.
b Rabies Center of Expertise, Ottawa Laboratories. Fallowfield, Canadian Food Inspection Agency (CFIA). Ottawa, Ont. Canadá K2H 8P9.
c Departamento de Patología. FMVZ–UNAM.
Recibido el 4 de mayo de 2011.
Aceptado el 28 de junio de 2011.
Resumen
El objetivo de este estudio fue la caracterización molecular y biológica del virus de la rabia en zorrillos de México, comparando una porción de la secuencia viral del gen P, con regiones correspondientes de variantes de virus rábico adaptadas en zorrillos y pertenecientes al genotipo 1 (virus de la rabia "clásica"), que circulan en América. Como parte de la caracterización biológica se incluyó el periodo de incubación y las lesiones histopatológicas después de la inoculación del virus por vía intracerebral en ratones. De acuerdo a los resultados de estudios filogenéticos, las cepas de zorrillo mexicano (variante antigénica (AV8 y AV10) son muy distintas en cuanto a su evolución. El aislado AV10 de Baja California Sur está muy relacionado con los virus que circulan en zorrillos de California; mientras que el aislado AV8 de San Luis Potosí tuvo mayor relación con la cepa del zorrillo del Centro/Sur que circula en los estados del sur, como Texas. Estas variantes se reflejaron en algunas propiedades biológicas de ambas cepas en ratones.
Palabras clave: Rabia zorrillos, Epidemiología molecular, Periodo de incubación, Gene P.
Abstract
The objective of this work was to characterize molecularly rabies viruses from Mexican skunks, by comparison of a portion of the viral P gene sequence with corresponding regions from other skunk–adapted rabies virus variants and with other genotype 1 rabies viruses that circulate in the Americas. Furthermore, incubation period and histopathologic lesions after virus inoculation by the intra–cerebral route in mice was characterized. According to the results of phylogenetic studies the Mexican skunk strains (Antigenic Variant (AV) 8 and AV10) are evolutionarily quite distinct. The AV10 isolate from South Baja California is quite closely related to the viruses that circulate in Californian skunks; while the AV8 isolate from San Luis Potosí was most closely related to the South central skunk strain that circulates in southern states such as Texas. These variations were reflected in some biological properties of both strains in mice.
Key words: Rabies, Skunks, Molecular epidemiology, Incubation period, P gen.
INTRODUCCIÓN
La rabia es una enfermedad en la que se presenta encefalitis aguda, progresiva e incurable, causada por todos los miembros del género Lyssavirus de la familia Rhabdoviridae. Este género contiene hasta ahora 12 virus: el de la rabia (VRAB), virus del murciélago Lagos, virus Mokola, virus Duvenhage, Lyssavirus del murciélago europeo tipo 1 y 2 (EBLV–1 y EBLV–2), Lyssavirus del murciélago Australiano, virus Aravan, virus Khujand, virus Irkut y virus caucásico del oeste(1). Una nueva especie propuesta es el virus del murciélago de Shimoni que ha sido recientemente aislado del murciélago con nariz en forma de hoja (Hipposideros commersoni)(2). Aunque varios genotipos de Lyssavirus son reconocidos mundialmente(2,3), sólo el virus genotipo 1, representado por el virus de la rabia serotipo 1 clásico, es sabido que circula en el continente Americano(4,5).
La rabia urbana en México ha sido significativamente reducida durante la última década por control canino intensivo y campañas de vacunación(6). Sin embargo, al reducir el número de casos de rabia en perros, ha sido muy notoria la presencia de rabia en varias especies silvestres tanto de vida terrestre como aérea(7,8,9,10). El murciélago vampiro (Desmodus rotundus) representa al portador que con mayor frecuencia transmite la rabia a humanos y al ganado, principalmente bovino, pero también se ha informado del potencial que presentan los zorrillos para causar esta enfermedad en humanos(11). La especie principal de zorrillo que actúa como reservorio de rabia en México es el zorrillo moteado (Spilogale putorius), aunque otras especies como el zorrillo de nariz porcina (Conepatus leuconotus) han sido documentadas como rabiosas(11). Por otro lado, en Canadá y en Estados Unidos de América la especie de zorrillo más comúnmente asociado con la rabia es el zorrillo rayado (Mephitis mephitis)(12).
Se ha encontrado que los métodos antigénicos, que utilizan un panel reducido de anticuerpos monoclonales, identifican las siguientes variantes antigénicas (AV) en reservorios silvestres mexicanos: AV3 y 11 cuyos portadores son los murciélagos vampiros, AV4 y 9 detectadas en murciélagos de cola de ratón (Tadarida brasiliensis), AV7 de linces y zorros, y dos tipos antigénicos, AV8 y AV10 asociados con zorrillos en dos partes del país, una región central que incluye a San Luis Potosí (SLP) y Baja California Sur (BCS), respectivamente(9).
Es sabido por ejemplo que las variantes AV8 y AV10 se refieren a variantes antigénicas del virus de la rabia mantenidas en poblaciones de zorrillos.
La caracterización parcial de las secuencias del gen N del virus de la rabia de algunas representantes de estas variantes no asoció la cepa de zorrillo mexicano de BCS con ninguna variante de rabia, mientras que los aislados del lince mostraron estar muy relacionados con cepas de zorros del sur de Estados Unidos de América(10,13). Adicionalmente, la caracterización genética de la región G/G–L viral ha facilitado el desarrollo de pruebas genéticas rápidas, empleando el polimorfismo de la longitud de los fragmentos de restricción (RFLP) para descartar aislados de rabia de perro o murciélago vampiro y también para identificar un ciclo epidemiológico conocido como "hipervariable" que está asociado con virus de zorrillos(14). Actualmente, la relación epidemiológica molecular de las dos variantes del virus de la rabia de zorrillos mexicanos no es clara con respecto a otras cepas de rabia de zorrillo de América y en un contexto más amplio de los Lyssavirus. A pesar de su descubrimiento relativamente reciente, es probable que estas cepas de virus de la rabia de zorrillo mexicano hayan surgido durante un periodo de tiempo significativo y ciertamente más temprano de lo que evidencian los datos de monitoreo de la rabia.
El objetivo de este trabajo fue elucidar los orígenes filogenéticos de estos dos virus del zorrillo utilizando una porción de la secuencia del gen P del virus de la rabia con regiones correspondientes de otras variantes del virus de la rabia adaptados a zorrillo y con otros virus de rabia del genotipo 1 que circulan en América. Además, se ha propuesto que la proteína P del virus de la rabia funciona a efecto del movimiento de los componentes del virus de la rabia junto con axones neuronales en virtud de su asociación con el componente de la dineína LC8(15), y puede modular interacciones entre el virus y el hospedero por vía de numerosas características estructurales variables(3). Las secuencias de la proteína P pudieron ser predichas a partir de estos datos y usadas para evaluar si las características estructurales diferentes de la proteína P viral podrían ser responsables de estas características biológicas, tales como periodo de incubación y cambios histopatológicos observados entre los aislados en estudio.
MATERIALES Y MÉTODOS
Virus
Para el estudio sobre periodos de incubación e histopatología se emplearon cuatro diferentes virus, incluyendo dos cepas distintas de zorrillo, previamente determinadas como variantes antigénicas (AV) 10 de Baja California Sur (número de acceso AY998247) y AV8 aislada de San Luis Potosí, México (número de acceso AY998275); un aislado de murciélago vampi ro en Pánuco, Veracruz (número de acceso AY998253); y como cepa de referencia, la cepa estándar del virus de desafío (CVS). Cada cepa se ajustó a 102.5 LD50% en ratones, título correspondiente a lo encontrado en el primer pase de la cepa de zorrillo.
Para el análisis de la secuencia de nucleótidos se emplearon los siguientes virus de la rabia disponibles en la colección de Lyssavirus del CFIA: cuatro aislados de zorrillo de California (CAV637SK, CAV650SK, CAV652SK y CAV654SK); dos aislados de zorrillo mexicano MXV684SK y MXV854SK pertenecientes a AV10 y AV8(16), respectivamente; y aislamientos previamente caracterizados, incluyendo tres aislados de zorrillo del centro/sur de Estados Unidos de América en Texas (TXV211SK, TXV212SK y TXV215SK); dos del zorrillo del oeste de Canadá (\CL0867SK y WCL1741SK); y un aislado (KY2877DG) representativo del zorrillo del medio–oeste de Estados Unidos de América(17). También se incluyó un aislamiento de murciélago vampiro mexicano (MXV229VB) para comparar.
Todas las secuencias utilizadas en estos estudios han sido depositadas en el "GenBank" y tienen los siguientes números de acceso: CAV637 SK, DQ275555; CAV650SK, DQ275556; CAV652SK, DQ275557; CAV654SK, DQ275558; MXV684SK, AY998258; MXV854SK, AY998275; TXV211SK, AF369287; TXV212SK, AF369288; TXV215SK, AF369290; WCL0867SK, AF369285; WCL1741SK, AF369286; KY2877DG, AF369292; MXV229VB, AF369362. La secuencia CVS empleada se obtuvo del GenBank, con número de acceso D42112.
Propagación del virus
Los cerebros originales infectados con cada uno de los cuatro aislados se propagaron por primer pase en ratones de 21 días de edad. Cuando estos mostraron signos clínicos característicos de rabia, fueron sacrificados y se extrajeron los cerebros. El virus se sometió a dos pases más y el periodo de incubación se registró en cada caso.
RT/PCR y análisis de la secuencia de nucleótidos
El ARN genómico del virus de la rabia se extrajo de 100 mg del tejido cerebral original usando Trizol (Gibco BRL, Grand Island, NY) de acuerdo con las instrucciones del fabricante, y resuspendido en 100 ml de agua libre de ARNasas. La amplificación completa del gen P se realizó empleando iniciadores que flanquean el marco de lectura abierta del gen P, por lo tanto: rabPrev (5'– CTACTTCTC CGGGGAAACCAGAAG–3' cuyos nucleótidos blanco son los 1249–1272 de la cepa PV de referencia) y rabPrev (5'– GGRAGCCAYAGGTC RTCGTCAT–3' que tiene como blanco a los nucleótidos 2575–2596 de la cepa PV). El método d e RT– P C R se realizó como se describió previamente(3). El amplicón de 1348 pb resultante se purificó usando el Wizard Clean–up Kit (Promega, Madison, WI) antes de la secuenciación de los nucleótidos en un secuenciador automático LiCor 4200 usando los acostumbrados iniciadores internos marcados con tinción infrarroja (IR) y también utilizando el Thermo SequenaseTM Primer Cycle Sequencing Kit (Amstersham Biosciences, Buckinghamshire, UK). En algunos casos en donde se generaba producto insuficiente a partir de una sola ronda de PCR, se realizaban PCR anidadas o semi–anidadas empleando varias combinaciones de los iniciadores externos, seguidos de los internos: iniciador sentido (+) P967 (5'–GAGATGG CNGARGAGACTGT WGA–3') correspondiente a los nucleótidos 1568–1590 de la cepa PV ó P968 (5 ' –AYGAAAAAAACTAACAC CCCTCCT–3') correspondiente a los nucleótidos 14731496 y un iniciador reverso (–) P905 (5'–CCTTAACTA TGTCRTCAAGRTTCA–3')(18) correspondiente a los nucleótidos 2208–2231. Las secuencias de los nucleótidos fueron alineadas empleando ClustalX version 1.8(19) y se realizó el análisis filogenético por algoritmo de unión de vecino (Neighbor joining (NJ) empleando PHYLIP versión 3.61 (ver http://evolution.genetics.washington.edu/phylip.html) como previamente está descrito(3). TreeView(17) fue usado para generar producción gráfica de los árboles. La traducción de la secuencia de nucleótidos a proteína fue realizada usando el DNAsis software (Hitachi) y los alineamientos secuenciales de proteína fueron llevados a cabo con ClustalX y el programa ProtPars de Phylip.
Histopatología
Los cerebros infectados con cada aislamiento fueron conservados para la evaluación histopatológica. Los tejidos se fijaron por inmersión en formalina neutra tamponada al 10%, procesado por procedimientos rutinarios y embebidos en parafina. Las secciones fueron de 3 mm y teñidas con hematoxilina–eosina (H & E).
RESULTADOS
Caracterización molecular de cepas de zorrillo
Los datos de secuencia de nucleótidos para el gen P de 13 virus de la rabia se obtuvieron como se mencionó. Los valores de distancia entre todos estos aislamientos se generaron a partir del nucleótido alineado y las secuencias proteicas predichas empleando los programas DNADIST y PROTDIST de Phylip versión 3.61, con inclusión de la secuencia de referencia del CVS (Cuadro 1). Mientras que los aislados de reservorios relacionados epidemiológicamente mostraron valores de distancia de nucleótidos > 0.1 (con un rango de 0.0411 a 0.0847 para los cuatro virus de California, entre 0.0302 a 0.0846 para los tres virus de zorrillo de Texas y hasta 0.0619 para los especímenes representativos de la cepa de zorrillo del medio–oeste de Canadá y Estados Unidos de América); las distancias de nucleótidos entre los aislados pareados fueron mayores, con una escala de 0.12 a 0.280. Consistente con un estudio previo que proponía que los aislados que difieren más de 0.08 en la distancia genética del locus P de la rabia deben considerarse como variante genética distinta(3), parece ser que los dos aislados mexicanos, con una distancia de nucleótidos de 0.2606 entre estos, son claramente representativos de dos cepas distintas que no tienen relación con los otros aislamientos de zorrillos examinados en este trabajo.
El análisis de NJ de estos virus de la rabia se muestra en la Figura 1. Basado en los valores asociados con los mayores clados de los árboles filogenéticos, hubo claramente un fuerte soporte de agrupamiento geográfico de aislamientos de rabia de zorrillos como se indica a continuación: (A) el clado de zorrillo de (centro/sur) Texas, fue la vari ante terrestre más claramente divergente estudiada y estuvo relativamente asociada con la cepa de murciélago vampiro representativo de cepas de murciélagos en América; (B) el clado del zorrillo de California; y (C) un clado comprometiendo tanto con aislados del oeste de Canadá como del medio–oeste de Estados Unidos de América. Los dos aislados de zorrillo mexicano agrupados distintivamente dentro de este árbol, tanto la variante AV10 (MXV684SK) ubicada en el grupo de California, pero con poco soporte (437), como el aislado AV8 de zorrillo (MXV854SK) agrupado más cercanamente con el clado de zorrillo de Texas con soporte moderado (678) (Figura 1).
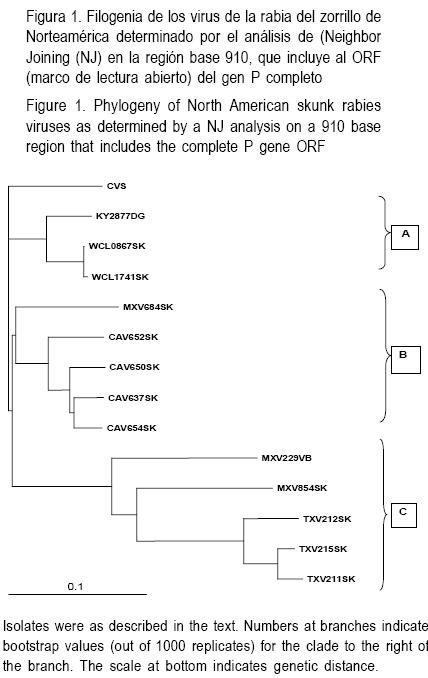
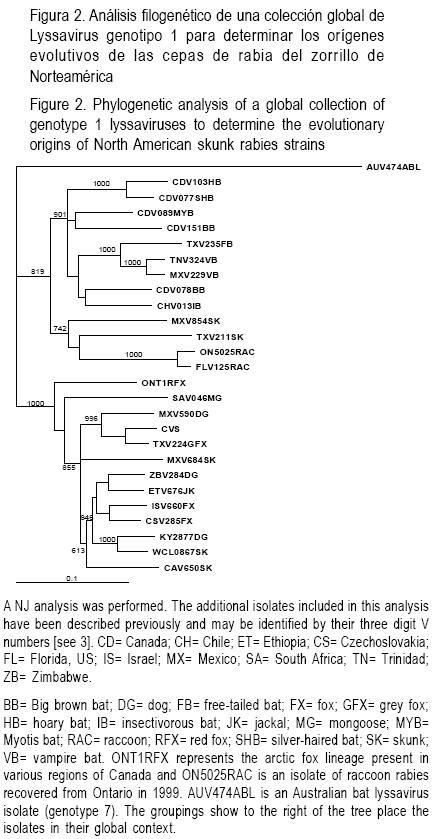
Con el objetivo de investigar más a fondo el linaje de los aislados del zorrillo mexicano, se llevó a cabo otro análisis filogenético empleando secuencias del gen P derivadas de una colección más global del virus de la rabia(2) con la secuencia de un aislamiento de Lyssavirus de murciélago australiano utilizado como grupo externo (Figura 2). El aislado AV10 (MXV684SK) fue segregado con un buen soporte (855) a partir de una colección de virus obtenida de varias zonas geográficas y especies incluyendo al perro mexicano, al zorro gris de Texas, variantes y cepas del zorrillo de California y del medio–oeste del viejo mundo. Estas cepas han sido consideradas como representativas del linaje cosmopolita que fue transferido a muchas regiones del mundo durante la época de la colonia(20). La inclusión de MXV684SK en el subtipo 1 del virus de la rabia genotipo(3) está fuertemente respaldado (valor bootstrap de 1000). En comparación, el aislado AV8 (MXV854SK) agrupado dentro del subtipo 2 del genotipo 1 (valor bootstrap de 819) estaba asociado con el clado que incluía cepas terrestres albergadas por zorrillos y mapaches (valor bootstrap de 742).
Comparación de proteínas P predichas
Para explorar si las diferencias observadas en el periodo de incubación entre cepas fijas de rabia (CVS), zorrillo y murciélago vampiro podían ser explicadas por diferencias en dominios funcionales importantes de la proteína P, se generó un alineamiento de secuencias de la proteína P como representativo de cepas de zorrillos, cepas de CVS así como de murciélago vampiro para compararlas (Figura 3). Consistente con observaciones previas de la organización estructural de la proteína P, las regiones más conservadas (aminoácidos 1–50 y 200240 en este alineamiento) y dominios altamente variables (residuos 55–80 y 130–180) fueron evidentes. Sin embargo, la comparación de CVS y las secuencias del virus del murciélago vampiro con aquellas determinadas para todas las cepas de zorrillo no aclararon la identificación de patrones de sustitución que mostraron ser típicos de cepas de zorrillos; en cambio, los sustitutos parecían reflejar las relaciones filogenéticas de los aislados. Se examinó a fondo la conservación de varias características de la proteína P, que en caso de ser modificadas, podían tener impacto en las interacciones virus–hospedero; éstas incluyeron el motivo de unión de LC8(15), residuo de serina conocido como blanco de fosforilación de por lo menos dos proteínas cinasas distintas(21) y cuatro residuos internos de metionina mostrando, en el caso de la cepa CVS, ser capaces de dirigir la iniciación de la traducción interna para producir N–terminal truncado del producto gen P(22). Como se muestra en la Figura 3, el motivo LC8 de unión localizado en los residuos 139–151 muestra variación en la secuencia primaria, aunque el motivo de unión crítico (DKXTQT) localizado en los residuos 143147 fue retenido en todas las cepas a excepción de una sustitución (T a R) en el residuo 147 de la muestra KY22877DG. Mientras que hubo variación significativa en residuos inmediatamente adyacentes a este motivo de unión del residuo 6, las dos cepas mexicanas no mostraron diferencias consistentes con la cepa de referencia CVS. De los cuatro residuos de metionina internos que inician la traducción interna, todos los residuos en posiciones 20 y 53 se conservaron, no así los de posición 69 y 83. Los residuos serina 63, 64, 162, 210 y 271 de la cepa CVS, de los que se conoce que son blanco de fosforilación (23), se mantuvieron en ambas secuencias de la cepa de zorrillo mexicano, excepto los residuos 63 y 64, que permanecen en una de las regiones hipervariables, no se conservaron en alguna de las otras cepas de zorrillo (como por ejemplo, la cepa de zorrillos de Texas). En todos los casos los residuos 162, 210 y 271 se conservaron en las últimas dos posiciones mantenidas dentro del contexto de la secuencia de consenso de proteína kinasa C.
Periodo de incubación viral
La inoculación intracerebral en ratones con cepa CVS dio por resultado un periodo de incubación consistentemente más corto (6 días) comparado con lo observado para las cepas de zorrillo (hasta 21 días), mientras que la cepa de murciélago vampiro tuvo un periodo de incubación de longitud intermedia (entre 12 a 15 días). Cuando los datos para los tres pases fueron considerados como ANDEVA de una vía, no hubo diferencia significativa para los cuatro grupos (P<0.001 excepto P=0.029 para las dos cepas de zorrillo). La comparación de los datos para los tres pases secuenciales (P1, P2 y P3) de cada cepa mostraron que, por ANDEVA de una vía, no había cambio significativo para el aislado de zorrillo de BCS (P=0.81 ), pero los periodos de incubación aparentemente más cortos para las cepas de zorrillo de SLP y murciélago vampiro al pase 3 fueron significativos (P=0.014 y 0.027, respectivamente). Estas conclusiones se reforzaron por comparación de la prueba t de Student de periodos de incubación de P1 y P3 para los tres aislados virales de "calle"; la diferencia para la cepa de zorrillo de BCS no fue significativa (P=0.539), pero las diferencias en estos valores para las cepas de zorrillo de SLP y murciélago vampiro sí fueron significativas (P=0.025 y 0.016, respectivamente).
Histopatología
Los ratones inoculados con CVS presentaron infiltración linfocitaria perivascular de leve a moderada en el cerebelo, corteza cerebral y región del tálamo, junto con microgliosis leve. La Figura 4A muestra que las lesiones resultantes de la inoculación con cepa de murciélago vampiro presentaron infiltración perivascular de leve a moderada en cerebelo y corteza cerebral, infiltración perivascular leve en hipocampo, región del tálamo; y el puente, congliosis leve. Las lesiones histopatológicas causadas por infección de ratones con virus de la rabia del zorrillo (AgV 8) incluyeron lesiones en forma de esponja en el neuropilo del tálamo (Figura 4B). Además se observó microgliosis leve (Figura 4C) e infiltración linfocitaria perivascular de moderada a severa en cerebelo, corteza cerebral y puente; e infiltración linfocitaria perivascular severa en hipocampo y región del tálamo. Se examinaron secciones duplicadas para todas las regiones cerebrales y los resultados fueron reproducidos en todos los casos. Los ratones control no manifestaron cambios histológicos.

DISCUSIÓN
Como se informó previamente, los virus AV10 han sido hallados en zorrillos de la península de Baja California, mientras que los virus AV8 estaban asociados con zorrillos de las regiones centrales de México, como San Luis Potosí, Aguascalientes y Jalisco. Anteriormente, la caracterización de una porción del gen N de dichos aislados ha concluido que las cepas de zorrillos mexicanos de BCS pertenecen a distintos linajes de aquéllos encontrados en otros reservorios terrestres y silvestres(11,13).
En este estudio, la caracterización molecular se enfocó al gen P, una región relativamente divergente del virus que ha mostrado ser adecuada para estudios epidemiológicos tanto globalmente extensos como finamente detallados(3,24). La comparación de secuencias del gen P determinadas para ambas variantes antigénicas del virus de la rabia que circulan en zorrillos mexicanos conllevó a las siguientes conclusiones: 1) las dos variantes de zorrillo mexicano son evolutivamente distintas. 2) el aislado AV10 de BCS está muy relacionado con los virus circulantes en zorrillos de California, siendo un hallazgo consistente con sus parientes geográficamente cercanos. Sin embargo, la evidencia no fue lo suficientemente fuerte para la naturaleza monofilética de los virus que circulan en California y BCS; por lo tanto, actualmente no se puede suponer que una surgió directamente de la otra. El análisis de otros especímenes mexicanos puede ayudar para posteriormente elucidar la relación evolutiva de estos dos grupos virales. 3) el aislado AV8 de SLP estaba cercanamente relacionado con la cepa del zorrillo del centro/sur que circulaba en los estados del sur–este, como Texas; sin embargo, no hubo evidencia suficiente para respaldar la naturaleza monofilética del virus de la rabia del zorrillo de México y de Texas y se argumentaría que, debido la distancia genética observada entre estos dos grupos, deben ser considerados como dos clados distintos.
Se ha propuesto que las cepas de rabia circulando en hospederos terrestres de América (e.g. mapaches y zorrillos) surgieron por parte de quirópteros hospederos(25). De hecho, se ha documentado el potencial para el surgimiento de nuevas cepas de rabia posteriores a la transmisión de esta enfermedad por el murciélago como reservorio, a una población localizada de zorrillos (fenómeno denominado "spillover")(26). De la misma manera, la variante AV8 bien pudo emerger de ciertas cepas de murciélago. Dada la diferencia en especies de zorrillos que portan rabia en México comparadas con las de Estados Unidos de América y Canadá, así como la distancia genética entre los virus AV8 en México y aquéllos en Texas, es probable que esta cepa de zorrillo mexicano surgiera como fenómeno de "spillover" de un murciélago que actuó como reservorio de la rabia independientemente de otros fenómenos de este tipo más hacia el norte.
La variación molecular y antigénica claramente puede afectar la patogénesis del virus de la rabia, siendo una propiedad que puede manifestarse en diferencias en el periodo de incubación, cambios histopatológicos y presentación clínica. Este trabajo ha demostrado que ambas cepas de zorrillo causan en ratones un periodo de incubación más largo que lo observado con aislados aéreos, y en cuanto a periodos de incubación de cepas de zorrillo de BCS mostraron menor adaptación al ratón que la cepa de zorrillo de SLP o la cepa aérea. Además, las dos cepas de zorrillo causaron lesiones histopatológicas similares a las lesiones en forma de esponja reportadas en zorrillos infectados con cepas de rabia de zorrillo canadiense(26,27); aunque este tipo de lesiones se ha encontrado en cerebro de ratón inoculado con virus de la rabia de lince mexicano(28), que es molecularmente similar al virus de zorros de Texas(13), estas lesiones fueron muy distintas de las originadas por la cepa aérea incluida en este estudio. Así, el virus de la rabia del zorrillo norteamericano provoca cambios patológicos similares en animales infectados a pesar de sus muy distintos orígenes evolutivos. Se anticipa que esta similitud en la patología debe ser consecuencia de atributos funcionales similares en una o más proteínas virales. Aunque, es evidente que la proteína G tiene un papel importante en la patogénesis viral(29), la neuroinvasividad del virus de la rabia ha sido ligado a varios elementos genómicos virales(30). Los dominios funcionales específicos dentro de una o más proteínas virales pueden impactar la susceptibilidad en diferentes especies, periodo de incubación, duración de signos clínicos y frecuencia de comportamiento agresivo; todos estos parámetros pueden contribuir al fenómeno de selectividad de especies en la rabia enzoótica(12)
Sin embargo, la base molecular para estas diferencias en adaptación al ratón puede no ser evidente sin la caracterización molecular completa de estos virus a lo largo de sus genomas. Las comparaciones de la proteína P realizadas en este estudio, no identificaron características de este producto para la cepa de zorrillo de BCS que fueron claramente diferentes de las otras cepas estudiadas (CVS y murciélago vampiro) o, para ese propósito, características estructurales que claramente distinguen a las cepas de zorrillo de las otras, lo cual explicaría el mayor periodo de incubación observado. La caracterización de otros genes virales, particularmente la secuencia completa del gen G, que codifica para la superficie de la glicoproteína responsable del receptor de la célula huésped vinculante y entrada del virus en la célula, es otro producto viral que merece mayor escrutinio.
En México, durante el año 2000, se diagnosticaron ocho zorrillos rabiosos y una muerte humana fue atribuida a esta especie(31) Desde entonces, los casos de rabia en zorrillo han sido 7, 7, 6 y 2 en los años 2001–2004, respectivamente(32). En 2001, dos de siete muertes en México, representando alrededor de 30 % del total de los casos, fueron atribuidos a zorrillos. Recientemente, se notificó un caso de un humano muerto por rabia transmitida por un zorrillo infectado en Batopilas, Chihuahua. El caso fue confirmado por la Secretaría de Salud, después de haber realizado las pruebas correspondientes en el animal capturado. Estas cifras marcan claramente la importancia del surgimiento de la rabia portada por animales silvestres terrestres en este país y la necesidad de comprender la biología y epidemiología de esta enfermedad para ayudar en los esfuerzos de control.
LITERATURA CITADA
1. Dietzgen RG, Calisher CH, Kurath G, Kusmin IV, Rodríguez LL, Stone DM, et al. Family Rhabdoviridae. In: King AM, Adams MJ, Carstens EB, Lefkowitz EJ, editors. Virus taxonomy: classification and nomenclature of viruses. Ninth Report of the International Committee on Taxonomy of Viruses, San Diego: Elsevier; 2011. [In press] [ Links ].
2. Kuzmin IV, Mayer AE, Niezgoda M, Markotter W, Agwanda B, Breiman RF, Rupprecht CE. Shimoni bat virus, a new representative of the Lyssavirus genus. Virus Res 2010:149:197–210. [ Links ]
3. Nadin–Davis SA, Abdel–Malik M, Armstrong J, Wandeler AI. Lyssavirus P gene characterization provides insights into the phylogeny of the genus and identifies structural similarities and diversity within the encoded phosphoprotein. Virology 2002;298: 286–305. [ Links ]
4. Loza–Rubio E, Vargas R, Hernández E, Batalla D, Aguilar–Setién A. Investigation of rabies virus strains in Mexico with a panel of monoclonal antibodies used to classify Lyssavirus. Bull PAHO. 1996(30):31–35. [ Links ]
5. Smith JS. New aspects of rabies with emphasis on epidemiology, diagnosis, and prevention of the disease in the United States. Clin Microbiol 1996(9):166–176. [ Links ]
6. Velázquez–Monroy O, Vargas–Pino F, Gutiérrez–Cedillo V, Lecuona–Olivares A. Advances in canine rabies control in México. In: 14th Annual Rabies in the Americas Conference, Philadelphia, Pennsylvania, 2003. Thomas Jefferson Institute, USA. 2003. [ Links ]
7. Loza–Rubio E, Pedroza–Requénes R, Montano–Hirose JA, Aguilar–Setién A. Caracterización con anticuerpos monoclonales de virus de la rabia aislados de fauna doméstica y silvestre de México. Vet Mex 1998;29:345–349. [ Links ]
8. Loza–Rubio E, de Mattos CC, Aguilar–Setién A, de Mattos CA. Aislamiento y caracterización molecular de un virus rábico, obtenido de un murciélago no hematófago en la Ciudad de México. Vet Méx 2000;31:147–152. [ Links ]
9. Velasco–Villa A, Gómez–Sierra M, Hernández–Rodríguez G, Juárez–Islas V, Meléndez–Félix A, Vargas–Pino F, Velázquez–Monroy O, Flisser A. Antigenic Diversity and Distribution of Rabies virus in Mexico. J Clin Microbiol 2002;40:951–958. [ Links ]
10. Velasco–Villa A, Orciari LA, Souza V, Juárez–Islas V, Gómez–Sierra M, Castillo A, Flisser A, Rupprecht C. Molecular epizootiology of rabies associated with terrestrial carnivores in México. Virus Res 2005;11:13–27. [ Links ]
11. Aranda M, López de Buen L. Rabies in Skunks from Mexico. J. Wildlife Dis 1999;35:574–577. [ Links ]
12. Charlton KM, Webster WA, Casey GA, Rupprecht CE. Skunk rabies. Rev Infect Dis 1998;10(Suppl 4):S626–628. [ Links ]
13. de Mattos CC, de Mattos CA, Loza–Rubio E, Aguilar–Setién A, Orciari LA, Smith JS. Molecular Characterisation of Rabies virus Isolates from Mexico: Implications for transmission dynamics and human risk. Am J Trop Med Hyg 1999;61:587–597. [ Links ]
14. Loza–Rubio E, Aguilar–Setién A, Bahloul C, Brochier B, Pastoret PP, Tordo N. Discrimination between epidemiological cycles of rabies in Mexico. Arch Med Res 1999;30:144–149. [ Links ]
15. Poisson N, Real E, Gaudin Y, Vaney C, King S, Jacob Y, Tordo N, Blondel D. Molecular basis for the interaction between rabies virus phosphoprotein P and the dynein light chain LC8: Dissociation of dynein–binding properties and transcriptional functionality of P. J Gen Virol 2001;82:2691–2696. [ Links ]
16. Los anticuerpos monoclonales en la caracterización y vigilancia de los virus de la rabia en América Latina y el Caribe. Pan Am J Public Health 2000;8:214–217. [ Links ]
17. Page RDM. TREEVIEW: An application to display phylogenetic trees on personal computers. Comp Appl Biosci 1996;12:357–358. [ Links ]
18. Nadis–Davis SA, Loza–Rubio E. The molecular epidemiology of rabies associated with chiropteran hosts in Mexico. Virus Res 2006;117:215–226. [ Links ]
19. Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG. The ClustalX windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nuc Acids Res 1997;24:4876–4882. [ Links ]
20. Smith JS, Orciari LA, Yager LA, Seidel HD, Warner CK. Epidemiologic and historical relationships among 87 rabies virus isolates as determined by limited sequence analysis. J Infect Dis 1992;166:296–307. [ Links ]
21. Gupta AK , Blondel D, Choudhary S, Banerjee AK. The phosphoprotein of rabies virus is phosphorylated by a unique cellular protein kinase and specific isomers of protein kinase C. J Virol 2000;74:91–98. [ Links ]
22. Chenik M, Chebli K, Blondel D. Translation initiation at alternate in–frame AUG codons in the rabies virus phosphoprotein mRNA is mediated by a ribosomal leaky scanning mechanism. J Virol 1995;69:707–712. [ Links ]
23. Nadin–Davis SA, Simani S, Armstrong J, Fayaz A, Wandeler AI. Molecular and antigenic characterization of Rabies viruses from Iran identifies variants with distinct epidemiological origins. Epidemiol Infect 2003;131:777–790. [ Links ]
24. Badrane H, Tordo N. Host–switching in Lyssavirus history from the chiroptera to the carnivora orders. J Virol 2001;75:8096–8104. [ Links ]
25. Smith J, Rohde R, Mayes B, Parmely C, Leslie MJ Molecular evidence for sustained transmission of a bat variant of rabies virus in skunks in Arizona. In: 12th Ann Rabies in the Americas Conf. Peterborough, Ontario, CFIA, Canada, 2001. [ Links ]
26. Bundza A, Charlton KM. Comparison of spongiform lesions in experimental scrapie and rabies in skunks. Acta Neuropathol 1988;76:275–280. [ Links ]
27. Charlton KM, Casey GA, Campbell JB. Experimental rabies in skunks: effects of immunosuppression induced by cyclophosphamide. Can J Comp Med 1984;48:72–77. [ Links ]
28. Weimersheimer JE, Loza–Rubio E, Morales SE. Histopathological lesions in mice caused by rabies virus molecular variants circulating in Mexican wildlife. Téc Pecu Méx 2004;42:411–417. [ Links ]
29. Faber M, Faber ML, Papaneri A, Bette M, Weihe E, Dietzschold B, Schnell MJ. A single amino acid change in rabies virus glycoprotein increases virus spread and enhances virus pathogenicity. J Virol 2005;79:14141–8. [ Links ]
30. Faber, M, Pulmanausahakul R, Nagao, K, Prosniak M, Rice AB, Koprowski H, Schnell Mj, Dietzschold B. Identification of viral genomic elements responsible for rabies virus neuroinvasiveness. Proc Natl Acad Sci. USA 2004;101:16328–16332. [ Links ]
31. OPS. Boletín Vigilancia Epidemiológica de la Rabia en las Américas. Washington, DC: Organización Panamericana de la Salud: Organización Mundial de la Salud. 2000(XXXII). [ Links ]
32. OPS. Boletín Vigilancia Epidemiológica de la Rabia en las Américas Volumen.. Washington, DC: Organización Panamericana de la Salud: Organización Mundial de la Salud. 2004(XXXVI). [ Links ]





![Phenotypic and molecular characterization of populations of arizona cottontop [Digitaria californica (Benth.) Henr.]](/img/en/next.gif)








