Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.3 no.1 Mérida ene./mar. 2012
Revisión de literatura
Uso de productos derivados de Bacillus thuringiensis como alternativa de control en nematodos de importancia veterinaria. Revisión
Use of Bacillus thuringiensis products as alternative method of control against important veterinary parasitic nematodes. Review
Alejandro Vázquez–Pinedaª, Alejandra Bravo–de–la–Parrab, Pedro Mendoza–de–Givesc, Enrique Liébano–Hernándezc, Ismael Hernández–Linaresc, Nandy Yáñez–Pérezc, Liliana Aguilar–Marcelinoc, Gabriel Ramírez–Vargasc, Elías Hernández–Castroª, Isidro Gutiérrez–Seguraª, Ma. Eugenia López–Arellanoc
a Unidad de Sistemas de Producción Agrícola, Unidad Tuxpan, Km 25.5 Carr. Iguala–Tuxpan, Iguala Guerrero. México.
b Instituto de Biotecnología. Universidad Nacional Autónoma de México, Cuernavaca, México
c Centro Nacional de Investigación Disciplinaria en Parasitología Veterinaria, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Carretera Cuernavaca–Cuautla #8534, Col. Progreso, Jiutepec, Morelos, México. mlopez_arellano@hotmail.com. Correspondencia al último autor.
Resumen
La bacteria entomopatógena Bacillus thuringiensis produce cristales proteicos con actividad citotóxica en contra de insectos y nematodos. La toxicidad de B. thuringiensis en plagas agrícolas es ampliamente conocida, pero poco se conoce acerca de su actividad en contra de nematodos parásitos. Recientemente, la actividad nematicida de las proteínas derivadas de B. thuringiensis se demostró en parásitos de mamíferos como Haemonchus, Teladorsagia, Nippostrongylus, y Ancylostoma, y en nematodos de plantas, Globodera y Meloidogyne. Entre el grupo de B. thuringiensis con efecto nematicida, las proteínas de la cepa IB–16 han mostrado actividad letal de 50 a 100 % en contra de diferentes estadios del principal género de rumiantes, Haemonchus contortus. Asimismo, los géneros de nematodos de vida libre, Panagrellus redivivus y Caenorhabditis elegans han sido blanco de estudios de la acción nematicida de B. thuringiensis. Por ejemplo, el efecto tóxico de la proteína Cry5B de B. thuringiensis se observó en las células intestinales de C. elegans, además esta acción parece involucrar receptores celulares específicos, similares a los que se han notificado en contra de plagas agrícolas. Asimismo, la unión de la proteína Cry5B ocurre en receptores específicos, como moléculas de carbohidratos, las cuales están presentes en la membrana de las células de intestino de los nematodos, ocasionando daño y muerte. A través de este tipo de estudios, los derivados de B. thuringiensis podrían considerarse una alternativa de control en nematodos que afectan a los animales domésticos, como rumiantes, así como en contra de otros nematodos patógenos de mamíferos e incluso de plantas agrícolas.
Palabras clave: Nematodos, Bacillus thuringiensis, Control.
Abstract
Bacillus thuringiensis is an entomopathogenic bacterium that produces crystal–proteins with cytotoxic activity against insects and nematodes. B. thuringiensis toxicity on agriculture pests is widely recognized; however, there is little information about the lethal action of B. thuringiensis against nematodes. Recently, the nematicide activity of B. thuringiensis proteins was showed against Haemonchus, Teladorsagia, Nippostrongylus, and Ancylostoma genera of mammals, and against the plant parasitic nematodes, Globodera and Meloidogyne. From a list of B. thuringiensis strains with nematicide effect, selected proteins from the IB–16 isolate showed 50 to 100 % nematocidal efficacy against different developing stages of H. contortus. Additionally the in vitro assay showed evidence about the lethal activity of this strain against the free–living nematodes Panagrellus redivivus and Caenorhabditis elegans. The Cry5B protein of B. thuringiesis caused tissue damage on the C. elegans mid–gut and its action probably involves specific gut–receptor, similar to reporte with nematodes of importance in agriculture. Also, Cry5B protein–receptors link appears to involve carbohydrate moieties on intestinal cells, and cause tissue damage and nematodes death. Through these studies, selected B. thuringiensis proteins could be considered in future trials as potential alternative tools of control against parasitic nematodes of domestic animals, such as ruminants and other pathogens of mammals and even from agriculture crops.
Key words: Nematodes, Bacillus thuringiensis, Control.
INTRODUCCIÓN
La bacteria B. thuringiensis es un bacilo Gram (+) que se localiza en diferentes hábitats del medio como cadáveres de insectos, semillas y granos. El interés por estudiar B. thuringienses como uno de los principales métodos alternativos de control en plagas, se debe a las propiedades citotóxicas que le confieren las d–proteínas, Cry y Cyt. A la fecha, existen más de 160 cepas de B. thuringiensis que producen estas proteínas, clasificadas con base a la homología en la secuencia de aminoácidos y por su especificidad en contra de plagas agrícolas(1). Entre estas cepas, algunas de ellas tienen actividad tóxica hacia nematodos de vida libre y nematodos parásitos de plantas y animales(2–3). El modo de acción nematicida de las cepas de B. thuringiensis no ha sido aún determinado, pero algunos de sus derivados han mostrado inhibir el desarrollo de larvas y causar la muerte de adultos. En estudios previos, se observó que la acción nematicida de las d–proteínas de B. thuringiensis involucra glicoproteínas y proteasas como posibles receptores de unión a células de intestino en C. elegant(4).
Por medio de los resultados de estos estudios, se puede explorar a futuro el potencial de B. thuringiensis en contra de nematodos parásitos. Además, el modo de acción de B. thuringiensis en nematodos podría implicar otros mecanismos, tomando en cuenta la biología de nematodos parásitos de plantas y mamíferos, diferente a lo que se conoce hasta la fecha en insectos. La presente revisión contempla los estudios realizados hasta la fecha, los cuales nos permiten examinar una nueva alternativa de control biológico y sus derivados en contra del Phylum Nematoda.
NEMATODOS PARÁSITOS DE IMPORTANCIA EN MEDICINA VETERINARIA
La parasitología es una amplia rama de estudio que involucra diversos organismos patógenos que infectan plantas, animales y al hombre. Para facilitar su estudio y para lograr una mejor comprensión de su actividad biológica, los parásitos se han dividido en tres grandes grupos: Protozoarios, Artrópodos y Helmintos. Este último grupo, comprende a su vez al Phylum Platyhelminthes (gusanos planos) y Phylum Nemathelminthes (gusanos redondos)(5).
El Phylum Nemathelminthes presenta gran diversidad de géneros que forman los complejos de nematodos, cuyos procesos patológicos provocan severos daúos a sus hospederos(5,6). Durante su evolución y adaptación, los nematodos han desarrollado múltiples mecanismos genéticos, a través de los estadios de vida libre y estadios de vida parásita para poder adaptarse a diferentes hábitats en clima tropical, templado y seco(5,7,8). Además, en los últimos años, el cambio climático en el planeta ha influido para incrementar la población de helmintos que afectan a los animales domésticos(9). Por ejemplo, en algunas regiones de Escocia, donde anteriormente se observaba baja prevalencia de helmintos, la situación se ha invertido, convirtiéndose en zonas de riesgo a parásitos por el incremento de temperatura y humedad(7).
El tratamiento en contra de las nematodiasis se realiza con diferentes antihelmínticos y es hasta la fecha, el único método de control en el mercado. Sin embargo, varios géneros de nematodos han generado mecanismos de resistencia antihelmíntica hacia los principales compuestos químicos disponibles en el mercado, permitiendo de esta forma la continuidad de las nematodiasis en animales domésticos y en el hombre(10,11).
La causa principal de la resistencia antihelmíntica es la respuesta genética ante la presión de selección causada por la continua exposición de los parásitos a los antihelmínticos(12). Se han identificado múltiples factores que actúan como desencadenantes de la resistencia antihelmíntica en los parásitos como son: frecuencia de tratamientos, aplicación de dosis incorrectas, uso erróneo de antihelmíntico, combinación de compuestos, etc., los cuales impactan negativamente los costos de producción en forma directa e indirecta. Por otro lado, las normas oficiales sobre el uso de drogas en animales para consumo son muy claras, enfatizando que los derivados alimenticios de origen animal deben estar libres de residuos tóxicos y de patógenos(13,14). Los rumiantes domésticos, aves y cerdos son considerados la principal fuente de alimento a nivel mundial; sin embargo, existen muchos patógenos que los afectan; entre ellos los nematodos, que al invadir a sus hospederos, estos inician cambios genéticos que les permiten evadir la respuesta inmune, y tolerar el efecto tóxico de compuestos químicos anti helmínticos(13, 15–18).
Dentro del complejo que forman los nematodos parásitos, los géneros que poseen hábitos hematófagos como Ancylostoma, Bunostomum, Ostertagia, Teladorsagia y Haemonchus, son considerados los principales patógenos en rumiantes domésticos, porque afectan la producción ganadera al cursar como enfermedad de tipo crónico o agudo, en esta última la severidad del daño conduce rápidamente a la muerte(19,20). Por otro lado, la transmisión de otros géneros de nematodos al ser humano es considerada un grave problema de salud causada por patógenos como Trichinella spiralis, Oesophagostomum bifurcum, Toxocara vitulorum, y Strongyloides spp, por contaminación de alimentos de origen animal, cuyo porcentaje de prevalencia ha incrementado en los últimos años, razón por la cual son objeto de estrictas medidas preventivas de diagnóstico y control(21–26).
Con el uso de nuevas alternativas de control como son los derivados de B. thuringiensis, se espera que esta bacteria contribuya a fortalecer los programas sanitarios en contra de nematodos parásitos que afectan a mamíferos y a plantas. Las d–proteínas de B. thuringiensis han mostrado ser inocuas al ser humano y a otros mamíferos, y aunque su efecto nematicida es poco conocido, B. thuringiensis es una herramienta de control con posible potencial tóxico en contra de nematodos de importancia veterinaria y agrícola.
FACTORES DE VIRULENCIA DE Bacillus thuringiensis
Bacillus thuringiensis es una bacteria aerobia, Gram (+), formadora de endosporas que sintetiza cuerpos microscópicos que adquieren la forma de cristal de naturaleza proteica(27). El cristal de B. thuringiensis está conformado por diferentes proteínas y metabolitos de importancia en contra de plagas agrícolas como son las d–endotoxinas, quitinazas, fosfatasas, hemolisinas, etc. Dentro de este grupo, las d–endotoxinas son las principales proteínas derivadas del cristal, también conocidas como proteínas Cry y Cyt. Estas proteínas se clasifican con base al porcentaje de homología determinado por la secuencia de aminoácidos dentro de la gran familia de genes cry y cyt(28). Figura 1.
Por su importancia como agentes de control biológico, las proteínas Cry y Cyt son las únicas que han sido ampliamente estudiadas como plaguicidas en el área agrícola. En los últimos años también se ha reconocido su efecto tóxico en mosquitos vectores que transmiten agentes infecciosos a humanos capaces de causar la muerte(28–30).
Las Cry son el único grupo de proteínas derivadas de las cepas de B. thuringiensis que se utilizan en forma comercial, desde hace más de 50 años en contra de diferentes plagas agrícolas. En contraste, las cepas de B. thuringiensis con efecto nematicida aún requieren ser estudias a profundidad para establecer su posible aplicación en el campo. A la fecha, importantes avances se han obtenido acerca del efecto tóxico de B. thuringiensis, así como el estudio de su mecanismo de acción en nematodos, tomando como modelos biológicos a nematodos parásitos y de vida libre, tanto de plantas como de mamíferos.
Los derivados del cristal de B. thuringiensis son productos biológicos biodegradables, inocuos para el ser humano y otros mamíferos, así como para plantas e invertebrados benéficos al medio. La acción letal de las cepas de B. thuringiensis es altamente específica, y han sido encontradas con actividad en contra de los patógenos blanco para los cuales fueron dirigidas, sin afectar a otros organismos. Hasta la fecha, el mercado agrícola ha mostrado buena aceptación por su efectividad en contra de plagas(30,31).
La especificidad letal que han mostrado las d–proteínas de B. thuringiensis en contra de insectos blancos, sin alterar a otras especies, fue la principal característica que se usó para formar la primera nomenclatura de B. thuringiensis(32). Sin embargo, la adición de nuevas cepas con la misma actividad tóxica en contra de diversos insectos blanco, causó confusión. Posteriormente, se modificó la primera nomenclatura y se formó una segunda clasificación con base en el nivel de identidad de las secuencias de aminoácidos para cada cepa nueva, generándose un árbol filogenético nuevo para las d–proteínas(33). Hasta la fecha, 168 proteínas Cry y dos tipos de proteínas Cyt han sido clasificadas, entre las cuales seis grupos de genes cry que codifican proteínas con posible acción nematicida han sido identificados; sin embargo, no se ha reconocido alguna proteína Cyt con posible actividad letal en contra de nematodos(1,28,33). Figura 1.
El efecto letal de las d–endotoxinas, Cry y Cyt de B. thuringiensis en plagas agrícol as ha sido ampliamente estudiado en géneros de insectos Lepidópteros, Dípteros y Coleópteros(27). Además, diferentes notificaciones han demostrado el mecanismo de toxicidad en la interacción de proteínas Cry (por ejemplo, Cry1Aa) en insectos blanco a través de receptores específicos, identificados algunos como N–aminopeptidasa, alfa–amilasa, lipoproteínas y glicoproteínas, los cuales se localizan en la membrana de células de intestino(29,34). La unión de receptores de proteínas Cry a la membrana de células intestinales, provoca una serie de cambios osmóticos (intercambio de iones Na+ y K+) que llevan a la formación de vacuolas en el citoplasma, formando orificios o poros en la membrana plasmática. La formación de poros en las células de intestino inhibe la absorción de nutrientes, causando la muerte en insectos blanco por inanición(35,36–38). (Figura 2)
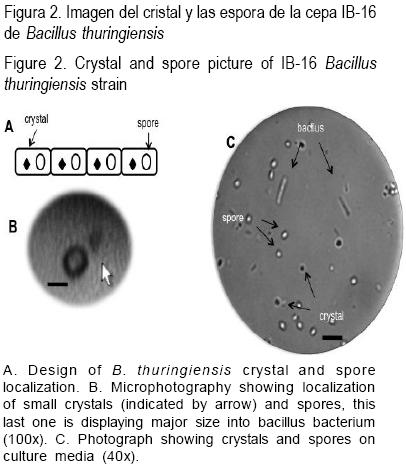
En contraste, los estudios de toxicidad de las proteínas de B. thuringiensis en nematodos son relativamente recientes, debido a que se interrumpieron aproximadamente por una década. Sin embargo, importantes avances se han logrado al mostrar el posible potencial terapéutico de los derivados de B. thuringiensis en contra de nematodos parásitos de plantas y mamíferos.
TOXICIDAD DE B. thuringiensis EN CONTRA DE NEMATODOS
A partir de los estudios realizados por Gill et al(39), diferentes proteínas de las cepas de B. thuringiensis han mostrado toxicidad en contra de géneros de nematodos de vida libre como son: Acrobeloides sp, Distolabrellus veechi, Prisionchus pacificas, Panagrellus redivivus y Caenorhabditis elegans; así como en contra de nematodos parásitos de mamíferos, por ejemplo, Nippostrongylus brasilensis, Ancylostoma ceylanicum, Trichostrongylus colubriformis, Teladorsagia circumcincta y Haemonchus contortus(2,40–43) y en los nematodo de plantas, Globedera pallida y Meloidogyne incognita(44,45).
Asimismo, los logros obtenidos hasta la fecha, sugieren que las proteínas Cry también son el grupo más importante en contra de nematodos. Además, el modo de acción de las proteínas Cry parece ser similar a la forma cómo actúan las toxinas en contra de la Clase Insecta. Así lo demuestra la acción letal de B. thuringiensis en C. elegans al interactuar con diferentes toxinas Cry (5A y 5B, 6A y 6B, 12A, 14A y 21A). Al ingerir C. elegans la proteína Cry recombinante, los autores observaron procesos degenerativos en intestino y formación de vacuolas en las células del intestino medio de C. elegans adultos y del cuarto estadio larvario (L4) por la acción de B. thuringiensis, comparado con el grupo control, el cual no mostró ninguno de estos procesos degenerativos. Los mismos autores, notificaron la inhibición del desarrollo de L4 y disminución de la fecundidad en adultos de C. elegans por el efecto de proteínas Cry(2,4). Además, los estudios de toxicidad de la proteína Cry5B de B. thuringiensis sobre C. elegans, sugieren que glicoproteínas y lipoproteínas actúan como receptores a nivel de intestino para activar el daño celular y causar la muerte de C. elegans(46).
El modo de acción de proteínas Cry en nematodos de vida libre, podría ser similar en nematodos parásitos, tomando en cuenta que la mayoría de los géneros comparten características de ontogenia, fisiología y morfología altamente similares. Por ejemplo, los estadios de nematodos de vida libre consumen bacterias y detritus del medio (excremento, tierra), durante todo su desarrollo, hasta alcanzar su fase infectiva(5,47,48). A través del cambio de vida libre a nematodos parásitos, los hábitos alimenticios de los parásitos, cambian, se convierten en nematodos obligados para adquirir nutrientes del hospedero a partir de la invasión tisular, hasta que mueren. En esta etapa de la infección, el efecto de los derivados de B. thuringiensis podría tener acción sobre los nematodos parásitos de mamíferos.
Entre los nematodos de importancia veterinaria, el género Haemonchus contortus ha sido utilizado como modelo biológico para estudiar el efecto de B. thuringiensis debido a su importancia en la salud de rumiantes domésticos a nivel mundial. En la última década, se realizaron diversos estudios para determinar el efecto nematicida de las cepas de B. thuringiensis en contra de H. contortus tanto en pruebas in vitro como in vivo. Recientemente en nuestro país, se realizó un estudio molecular con 40 cepas mexicanas de B. thuringiensis con posible potencial nematicida que identificó cinco principales cepas de B. thuringiensis con base a la secuencia de aminoácidos. Las selección se realizó con las cepas que contenían proteínas Cry, codificadas por los genes cryl, cry3 y cry5, denominadas PS86Q3 (Q3), PS14OE2 (E2) y PS211B2 (B2); respectivamente; así como también por dos cepas más, las cuales fueron seleccionadas a través de bioensayos, debido a que no mostraron alinearse a ninguna de las secuencias diseñadas para su estudio, por lo cual se les considero cepas "raras", denominadas cepas IB–61 e IB–16(43,49).
Los autores de este estudio, utilizaron la proteína soluble, la cual es el complejo de proteínas, compuesta por cinco cepas de B.thuringiensis, así como estadios de vida libre de H. contortus. La efectividad letal de las proteínas solubles, que forman parte del cristal de las cepas en estudio de B. thuringiensis sobre H. contortus, varió entre 20 y 100 % (Cuadro 1). Las cepas PS86Q3 (Q3), PS14OE2 (E2) y PS211B2 (B2) mostraron el efecto más bajo de toxicidad; resultados contrarios, se obtuvieron al analizar las cepas IB–61 e IB–16, cuya toxicidad fue mayor en contra de los diversos estadios de vida libre de H. contortus. Asimismo, se observó que el efecto letal de la toxina soluble de IB–16 fue inhibir la eclosión de huevo a larva de H. contortus; al mismo tiempo, las larvas que lograron eclosionar, murieron en un periodo muy corto (12 h) y el movimiento de las mismas fue disminuyendo en forma visible, hasta quedar muertas(43).
Asimismo, gerbos y corderos Pelibuey infectados con H. contortus fueron tratados por vía sistémica con proteínas solubles de la cepa IB–16, los cuales mostraron reducción de larvas histiotrópicas en estómago y de nematodos adultos en un rango de 50 a 70 %(50).
La cepa IB–16 de B. thuringiensis sintetiza cinco proteínas con peso molecular de 25, 45, 55, 70 y 100 kilodaltons (kDa) en geles de poliacrilamida desnaturalizantes (SDS–PAGE) y por proteínas de 25 kDa y 70 kDa detectadas en gel es no desnaturalizantes (NATIVE–PAGE). A través de la separación de proteínas de la cepa IB–16 de B. thuringiensis por HPLC se determinó la efectividad letal de la proteína de 70 kDa in vitro, como el principal componente de la cepa IB–16(50–52). Asimismo, la proteína de 70 kDa está conformada por glicoproteínas y la proteína de 25 kDa contiene proteasas, pero el efecto letal de esta última fue muy bajo en contra de larvas de Haemonchus(51–53).
Actualmente, diversos estudios de la cepa IB–16 de B. thuringiensis continúan realizándose para identificar el gen que codifica la proteína de 70 kDa para su posible aplicación como agente recombinante. Por medio de estos estudios se pretende abrir nuevas expectativas de control utilizando herramientas biotecnológicas, diferentes a los antihelmínticos comerciales. Por otro lado, la actividad letal de cepas experimentales de B. thuringiensis sobre estadios de vida libre de H. contortus, podría ser otro método de control biológico, cuya aplicación se realice sobre potreros contaminados, para contribuir a disminuir la prevalencia de nematodos gastrointestinales de vida libre a mediano plazo, así como a reducir los problemas de resistencia de tipo múltiple a los antihelmínticos en regiones de riesgo debido a la prevalencia de nematodos.
AGRADECIMIENTOS
Los autores agradecen a CONACYT por haber apoyado los proyectos número 28802 y 23953–48875–Z.
LITERATURA CITADA
1. Crickmore N, Zeigler DR, Schnepf E, Van Rie J, Lereclus D, Baum J, Bravo A, Dean DH. "Bacillus thuringiensis toxin nomenclature" (2010). [on line]: http://www–lifesci.sussex.ac.uk/Home/Neil_Crickmore/Bt/. Accessed Jun 15, 2010. [ Links ]
2. Wei J–Z, Hale K, Carta L, Platzer E, Wong C, Fang S–Ch, et al. Bacillus thuringiensis crystal proteins that target nematodes. Microbiol 2003;100:2760–2765. [ Links ]
3. López–Arellano ME. Experiencias en el uso de Bacillus thuringiensis en contra del nemátodo Haemonchus contortus. En: Fernández RM. Perspectivas de control biológico parasitario y nuevas alternativas en el sector pecuario. México DF, INIFAP. 2010. [ Links ]
4. Marroquin LD, Elyassnia D, Griffits JS, Feitelson JS, Aroian RV. Bacillus thuringiensis (Bt) toxin susceptibility and isolation of resistance mutants in the nematode Caenorhabditis elegans. Genetics 155;1693–1699. [ Links ]
5. Soulsby EJL, Helminths, Arthropods and protozoa of domesticated animals. London, UK: Bailliere Tindal; 1982. [ Links ]
6. Brooker S. Estimating the global distribution and disease burden of intestinal nematode infections: Adding up the numbers–A review. Int J Parasitol 2010;40(10):1137–1144. [ Links ]
7. Kenyon F, Sargison ND, Skuce PJ, Jackson F. Sheep helminth parasitic disease in south eastern Scotland arising as a possible consequence of climate change. Vet Parasitol 2009;163:293–297. [ Links ]
8. Malakhov VV. Nematodes. Structure, development, classification, and phylogeny. Washington, USA: Smithsonian Institution Press; 1994. [ Links ]
9. Kutz SJ, Jenkins EJ, Veitch AM, Ducrocq J, Polley L, Elkin B, Lair S. The Arctic as a model for anticipating, preventing, and mitigating climate. Vet Parasitol 2009;163:217–228. [ Links ]
10. Geary TG, Woo K, McCarthy JS, Mackenzie CD, Horton J, Prichard RK et al. Unresolved issues in anthelmintic pharmacology for helminthiases of humans. Int J Parasitol 2010;40(1):1–13. [ Links ]
11 . James CE, Hudson AL, Davey MW. Drug resistance mechanisms in helminths: is it survival of the fittest? Trends Parasitol 2009;25 7):328–335. [ Links ]
12. Köhler P. The biochemical basis of anthelmintic action and resistance. Int J Parasitol 2001;31:336–345. [ Links ]
13. Campbell WC, George Conder A, Marchiondo AA. Future of the animal health industry at a time of food crisis. Vet Parasitol 2009;163:188–195. [ Links ]
14. Waller PJ. From discovery to development: current industry perspectives for the development of novel methods of helminth control in livestock. Vet Parasitol 2006;139(1–3):1–14. [ Links ]
15. Gómez–Muñoz MT, Canals–Caballero A, Almeria S, Pasquali P, Zarlenga DS, Gasbarre LC. Inhibition of bovine T lymphocyte responses by extracts of the stomach worm Ostertagia ostertagi. Vet Parasitol 2004;120:199–214. [ Links ]
16. Else KJ. Have gastrointestinal nematodes outwitted the immune system? Parasite Immunol 2005;27:407–415. [ Links ]
17. Graham SP, Trees AJ, Collins RA, Moore DM, Guy FM, Taylor MJ, Bianco A. Down–regulated lymphoproliferation coincides with parasite maturation and with the collapse of both Gamma Interferon and Interleukin–4 responses in a bovine model of Onchocerciasis. Infect Immun 2001;7:4313–4319. [ Links ]
18. International Federation for Animal Health Product categories distribution of world market for animal health products. [on line]: http://ifahsec.org/fr_report.htm. Accessed Jun 28, 2009. [ Links ]
19. Fox MT. Pathophysiology of infection with gastrointestinal nematodes in domestic ruminants: recent developments. Vet Parasitol 1997;72(3–4):285–97. [ Links ]
20. Vázquez–Prats VM, Flores–Crespo J, Santiago–Valencia C, Herrera–Rodríguez D, Palacios–Franquez A, Liébano Hernández E, et al. Frecuencia de nemátodos gastroentéricos en bovinos de tres áreas de clima subtropical húmedo de México. Tec Pecu Méx 2004;42:237–245. [ Links ]
21. Davila G, Irsik M, Greiner EC. Toxocara vitulorum in beef calves in North Central Florida. Vet Parasitol 2010;168(3–4):261–263. [ Links ]
22. Dorny P, Praet N, Deckers N, Gabriel Sl. Emerging food–borne parasites. Vet Parasitol 2009;163:196–206. [ Links ]
23. Itoh N, Kanai K, Hori Y, Hoshi F, Higuchi S. Prevalence of Giardia intestinalis and other zoonotic intestinal parasites in private household dogs of the Hachinohe area in Aomori prefecture, Japan in 1997, 2002 and 2007. J Vet Sci 2009;10(4); 305–308. [ Links ]
24. Kobayashi I, Kajisa M, Farid AS, Yamanaka A, Horii Y. Paralyticileus and subsequent death caused by enteric parasite, Strongyloides papillosus, in Mongolian gerbils. Vet Parasitol 2009;162:100–105. [ Links ]
25. Pozio E, Darwin K, Murrell. Systematics and Epidemiology of Trichinella. Adv Parasitol 2006;63:367–439. [ Links ]
26. Youn H. Review of zoonotic parasites in medical and veterinary fields in the Republic of Korea. Korean J Parasitol 2009;47:S133–S141. [ Links ]
27. De Maagd RA, Bravo A, Crickmore N. How Bacillus thuringiensis has evolved specific toxins to colonize the insect world. Trend Genet 2001;17:167–231. [ Links ]
28. Schnepf E, Crickmore N, Van Rie J, Lereclus D, Baum J, Feitelson J, et al. Bacillus thuringiensis and Its Pesticidal Crystal Proteins. Microbiol Mol Biol Rev 1998;62:775–806. [ Links ]
29. Fernandez–Luna MT, Lanz–Mendoza H, Gill SS, Bravo A, Soberon M, Miranda–Rios J. An alpha–amylase is a novel receptor for Bacillus thuringiensis ssp. israelensis Cry4Ba and Cry11Aa toxins in the malaria vector mosquito Anopheles albimanus (Diptera: Culicidae). Environ Microbiol 2010;12(3):746–757. [ Links ]
30. Kumar S, Chandra A, Pandey KCJ. Bacillus thuringiensis (Bt) transgenic crop: an environment friendly insect–pest management strategy. Environ Biol 2008;29(5):641–53. [ Links ]
31. Sanders ME, Morelli L, Tompkins TA. Sporoformers as Human Probiotics: Bacillus, Sporolactobacillus, and Brevibacillus. Comprehen Rev Food Sci Food Safety 2003:2:101–110. [ Links ] 32. Hofte H, Whiteley HR. Insecticidal crystal proteins of Bacillus thuringiensis. Microbiol Rev 1989;53;(2):242–255. [ Links ]
33. Crickmore N, Zeigler DR, Feitelson J, Schnepf E, Van Rie J, Lereclus D, Baum J, Dean DH. Revision of the Nomenclature for the Bacillus thuringiensis pesticidal. Microbiol Mol Biol Rev 1998;62:807–813. [ Links ]
34. Arenas I, Bravo A, Soberón M, Gómez I. Role of alkaline phosphatase from Manduca sexta in the mechanism of action of Bacillus thuringiensis Cry1 Ab toxin. J Biol Chem 2010;285(17) : 12497–12503. [ Links ]
35. Aranda E, Sánchez J, Peferoen M, Güereca L, Bravo A. Interactions of Bacillus thuringiensis crystal proteins with the midgut epithelial cells of Spodoptera frugiperda (Lepidoptera: Noctuidae). J Invertebr Pathol 1996;68:203–212. [ Links ]
36. Bravo A, Jansens S, Perferoen M. Immunocytochemical localization of Bacillus thuringiensis insecticidal crystals proteins in intoxicated insects. J Invertebr Pathol 1992;60:237–246. [ Links ]
37. Bravo A, Miranda R, Gómez I, Soberon M. Pore formation activity of Cry toxins from Bacillus thuringiensis in an improved membrane preparation from Manduca sexta midgut cell microvilli. Biochim Biophys Acta 2002;1562:63–69. [ Links ]
38. Gill SS, Cowles EA, Pletratonio PV. The mode of action of Bacillus thuringiensis endotoxi ns. Annu Rev Entomol 1992;37:615–636. [ Links ]
39. Gill SS, Hornung JM, Ibarra JE, Singh GJP, Federici BA. Cytolytic activity and immunological similarity of the Bacillus thuringiensis subsp. israelensis and Bacillus thuringiensis subsp. morrisoni isolate PG–14 toxins. Appl Environ Microb 1987;1251–1256. [ Links ]
40. Botjer K, Bone L. Changes in morphology of Trichostrongylus colubriformis eggs and the juveniles caused by Bacillus thuringiensis. J Nematol 1987;19:282–286. [ Links ]
41. Cappello M, Bungiro RD, Harrison LM, Bischof LJ, Griffitts JS, Barrows BD, Aroian RV. A purified Bacillus thuringiensis crystal protein with therapeutic activity against the hookworm parasite Ancylostoma ceylanicum. PNAS 2006;103(41):15154–15159. [ Links ]
42. Koetze AC, Grady JO, Gough JM, Pearson R, Bagnall NH, Kemp DH, et al. Toxicity of Bacillus thuringiensis to parasitic and free–living life–stages of nematode parasites of livestock. Int J Parasitol 2005;35:1013–1022. [ Links ]
43. López–Arellano ME, Flores–Crespo J, Mendoza–de–Gives P, Bravo–de–la–Parra A, Herrera–Rodríguez D, Liébano–Hernández D, et al. In vitro lethal activity of Bacillus thuringiensis toxins against Haemoanchus contortus eggs and infective larvae. Int J Nematol 2002;12:66–72. [ Links ]
44. Rake J, Sikora RA. Influence of plant health–promoting rhizobacteria Agrobacterium radiobacter and Bacillus sphaericus on Globodera pallida root infection of potato and subsequent plant growth. J. Phytpath (Phytopathologische Zeitschrift) 1992;134;198–208. [ Links ]
45. Mohammed SH. Saedy MAE, Enan MR, Ibrahim NE, Ghareeb A, Moustafa SA. Biocontrol efficiency of Bacillus thuringiensis toxins against root–knot nematode, Meloidogyne incognita. J Cell Mol Biol 2008;7(1):57–66. [ Links ]
46. Griffitts JS, Huffman DL, Whitacre JL, Barrows BD, Marroquin LD, ller RM, et al. Resistance to a bacterial toxin is mediated by removal of a conserved glycosylation pathway required for toxin–host interactions. J Biol 2003;278(46):45594–45602. [ Links ]
47. Dieterich C, Sommer RJ. How to become a parasite – lessons from the genom es of nem atodes. Trends Genet 2009;25(5):203–209. [ Links ]
48. Johnson TE, Wood WB. Genetic analysis of life–span in Caenorhabditis elegans. Proc Natl Acad Sci 1982;79:6603–6607. [ Links ]
49. Ontiveros FEG, 1997. Evaluación del efecto nematotóxico de toxinas de Bacillus thuringiensis sobre la viabilidad de Haemonchus contortus in vitro [tesis licenciatura]. Morelos, México. Universidad Autónoma del Estado de Morelos; 1997. [ Links ]
50. López ME, Flores J, Mendoza P, Vázquez V, Liébano E, Bravo A, et al. Use of Bacillus thuringiensis toxin as alternative method of control against Haemonchus contortus. Ann NY Acad Sci 2006;1081:347–354. [ Links ]
51. Vázquez–Pineda A, Yáñez–Pérez NG, López–Arellano ME, Mendoza–de–Gives P, Liébano–Hernández E, Bravo–de–la–Parra A. Biochemical characterization of two purified proteins of the IB–16 Bacillus thuringiensis strains and their toxicity against the sheep nematode Haemonchus contortus in vitro. TBED 2010;57:111–114. [ Links ]
52. Yáñez–Pérez NG. Evaluación de dos componentes proteinaceos que conform an la cepa IB –16 de Bacillus thuringiensis contra Haemonchus contortus [tesis licenciatura]. Morelos, México. Universidad Autónoma del Estado de Morelos; 2009. [ Links ]
53. Hernández–Linares I, López–Arellano ME, Mendoza–de–Gives P, Liébano–Hernández E, Bravo–de–la–Parra A. Lethal activity of two Bacillus thuringiensis toxins against Haemonchus contortus histiotropic larvae. Ann NY Acad Sci 2008;1149:177–179. [ Links ]














