Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.2 no.3 Mérida jul./sep. 2011
Notas de investigación
Inducción de IgA e IgG anti-omp48 en conejos inmunizados intragástricamente con una fracción extracelular de Aeromonas veronii
Induction of omp48-specific IgA and IgG in rabbits intragastrically immunized with an extracellular fraction of Aeromonas veronii
Eduardo Ruiz-Bustosa, Arturo Pedro Sierra-Beltránb, María de Jesús Romero-Geraldob, Felipe Ascenciob
a Universidad de Sonora, Departamento de Ciencias Químico Biológicas. Blvd. Luis Encinas y Rosales, Hermosillo, Sonora 83000, México. Tel +52(662)259-2163 erbustos@guayacan.uson.mx. Correspondencia al primer autor.
b Centro de Investigaciones Biológicas del Noroeste.
Recibido el 17 de agosto de 2010
Aceptado el 18 de enero de 2011
RESUMEN
Una proteína de membrana externa de 48 kDa (omp48) de Aeromonas veronii (A. veronii), que tiene afinidad por secreciones de la mucosa (tal como mucina, lactoferrina, inmunoglobulinas o colágeno), induce una respuesta inmune estadísticamente significativa al ser administrada intragástricamente a conejos blancos de Nueva Zelanda. Estudios posteriores mostraron una correlación positiva entre las inmunoglobulinas y la respuesta de células productoras de anticuerpo (CPA). La administración intragástrica del antígeno induce una respuesta vigorosa, tanto local como sistémica, principalmente de inmunoglobulinas A y G contra la omp48 de A. veronii. Estas se evidenciaron por la presencia de (i) células productoras de anticuerpos contra omp48 en el tracto gastrointestinal, bazo y sangre, y (ii) elevados niveles de anticuerpos circulantes. La estimulación del sistema inmune de mucosa mediante antígenos bacterianos inmunogénicos, puede ser una importante alternativa para el control y prevención de enfermedades asociadas a Aeromonas.
Palabras clave: Inmunidad de mucosas, Aeromonas veronii, Adhesinas, Proteínas de membrana externa, Vacunas.
ABSTRACT
A 48 kDa outer membrane protein (omp48) of Aeromonas veronii exhibiting affinity for mucosal secretions (mucin, lactoferrin, immunoglobulins, or collagen), induced a statistically-significant immune response when given intragastrically to white New Zealand rabbits. Further studies showed a positive correlation between immunoglobulins and antibody-producing cells (APC). Intragastric administration of the antigen induces vigorous local and systemic responses, mostly IgA and IgG against A. veronii omp48. Responses were evident by the presence of (i) APC to omp48 in the gastrointestinal tract, spleen and blood; and (ii) high levels of circulating antibodies. Stimulation of the mucosal immune system by immunogenic bacterial antigens can be a major alternative for the control and prevention of Aeromonas-associated diseases.
Key words: Mucosal immunity, Aeromonas veronii, Adhesins, Outer membrane proteins, Vaccines.
Las especies móviles de Aeromonas han sido reconocidas como patógenos de animales tanto de sangre fría como caliente, incluido el hombre(1-4). En humanos, la manifestación clínica más común es diarrea, aunque también se han descrito infecciones de heridas, septicemia, así como otras infecciones extraintestinales. Se han documentado varios reportes de infecciones gastrointestinales por Aeromonas en humanos asintomáticos, asociadas a la ingestión de agua no tratada o al consumo de alimentos marinos(5-6). Aunque se ha demostrado que algunas cepas de Aeromonas producen diversos factores de virulencia(6,7,8), la administración de Aeromonasvivas a ratones tratados con estreptomicina, aves gnotobióticas o voluntarios saludables, no indujo una diarrea significativa(9,10,11). Pese a que se han realizando ensayos en animales para probar la virulencia de cepas aisladas, ninguno resulta práctico para el estudio de los mecanismos patogénicos de diarrea o la invasión de mucosas, que pudieran ocurrir en las infecciones intestinales en humanos. Se han empleado ensayos intestinales en ratón, rata y conejos, para probar la producción de una enterotoxina producida por cepas de Aeromonas(12,13).
Pazzaglia et al(14) han desarrollado un modelo de sección removible de intestino en conejo para la evaluación de los mecanismos patogénicos de cepas de Aeromonas, sugiriendo al conejo como un modelo animal alternativo para el estudio de infecciones por Aeromonas en mamíferos e incluso para el estudio de herramientas inmunoterapéuticas e inmunoprofilácticas. Si consideramos la posibilidad de utilizar vacunas basadas en adhesinas contra infecciones por Aeromonas, es importante evaluar la extensión de la respuesta inmune tanto local como sistémica inducida por las adhesinas bacterianas, mediante la determinación de los niveles de anticuerpos y células productoras de anticuerpos de distintos isotipos posterior a la inmunización con antígenos de Aeromonas, tanto asociados a la célula como extracelulares, administrados directamente al estómago mediante intubación. Uno de tales antígenos es una proteína de 48 kDa de A. veronii (omp48) que exhibe afinidad por constituyentes de secreciones de mucosa tales como mucina, lactoferrina e inmunoglobulinas y que predominantemente es secretada por A. veronii(15).
Los objetivos del trabajo fueron determinar (i) la actividad inmunoestimulante de una fracción extracelular rica en omp48 de A. veronii, sobre el sistema inmune de mucosa en conejos como modelo experimental; (ii) evaluar adyuvantes sobre la mucosa como potenciadores de la respuesta inmune; (iii) evaluar la posible inducción de anticuerpos y células productoras de anticuerpo, local y sistémica, por la administración intragástrica del inmunógeno omp48 de A. veronii; y (iv) determinar los isotipos predominantes de inmunoglobulinas.
Para el desarrollo del presente trabajo, se empleó la cepa Aeromonas veronii biovar veronii (cepa A186), aislada de heces de un hombre con infección diarreica en el hospital de la Universidad de Lund, Suecia; esta cepa reconoce mucina, lactoferrina, colágeno e inmunoglobulinas(16,17). Para el aislamiento y purificación de la omp48 liberada al medio de cultivo, la bacteria fue cultivada a 32 °C en una botella de polipropileno de 20 L en caldo Luria Bertani con aeración constante hasta que el cultivo alcanzó la fase estacionaria (aproximadamente 30 h). Las células se removieron por centrifugación a 5,000 xg. La omp48 se aisló del sobrenadante de cultivo mediante precipitación con sulfato de amonio (60 a 80 % de saturación) y purificada por cromatografía de afinidad en una columna de Mucina-sefarosa (Pharmacia), previamente equilibrada con buffer de fosfato 0.015 M, pH 7.2, conteniendo NaCl 0.15 M. La omp48 se eluyó posteriormente con NaCl 1 M y dial izó contra bicarbonato de amonio 0.01 M. Análisis de electroforesis (SDS-PAGE) y transferencias Western del material purificado revelaron una proteína principal de 48 kDa y una proteína secundaria de 38 kDa, que también reconoce mucina marcada con peroxidasa. El material purificado por elusión pasiva de geles de poliacrilamida libre de LPS, se liofilizó y almacenó a 4 °C hasta su uso (Ascencio et al, datos no publicados).
La fracción rica en la proteína de 48 kDa (omp48) se acopló covalentemente a la subunidad B de la toxina del cólera (CTB) para incrementar la respuesta inmune tipo IgA en mucosa. La omp48 y CTB se acoplaron al N-succinimidil-(3-[2-piridil]-ditio) propionato (SPDP) en proporciones equimolares 1:30 (omp48) y 1:10 (CTB) de acuerdo a las instrucciones del fabricante (Boehringer Mannheim Biochemicals, Mannheim, Alemania). Las preparaciones se sometieron a filtración en gel para eliminar el SPDP libre, empleando columnas de Sephadex G25 (Pharmacia). El derivado de omp48 se redujo con ditiotreitol 1 mM en buffer de acetato de sodio 0.1 M-NaCl 0.1 M (pH 4.5). La preparación resultante de omp48 se incubó por 16 h a 22 °C en presencia del derivado de la CTB en proporciones equimolares, que favorece el acoplamiento entre las dos moléculas ( ~ 90 % de acoplamiento). Posteriormente a la incubación, la mezcla fue dializada contra PBS. El conjugado resultante omp48-CTB se evaluó tanto por su capacidad de reconocimiento del gangliósido GM1 como por la actividad de unión a inmunoglobulinas, lactoferrina, mucina y colágeno. Estas actividades se evaluaron mediante ELISA empleando GM1 como sistema de captura de la fase sólida, así como inmunoglobulinas, lactoferrina, mucina y colágeno marcados con peroxidasa (POD), como sondas. Otras preparaciones evaluadas fueron (i) una mezcla de omp48, covalentemente acoplada a la CTB y CTB libre (omp48-CTB + CTB); (ii) una mezcla de omp48, covalentemente acoplada a la CTB y toxina del cólera (CT) libre, (omp48-CTB + CT); (iii) una mezcla de omp48, covalentemente acoplada a albúmina sérica bovina, y CT libre (omp48-BSA + CT); (iv) una mezcla de omp48 y CT, y (v) omp48 sola. Como testigo también se incluyó un grupo de animales que recibieron solamente buffer de bicarbonato de sodio; así mismo grupos testigo con CT y/o CTB solamente, cuyas lecturas fueron sustraídas de las obtenidas de las preparaciones correspondientes.
Para cada preparado de inmunógeno se emplearon grupos de 10 conejos hembras, cepa Nueva Zelanda de dos meses de edad con un peso promedio de 2.3 ± 0.4 Kg. Estos fueron inmunizados con las preparaciones de los inmunógenos de A. veronii-omp48 diluidas en NaHCO3 0.35 M, a una concentración final de 150 μg/ml. Los grupos de prueba, recibieron intragástricamente, 150 μg por animal, realizándose las inmunizaciones a los días 0, 10 y 20. Diez días después de cada inmunización, 10 conejos inmunizados con cada inmunógeno y 10 conejos no inmunizados se sacrificaron y se tomaron muestras de sangre, intestino delgado y bazo, para cuantificar el número de células productoras de anticuerpo (CPA) específicas y no específicas mediante una técnica de inmunoabsorción antigénica acoplado a enzimas (ELISPOT). Paralelamente, muestras de suero, bilis y moco intestinal se recolectaron y se determinaron, por ELISA, los niveles de anticuerpos (IgG, IgM, IgA e inmunoglobulinas secretorias) contra omp48. Los animales fueron sedados con cloroformo y sacrificados mediante dislocación cervical. Mediante disección abdominal se obtuvo la bilis de la vesícula biliar con una aguja número 27, colocándose inmediatamente en hielo y procesada. Así mismo se removieron quirúrgicamente segmentos de 10 cm del duodeno y lavados interiormente con 10 ml de PBS frío. El segmento intestinal fue abierto longitudinalmente y se removió el moco utilizando un raspador de células. Los linfocitos intestinales fueron aislados por disgregación enzimática con dispasa(18), mientras que los linfocitos de sangre periférica se aislaron por centrifugación con gradiente isopicnico estándar en Histopaque 1177 (Sigma Co., St. Louis MO) como se establece por el fabricante. Las células aisladas fueron lavadas, y suspendidas en medio de Iscove suplementado con suero fetal de bovino 5 % (medio completo). Las suspensiones celulares también fueron obtenidas del bazo mediante ruptura suave del tejido a través de una malla de acero estéril y purificadas como se ha descrito previamente(18). La viabilidad celular, determinada por exclusión con azul de tripano, fue del 80 al 90 % para el bazo, células linfoides intestinales y linfocitos periféricos. Las células productoras de anticuerpo se cuantificaron por ELISPOT(19). Los pozos de las microplacas de ELISA se recubrieron con omp48 (10 μg en 100 μl por pozo) y bloqueados con albúmina sérica bovina (BSA) al 3% en PBS. Las proteínas no adsorbidas fueron removidas con tres lavados con PBS que contenía Tween-20 0.1 % v/v, se añadieron 200 μl de medio completo a los pozos e incubados a 37 °C por 30 min. Los contenidos de los pozos fueron reemplazados con 100 μl de medio completo que contenía cantidades distintas de células linfoides. Para cada determinación se utilizaron tres repeticiones, analizándose por triplicado cada una de ellas. Después de lavar con PBS-Tween 20, se añadieron 100 μl de PBS-Tween 20 que contenía FCS 1% y anticuerpos porcinos contra IgA, IgG e IgM de conejo, conjugados con fosfatasa alcalina (FA). Las placas se incubaron por 90 min a 37 °C. Después de lavar con PBS-Tween, 100 μl de una solución de 5-bromo-4-cloro-3-indolilfosfato p-toluidina (0.15 mg/ml) se agregaron a cada pozo, e incubados por 20 min a 22 °C. Después de este tiempo, los pozos se lavaron con agua, y después de secarlos se examinaron por microscopía de bajo aumento (40x) para determinar la presencia de manchas azules. Por otro lado, las secreciones de la mucosa intestinal de los conejos sacrificados se recolectaron mediante procedimientos estándares. El moco, diluido 1:5 con buffer TRIS 0.1 M conteniendo fluoruro de fenilmetilsulfonilo (PMSF) 10 mM, se centrifugó para remover la materia particulada, y se cuantificaron las inmunoglobulinas secretadas, como se describe a continuación: las microplacas de ELISA de polivinilo de 96 pozos se cubrieron con omp48 (10 μl en 100 μl por pozo) y bloqueados con BSA 3% en PBS. Posteriormente se agregaron, por triplicado, 100 μlde secreciones de mucosa, así como de bilis y suero (1:5 con buffer TRIS 0.1 M) y se incubaron a 37 °C por 90 min. Después de lavar, se agregaron los anticuerpos porcinos anti-IgG, IgM e IgA de conejo, conjugados a fosfatasa alcalina, incubando las placas a 37 °C por 90 min. Después de lavar, se agregaron a cada pozo 100 μlde una solución (1 mg/ml) del sustrato p-nitrofenil fosfato en buffer dietanolamina al 10 %, y las placas se leyeron a 405 nm después de incubar a 22 °C por 20 min. Los niveles de anticuerpos son expresados como unidades de densidad óptica (a 405 nm) por factor de dilución. Los resultados se expresan como los promedios ± errores estándar. Las diferencias entre los grupos se evaluaron empleando la prueba t de Student de dos colas. Las diferencias en las variaciones entre organismos inmunizados y sus correspondientes no inmunizados se evaluaron por la prueba F. Las diferencias entre todos los grupos fueron comparados con la prueba multifactorial ANOVA(18,19). Las mediciones entre los grupos inmunizados fueron consideradas significativas a una probabilidad de P<0.01.
La inoculación con los diferentes preparados de omp48, indujo una respuesta inmune y, como se esperaba, los animales testigos no mostraron respuesta (Figura 1). Dentro de los grupos experimentales, no se observó diferencia alguna en la respuesta por IgA después de las dos primeras inmunizaciones. Por otro lado, al final del período de inmunización, se pudo detectar una respuesta significativa (P<0.01) en el nivel de IgA en mucosa con el inmunógeno omp48 + CT (Figura 1 IgA, panel F). Respecto a la respuesta por IgA en bilis, el titulo de anticuerpos fue significativamente mayor al observado en la mucosa, incluyendo la producción de anticuerpos del isotipo IgG. Como en el primer caso, no se detectó diferencia significativa entre los inmunógenos probados.
El perfil de las células productoras de anticuerpos (CPA) demostró una tendencia distinta (Figura 2). Aunque la respuesta a la inmunización inicial fue similar entre los inmunógenos evaluados, después de la segunda inmunización las cuentas fueron significativamente superiores en los conejos inmunizados, en comparación con el grupo testigo. La administración intragástrica del inmunógeno omp48-CTB indujo un incremento en las cuentas de CPA que fue significativamente superior al resto de los inmunógenos a partir de la segunda inmunización con el mismo inmunógeno, tanto para IgG como IgA en mucosa; sin embargo, la respuesta de IgG inducida a los 30 días por omp48 y omp48 + CT fue superior a la inducida por omp48-CTB. Al emplear las distintas preparaciones de los inmunógenos, la respuesta inmune primaria, como se reveló por los resultados de ELISA, fue significativa (P<0.01) al compararla con el grupo testigo; sin embargo, los resultados de ELISPOT mostraron incremento similar al del grupo testigo (Figura 2). Después del primer refuerzo, los niveles de anticuerpos disminuyeron significativamente al compararse con los de la primera respuesta, pero la estimulación de las CPA alcanzó su valor más elevado, que fue significativamente influida por el inmunógeno omp48-CTB, estimulando la generación de CPA en la mucosa intestinal. El segundo refuerzo resultó en un número de CPA similar para todos los inmunógenos probados al compararse con la respuesta inicial, con mayores cuentas de células productoras de IgA en bazo.
Los títulos de anticuerpos fueron, de nuevo, significativamente distintos (Figura 1), siendo la IgG sérica la más predominante en comparación con el grupo testigo. La respuesta principal fue observada en las inmunoglobulinas séricas, determinadas por ELISA (Figura 3). Los análisis por ELISPOT de los distintos tejidos también mostraron una elevación del número de células productoras de anticuerpo (Figura 2). Posterior al primer refuerzo, hubo una elevación significativa (P<0.01) de las células productoras de IgG en suero, demostrando una fuerte afinidad hacia la omp48, que se mantuvo a lo largo del esquema de inmunización con el inmunógeno omp48-CTB. El principal isotipo de inmunoglobulina inducido por el protocolo de inmunización fue la IgG encontrada en el suero de conejos inmunizados (Figura 3). Después de la primera inmunización, este incremento fue similar en todas las preparaciones, todas ellas significativamente diferentes al grupo testigo. El isotipo IgA también se incrementó significativamente en el suero, y también fue mayor en bilis y secreciones de mucosas al compararse con el testigo (Figura 1). De igual forma, se incrementaron significativamente las cuentas de CPA, principalmente del isotipo IgG (Figuras 2, 3). También se afectaron de forma positiva por la inmunización las cuentas de células productoras de IgA. Hacia el final del protocolo de inmunización, también se observó un incremento en la respuesta del isotipo IgG como la principal inmunoglobulina estimulada, principalmente a nivel de suero (Figura 3), e igualmente la respuesta en bilis y moco se incrementó significativamente (Figura 1). La IgA se encontró afectada de forma similar por las diferentes preparaciones en todos los tejidos estudiados; y respecto a la IgG, el nivel más alto se encontró en el suero de los conejos inmunizados.
La respuesta inmune inducida por la administración de omp48-CTB indujo una producción de anticuerpo, observada por la correlación de los anticuerpos tejido-específicos (P<0.05, r>0.9). Por ejemplo, después de la primera inmunización, existe correlación positiva entre las células productoras de IgA intestinal, y los títulos de IgA e IgG en moco (Cuadro 1), respuestas que pueden ser de mucho beneficio para el huésped, fortaleciendo de esta forma, la respuesta inmune a nivel de mucosa, sitio de colonización por A. veronii. Algo interesante de resaltar fue que se encontró una correlación negativa entre las células productoras de IgA intestinal y los títulos de IgA sérico.
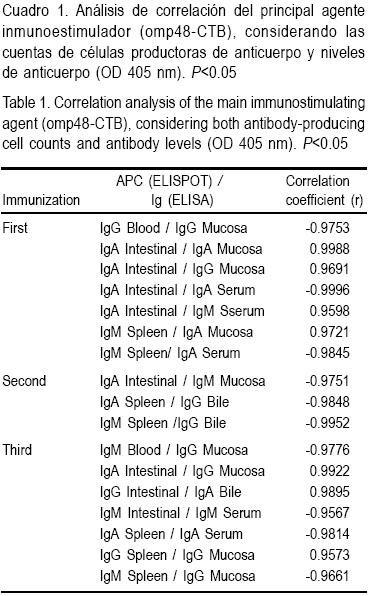
Con el primer refuerzo, el efecto del inmunógeno sobre la interacción entre las CPA y las respuestas de anticuerpo secretor disminuyó y no se observó un impacto significativo. Después del segundo refuerzo, aparecieron interacciones entre el número de células productoras de IgA e IgG de moco (r = 0.9922), así como entre las células productoras de IgG intestinal e IgA biliar (r= 0.9895). Estas respuestas pueden conferir protección del huésped contra la presencia de omp48, y, por lo tanto, actuar contra infecciones asociadas a A. veronii. La presencia de CPA de los isotipos IgA e IgG en el bazo de animales inmunizados, pudieran también conferir la habilidad de reaccionar contra futuras exposiciones a este patógeno.
Aun cuando la inducción de una respuesta inmune sistémica es útil en la prevención o limitación de manifestaciones extraintestinales de infecciones por Aeromonas, la generación de una respuesta inmune efectiva a nivel de mucosas en la superficie intestinal pudiera ser crucial para prevenir la adhesión bacteriana y posiblemente limitar o impedir las infecciones por Aeromonas tanto intestinales como extraintestinales.
Este estudio demostró que se puede inducir una inmunoestimulación significativa mediante la administración intragástrica de omp48 de A. veronii. La administración intragástrica de pequeñas cantidades (150 μg) de omp48 induce la producción de anticuerpos IgA, IgG e IgM específicos en mucosas, en bilis y sistémicos de conejos. Los conejos inmunizados intragástricamente con 150 Hg de omp48 produjeron un elevado número de células productoras de anticuerpos específicas a omp48 en el tejido intestinal al compararse con animales no inmunizados. El mismo tipo de análisis en sangre y linfocitos de bazo mostró resultados similares en cuanto a la distribución de isotipos de anticuerpos anti-omp48; sin embargo, el número de células productoras de anticuerpo en la mucosa fue mayor. El análisis por ELISA de suero, bilis y moco intestinal obtenidos de conejos inmunizados intragástricamente indicó niveles elevados de IgA e IgG circulantes, pero no de IgM específicos contra omp48.
Después de la primera inmunización, los inmunógenos formados por los complejos omp48-CTB y omp48-CTB + CTB estimularon niveles significativamente elevados de IgG e IgA específicos a omp48 en suero y, en un nivel menor, en bilis y moco intestinal, al compararse con la inmunización con omp48 solo. Estos niveles de anticuerpos séricos inducidos por los inmunógenos complejos pueden proporcionar una segunda línea de defensa contra infecciones por la familia Vibrionaceae que hubieran atravesado la barrera de la mucosa intestinal(9,19). Por otro lado, se pudo observar una respuesta general significativa en conejos intragástricamente inmunizados con el inmunógeno omp48-CT, sin embargo la administración de tal adyuvante ha sido relacionada anteriormente con daño tisular y procesos necróticos(20), razón por la cual no se considera como candidato.
Al parecer ocurrieron cinéticas homólogas de la respuesta inmune en suero y secreciones intestinales. Las respuestas de IgA anti-omp48 en bilis, moco intestinal y suero se hacen evidentes después de 10 días posteriores a la primera inmunización intragástrica. Las respuestas de anticuerpo IgG anti-omp48 no aparecieron en suero con la primera inmunización, alcanzando niveles elevados después del tercer refuerzo manteniéndose más elevados que los anticuerpos IgA anti-omp48.
Se han estudiado ampliamente los mecanismos para la inducción de respuestas IgA intestinales asociadas a inmunizaciones intragástricas(20,21,22). Por lo general, la estimulación de los tejidos linfoides de las mucosas (por ejemplo células M cubiertas de folículos linfoides) puede resultar en la diseminación y reclutamiento de células linfoides a remotos sitios efectores en mucosas. Sin embargo, se observan las diferencias en la respuesta inmune de mucosa dependiendo del antígeno, adyuvante, y la especie animal. Prueba del origen de los anticuerpos anti-omp48 en suero y el tracto gastrointestinal fue proporcionada por los análisis ELISPOT. Por ejemplo, sólo se encontraron CPA del tipo IgA contra omp48 en el intestino de un conejo al que se le dio intragástricamente omp48. La presencia de números elevados de IgG anti-omp48, después del primer refuerzo, en el bazo de conejos intragástricamente inmunizados con omp48-CTB y omp48-CTB + CTB apoyaron más la hipótesis de que los anticuerpos de IgG séricos son derivados del tejido linfoide periférico, como lo es el bazo. Respuestas inmunológicas similares han sido reportadas en ratones intragástricamente inmunizados con el toxoide tetánico, con la toxina del cólera como adyuvante(18). Debido a que la expresión de adhesinas extracelulares con afinidad hacia mucinas u otros constituyentes de mucosas es una propiedad común en especies de Aeromonas y otras Vibrionaceae(23), estamos ahora evaluando si las respuestas inmunes inducidas por la estrategia de inmunización descrita en este artículo protege contra infecciones de A. veronii y otras Vibrionaceae, en mamíferos, tal como lo hemos realizado en peces experimental mente infectados, encontrando no sólo una respuesta inmune significativa, sino una acción protectora de la respuesta inducida en peces, contra infecciones experimentales con Aeromonas(24).
Por todo lo anterior podemos concluir que la administración intragástrica de microgramos del antígeno induce una respuesta vigorosa, tanto local como sistémica de inmunoglobulinas A, G y M contra la omp48 de A. veronii con base en (i) el número de células productoras de anticuerpo en el tracto gastrointestinal, bazo y sangre, y (ii) elevados niveles de anticuerpos circulantes. La estimulación del sistema inmune de mucosa mediante antígenos bacterianos inmunogénicos, puede ser una importante alternativa para el control y prevención de enfermedades asociadas a Aeromonas.
AGRADECIMIENTOS
Este trabajo fue apoyado por Consejo Nacional de Ciencia y Tecnología, CONACyT (39510A/1), la Fundación Internacional de Ciencias, IFS (A/2125), y el Centro de Investigaciones Biológicas (PAC-11). Agradecemos al Dr. Juan Carlos Gálvez Ruiz por la edición del escrito. ERB fue receptor de una beca por parte de CONACyT (59291).
LITERATURA CITADA
1. Dumontet S, Pasquale V, Mancino M, Normanno G, Krovacek K. Incidence and characterization of Aeromonas spp in environmental and human samples in southern Italy. New Microbiol 2003;26:215-225. [ Links ]
2. Janda JM, Abbott SL. Evolving concepts regarding the genus Aeromonas: an expanding panorama of species, disease presentations, and unanswered questions. Clin Infect Dis 1998;19:77-83. [ Links ]
3. Pasquale V, Baloda SB, Dumontet S, Krovacek K. An outbreak of Aeromonas hydrophila infection in turtles (Pseudemis scripta). Appl Environ Microbiol 1994;60:1678-1680. [ Links ]
4. Rahman M, Colque-Navarro P, Jun I, Huys G, Swings J, Mollby R. Identification and characterization of pathogenic Aeromonas veronii biovar sobria asociated with epizootic ulcerative síndrome in fish in Bangladesh. Appl Environ Microbiol 2002;68:650-655. [ Links ]
5. Altwegg M, Martinetti Luccini G, Lüthy-Hottenstein J, Rohrback M. Aeromonas-associated gastroenteritis after consumption of contaminated shrimp. Eur J Clin Microbiol Infec Dis 1991;10:44-45. [ Links ]
6. Gracey M, Burke V. Characteristics of Aeromonas species and their association with human diarrheal diseases. J Diarrhoeal Dis Res 1986;4:70-73. [ Links ]
7. Gonzalez-Serrano CJ, Santos JA, Garcia-Lopez ML, Otero A. Virulence markers in Aeromonas hydrophila and Aeromonas veronii biovar sobria isolates from freshwater fish and from a diarrhoea case. J Appl Microbiol 2002;93:414-419. [ Links ]
8. Guimaraes MS, Andrade JR, Freitas-Almeida AC, Ferreira MC. Aeromonas hydrophila vacuolating activity in the Caco-2 human enterocyte cell line as a putative virulence factor. FEMS Microbiol Let 2002;207:127-131. [ Links ]
9. Merino S, Rubires X, Aguillar A, Guillot JF, Tomas JM. The role of the O-antigen lipopolysaccharide on the colonization in vivo of the germfree chicken gut by Aeromonas hydrophila serogroup O:34. Microb Patog 1996;20:325-333. [ Links ]
10. Morgan DR, Jonson PC, Dupont HL, Satterwhite K, Wood LV. Lack of correlation between known virulence properties of Aeromonas hydrophila and enteropathogenicity for humans. Infect Immun 1985;50:62-65. [ Links ]
11. Sanderson K, Ghazali FM, Kirov SM. Colonization of streptomycin-treated mice by Aeromonas species. J Diarrhoeal Dis Res 1996;14:27-32. [ Links ]
12. Burke V, Robinson J, Berry RJ, Gracey M. Detection of enterotoxins of Aeromonas hydrophila by a suckling mouse test. J Med Microbiol 1981;14:401-408. [ Links ]
13. Ljung Å, Kronevi T. Aeromonas hydrophila toxins- intestinal fluid accumulation and mucosal injury in animal models. Toxicon 1982;20:397-407. [ Links ]
14. Pazzaglia G, Sack RB, Bourgeois AL, Froehlich J, Eckstein J. Diarrhea and intestinal invasiveness of Aeromonas strains in the removable intestinal tie rabbit model. Infect Immun 1990;58:1924-1931. [ Links ]
15. Vazquez-Juarez RC, Barrera-Saldana HA, Hernandez-Saavedra NY, Gomez-Chiarry M, Ascencio F. Molecular cloning, sequencing, and characterization of omp48, the gene encoding for an antigenic outer membrane protein from Aeromonas veronii. J Appl Microbiol 2003;94:908-918. [ Links ]
16. Ascencio F, Aleljung P, Wadström T. Particle agglutination assay to identify fibronectin and collagen cell surface receptors and lectins in Aeromonas and Vibrio species. Appl Environ Microbiol 1990;56:1926-1931. [ Links ]
17. Ascencio F, Ljung Å, Wadström T. Characterization of lactoferrin binding by Aeromonas hydrophila. Appl Environ Microbiol 1992;58:42-47. [ Links ]
18. Jackson RJ, Fujihashi K, Xu-Amano J, Kiyono H, Elson CO, McGhee JR. Optimizing oral vaccines: Induction of systemic and mucosal B-cell and antibody responses to tetanus toxoid by use of cholera toxin as an adjuvant. Infect Immun 1993;61:4272-4279. [ Links ]
19. Czerkinsky C, Russell MW, Licke N., Lindbald M, Holmgren J. Oral administration of a streptococcal antigen coupled to cholera toxin B subunit evokes b antibody responses in salivary gland and extramucosal tissues. Infect Immun 1989;57:1072-1077. [ Links ]
20. Lycke N, Holmgren J. Strong adjuvant properties of cholera toxin on gut mucosal immune responses to orally presented antigens. Immunology 1986;59:301-308. [ Links ]
21. Hathaway LJ, Kraehenbuhl JP. The role of M cells in mucosal immunity. Cell Mol Life Sci 2000;57:323-332. [ Links ]
22. Van Ginkel FW, Nguyen HH, McGhee JR. Vaccines for mucosal immunity to combat emergin infectious diseases. Emerg Infect Dis 2000;6:123-132. [ Links ]
23. Ascencio F, Martinez-Arias W, Romero MJ, Wadström T. Analysis of the interaction of Aeromonas caviae, A. hydrophila and A. sobria with mucins. FEMS Immunol Med Microbiol 1998;20:219-229. [ Links ]
24. Merino-Contreras ML, Guzman-Murillo MA, Ruiz-Bustos E, Romero MJ, Cadena-Roa MA, Ascencio F. Mucosal immune response of spotted sand bass Paralabrax maculatofasciatus (Steindachner, 1868) orally immunised with an extracellular lectin of Aeromonas veronii. Fish Shellfish Immunol 2001;11:115-126. [ Links ]














