Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.2 no.3 Mérida jul./sep. 2011
Artículos
Transmisión de cepas atenuadas de Babesia bigemina y Babesia bovis por garrapatas Rhipicephalus (Boophilus) microplus
Transmissibility of Babesia bigemina and Babesia bovis attenuated strains by Rhipicephalus (Boophilus) microplus ticks
Edmundo Enrique Rojas Ramíreza, Juan Joel Mosqueda Gualitob, Jesús Antonio Álvarez Martíneza, Rubén Hernández Ortíza, Juan Alberto Ramos Aragóna, Carmen Rojas Martíneza, Germinal J. Cantó Alarcónb, Carlos Agustín Vega y Murguíaa, Julio Vicente Figueroa Millána
a Centro Nacional de Investigación Disciplinaria en Parasitología Veterinaria, INIFAP. Jiutepec, Mor., Apartado Postal 206 CIVAC, Morelos, 62500. Tel: 777/3192850 ext. 139. figueroa.julio@inifap.gob.mx. Correspondencia al último autor.
b Universidad Autónoma de Querétaro. Campus juriquilla.
Recibido el 3 de diciembre de 2009
Aceptado el 25 de enero de 2011
RESUMEN
Para evaluar la transmisión por garrapatas Rhipicephalus microplus (R. microplus) de una clona atenuada de Babesia bovis (BOR) y una cepa atenuada de Babesia bigemina (BIS), doce bovinos se dividieron en cuatro grupos e infestados de forma escalonada con larvas de R. microplus libres de Babesia spp. Un becerro de cada grupo se inoculó con 1x108 eritrocitos infectados (EI) con BIS, BOR, y cepas virulentas de B. bigemina y B. bovis, respectivamente. Se realizaron dos inoculaciones seriadas adicionales (pases/jeringa) y se colectaron hembras R. microplus cuya repleción coincidió con presencia de EI en los bovinos inoculados, y cuya progenie fue utilizada para infestar un grupo de bovinos receptores (pases/garrapata). Los tres pases sucesivos por jeringa evidenciaron EI en los bovinos que recibieron las cepas atenuadas y virulentas de B. bigemina y B. bovis. Se identificaron quinetos de Babesia en garrapatas alimentadas sobre bovinos infectados con cepas virulentas de B. bigemina y B. bovis. No se identificaron quinetos en garrapatas alimentadas sobre bovinos inoculados con cepas atenuadas. Todos los receptores infestados con progenie de garrapatas alimentadas sobre bovinos infectados con cepas virulentas, resultaron positivos a Babesia. Contrariamente, los receptores de garrapatas derivadas de bovinos inoculados con cepas atenuadas resultaron negativos, excepto por los infestados con garrapatas derivadas del tercer pase realizado con BIS y BOR. Las cepas atenuadas podrían conferir un margen de seguridad mayor como inmunógenos, al no ser transmitidas por R. microplus y no revertir a la virulencia al menos después de dos pases sucesivos en bovinos.
Palabras clave: Babesia bigemina, Babesia bovis, Rhipicephalus (Boophilus) microplus, Transmisión, Virulencia.
ABSTRACT
To assess transmissibility of attenuated Babesia bigemina (BIS) and Babesia bovis (BOR) strains by Rhipicephalus microplus (R. microplus), 12 steers from a tick-free area were divided in four groups and infested at different intervals with R. microplus larvae. One animal from each group was inoculated with 1x108 infected erythrocytes (IE) of attenuated BIS, BOR, virulent B. bigemina, or B. bovis field strains. Two additional serial passages were performed (syringe passages), and engorged female ticks were collected coincident with presence of IE in blood of infected steers. The offspring larvae were utilized to feed upon an additional group of recipient steers (tick passages). All needle passages were successful for inducing infection in steers that received both, the attenuated and field strains. Kinetes were detected in hemolymph of engorged female ticks fed on steers infected with virulent B. bigemina and B. bovis field strains. However, kinetes were not detected in hemolymph samples from ticks collected from the steers inoculated with the attenuated strains. All recipient steers infested with larvae from ticks that fed on steers infected with virulent strains became Babesia positive. By contrast, steers infested with larvae from ticks that fed on animals inoculated with attenuated strains were negative, except for the recipient steer receiving larvae from the third syringe passage of BIS and BOR. These strains could be safer to use as live immunogens in animals, as their virulence and ability to be transmitted by the tick is impaired at least after two blood passages in cattle.
Key words: Babesia bigemina, Babesia bovis, Rhipicephalus (Boophilus) microplus, Transmissibility, Virulence.
INTRODUCCION
La babesiosis bovina causada por B. bovis y B. bigemina se encuentra distribuida en áreas tropicales y subtropicales del mundo, y es considerada como una de las enfermedades más importantes transmitidas por garrapatas R. microplus y R. annulatus(1). Para el control de la babesiosis, se han recomendado diferentes procedimientos que incluyen: inmunización, quimioterapia, control de desplazamiento del ganado de áreas infectadas y control del vector(2). Se han descrito diferentes métodos para disminuir la virulencia de las especies patógenas en bovinos, tales como la realización de pases rápidos por inoculación parenteral en becerros esplenectomizados(3), pases lentos por inoculación parenteral en becerros intactos(4), la irradiación del parásito(5,6) y la atenuación del parásito por mantenimiento continuo en cultivo in vitro(7,8).
Trabajos previos de investigación en México han permitido demostrar que se cuenta con una cepa de B. bigemina (denominada "BIS") atenuada por pases en cultivo continuo en condiciones in vitro(9), que se ha comportado como población atenuada al no afectar en forma importante los valores hematológicos en animales inoculados(8). Al ser utilizada como vacuna ha inducido protección al desafío heterólogo con sangre infectada, así como por garrapatas infectadas en condiciones controladas y en condiciones de campo(10,11,12). Por otro lado, la irradiación reduce la virulencia sin afectar la capacidad inmunogénica de las cepas vacunales por la eliminación de la mayoría de la población de patógenos; de este modo se selecciona por parásitos de baja virulencia pero con una alta capacidad inmunogénica(6,13). De igual forma, una clona de Babesia bovis irradiada (denominada "BOR") y cultivada in vitro(14) se ha utilizado como componente de una vacuna viva en ganado susceptible, y ha demostrado capacidad protectora cuando los animales son desafiados con cepas virulentas(15,16), contando además con la gran ventaja conferida por su producción in vitro: un bajo riesgo de contaminación con otros agentes infecciosos(17); es una suspensión de glóbulos rojos altamente parasitada, y ofrece la posibilidad de producción de la vacuna de B. bovis en países que disponen con una adecuada infraestructura de laboratorio(1,17). Sin embargo, a la fecha se desconoce si el continuo paso de ganado a ganado revierte la clona irradiada para ser transmitida de nuevo por garrapatas.
Se ha descrito que los animales vacunados con organismos vivos permanecen como portadores, lo que conduce a la aparición de casos clínicos, debido a la reversión a la virulencia de las cepas cuando ellas son pasadas a través de animales intactos o cuando son transmitidos por garrapatas(18). Las cepas vacunales han sido desarrolladas para conferir una adecuada protección sin ser transmitidas por garrapatas, un rasgo considerado ecológicamente deseable, ya que previene la aparición de casos clínicos debido a la transmisión de la cepa vacunal por garrapatas(19). Sin embargo, esta capacidad solamente ha sido demostrada después de un pase en ganado susceptible(8,18-20).
El objetivo de este estudio fue evaluar si las cepas vacunales BIS y BOR son transmitidas por garrapatas después de tres pases en bovinos susceptibles, y determinar si existe reversión a la virulencia de estas cepas después de los pases sucesivos por bovinos sin su regreso al cultivo in vitro de donde se originaron.
MATERIALES Y MÉTODOS
Experimento 1
La cepa inmunizante de B. bigemina denominada BIS es originaria de México, fue obtenida de un caso clínico mediante aislamiento, adaptación y propagación continua en cultivo in vitro(9). Desde entonces, se ha mantenido alternadamente, ya sea en cultivo in vitro o en nitrógeno líquido como estabilizado criopreservado(16,21). Esta cepa ha sido evaluada como vacuna viva atenuada en estudios previos(10,11,12) y presentó un comportamiento semejante al descrito para cepas atenuadas. La cepa virulenta de B. bigemina (C) fue donada por el Dr. Lucious Chieves (USD-APH1S-NVSL, Ames, lowa, EE.UU.). Inicialmente fue aislada de un caso clínico y ha sido mantenida por pases a través de ganado susceptible, garrapatas y nitrógeno líquido(10,11). Se utilizó una colonia de garrapatas R. microplus libre de Babesia spp., mantenida in vitro y en animales en condiciones controladas(8).
Once bovinos Bos taurus de 1 año de edad, procedentes de una zona libre de garrapatas y sin respuesta inmunológica contra Babesia spp por la prueba de Inmunofluorescencia indirecta (IFI), se utilizaron como sigue: un animal se usó para la reactivación de la cepa virulenta de campo de B. bigemina, los otros animales se dividieron al azar en dos grupos, un grupo de seis bovinos para el experimento con la cepa BIS y los restantes para el experimento con la cepa de B. bigemina de campo virulenta (Grupo testigo). Los animales que recibieron la inoculación de la cepa BIS fueron designados A1, A2 y A3 (tres pases consecutivos por sub-inoculación vía intramuscular con jeringa); mientras que los bovinos B1, B2 y B3 recibieron las larvas de R. microplus procedentes de hembras repletas alimentadas en los bovinos A1, A2 y A3, respectivamente. Los bovinos del grupo testigo (C1, C2 y C3) se inocularon por vía intramuscular con jeringa con eritrocitos infectados (EI) con cepa de campo de B. bigemina, mientras que el bovino D1 recibió las larvas de R. microplus procedentes de hembras repletas alimentadas en el bovino C1 (Figura 1). El bovino A1 se inoculó con 1x108 EI infectados con cepa BIS, y una vez que resultó positivo a B. bigemina mediante examen microscópico de frotis teñido con colorante de Giemsa, se tomó sangre de éste y se realizó el segundo pase inoculando al bovino A2. El tercer pase se realizó cuando el bovino A2 resultó positivo a la infección mediante sub-inoculación del bovino A3 (Figura 1). Todos los pases se realizaron durante la fase de parasitemia y a una dosis equivalente a 1x108 EI. Los bovinos A1, A2, A3 y C1 fueron infestados, en cinco ocasiones, con 4,000 larvas de R. microplus libres de infección por Babesia spp los días -14, -12, -10, -8 y -6 (con respecto a la inoculación con EI, considerado como día 0). Una vez transcurrido el período de alimentación en el bovino (21 días), las garrapatas hembra repletas se limpiaron y colocaron en cajas individuales y se incubaron en una estufa a 27 °C con 85 % de humedad relativa. Diariamente y durante ocho días se realizó la prueba de hemolinfa y se procedió a realizar la observación de quinetos por microscopía.

Se seleccionaron las hembras repletas de R. microplus colectadas de los bovinos A1, A2, A3 y C1 que resultaron positivos a quinetos de Babesia en la prueba de hemolinfa(22). Cuando no se pudieron detectar como positivas por esta prueba, se seleccionaron las que se desprendieron naturalmente de los animales en días coincidentes con la presencia de EI con B. bigemina detectables en el bovino. Los animales B1, B2, B3 y D1 fueron infestados en una sola ocasión con 20,000 larvas, progenie de las garrapatas hembras seleccionadas de los animales A1, A2, A3 y C1, respectivamente.
El monitoreo de infección en los bovinos inoculados con EI o infestados con larvas de R. microplus se realizó mediante la determinación de temperatura rectal (TR), y la colección de sangre para elaboración de frotis sanguíneos a teñirse con colorante de Giemsa y observación al microscopio compuesto, así como para la determinación del volumen celular aglomerado (VCA). Muestras de sangre procedentes de los animales utilizados en el experimento de transmisión de la cepa atenuada de B. bigemina se criopreservaron en nitrógeno liquido a -196 °C(21) y procesadas posteriormente mediante la amplificación de ADN por la prueba de PCR anidada, procedimiento que permite obtener un amplicón de 172 pares de bases, esencialmente como se describió previamente(23), utilizando los oligonucleótidos específicos para B. bigemina(24), y los cuales alinean con secuencias de un gen ortólogo de VESA-1 (Antígeno Variable de la Superficie del Eritrocito, por sus siglas en inglés) de B. bovis (datos no publicados)
Experimento 2
La clona irradiada de B. bovis (BOR) fue obtenida de la cepa KBb(21). La cepa original es nativa de México, aislada de un caso clínico y adaptada al cultivo in vitro(7). Fue clonada por dilución crítica e irradiada en una fuente de Co60 a 187 Grays(14). Desde entonces, se ha mantenido alternadamente ya sea en cultivo in vitro o en nitrógeno líquido como estabilizado criopreservado(15). La cepa virulenta (V) fue igualmente donada por el Dr. Lucious Chieves; inicialmente fue aislada de un caso clínico y ha sido mantenida por pases a través de ganado susceptible, garrapatas y nitrógeno líquido(15). Se utilizó una colonia de garrapatas R. microplus libres de Babesia spp. La colonia se reproduce continuamente en el laboratorio de acuerdo a metodología previamente descrita(8). Se emplearon 12 bovinos B. taurus de 18 meses de edad procedentes de una zona libre de garrapatas y libres de anticuerpos contra Babesia spp mediante la prueba de IFI, los cuales fueron alojados en corrales en confinamiento y fueron alimentados ad libitum. Se formaron dos grupos de seis animales. Los seis bovinos de cada grupo fueron denominados con números del uno al seis precedido por la letra mayúscula de la cepa usada.
Los animales B1 y V1 fueron inoculados al día cero con 1x108 EI con una de las dos poblaciones de parásitos; el bovino B1 fue inoculado con la clona BOR, mientras que el bovino V1 fue inoculado con sangre infectada con la cepa virulenta de B. bovis. Estas inoculaciones correspondieron al primer pase a través de bovino susceptible intacto. Una vez que los bovinos B1 y V1 se detectaron positivos a B. bovis por la observación de laminillas de frotis sanguíneos teñidos con colorante Giemsa, los animales se sangraron y el segundo pase se realizó mediante la inoculación de sangre a los animales B2 y V2. El tercer pase se llevó a cabo cuando la sangre de estos bovinos mostró EI y se inoculó a los bovinos B3 y V3, respectivamente. Todos los pases fueron realizados durante el pico de parasitemia a una dosis equivalente a 1x108 EI (Figura 2). Los animales (pase 1) B1, y V1, se infestaron en cinco ocasiones, con 4,000 larvas R. microplus libres de Babesia spp los días -7, -5, -3, -1 y 3; los animales B2 y V2 se infestaron los días 0, 2, 4, 6, 8 y 10; mientras que los B3 y V3 se infestaron los días 7, 9, 11, 13, 15 y 17; considerando el día cero como el día en el cual los novillos B1 y V1 fueron primeramente inoculados. Se seleccionaron hembras repletas de R. microplus alimentadas en los animales 1, 2 y 3 (pases 1 al 3, respectivamente) que resultaron positivos al microscopio a la prueba de hemolinfa(22), o que se desprendieron naturalmente de los animales en días coincidentes con parasitemia detectables en el bovino. Las hembras repletas se limpiaron y se colocaron en cajas individuales y se incubaron en una estufa a 27 °C, 30 % de humedad relativa para permitir su ovoposición. Después de la incubación, la progenie procedente de cada hembra se utilizó para infestar a los bovinos 4, 5 y 6 en el orden siguiente: la progenie de garrapatas desprendidas de los animales B1 y V1, se colocaron en los novillos B4 y V4, respectivamente; Las larvas provenientes de las garrapatas desprendidas de los bovinos B2 y V2, se depositaron en los animales B5 y V5, respectivamente, y aquéllas provenientes de los bovinos B3 y V3, se utilizaron para infestar a los novillos B6 y V6. Las infestaciones se realizaron, en una ocasión, utilizando 20,000 larvas por animal. Diariamente durante ocho días se les realizó la prueba de hemolinfa y se procedió a realizar la observación de quinetos por microscopía. Diariamente se llevaron registros de TR, VCA y también se registró la presencia de B. bovis en los EI en todos los animales experimentales. Muestras de sangre procedentes de los animales utilizados en el experimento de transmisión de la clona irradiada de B. bovis se criopreservaron en nitrógeno líquido a -196 °C(21) y procesadas posteriormente mediante la amplificación de ADN por la prueba de PCR anidada, procedimiento que permite obtener un amplicón de 280 pares de bases, esencialmente como se ha descrito previamente(23), y utilizando los oligonucleótidos específicos para B. bovis(24), los cuales se alinean con secuencias internas del gen RAP-1 de B. bovis(25).
RESULTADOS
Experimento 1
Los resultados obtenidos después de realizar tres pases a través de bovinos susceptibles mediante la inoculación de B. bigemina cepa BIS se presentan en el Cuadro 1. El bovino A1 presentó parasitemia, aunque con porcentaje de EI bajó (<0.01 %) en los días 2 y 3 post-inoculación (PI), la TR se incrementó ligeramente (39.3 °C), y el porcentaje de caída del VCA fue del 25 %, sin requerir tratamiento específico contra babesiosis bovina. El bovino A2 mostró parasitemia (< 0.001 %) durante los días 10 y 11 PI, con TR elevada (40.4 °C) el día 3 PI y descenso en el valor de VCA del 25 %.
En el tercer pase (Bovino A3) y a pesar de que no se encontró evidencia clara de parásitos en frotis sanguíneo, se observó aumento en TR (39.7 °C) y disminución del VCA (20 %) el día 12 PI. Con respecto a los animales B1 y B2, infestados con la progenie de garrapatas obtenidas de los bovinos A1 y A2, respectivamente, durante el periodo prepatente todos los frotis revisados resultaron negativos a B. bigemina. De forma similar, al revisar la hemolinfa de las garrapatas alimentadas en los bovinos A1, A2 y A3, ninguna muestra resultó positiva; en contraste, el bovino receptor B3 mostró un eritrocito con forma sugestiva del estadio de trofozoito de B. bigemina durante los días 6 y 7 PI. Sin embargo, tanto la TR como el valor de VCA no presentaron cambios relevantes.
Sangre colectada del bovino B3 y procesada mediante la prueba de PCR-anidada confirmó la presencia de material genético de B. bigemina, al detectarse un fragmento del tamaño esperado de 172 pb especifico para B. bigemina (ver resultado representativo en Figura 3).
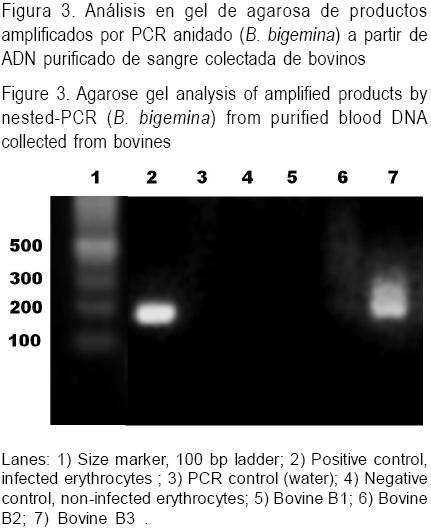
Al evaluar el comportamiento de la cepa de campo de B. bigemina (Cuadro 2) se encontró que el bovino C1 se detectó positivo al frotis sanguíneo el día 6 PI (< 0.01 %), manteniéndose positivo durante cinco días, con TR elevada (hasta 40 °C) y con ligero descenso del VCA (16 %). El bovino que recibió el segundo pase (bovino C2) mostró parasitemia desde el día 2 PI con porcentajes de EI de 0.13, 0.01, 0.08 y 0.13 % los días 2, 3, 4 y 5 PI, respectivamente; con fiebre de más de 41 °C posterior al inicio de la parasitemia y con una elevada disminución del VCA (45 %) el día 5 PI, por lo que fue necesario tratarlo con babesicida el día 6 PI. En el bovino que recibió el tercer pase por jeringa (C3) se presentó parasitemia del día 3 hasta el día 12 PI (<0.01 %), la temperatura solamente tuvo un ligero incremento el día 5 PI (39.7 °C), pero el VCA disminuyó los días 5, 6 y 7 PI (29 %) por lo que tuvo que ser tratado con babesicida el día 12 PI. Con respecto al experimento con la cepa de campo B. bigemina, todas las garrapatas que se alimentaron del bovino C1 y analizadas por la prueba de hemolinfa resultaron positivas mostrando la presencia de quinetos de Babesia. El bovino D1, infestado con la progenie de garrapatas hemolinfa-positivas del bovino C1 (Cuadro 2), manifestó la babesiosis clínica en forma severa, ya que se encontró positivo al frotis del día 4 al 9 PI (0.04 %) presentando fiebre (>40 °C) al día 6 PI y una caída drástica del VCA (66 %) del día 5 al 8 PI. Dado que el bovino D1 se detectó positivo al frotis desde el primer pase por garrapatas, esto confirma la transmisión de la cepa de campo de B. bigemina virulenta.

Experimento 2.
Los resultados obtenidos después de realizar tres pases a través de bovinos susceptibles mediante la inoculación por jeringa de la clona BOR de B. bovis se presentan en el Cuadro 3. Los novillos B1, B2 y B3 mostraron signos clínicos de moderados a ligeros a medida que el pase fue realizado: el período de incubación incrementó; el número de días con fiebre disminuyó; el período prepatente aumentó y la reducción en el VCA que decreció solamente 5 % en el tercer pase. No hubo presencia de signos clínicos en los novillos B4, B5 y B6 infestados con la progenie de las garrapatas R. microplus provenientes de los bovinos B1, B2 y B3, respectivamente. Por otra parte, no se logró encontrar parásitos por la lectura de laminillas teñidas con Giemsa durante el experimento en los animales receptores B4 y B5; sin embargo, se observaron EI en el bovino B6 (receptor de la progenie de garrapatas R. microplus alimentadas sobre el animal inoculado con el tercer pase), el cual apareció positivo el día 13 post-infestación. Los novillos no mostraron signos clínicos y la parasitemia fue demasiado baja para ser cuantificada. Este experimento demostró la falta de transmisión a través de garrapatas de la clona BOR después de uno y dos pases en ganado susceptible. La población fue transmitida después del tercer pase en animales intactos. Sin embargo, no existe riesgo aparente de que la enfermedad se presente, debido a que los parásitos no revirtieron a la virulencia por lo menos después de tres pases en bovinos. Ninguno de los animales de este grupo requirió ser tratado con medicamentos babesicidas. Todas las garrapatas colectadas de los animales inoculados con la clona BOR fueron negativas a la prueba de hemolinfa, incluyendo aquéllas que transmitieron el parásito a su progenie después del tercer pase.
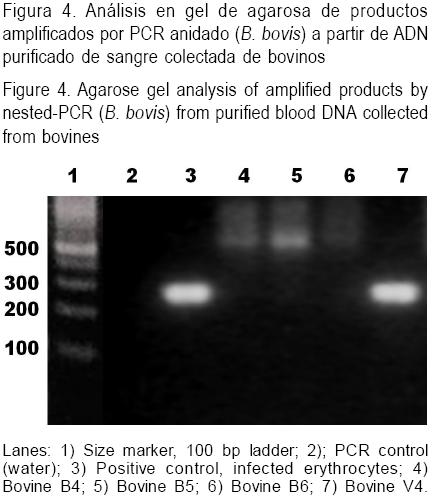
En contraste, y como se muestra en el Cuadro 4, el monitoreo de los animales inoculados con el aislado de campo de B. bovis mostró novillos con valores de temperatura rectal de 40 °C o superior en cada uno de los tres pases (animales VI, V2 y V3). También, los valores del VCA se vieron dramáticamente afectados, alcanzando decrementos de 42 a 50 % en los animales en que se realizaron los tres pases. En forma similar, los animales receptores infestados con larvas derivadas de garrapatas alimentadas sobre los bovinos antes mencionados, mostraron signos clínicos severos tales como TR mayor a 40 °C y una reducción del VCA del 43 al 53 %. Todos los animales presentaron EI los días 3-6,7-9, 5-8,10-12, 7-10 y 6-8 PI para los animales V1 al V6, respectivamente. Fue necesario administrar medicamentos babesicida a los seis bovinos. Las garrapatas ingurgitadas colectadas de los seis animales inoculados o infestados con progenie larval infectada con el aislado de B. bovis de campo resultaron todas positivas a la prueba de hemolinfa. Los resultados aquí obtenidos probaron que la clona BOR no es transmitida por garrapatas en el primer y segundo pase en ganado susceptible, pero sí al tercer pase, como fue determinado por microscopia óptica. Sin embargo, sangre colectada del bovino B6 y procesada mediante la prueba de PCR-anidada no logró confirmar la presencia de material genético de B. bovis, al no detectarse un fragmento de tamaño esperado de 280 pb especifico para B. bovis (ver resultado representativo en Figura 4).
DISCUSION
Los resultados encontrados en este estudio respecto a la transmisión por garrapatas y virulencia de una cepa de campo coinciden con los hallazgos reportados previamente, en donde se utiliza una cepa de procedencia distinta (Texcoco) como cepa de campo de B. bigemina, pero se demuestra la capacidad de multiplicarse en el vector, lo cual se confirma por la presencia de quinetos en hemolinfa de las hembras repletas, la transmisión trans-ovárica y la virulencia de la cepa en los animales receptores. De forma similar, se confirma que la cepa BIS no es transmitida por R. microplus después de un pase, como ha sido reportado previamente(8).
En este estudio se confirma que los parásitos mantenidos en cultivo in vitro perdieron la capacidad para multiplicarse en la garrapata vector durante un segundo pase por sub-inoculación en bovinos susceptibles. Esto, evidenciado por la ausencia de quinetos en la hemolinfa de garrapatas alimentadas en bovinos con parasitemia patente. Además, se demuestra que aún cuando sujeta a tres pases sucesivos en bovinos altamente susceptibles, la población de parásitos mantiene su característica biológica de reducida virulencia manifestada por los valores de TR y VCA determinados en los bovinos sub-inoculados, los cuales no mostraron cambios relevantes. Sin embargo, y aún cuando las garrapatas alimentadas en el bovino que recibió el tercer pase de la cepa BIS resultaron negativas en la prueba de hemolinfa, la progenie derivada de estas garrapatas tuvo la capacidad de transmitirla al bovino receptor. Si bien este bovino no manifestó signología clásica de babesiosis bovina por B. bigemina, el frotis sanguíneo de este bovino mostró formas intra-eritrocíticas sugestivas de B. bigemina, las que indicaban que el bovino receptor estaba realmente infectado, lo que se demostró mediante el análisis por PCR anidado, en el que se detectó un fragmento específico de B. bigemina del tamaño esperado. Dado que se requiere de una fase sexual de Babesia para que se lleve a cabo la infección de las células epiteliales del intestino de la garrapata vector, y consecuentemente llevarse a cabo la transmisión trans-ovárica(22,26), es probable que la población de parásitos de la cepa Seed requieren de por lo menos tres pases en bovinos infestados con R. microplus para que se induzca la formación de formas infectantes para la garrapata vector. Sin embargo se requiere de estudios adicionales para probar esta hipótesis.
Para el estudio con la clona BOR de B. bovis, los resultados encontrados coinciden con otros hallazgos reportados, los cuales demuestran la falta de transmisión por R. microplus de una cepa atenuada de B. bovis a través del primer pase en ganado susceptible(16,19,20). Una explicación a esto podría ser la pérdida de enzimas proteolíticas, las cuales tienen una función en los mecanismos de invasión de las células intestinales por los parásitos(16), una condición probablemente causada por irradiación, la cual provoca la ruptura de la cadena fosfodiester del ácido desoxiribonucleico (ADN), inactivando los genes en su totalidad (14). No obstante de que éstas son características altamente consistentes, el pase de esta clona irradiada a través de más de dos animales intactos podría volver al parásito infectivo para las garrapatas, como se observó en este trabajo durante el tercer pase. Es importante hacer notar que, si bien los parásitos se transmitieron en el tercer pase, solamente se encontró un parásito en el frotis sanguíneo después de dos horas de observación por un microscopista experto, y la prueba de PCR anidado no logró detectar material genético alguno. Esto puede ser resultado del umbral de sensibilidad analítica de la prueba de PCR anidado, dado que se requiere de la presencia de al menos 30 EI en una muestra de 200 /ti de paquete celular, para que se logre extraer la cantidad de molde suficiente que pueda dar un resultado positivo en la prueba de PCR(24,25). No obstante, el bovino receptor de la progenie larval derivada de garrapatas colectadas del bovino tercer pase nunca mostró signos clínicos de babesiosis bovina. Se ha reportado que una cepa atenuada de B. bovis fue transmitida por garrapatas después de 26 pases en vacas esplenectomizadas(27). Otros experimentos han demostrado la falta de transmisión después del primer pase por garrapatas R. microplus de una cepa vacunal de B. bovis(16,19,20).
CONCLUSIONES E IMPLICACIONES
Las cepas atenuadas BIS de B. bigemina y BOR de B. bovis no fueron transmitidas de forma trans-ovárica por garrapatas después de dos pases en bovinos, y no revirtieron a virulentas en pases subsiguientes de animales inoculados a animales susceptibles. La transmisión por garrapatas de las cepas atenuadas hasta un tercer pase por bovinos, una práctica no realizada comúnmente en las explotaciones ganaderas, reduce el riesgo de diseminación de los parásitos cuando estos se utilicen como vacuna viva contra la babesiosis bovina, amén de mantener las características deseables que debe reunir un inmunógeno vivo, que sea inocuo. No obstante, se requiere de estudios con un mayor número de pases sucesivos en animales susceptibles, para determinar los mecanismos genético-moleculares involucrados en el desarrollo del parásito dentro del eritrocito -en un bovino inoculado-, o en el intestino de R. microplus -formas sexuales-, que permiten al parasito adquirir nuevamente la capacidad patogénica hacia el bovino y la infectiva hacia la garrapata vector, para consecuentemente ser transmitidos de forma trans-ovárica. Estudios del genoma y transcriptoma de las poblaciones atenuadas de Babesia, permitirán identificar los cambios genéticos ocurridos en el genoma y cómo se manifiestan en el transcriptoma de las cepas atenuadas derivadas de cultivo in vitro, que se ven reflejadas en un fenotipo atenuado y con capacidad disminuida de ser transmitidas por la garrapata vector.
LITERATURA CITADA
1. Rolls PJ, Bock RE, de Vos AJ, Waldron SJ, Echaide IE. Bovine babesiosis. In: World Organization for Animal Health editor. Manual of diagnostic tests and vaccines for terrestrial animals 2010. Vol 2, [on line]. http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.04.02_bovine_babesiosis.pdf. Accessed Jun 30, 2010. [ Links ]
2. de Vos AJ. Distribution, economic importance and control measures for Babesia and Anaplasma. En: Dolan TT editor. Recent developments in the control of Anaplasmosis, Babesiosis and Cowdriosis: Proc Workshop, ILRAD, Nairobi, Kenya, 1991:3-12. [ Links ]
3. Callow LL, Mellors LT, McGregor W. Reduction in virulence of Babesia bovis due to rapid passage in splenectomized cattle. Int J Parasitol 1979;9(4):333-338. [ Links ]
4. Dalgliesh RJ, Callow LL, Mellors LT, McGregor W. Development of a highly infective Babesia bigemina vaccine of reduced virulence. Aust Vet J 1981;57:8-11. [ Links ]
5. Bishop JP, Adams LG. Babesia bigemina: Immune response of cattle inoculated with irradiated parasites. Exp Parasitol 1974;35(1):35-43. [ Links ]
6. Wright IG, Goodger BV, Mahoney DF. The irradiation of Babesia bovis. The difference in pathogenicity between irradiated and non-irradiated populations. Z Parasitenkd 1980;63:47-57. [ Links ]
7. Yunker CE, Kuttler KL, Johnson LW. Attenuation of Babesia bovis by in vitro cultivation. Vet Parasitol 1987;24:7-13. [ Links ]
8. Hernández OR, Álvarez MJA, Buening GM, Cantó AGJ, Monroy BM, Ramos AJA, et al. Diferencias en la virulencia y en la inducción de protección de aislamientos de Babesia B.bigemina derivados de cultivo in vitro. Téc Pecu Méx 1990;28(2):51-62. [ Links ]
9. Vega CA, Buening GM, Green TJ, Carson CA. In vitro cultivation of Babesia bigemina. Am J Vet Res 1985;46(2):416-420. [ Links ]
10. Figueroa MJV, Cantó AGJ, Álvarez MJA, Lona GR, Ramos AJA, Vega MCA. Capacidad protectora en bovinos de una cepa de Babesia bigemina derivada de cultivo in vitro. Téc Pecu Méx 1998;36(2):95-104. [ Links ]
11. Cantó AGJ, Figueroa MJV, Ramos AJA, Álvarez MJA, Mosqueda GJJ, Vega MCA. Evaluación de la patogenicidad y capacidad protectora de un inmunógeno fresco combinado de Babesia bigemina y Babesia bovis. Rev Vet Méx 1999;30(3):215-220. [ Links ]
12. Cantó AGJ, Álvarez MJA, Rojas REE, Ramos AJA, Mosqueda GJJ, Vega MCA, et al. Protección contra babesiosis bovina con una vacuna mixta de Babesia bovis y Babesia bigemina derivada de cultivo in vitro bajo una confrontación de campo. Inmunización en un área libre de enfermedad. Rev Vet Méx 2003;34(4):323-332. [ Links ]
13. Gil LA, Higuera B, Orrego J. Vacuna experimental contra Babesia bovis y Babesia bigemina producida con atenuación de los parásitos por irradiación. Rev Med Zoot 1987;39(1-2):49-57. [ Links ]
14. Rodríguez SD, Buening GM, Carson CA. Caracterización bioquímica preliminar de clonas de Babesia bovis irradiadas con cobalto 60. Téc Pecu Méx 1993;31(1):16-24. [ Links ]
15. Cantó AGJ, Figueroa MJV, Álvarez MJA, Ramos AJA, Vega MCA. Capacidad inmunoprotectora de una clona irradiada de Babesia bovis derivada de cultivo in vitro. Téc Pecu Méx 1996;34(3):127-135. [ Links ]
16. Álvarez JA, Ramos JA, Rojas EE, Mosqueda JJ, Vega CA, Olvera AM, et al. Field Challenge of cattle vaccinated with a combined Babesia bovis and B. bigemina frozen immunogen. Ann New York Acad Sci 2004;1026:277-283. [ Links ]
17. Shkap V, de Vos AJ, Zweygarth E, Jongejan F. Attenuated vaccines for tropical theileriosis, babesiosis and heartwater: The continuing necessity. Trends Parasitol 2007;23(9):420-426. [ Links ]
18. Timms P, Stewart NP. Growth of Babesia bovis parasites in stationary and suspension cultures and their use in experimental vaccination of cattle. Res Vet Sci 1989;47:309-314. [ Links ]
19. Mangold AJ, Aguirre DH, Cafrune MM, de Echaide ST, Guglielmone AA. Evaluation of the infectivity of a vaccinal and a pathogenic Babesia bovis strain from Argentina to Boophilus microplus. Vet Parasitol 1993;51:143-148. [ Links ]
20. O'Sullivan PJ, Calllow LL. Loss of infectivity of a vaccine strain of Babesia Argentina for Boophilus microplus. Aust Vet J 1986;42:252-254. [ Links ]
21. Palmer DA, Buening GM, Carson CA. Cryopreservation of Babesia bovis for in vitro cultivation. Parasitol 1982;84:567-572. [ Links ]
22. Smith RD. Ciclo biológico de Babesia en la garrapata. En: Moreno ChR editor. Ciencia Veterinaria Vol 2, UNAM, México. 1978:233-264. [ Links ]
23. Álvarez JA, Alpirez F, Rojas C, Figueroa JV. Probabilidad diaria de infección para Babesia spp mediante PCR anidado. Reunión Científica Tecnológica Forestal y Agropecuaria. Veracruz 2007:419-425. [ Links ]
24. Figueroa JV, Chieves LP, Johnson GS, Buening GM. Multiplex polymerase chain reaction based assay the detection of Babesia bigemina, Babesia bovis and Anaplasma marginale DNA in bovine blood. Vet Parasitol 1993;50:69-81. [ Links ]
25. Figueroa JV, Chieves LP, Johnson GS, Goff WL, Buening GM. Polymerase chain reaction-based diagnostic assay to detect cattle chronically infected with Babesia bovis. Rev Lat Amer Microbiol 1994;36:47-55. [ Links ]
26. Chauvin A, Moreau E, Bonnet S, Plantard O, Malandrin L. Babesia and its hosts: adaptation to long lasting interactions as a way to achieve efficient transmission. Vet Res 2009;40(2):37-55. [ Links ]
27. Mafra CL, Patarroyo JH, Silva SS. Babesia bovis: Infectivity of an attenuated strain of Brazilian origin for the tick vector B. microplus. Vet Parasitol 1994;52:139-143. [ Links ]














