Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.2 no.2 Mérida abr./jun. 2011
Notas de investigación
Respuesta de combinaciones Rhizobium - Clitoria ternatea en condiciones de estrés salino en el Valle del Cauto en Cuba
Response of Rhizobium - Clitoria ternatea combinations under salt stress in the Cauto Valley in Cuba
Raúl Carlos López Sánchezª, Roeland Samsonb, Patrick Vandammec, Bettina Eichler-Löbermannd, Ernesto Gómez Padillaª
ª Facultad de Ciencias Agrícolas, Universidad de Granma. Carretera Bayamo-Manzanillo km 17. Bayamo, 85 00/Cuba; rlopezs@udg.co.cu. Correspondencia al primer autor.
b Facultad de Ciencias. Universidad de Antwerp. Bélgica.
c Laboratorio de Agronomía Tropical y Subtropical y Etnobotánica. Universidad de Ghent, Bélgica.
d Facultad de Agricultura y Ciencias Ambientales, Universidad de Rostock, Rostock Alemania.
Recibido el 2 de febrero de 2010
Aceptado el 9 de diciembre de 2010
RESUMEN
Se estudió la respuesta de Clitoria ternatea en condiciones de estrés salino a la inoculación con aislamientos nativos y cepas comerciales de rizobios. El estudio se realizó en condiciones de invernadero y de campo. El efecto de tres cepas de rizobio (Jd19, 1031 y 1032) en el rendimiento y parámetros de la fijación de nitrógeno se comparó con el testigo y el tratamiento con fertilización nitrogenada. En el experimento en invernadero los mejores resultados para el rendimiento y parámetros de fijación de nitrógeno se encuentran con el aislamiento nativo de rizobio Jd19. En este tratamiento se encontraron los valores más altos de peso seco de masa aérea y raíces y de acumulación de nitrógeno. Además en el tratamiento con el aislamiento Jd19 se mostraron los valores más altos de relación K:Na, contenido de ureidos, clorofila a y b en el tallo y el mejor índice de efectividad de la inoculación. En el experimento de campo el tratamiento con el aislamiento Jd19 tuvo el mejor efecto positivo en comparación con el resto de los tratamientos. Los resultados indican que la combinación Clitoria ternatea-Jd19 es más eficiente en condiciones de estrés salino, y es posible su introducción a amplia escala en suelos afectados por la salinidad.
Palabras clave: Estrés salino, Fijación de nitrógeno, Leguminosas.
ABSTRACT
The purpose of the present study was to examine response of Clitoria tarnatea under salt stress to inoculation with native isolates and commercial strains of Rhizobium. This study was carried out both in greenhouse and field conditions. Effects of three Rhizobium strains (Jd19, 1031 and 1032) were compared to control and mineral N fertilization regarding yield and nitrogen fixation parameters. In the greenhouse experiment the best results for yield and nitrogen fixation parameters were found for the Jd19 native isolate treatment, where the highest dry weight of both shoots and roots and also of nitrogen uptake were observed. Besides, this treatment showed the highest K:Na ratio, as well as of contents of ureides, of a and b chlorophyll in stem and the best inoculation effectiveness index. In the field test, the Jd19 treatment showed the best positive effect in comparison to the other treatments. Results indicate that the Clitoria ternatea-Jd19 Rhizobium strain combination is the most efficient under salt stress and also that its wide scale introduction in saline soils is possible.
Key words: Salt stress, Nitrogen fixation, Legumes.
La salinidad es uno de los mayores factores limitantes para la agricultura en regiones áridas y semiáridas afectando más del 40 % de tierras irrigadas, especialmente las áreas más productivas del mundo(1).
En Cuba el denominado Valle del Cauto tiene una extensión aproximada de 4,000 km2, y más de la mitad de sus tierras están afectadas en determinado grado por la acumulación de sales en el suelo(2). En tanto cerca del 42 % de los suelos dedicados a la ganadería en este ecosistema se encuentran afectadas por la salinidad(2,3).
Una alternativa para la alimentación del ganado presente en este ecosistema puede ser la búsqueda de especies y ecotipos de leguminosas forrajeras tolerantes a la salinidad, ya que constituyen una alternativa viable y ecológica para el uso y rehabilitación de estos suelos, por su capacidad de fijar el nitrógeno atmosférico en simbiosis con rizobios del suelo, incrementar la materia orgánica de los suelos, servir de protección contra la erosión y mejorar la estructura del suelo(4). En tal sentido la especie Clitoria ternatea constituye una variante a utilizar al reportarse como una especie moderadamente tolerante a la salinidad y de buen potencial para la producción de forraje(5). Aunque existen muchos reportes en el mundo sobre el efecto de la salinidad en la simbiosis rizobio-leguminosa pratenses(6,7,8), en Cuba son escasos los reportes al respecto.
El objetivo del presente trabajo fue estudiar la respuesta de Clitoria ternatea cv. Oriente a la inoculación con Rhizobium en condiciones de estrés salino.
Se realizaron dos experimentos, el primero se estableció en un invernadero con techo de cristal, en el cual se tuvo controlado el riego a las plantas, así como la incidencia de plagas y enfermedades; y el segundo se realizó en condiciones de campo. En ambos experimentos se empleó la especie Clitoria ternatea, cultivar Oriente. El suelo empleado mostró valores medios de pH de 7.5, 3.5 % de materia orgánica, bajo contenido de fósforo asimilable para las plantas (P2O5: 0.45 mg/100 g) y potasio (K2O: 4.40 mg/100 g) (extraído en 0.5 m de ácido sulfúrico) y alto contenido de sodio Na+: 5 mg/ 100 g). El suelo se muestreó siguiendo los métodos descritos por la Norma Ramal Agrícola 79(9).
En el experimento en invernadero se emplearon los siguientes tratamientos: 1) +N-I (testigo con aplicación de 150 kg N ha–1 y sin inocular); 2) -N-I (testigo sin aplicación de nitrógeno y sin inocular); 3) inoculación con el aislamiento de rizobio Jd19; 4) inoculación con la cepa de Rhizobium 1032; 5) inoculación con la cepa de Rhizobium 1031.
Se utilizó un arreglo completamente aleatorizado con cinco repeticiones. Se cultivaron 10 plantas en macetas con 4 kg de suelo. El nitrógeno se añadió en cinco aplicaciones de 30 kg de N ha-1 en forma de urea como portador. A los 120 días se tomaron las 10 plantas por tratamiento y se llevó a cabo el conteo de nódulos (NNOD). Posteriormente se colocaron las muestras de nódulos en la estufa a 105 °C durante 48 h para determinar la materia seca de los nódulos (PSNOD) y de la parte aérea (MSPA). Posteriormente se determinaron el nitrógeno total (NT) (Kjeldahl method), el contenido de ureidos(10), clorofila a y b(11) y el porcentaje de Na+ y K+(12).
Se analizó el índice de respuesta al nitrógeno (IRN) y el índice de efectividad de la inoculación (IEI) mediante la ecuación:

Donde (+I) y (-I) representan los tratamientos inoculados y sin inocular, respectivamente(13).
El experimento de campo se desarrolló en la Empresa Genética y Cría "Manuel Fajardo" del municipio Jiguaní, provincia Granma, a los 20°19 N y los 76°33 O, en condiciones naturales de campo, sobre pasto estrella, el cual previamente fue pastoreado por el ganado de forma rasante al suelo, y posteriormente se hicieron surcos de 18 m lineales a una distancia de 1.5 m entre ellos. La distribución de los tratamientos en el campo fue el de parcelas con testigos intercalados (con y sin nitrógeno), cada dos variantes y con tres repeticiones. El experimento se repitió dos veces durante dos años consecutivos, en los meses de septiembre a enero con la finalidad de buscar repetitividad en los resultados; en ambas ocasiones se realizó una fertilización basal 40-50-50 de N-P-K(5).
Los tratamientos fueron: 1) +N-I control con aplicación de 150 kg N ha–1 y sin inocular; 2) -N-I control sin aplicación de nitrógeno y sin inocular; 3) inoculación con el aislamiento de rizobio Jd19; 4) inoculación con la cepa de Rhizobium 1031.
A los 150 días se cosecharon 10 plantas por repetición y se evaluó el rendimiento y los parámetros de fijación de nitrógeno descritos en el experimento anterior.
Los datos obtenidos se analizaron estadísticamente empleando varianza. Las medias fueron comparadas por un análisis de rangos múltiples de Duncan(14). El procesamiento estadístico se realizó con el paquete Statistical para Windows, versión 6.1(15).
Experimento en invernadero
Las combinaciones con el aislamiento Jd19 y la cepa 1031 mostraron los valores más elevados de biomasa aérea (Cuadro 1), solamente superado (P<0.01) por el testigo con nitrógeno. El aislamiento Jd19 a su vez presentó diferencias significativas (P<0.01) con el resto de los tratamientos en los indicadores Nnod, PSNOD, NT, acumulación de ureidos y un I EI superior incluso al IRN de esta especie (Cuadro 2).
Esto es el resultado de la simbiosis con una cepa altamente efectiva, la cual fue aislada de suelos afectados por la salinidad, reafirmando la importancia que tiene el aislamiento de cepas de rizobios de estos suelos, al ser microorganismos adaptados al estrés salino, y con grandes posibilidades de poder obtener incrementos del rendimiento de materia seca y fijación de nitrógeno en condiciones de estrés salino.
La acumulación de iones de Na+ y K+ en los diferentes tratamientos mostró el mejor comportamiento en la combinación Clitorea ternatea - Jd19, y en el tratamiento testigo con nitrógeno (Cuadro 3), este comportamiento puede estar relacionado con la tolerancia mostrada por este aislamiento a la salinidad en los estadios iniciales de formación de los nódulos, el cual es el más sensible al estrés salino(16). Esto le permitió una mejor sincronización de la combinación del Na+ y el K+ en los tejidos de las plantas y además disminuir los daños por el estrés salino(17).
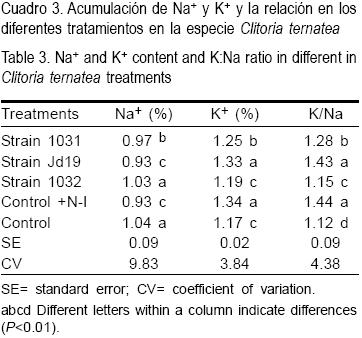
El estrés salino afecta la acumulación de nitrógeno y la toma de K+ por vía directa e indirecta por varias vías y puntos de asimilación. Dicha afectación es más pronunciada cuando se está en presencia de una simbiosis menos efectiva, lo cual trae consigo que las raíces de las plantas tengan una pobre asimilación de nutrientes y la fijación del N atmosférico sea menor(18).
Comportamiento similar mostraron los indicadores de acumulación de clorofila, materia seca de la parte aérea y acumulación de nitrógeno (Cuadros 2,3), donde la combinación que mostró el mejor comportamiento fue con el aislamiento Jd19, sólo superada para el segundo indicador por el tratamiento control con nitrógeno. Es de destacar que los valores de clorofila a presentaron menor variación en los diferentes tratamientos que la clorofila b, resultado que se corresponde con lo obtenido por otros autores en la especie Vigna unguiculata(19). En tanto se reporta un aumento del contenido de ureidos en presencia de cepas de rizobios con tolerancia a la salinidad en el cultivo del frijol y una menor acumulación de sodio en combinaciones con tolerancia al estrés salino(20). La disminución observada en estos indicadores en las otras combinaciones rizobio-leguminosa pudiera estar dada por la poca efectividad de estos aislamientos, lo cual provoca un mayor daño oxidativo en los componentes celulares(21).
Un incremento de la tolerancia a la salinidad y la fijación de nitrógeno, así como la presencia de mecanismos de adaptación han sido reportados por diversos autores(7,22,23), los cuales han encontrado resultados positivos cuando inoculan las leguminosas con cepas de rizobios efectivas en condiciones de estrés salino. De igual manera se reportan variaciones en cuanto a la tolerancia a la salinidad en leguminosas inoculadas con diferentes cepas de rizobios(24,25).
Existen resultados relacionados con la presencia de simbiosis rizobio-leguminosa efectivas a partir del uso de aislamientos realizados en suelos afectados por la salinidad, lo que representa una alternativa biológica para el uso y explotación de suelos afectados por el estrés salino(26,27,28).
Experimento de campo
El rendimiento de materia seca y la acumulación de nitrógeno en la parte aérea mostró diferencias (P<0.01) en los diferentes tratamientos (Cuadro 4). El aislamiento nativo Jd19 mostró los mayores valores de materia seca y nitrógeno en comparación con el testigo sin nitrógeno y sin inocular, solamente superado por el tratamiento fertilizado con nitrógeno.
El contenido de ureidos presentó los valores más elevados en el tratamiento con el aislamiento Jd19 (Cuadro 4), y estuvo bastante cercano al valor obtenido por esta combinación en el ensayo en macetas, demostrándose su tolerancia a la salinidad, teniendo en cuenta que en el resto de las combinaciones estudiadas con otras especies se produjo una disminución más considerable de este indicador en condiciones de campo.
El tratamiento con el aislamiento Jd19 presentó el mayor número de nódulos (P<0.01), mayor contenido de ureidos y con altos valores de acumulación de nitrógeno en comparación con el tratamiento con nitrógeno.
La simbiosis con el aislamiento Jd19 mostró un I EI muy cercano al IRN para esta especie y una mayor nodulación, que supera significativamente el resto de los tratamientos; este indicador está relacionado con el contenido de ureidos y el IEI para esta especie, lo que demuestra la efectividad mostrada por esta cepa de rizobio en condiciones de estrés salino (Cuadro 4).
Las afectaciones que produce el estrés salino que provoca una pobre simbiosis con la cepa 1031, puede estar causado por la baja tolerancia a la salinidad del microsimbionte en comparación con el aislamiento Jd19, lo que provoca una baja población de rizobios en la rizosfera, además de fallas en el proceso de infección y la inhibición de la nodulación.
Se menciona que C. ternatea es ligeramente específica en sus necesidades de inoculación(1) y se indica como tolerante a la salinidad, sequía y altas temperaturas. Esto explica lo obtenido en este experimento, donde la misma fue la que presentó el mejor comportamiento en los indicadores evaluados, además de obtener rendimientos de materia seca bastante aceptables comparables en condiciones óptimas de cultivo, y teniendo en cuenta las condiciones extremas de altas temperaturas, sequía y salinidad en el área de estudio(5).
Las plantas inoculadas aumentan su biomasa y tienen mayor resistencia a la salinidad y a la sequía. Esto pudiera atribuirse a la prolina, que tiene la capacidad de suministrar poder reductor para mantener el metabolismo del bacteroide hasta que se restablezca el estado normal de hidratación de la planta, y a su vez contribuir a mantener la turgencia celular(29).
Los resultados obtenidos coinciden por lo obtenidos por otros autores(30) e indican la efectividad de la inoculación de la especie C. ternatea con rizobios efectivos para obtener rendimientos de materia seca cercanos a cuando se emplea la fertilización nitrogenada; por otra parte resulta importante la respuesta a la inoculación y mas aún la utilización del aislamiento Jd19 proveniente de suelos afectados por la salinidad.
LITERATURA CITADA
1. FAO. Global network on integrated soil management for sustainable use of salt-affected soils. Rome, Italy: FAO. Land and Plant Nutrition Management Service. 2005. [ Links ]
2. González LM, Ramírez R, López R. Efecto de diferentes niveles de salinidad en el crecimiento y la acumulación de biomasa de plántulas de Leucaena leucocephala. Pastos y Forrajes 1999;22:39-42. [ Links ]
3. Ramírez R, González LM, López R. Afectaciones por salinidad en plántulas de Centrosema pubescens y Stylosanthes guianensis. Pastos y Forrajes 1999;22:122-115. [ Links ]
4. Nichols P, Malik A, Stockdale M, Colmer T. Salt tolerance and avoidance mechanisms at germination of annual pasture legumes: importance for adaptation to saline environments. Plant Soil 2009;(315):241-255. [ Links ]
5. FAO. Leguminosas forrajeras tropicales. Colección FAO: Producción y protección vegetal. 1991. [ Links ]
6. Bedaf M, Bahar M, Saeidi G, Mengoni A, Bazzicalupo M. Diversity of Sinorhizobium strains nodulating Medicago sativa from different Iranian regions. FEMS Microbiol Lett 2008;288:40-46. [ Links ]
7. Mhadhbi H, Fotopoulos V, Djebali N, Polidoros A, Aouani M. Behavior of Medicago truncatula-Sinorhizobium meliloti symbioses under osmotic stress in relation with the symbiotic partner input: Effects on nodule functioning and protection. J Agron Crop Sci 2009;95:225-231. [ Links ]
8. Abdel-Wahab AM, Shabebw MSA, Younis MAM. Studies on the effect of salinity, drought stress and soil type on nodule activities of Lablab purpureus (L.) sweet (Kashrangeeg). J Arid Environ 2002;51:587-602. [ Links ]
9. MINAGRI. Norma Ramal Agrícola no. 79: Suelos, análisis químicos, reglas generales. La Habana: Dirección de Normalización, Metrología y Control de la Calidad. 1981. [ Links ]
10. Boddey RM, Pereira JAR, Hungría M, Thomas RJ, Neves MCP. Methods for the study of nitrogen assimilation and transport in grain legumes. MIRCEN J 1987;3:3-22. [ Links ]
11. Lichtenthaler HK, Wellburn AR. Determinations of total carotenoids and chlorophylls a and b ofleafextracts in different solvents. In: Abstracts of the 6th Int Cong on Photosynthesis. Brussels. 1983:415. [ Links ]
12. Wintermans JF, DeMots A. Spectrophotometric characteristics of chlorophyll a and b and their pheophytins in ethanol. Biochem Biophys 1965; Acta 109:448-453. [ Links ]
13. CIAT 1988. Simbiosis leguminosa-rizobio: manual de métodos de evaluación, selección y manejo agronómico. Cali, Colombia: Centro International de Agricultura Tropical. 1988. [ Links ]
14. Duncan DB. Multiple range and multiple F test. Biometrics. 1955;11:1. [ Links ]
15. FOASTAT Statistical Databases. http://www.apps.fao.org. 2003. [ Links ]
16. Velagaleti RR, Kramer D, Marsh S, Reichenbach NG, Fleischman PE. Some approaches to rapid and pre-symptom diagnosis of chemical stress in plants. ASTM STP 1990;(1091):333-345. [ Links ]
17. El-Bashiti T, Hamanci H, Huseyin AO, Meral Y. Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions. Plant Sci 2005;169:47-54. [ Links ]
18. Läuchli A, Lüttge U. editors. Salinity: Environment - Plants -Molecules. Printed in the Netherlands: Kluwer Academic Publishers 2002;229-248. [ Links ]
19. Martínez-Drets G, Catalán AL, Carrera I, Batista S. Crecimiento y expresión de los genes de nodulación en Rhizobium meliloti en condiciones de estrés [resumen]. Reunion Latinoamericana de Rhizobiologia, Santa Cruz de la Sierra, Bolivia. 2006:7-9. [ Links ]
20. Khadri M, Tejera N, Lluch C. Sodium chloride-ABA interaction in two common bean (Phaseolus vulgaris) cultivars differing in salinity tolerance. Environ Exp Botany 2007;60:211-218. [ Links ]
21. Rubio M, Bustos-Sanmamed P, Clemente M, Becana M. Effects of salt stress on the expression of antioxidant genes and proteins in the model legume Lotus japonicas. New Phytologist 2009;81:851-859. [ Links ]
22. Ashraf M, Iram A. Drought stress induced changes in some organic substances in nodules and other plant parts of two potential legumes differing in salt tolerance. Flora 2005;(200): 535-546. [ Links ]
23. Moschetti G, Peluso A, Protopapa A, Anastasio M, Pepe O. Defez R. Use of nodulation pattern, stress tolerance, nodC gene amplification, RAPD-PCR and RFLP-16S rDNA analysis to discriminate genotypes of Rhizobium leguminosarum biovar viciae. Systematic Appl Microbiol 2005;28:619-631. [ Links ]
24. Dixon RK. Inoculation of Leucaena and Proposis seedlings with Glomus and Rhizobium species in saline soils: rhizosphere relations and seedling growth. Arid Soil Res Rehab 1992; 7:133-44. [ Links ]
25. Stoddard F, Balko C, Erskine W, Khan H, Link W, Sarker A. Screening techniques and sources of resistance to abiotic stresses in cool-season food legumes. Euphytica 2006;47:167-186. [ Links ]
26. López R, Eichler-Löbermann B, Gómez E, Schnug E. Response of Leucaena leucocephala cv. Peru to Rhizobium inoculation under salt stress. Landbauforschung Völkenrode 2007;4(57):307-311. [ Links ]
27. Javid Z, Fisher, R.F. Dinitrogen fixation by Dalbergia sissus and Leuceana leucocephala with native Pakistani rhizobia strains. Arid Soil Res Rehab 1989;3:385-90. [ Links ]
28. Bolaños L, Martin M, El-Hamdaoui A, Rivilla R, Bonilla I. Nitro- genase inhibition in nodules from pea plants grown under salt stress occurs at the physiological level and can be alleviated by B and Ca. Plant Soil 2004;280:135-142. [ Links ]
29. Tomasi L, Leal A, Michelena VA. Evaluación fisiológica del quinchoncho (Cajanus cajan (L) Mill sp.) sometido a estrés hídrico e inoculado con rizobio. Memorias XIX RELAR. 1998:212-213. [ Links ]
30. López M, Tejera N, Iribarne C, Lluch C, Herrera-Cervera J. Trehalose and trehalase in root nodules of Medicago truncatula and Phaseolus vulgaris in response to salt stress. Physiologia Plantarum 2008;134:575-582. [ Links ]














