Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.2 no.1 Mérida ene./mar. 2011
Artículos
Frecuencia de Varroa destructor, Nosema apis y Acarapis woodi en colonias manejadas y enjambres silvestres de abejas (Apis mellifera) en Mérida, Yucatán, México
Frequency of Varroa destructor, Nosema apis and Acarapis woodi in managed colonies and wild swarms of honey bees (Apis mellifera) in Merida, Yucatan, Mexico
Jesús Froylán Martínez Puca, Luis A. Medina Medinab, Gloria Aracelly Catzín Venturab
aCampo Experimental Edzná, INIFAP. Kilómetro 15 carretera Campeche-Pocyaxum. 24570, Chiná, Campeche. martinez.jesusfroylan@inifap.gob.mx. Correspondencia al primer autor.
b Departamento de Apicultura, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán.
Recibido el 4 de febrero de 2009
Aceptado para su publicación el 6 de julio de 2010
RESUMEN
Las enfermedades y parasitosis que afectan a las abejas melíferas causan importantes pérdidas económicas a la actividad apícola. Sin embargo, los daños provocados por dichas parasitosis se presentan de manera heterogénea en colonias manejadas y en enjambres silvestres. Con la finalidad de determinar la frecuencia y niveles de infestación de V. destructor, N. apis y A. woodi en abejas melíferas en Yucatán, se colectaron un total de 76 muestras de abejas melíferas, durante junio a septiembre de 2006, siendo 27 de colonias manejadas y 49 de enjambres silvestres. La frecuencia de V. destructor en colonias manejadas fue de 62.9 %, con un nivel de infestación de 1.70 ± 0.26 (ácaros/100 abejas), y en los enjambres silvestres fue de 55.1 %, con un nivel de infestación de 1.96 ± 0.44. No se observaron diferencias en la frecuencia (X2 = 0.44, gl = 1, P =0.51), y niveles de infestación (t=0.14, P=0.89). La frecuencia de N. apis en las colonias manejadas fue de 74.0 %, con una media de infestación de 1´480 x 103 ± 232 x 103 (esporas/ abeja), y en los enjambres silvestres de 53.0 %, con una media de infestación de 1´416 x 103 ± 264 x 103, no se observaron diferencias en la frecuencia (X2 = 3.22, gl = 1, P= 0.07) y niveles de infestación (t=0.18, P=0.86). No se detectó la presencia de A. woodi en las muestras analizadas. Los resultados demuestran un aumento en la frecuencia de N. apis en Yucatán.
Palabras clave: Frecuencia, Apis mellifera, Varroa destructor, Nosema apis, Acarapis woodi.
ABSTRACT
Diseases and parasitosis that affect honey bees produce heavy losses to the honey industry. However, damages do not affect managed colonies and wild swarms homogeneously. With the purpose of determining frequency and rate of infestation of V. destructor, N. apis and A. woodi in bees in Yucatan, 76 bee samples were collected between June and September 2006, 27 from managed colonies and 49 from wild swarms. V. destructor frequency in managed colonies was 62.9 %, showing a 1.70 ± 0.26 mites/ 100 bees infestation rate and of 55.1 % in wild swarms, with a 1.96 ± 0.44 mites/100 bees infestation rate. No differences were found either for frequency (×2=0.44, d.f.=1, P=0.51) or infestation rate (t=0.14, P=0.89). N. apis frequency in managed colonies was 74.0 %, showing a 1,480*103 ± 232*103 spores/bee infestation rate and of 53.0 % in wild swarms, with a 1,416*103± 264*103 spores/bee infestation rate. No differences were found either for frequency (X2=3.22, df=1, P=0.07) or infestation rate (t=0.18, P=0.86). No presence of A. woodi was detected. Results confirm an increase in N. apis presence in Yucatan.
Key words: Frequency, Apis mellifera, Varroa destructor, Nosema apis, Acarapis woodi.
INTRODUCCIÓN
Las abejas melíferas están propensas a sufrir el efecto de diversas parasitosis que afectan el desarrollo y la producción de las colonias(1). En la mayoría de los casos, las pérdidas económicas suelen ser considerables, ya que los daños provocados por dichas parasitosis van desde una reducción en la producción de miel(2,3), hasta la pérdida total de la colonia(4). Entre las principales parasitosis que afectan a las abejas melíferas destaca la varroasis, causada por el ácaro V. destructor(5), considerado como el principal problema sanitario al que se enfrenta la apicultura a nivel mundial, ya que se ha observado la pérdida total de colonias después de dos a cuatro años de haber iniciado la infestación en caso de no recibir ningún tratamiento(4); a la llegada del ácaro en el estado de Yucatán, los productores reportaron pérdidas de 30 a 70 % de las colonias infestadas, mortalidad atribuida en su mayor parte a V. destructor(6); así mismo, las colonias infestadas reducen la producción de miel hasta en un 65 % en comparación a las colonias libres de esta parasitosis(3). También se ha observado que la infestación de este ácaro aumenta la posibilidad de que otras enfermedades se presenten en las colonias infestadas(1,4,7).
Entre las principales parasitosis asociadas a V. destructor se encuentra la nosemosis, una parasitosis del tracto digestivo de las abejas adultas causada por el protozoario N. apis(1,8,9), cuyos efectos son considerados de poca importancia en países que cuentan con climas tropicales o subtropicales(10). Sin embargo, en la actualidad se ha observado que el número de esporas de N. apis se incrementa al aumentar los niveles de infestación de V. destructor, debido a que éste, provoca una reducción en la hemolinfa de la abeja infestada, favoreciendo la multiplicación de esporas de N. apis(11). Así mismo, se ha observado que infestaciones mixtas de V. destructor y N. apis han provocado un aumento en la mortalidad de las colonias infestadas a pesar de que el número de esporas de N. apis sea menor en comparación con la infestación únicamente de N. apis(12).
No obstante, los daños provocados por dichas parasitosis, se presentan de manera heterogénea en las colonias manejadas y en los enjambres silvestres, ya que el mecanismo de transmisión juega un papel importante en la virulencia de dichas parasitosis, el cual puede llevarse a cabo de forma horizontal o vertical(13). Si el parásito pasa directamente a la descendencia del hospedador (transmisión vertical, el éxito reproductivo del parásito depende del éxito reproductivo del hospedero, dando como resultado una baja virulencia. La transmisión horizontal ocurre cuando una parte de la población le transmite el parásito a otra, incrementando la virulencia del parásito(13,14).
En Yucatán se cuenta con la presencia de la abeja africanizada desde 1987(15), a la cual se le atribuyen diversos mecanismos en contra de V. destructor, así como también una elevada tendencia a enjambrar. Por tal motivo es importante conocer el estado sanitario en que se encuentran las colonias manejadas y los enjambres silvestres, debido a que en la actualidad se han observado pérdidas considerables en el número de colonias manejadas de abejas melíferas en el continente Europeo sin una causa aparente(16), mortalidad que hasta el momento aún no se ha presentado en Yucatán.
El objetivo del presente trabajo fue determinar la frecuencia y niveles de infestación de Varroa destructor, Nosema apis y Acarapis woodi en colonias manejadas y enjambres silvestres de abejas Apis mellifera en Mérida, Yucatán.
MATERIALES Y MÉTODOS
El trabajo se realizó en el Campus de Ciencias Biológicas y Agropecuarias (CCByA), de la Universidad Autónoma de Yucatán (UADY), ubicada en el km 15.5 de la carretera Mérida-Xmatkuil. Entre junio y septiembre de 2006, se colectaron un total de 76 muestras de abejas adultas, siendo 27 colonias manejadas y 49 enjambres silvestres provenientes de la ciudad de Mérida y sus alrededores. Cada muestra, consistió entre 200 a 300 abejas adultas colectadas en un frasco conteniendo 70 ml de alcohol etílico al 85 % para su conservación.
Las muestras de enjambres silvestres se colectaron con el apoyo del H. Cuerpo de Bomberos cuando estos recibían reportes de enjambres silvestres por parte de la población civil, y las muestras de colonias manejadas por parte de apicultores participantes. El diagnóstico del ácaro V. destructor se realizó de acuerdo a la técnica propuesta por De Jong et al(17), la cual consiste en colocar a las abejas colectadas, en frascos de plástico en forma invertida con la tapa y una malla criba de 3 mm de abertura en el cuello de la botella sin fondo; posteriormente se le agregó a la muestra colectada una solución de alcohol etílico al 85%, hasta cubrir la totalidad de la muestra. El frasco fue colocado en un agitador mecánico durante 15 min a 180 rpm, de esta manera los ácaros que se encontraban sobre el cuerpo de las abejas fueron removidos, la malla de alambre permitió el paso de los ácaros pero no de las abejas. Finalmente la solución fue colada a través de una tela de color blanco en la cual quedaron retenidos los ácaros para su conteo; el porcentaje de infestación se determinó mediante la siguiente fórmula:
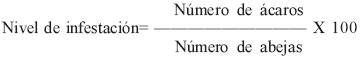
La presencia de N. apis, se determinó de acuerdo a la técnica de Catwell(18), la cual consiste en macerar el abdomen de 25 abejas adultas por cada muestra en un mortero; posteriormente se añadieron 25 ml de agua destilada al macerado, utilizando nigrosina para teñir las esporas. Una gota del macerado fue colocada en un portaobjetos y fue analizada en un microscopio óptico compuesto a 40X; si en la prueba se detectó la presencia de esporas, se procedió al conteo de éstas con la ayuda de una cámara de Neubauer. La intensidad de la infestación se determinó de acuerdo a los parámetros propuestos por Jaycox(19).
Para determinar la presencia de A. woodi, se utilizaron 20 abejas adultas de cada muestra mediante la técnica de disección, la cual consiste en colocar a las abejas sobre un papel filtro para eliminar el exceso de alcohol, posteriormente cada abeja fue analizada bajo un microscopio estereoscópico colocando a la abeja en posición dorsal sobre la superficie de una base de corcho, fijada con la ayuda de unas agujas entomológicas las cuales fueron insertadas a la altura del tórax; a cada abeja se le disectó la cabeza junto con el primer par de patas, dejando visible el primer anillo toráxico.
Para determinar si existen diferencias estadísticas entre la frecuencia de positividad por colmena entre las muestras procedentes de colonias manejadas y enjambres silvestres para V. destructor como para N. apis, se empleó una prueba de Ji cuadrada. Para determinar diferencias en los niveles de infestación de V. destructor y N. apis entre las colonias manejadas y los enjambres silvestres se aplicó una prueba " t " de Student. Los niveles de infestación de V. destructor fueron convertidos a arcoseno antes de aplicar la prueba estadística(20).
RESULTADOS
Frecuencia y niveles de infestación de V. destructor
La frecuencia de V. destructor en las colonias manejadas fue de 62.9 %, y en los enjambres silvestres de 55.1 % (Cuadro 1). El nivel de infestación en las colonias manejadas fue de 1.70 ± 0.26 (ácaros/100 abejas), y en los enjambres silvestres de 1.96 ± 0.44 (ácaros/100 abejas). Sin embargo, no se encontraron diferencias estadísticas significativas en la frecuencia (X2=0.44, gl=1, P=0.51), y niveles de infestación (t=0.14, P=0.89), entre ambos grupos.
Frecuencia y niveles de infestación de N. apis
La frecuencia de N. apis en las colonias manejadas fue de 74.0 %, y en los enjambres silvestres de 53.0 % (Cuadro 2). Sin embargo, no se encontraron Figura 1. Proporción parásitos en colonias manejadas y diferencias significativas (X2=3.22, gl=1, enjambres silvestres P=0.07).

El nivel de infestación en las colonias manejadas tuvo una media =1'480 x 103 ± 232 x 103 (esporas/abeja), similar a la registrada en los enjambres silvestres (1'416 x 103 ± 264 x 103 esporas/abeja; t=0.18, P=0.86).
Proporción de colonias manejadas y enjambres silvestres con infestaciones simples y mixtas
Las colonias manejadas que presentaron infestación simple de varroa y nosema tuvieron un promedio de 2.56 ± 0.88 ácaros/100 abejas, y un promedio de 889 x 103 ± 206 x 103 esporas/abeja. Las colonias manejadas que presentaron infestaciones mixtas registraron un promedio de 1.51 ± 0.24 ácaros/100 abejas, y 1'733 x 103 ± 299 x103 esporas/abeja.
Los enjambres silvestres que presentaron infestación simple de varroa y nosema tuvieron un promedio de 1.04 ± 0.26 ácaros/100 abejas, y un promedio de 1'994 x 103 ± 645 x 103 esporas/abeja. Los enjambres silvestres que presentaron infestaciones mixtas de varroa y nosema registraron un promedio de 2.51 ± 0.65 ácaros/100 abejas, y 1'110 x 103 ± 200 x103 esporas/abeja (Figura 1). No se observó asociación entre los parásitos y el tipo de colonia (silvestre o manejada; X2=3.34, gl=3, P=0.34).
Frecuencia y niveles de infestación de A. woodi
No se observó la presencia del ácaro traqueal A. woodi en ninguna muestra analizada de colonias manejadas y de enjambres silvestres en este estudio.
DISCUSIÓN
Frecuencia y niveles de infestación de V. destructor
La frecuencia de V. destructor en las colonias manejadas (62.9 %), fue numéricamente superior (P>0.05) a la registrada en los enjambres silvestres (55.1 %), lo cual coincide con lo reportado por diversos autores(13,14), quienes afirman que la transmisión vertical, la cual ocurre por medio de la enjambrazón es menos virulenta que la transmisión horizontal, que se presenta por medio de la deriva de las abejas pecoreadoras, zánganos o por medio del pillaje, ya que mediante este proceso se interrumpe el ciclo biológico del parásito.
Sin embargo, es importante señalar que los enjambres silvestres no reciben ningún tipo de tratamiento (químico o alternativo), en contra del crecimiento poblacional del ácaro V. destructor y mucho menos alimentación artificial en época de escasez como generalmente ocurre con las colonias manejadas. Así mismo, se pudo observar que el 26 % de los enjambres silvestres se encontraban totalmente libres de parásitos en comparación al 15 % de las colonias manejadas.
El nivel de infestación en las colonias manejadas, fue similar a la registrada en los enjambres silvestres. Los resultados obtenidos en el presente estudio difieren con los reportados por otros autores(21), quienes mencionan bajos niveles de infestación de V. destructor en los enjambres silvestres en comparación a las colonias manejadas.
Se ha demostrado que los bajos niveles de infestación en los enjambres silvestres, se debe a que durante el proceso de enjambrazón, aproximadamente el 25 % de la población de los ácaros presentes en la colonia salen junto con el enjambre, y el 75 % de los ácaros permanece en la colonia original, dando como resultado una reducción en los niveles de infestación en la colonia original y en el enjambre(14). Incluso el proceso de enjambrazón se ha sugerido como un mecanismo para regular el crecimiento poblacional de diversas parasitosis(22,23).
La frecuencia de V. destructor obtenida en las manejadas (62.9 %), fue similar a la reportada previamente, en la región Metropolitana correspondiente a la ciudad de Mérida en 1996, siendo de un 64.0 %(7). Sin embargo, el nivel de infestación observado en el presente estudio en colonias manejadas (1.70 ácaros/100 abejas), difiere a lo reportado en 1996, siendo de 4.91 (ácaros/100 abejas(23), indicando una reducción en los niveles de infestación. La reducción en los niveles de infestación de V. destructor en las colonias manejadas posiblemente se deba a la aplicación de diversos tratamientos químicos (fluvalinato y flumetrina), o alternativos (ácido fórmico y el timol), para el control del ácaro, y en los enjambres silvestres debido al proceso de enjambrazón, el cual actúa para regular el crecimiento poblacional de V. destructor(14,22,23).
Existen reportes en algunas regiones del mundo, que sugieren la posible adaptación entre el parásito y el huésped; por ejemplo en Francia, se observó una reducción en la cantidad de enjambres silvestres debido al ácaro V. destructor, para posteriormente incrementarse de manera paulatina(23). En Yucatán se cuenta con la presencia de la abeja africanizada la cual presenta diversos mecanismos de resistencia en contra del crecimiento poblacional del ácaro V. destructor(7,24). Sin embargo, es importante determinar si la reducción en los niveles de infestación se debe a una reducción en la virulencia del parásito, o a la aplicación constante de tratamientos para reducir los niveles de infestación de V. destructor, lo cual podría dar como consecuencia el desarrollo de ácaros resistentes a los tratamientos químicos, de los cuales ya se tienen reportes en México(25,26).
Frecuencia y niveles de infestación de N. apis
Se observó una elevada frecuencia de N. apis en las colonias manejadas (74.0 %), en comparación a los enjambres silvestres (53.0 %), esto se debe a diversos factores, que generalmente son causados por el propio apicultor, como la manipulación constante de las colmenas, lo cual agrava los niveles de estrés(1,2,27), el aplastamiento de las abejas al momento de cerrar las colmenas(8,9), el empleo de equipo contaminado y el intercambio de panales de una colonia enferma a una colonia sana(8,9,19). Así mismo, se ha comprobado que las esporas de N. apis pueden ser transmitidas a través de la cera(1,8,27), el polen(2), la jalea real(2), y los bebederos contaminados(2,19,27).
El intercambio de panales realizado por el apicultor es un medio importante para la transmisión de esporas de N. apis(8,9,19), lo cual no ocurre en los enjambres silvestres, ya que estos construyen panales nuevos al momento de establecerse en un nuevo nido, de esta manera las abejas que emergen presentarán menores niveles de infestación en comparación a las abejas que emergen de panales viejos utilizados en las colonias manejadas.
El confinamiento es uno de los principales factores que favorecen el desarrollo de N. apis(1,8,27), lo cual ocurre generalmente en las colonias manejadas, donde mientras más largo sea el periodo de confinamiento mayor será la probabilidad de que la enfermedad se presente, debido al estrecho contacto entre las abejas(8,9). Todos los factores que fomenten la retención de heces y eviten la defecación al aire libre, favorecen la diseminación de esporas dentro de la colmena(1); esto se debe a que las esporas se difunden con la materia fecal de las abejas adultas y son ingeridos por las abejas jóvenes cuando limpian los panales contaminados(8,9,27).
Sin embargo, a pesar de que se observó una elevada frecuencia en las colonias manejadas en comparación a los enjambres silvestres, no se observaron diferencias significativas; es importante mencionar que estudios realizados en Yucatán para determinar la prevalencia de N. apis en enjambres silvestres durante 1992 y 1993 fueron negativos a la presencia del parásito, posiblemente debido a que los enjambres silvestres generalmente se encuentran expuestos al medio ambiente, y no se encuentran confinados en un sitio determinado como ocurre en las colonias manejadas(28,29).
La elevada frecuencia de N. apis, obtenida en el presente estudio en las colonias manejadas y en los enjambres silvestres, posiblemente se deba en parte al ácaro V. destructor, ya que se ha observado que el mecanismo de alimentación del ácaro provoca el debilitamiento de las abejas infestadas, ocasionando que N. apis se reproduzca con una mayor intensidad en las abejas parasitadas(30).
La frecuencia de N. apis ha tenido un aumento considerable en las colonias manejadas y en los enjambres silvestres, ya que en 1980 la prevalencia a nivel nacional de N. apis en las colonias manejadas fue de 3.8 %, concluyendo que no podía ser considerado como un problema para la apicultura a nivel nacional(10). Sin embargo, estudios realizados en Yucatán en muestras colectadas durante 1990, reportaron una frecuencia a nivel estatal de un 7.2 % y de un 13.3 % en muestras colectadas en la ciudad de Mérida(31), para 1992 la prevalencia a nivel estatal era de un 14. 4 %, prácticamente el doble a la prevalencia reportada dos años antes y de un 20.0 % en la ciudad de Mérida(32).
Se ha observado que existe una correlación estadísticamente significativa entre la precipitación pluvial y N. apis(27), lo cual pudo haber influido en la elevada frecuencia obtenida en el presente trabajo, ya que las muestras fueron colectadas durante los meses de junio a septiembre, correspondiente a la época de lluvias en Yucatán(15), así como también se ha sugerido la existencia de una posible relación entre el clima y la enfermedad(31).
Sin embargo, la elevada frecuencia obtenida en colonias manejadas y enjambres silvestres podría ser la presencia de una nueva especie de parásito descubierto en A. mellifera, ya que en los últimos años se ha reportado que N. ceranae, un parásito que originalmente afectaba a la abeja asiática A. cerana, se encuentra parasitando a las abejas A. mellifera(16,33), y se encuentra distribuido en gran parte del mundo(34), desplazando a N. apis de manera rápida. En la actualidad se ha observado una elevada mortalidad de colonias de abejas melíferas en el continente Europeo, generalmente asociado a la interacción de V. destructor y N. ceranae, conocido como Síndrome del Despoblamiento de las Colonias. Sin embargo, en Yucatán hasta el momento no existen reportes de pérdidas relacionadas con dicho fenómeno. En el presente estudio no se pudo confirmar la especie de nosema correspondiente a las muestras positivas, ya que morfológicamente son muy similares(35).
Proporción de colonias manejadas y enjambres silvestres con infestaciones simples y mixtas
El porcentaje de colonias manejadas con infestaciones mixtas fue mayor a la registrada en los enjambres silvestres, posiblemente debido a que V. destructor ocasiona una reducción en la cantidad de la hemolinfa de la abeja parasitada facilitando la reproducción de N. apis(11). El elevado porcentaje de infestaciones mixtas en colonias manejadas en comparación a los enjambres silvestres se debe posiblemente a las malas prácticas de manejo por parte del apicultor, ya que únicamente el 14.8 % de las colonias manejadas se encontraban libres de parásitos en comparación con el 26.5 % de los enjambres silvestres.
Frecuencia y niveles de infestación de A. woodi
En el presente trabajo no se detectó la presencia del ácaro traqueal A. woodi, por lo tanto, este parásito no puede ser considerado un problema sanitario para la apicultura en Yucatán. Sin embargo, existen algunos reportes que confirman la presencia de dicho parásito. En 1992 la frecuencia de A. woodi en Yucatán fue de 3.11 %, y de un 10.0 % en la ciudad de Mérida(36).
Estudios realizados en Yucatán en muestras colectadas de enjambres silvestres revelan de manera similar, una baja frecuencia de A. woodi, siendo de un 4.92 %, en 1992 y de un 17.46 % en 1993, encontrándose Mérida libre de A. woodi en ambos periodos de muestreo.
Como se puede observar, muchos autores reportan una baja frecuencia de A. woodi, caso contrario a lo observado en el resto del país. El primer reporte de A. woodi en México, se realizó en 1980 en apiarios cercanos a Guadalajara(37), y posteriormente, se reportó su presencia en 23 de los 32 estados que conforman la República Mexicana, encontrándose Yucatán entre los estados libres de esta parasitosis(38).
Una de las razones por la que la península de Yucatán se encontró libre de A. woodi por tiempo prolongado se debe a que los apicultores de esta región se encuentran aislados con los apicultores del resto del país, y tienen la costumbre de criar a sus propias reinas, reduciendo la importación del material infestado y por lo tanto las posibilidades de infestación son limitadas(39).
La nula presencia de A. woodi en este trabajo puede deberse a diversos factores que intervienen en el ciclo biológico del parásito, ya que se han reportado diferencias entre distintas líneas de abejas(1). Las abejas africanizadas presentan menores niveles de infestación de A. woodi en comparación con las abejas europeas, lo cual pudo haber influido en los estudios previos realizados(40), debido a que en Yucatán se cuenta con la presencia de la abeja africanizada desde 1987(15), la cual presenta un periodo de vida menor en comparación a las abejas europeas, así como diversos mecanismos de resistencia hacia diversas enfermedades, como el proceso de enjambrazón. En un estudio realizado entre 1986 y 1989 en el estado de Quintana Roo se encontró una elevada prevalencia de A. woodi en colonias manejadas en comparación a los enjambres silvestres(41).
Las altas temperaturas que se registran en Yucatán puede ser un factor que limita el crecimiento del ácaro dentro de la colonia, ya que se ha observado que sometiendo a las abejas infestadas a temperaturas altas (38 ºC) se pueden eliminar a los ácaros traqueales sin afectar a las abejas(42). Se ha observado que los daños provocados por A. woodi se presentan de manera heterogenea, ya que existen poblaciones donde no se observan daños debido a este parásito, siendo posible que por medio de una selección natural las abejas puedan desarrollar resistencia(1), o bien por medio de la selección artificial se han desarrollado líneas resistentes como la Buckfast(43), las cuales presentan un alto comportamiento de acicalamiento y bajos niveles de infestación(44).
En base a los resultados obtenidos, la nula presencia de A. woodi en el presente estudio posiblemente se deba a que la prevalencia del parásito es muy reducido, por lo tanto, el tamaño de las muestra no fue lo suficiente amplio para detectar su presencia. Sin embargo, existen otros factores que posiblemente han ayudado a reducir la presencia de dicho parásito o incluso a eliminarlo, ya que los estudios previos realizados para determinar su prevalencia, se realizaron antes de la llegada del ácaro V. destructor a nuestro estado ocurrido en 1994(45), el cual ha inducido a los apicultores a la aplicación de diversos métodos para el control de V. destructor, entre los que destacan el ácido fórmico(1,19), y el mentol(19), los cuales también tienen un efecto sobre A. woodi.
CONCLUSIONES E IMPLICACIONES
La frecuencia de V. destructor en el estado de Yucatán permanece constante, sin embargo se ha observado una reducción en los niveles de infestación en los últimos años. Por el contrario la frecuencia de N. apis se ha incrementado de manera considerable, por lo cual se deben implementar prácticas de manejo encaminadas a reducir los niveles de infestación de dicho parásito. No se observó la presencia del ácaro traqueal A. woodi, en ninguna muestra analizada, por lo cual este parásito no debe ser considerado como un problema sanitario en Yucatán.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONACYT), por la beca otorgada durante la realización de este trabajo. Al Campus de Ciencias Biológicas y Agropecuarias (CCByA), de la Universidad Autónoma de Yucatán (UADY), por todo el apoyo otorgado durante la realización de este trabajo. .Al Programa de la Abeja Africana de la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA), por el apoyo otorgado en la colecta de muestras procedentes de colonias manejadas. Al H. Cuerpo de Bomberos de la Secretaría de Seguridad Pública del Gobierno del Estado de Yucatán, por el apoyo otorgado en la colecta de muestras procedentes de enjambres silvestres.
LITERATURA CITADA
1. Ritter W. Enfermedades de las abejas. España: Acribia, SA; 2001. [ Links ]
2. Cornejo LO, Rossi CO. Enfermedades de las abejas su profilaxis y su prevención. Argentina: Hemisferio Sur, SRL; 1974. [ Links ]
3. Arechavaleta VM, Guzmán–Novoa E. Producción de miel en colonias de abejas (Apis mellifera L.) tratadas y no tratadas con un acaricida contra Varroa jacobsoni Oudemans en el Valle de Bravo, Estado de México. Vet Méx 2000;31:381–384. [ Links ]
4. De Jong D. Mites: Varroa and other parasites of brood. In: Honey bees pest, predator and diseases, 2a ed. Mors A, Nowogrodzki R editors. Ohio, USA: The A.I. Root Co Medina; 1997; 200–218. [ Links ]
5. Anderson DL, Trueman J. Varroa jacobsoni (Acari:Varroidae) is more than one species. Exp Appl Acarology 2000;24(3):165–189. [ Links ]
6. Medina ML. Frecuency and infestation levels of the mite Varroa jacobsoni Oud. in managed honey bee (Apis mellifera L.) colonies in Yucatan, México. Am Bee J 1998; 38(2):125–127. [ Links ]
7. Medina ML, Vicario ME. The presence of Varroa destructor mite and Ascosphaera apis fungi in collapsing and normal honey bee (Apis mellifera L.) colonies in Yucatán, México. Am Bee J 1999;139(10):794–796. [ Links ]
8. Fries I. Nosema apis, a parasite in the honey bee colony. Bee World 1993; 74(1):5–19. [ Links ]
9. Fries I. Protozoa In: Morse R, Flottum K editors Honey bee pests, predators, & diseases. Third ed. The A.I. Root Co Medina; 1997:57–76. [ Links ]
10. Wilson W, Nunamaker R. The incidence of Nosema apis Z. in honey bees in Mexico. Bee World 1983;64(3):132–136. [ Links ]
11. Orantes F, Garcia A. Nosema disease en the honey bee (Apis mellifera L.) infested with varroa mites in southern Spain. Apidologie 1997;28:105–112. [ Links ]
12. Hinojosa A. González D. Prevalencia de parásitos en Apis mellifera L. en colmenares del secano costero e interior de la VI Región, Chile. Parasitol. Latinoam 2004;59:137–141. [ Links ]
13. Fries I, Camazine S. Implications of horizontal and vertical pathogen transmision for honey bee epidemiology. Apidologie 2001;32:1–16. [ Links ]
14. Wilde J, Fuchs S, Bratkowski J, Siuda M. Distribution of Varroa destructor between swarms and colonies. J Apic Res 2005;44(4):190–194. [ Links ]
15. Echazarreta CM, Quezada–Euán JJG, Medina ML, Pasteur K L. Beekeeping in the Yucatan peninsula: development and current status. Bee World 1997;78:115–127. [ Links ]
16. Higes M, Martýn R, Meana A. Nosema ceranae, a new microsporidian parasite in honeybees in Europe. J Invertebr. Pathol 2006;(2):93–95. [ Links ]
17. De Jong D, De Roma A, Goncalves, LS. A comparative analysis of shaking solutions for the detection of Varroa jacobsoni on adult honey bees. Apidologie 1982;13(3):297–306. [ Links ]
18. Cantwell, GE. Standard methods for counting nosema spores. Am Bee J 1970;10(6):222–223. [ Links ]
19. OIRSA–BID. Enfermedades y plagas de la abeja melífera occidental. Salvador. 1990. [ Links ]
20. Snedecor GW, Cochran WG. Métodos estadísticos. México: CECSA; 1984. [ Links ]
21. Goncalves S, De Jong D, Nogueira R. Infestation of feral honey bee colonies in Brasil by Varroa jacobsoni. Am Bee J 1982;122(4):249–251. [ Links ]
22. Royce L, Rossignol P, Burgett D, Stringer B. Reduction of tracheal mite parasitism of honey bees by swarming. Phil. Trans R Soc Lond 1991;331:123–129. [ Links ]
23. Le Conte Y. Honey bees surviving Varroa destructor infestations in France, In: Experts' Meeting on Apiculture Varroa Control. Brussels, 2003. European Commission Brussels. 2004:82–84. [ Links ]
24. Martin S, Medina M L. Africanized honeybees have unique tolerance to Varroa mites. Trends Parasitol 2004;20(3):112– 114. [ Links ]
25. Rodríguez–Dehaibes S, Otero–Colina G, Pardio V, Villanueva J. Resistence to amitraz and flumethrin in Varroa destructor populations from Veracruz, Mexico. J Apicult Res 2005;44(3):2005. [ Links ]
26. Rodríguez–Dehaibes S, Otero–Colina G, Villanueva J, Martínez P, Chavéz, C, Lagunas R. Resistencia de Varroa destructor a los plaguicidas usados para su control en las regiones Golfo y Centro–altiplano, México. En: Congreso Internacional de Actualización Apícola del 16 al 18 de mayo de 2007. Boca del Río, Veracruz, México. 2007:40–44. [ Links ]
27. Bailey, L. Patología de las abejas. España: Acribia; 1981. [ Links ]
28. May–Itzá W de J. Prevalencia de Nosema apis Z. y Acarapis woodi R. en colonias silvestres de abejas africanizadas y europeas (Apis mellifera L.) en el estado de Yucatán [tesis licenciatura]. México: Universidad Autónoma de Yucatán; 1995. [ Links ]
29. Quezada–Euán JJ, May–Itza W. Características morfométricas, poblacionales y parasitosis de colonias silvestres de Apis mellifera (Hymenoptera: Apidae) en Yucatán, México. Folia Entomol. Mex 1996;97:1–19. [ Links ]
30. Orantes F, González, A. La nosemosis en el sur de España. Vida Apícola 1998;91:8–53. [ Links ]
31. García MM, Quezada–Euán JJ. Distribución de la Nosemosis en apiarios comerciales del estado de Yucatán. Apicultura Moderna 1993;5:22–24. [ Links ]
32. Carrillo O. Prevalencia y distribución de Acarapis woodi (Rennie) y Nosema apis (Zander) en 15 sitios del estado de Yucatán en el año de 1992. Niveles de infestación y susceptibilidad en los ecotipos Africanizados y Europeas de Apis mellifera L. [tesis licenciatura]. México: Universidad Autónoma de Yucatán. 1996. [ Links ]
33. Huang WF, Jiang JH, Chen YW, Wang CH. Complete rRNA sequence of the Nosema ceranae from honeybee (Apis mellifera). 2005: https://gra103.aca.ntu.edu.tw/gdoc/F90632004a.pdf. Accessed Nov 25, 2005. [ Links ]
34. Klee J, Besana A, Genersch E, Gisder S, Nanetti A, Quyet D, Xuan S, et al. Widespread dispersal of the microsporidian Nosema ceranae, an emergent pathogen of the western honey bee, Apis mellifera. J Invert Pathol 2007 [in press] [ Links ].
35. Fries I, Martín R, Meana A, García–Palencia P, Higes M. Natural infections of Nosema ceranae in European honey bees. J Apicult Res 2006;45(3):230–233. [ Links ]
36. Echazarreta CM, García MA. Prevalencia de la acariosis traqueal en las abejas (Apis mellifera L. Hymenoptera: Apidae). Congreso Nacional de Entomología. S.L.P. México. 1992:190–191. [ Links ]
37. Wilson W, Nunamaker R. The infestation of honey in Mexico with Acarapis woodi. Am Bee J 1982;122(7):503–505. [ Links ]
38. Guzmán–Novoa E, Zozaya Rubio A. The effects of chemotherapy on level of infestation and production of honey bees with acariosis. Am Bee J 1984;124(9):669–672. [ Links ]
39. Wilson W, Nunamaker R. Futher distribution of Acarapis woodi in Mexico. Am Bee J 1985:125(2):109–111. [ Links ]
40. Lagunas R, Vázquez M. Detección de acariosis traqueal por Acarapis woodi (Acarida) en enjambres de "abejas africanizadas" Apis mellifera scutellata y "abejas europeas" Apis mellifera ligustica en las cercanías de Nautla, Veracruz [resumen]. Congreso Nacional de Entomología. Universidad Autónoma de San Luis Potosí. 1992:192. [ Links ]
41. Vivas RJ, Cobá NJ. Análisis retrospectivo de la acariosis en el estado de Quintana Roo [resumen]. Reunión Nacional de Investigación Pecuaria. México. 1990:119–120. [ Links ]
42. Harbo J. Effects of the hive color and heat on tracheal mites. Am Bee J 1994;(134):741–742. [ Links ]
43. Wilson W, Pettis J, Herdrson C, Morse R. Traqueal mites In: Morse R. Flottum K. Honey bee pests, predators, & diseases. Third ed. Ohio,USA: The A.I. Root Co Medina; 1997:253–277. [ Links ]
44. De Guzmán LI, Rinderer T, Delatte G, Stelzer A, Beaman L, Kuznetsov V. Resistance to Acarapis woodi by honey bees from far–eastern Russia. Apidologie 2002;33:411–415. [ Links ]
45. Rodríguez SR, Moro JM, Otero GC. Varooa found in Mexico. Am Bee J 1996;132(11):728–729. [ Links ]














