Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.1 no.2 Mérida abr./jun. 2010
Notas de investigación
Estacionalidad reproductiva de los machos cabríos de la raza Alpino–Francés adaptados al subtrópico Mexicano
Reproductive seasonality of young French–Alpine goat bucks adapted to subtropical conditions in Mexico
Evaristo Carrilloa, Cesar Alberto Meza–Herrerab, Francisco Gerardo Vélizc
a Instituto Tecnológico de Torreón.
b Universidad Autónoma Chapingo, Unidad Regional Universitaria de Zonas Áridas.
c Departamento de Ciencias Médico Veterinarias, Universidad Autónoma Agraria Antonio Narro, Periférico Raúl López Sánchez y Carretera a Santa Fe, 27054, Torreón, Coahuila, México. velizderas@yahoo.com. Correspondencia al tercer autor.
Recibido el 7 de octubre de 2008
Aceptado para su publicación el 11 de noviembre de 2009
RESUMEN
El objetivo del presente estudio fue determinar un posible patrón de estacionalidad reproductiva de los machos cabríos de la raza Alpino–Francés adaptados a condiciones intensivas del subtrópico Mexicano (26° LN). El estudio consideró 11 machos, los cuales fueron sometidos a las variaciones naturales del fotoperiodo de la Comarca Lagunera (13:41 h/luz durante el solsticio de verano y 10:19 h/luz en el solsticio de invierno). Los animales tuvieron libre acceso a heno de alfalfa (17 % PC) y 200 g de concentrado comercial (14 % PC) animal–1 día.1, durante todo el período experimental (diciembre a septiembre). Se observó una disminución (P<0.05) en la motilidad progresiva y el porcentaje de espermatozoides vivos al pasar de 1.4 ± 0.1 (escala de 1–5) y 21 ± 2 % de enero a junio, a valores de 2.5 ± 0.2 y del 49 ± 4 % durante julio a diciembre, respectivamente. La latencia a eyacular en vagina artificial fue de 102 ± 7 seg de diciembre a julio, observando una reducción a 52 ± 1 seg entre agosto y septiembre. El volumen del eyaculado fue de 0.1 ± 0.03 ml eyaculado–1 de enero a julio, observando un incremento a 0.5 ± 0.04 ml eyaculado–1 durante agosto, septiembre y diciembre. Los resultados del estudio demuestran que machos cabríos Alpino–Francés jóvenes criados con un esquema intensivo a 26° LN en el subtrópico mexicano muestran un patrón estacional con respecto a calidad espermática, libido y peso testicular que se extiende de enero a julio en esta latitud.
Palabras clave: Estacionalidad reproductiva, Caprinos, Alpino–Francés, Espermatozoides, Comportamiento sexual.
ABSTRACT
Limited data is available on reproductive seasonality in French Alpine goat bucks raised under intensive conditions in northern Mexico, at subtropical latitude (26° N). A study was done of eleven young French Alpine bucks subject to natural, regional photoperiod variations (13:41 h/light at summer solstice; 10:19 h/light at winter solstice). Animals were fed alfalfa hay (17% CP) ad libitum and a commercial supplement (14% CP) at 200 g animal–1 day–1 during the experimental period (December to September). Sperm motility increased (P<0.05) from 1.5 units from January to May to 2.5 units from July to September. Sperm viability also increased, from 25 % in January to May to 40 % in July to September. Ejaculate volume was 0.1 ± 0.03 ml ejaculate–1 from January to July, lower (P<0.05) than the 0.5 ± 0.04 ml ejaculate–1 recorded in August, September and December. Latency to ejaculate in an artificial vagina decreased (P<0.05) from 102 ± 7 sec in December to July, to 52 ± 1 sec in August and September. The studied French Alpine bucks exhibited seasonality in semen quality characteristics, body and testicular variables and sexual response, with generally lower variable values and less sexual activity from January to July followed by increased values and activity.
Key words: Seasonal reproduction, Goats, French Alpine bucks, Sperm, Semen characteristics, Sexual behavior.
La actividad reproductiva de los animales domésticos puede ser influenciada por varios factores como son: la raza, la localización, el fotoperiodo y la alimentación entre otras(1,2). La actividad sexual anual de las cabras ha sido estudiada en varias razas y en varias regiones(3–5); sin embargo, la información que se tiene en muchos aspectos de la actividad reproductiva es escasa y en muchos casos solamente se tienen las características de las razas locales y de las razas puras en sus regiones de origen. En efecto, donde existen más reportes es en los caprinos de las latitudes templadas (>35° Latitudes Norte o Sur), mientras que en las latitudes subtropicales (25 a 35° Latitudes Norte o Sur) es poca la información que se conoce(6). Los machos de las razas Alpinos y Saanen de las zonas templadas (45° N, la duración del día en el solsticio de invierno es aproximadamente de 8 h de luz y en el solsticio de verano es de 16 h de luz) muestran una marcada estacionalidad reproductiva. En estos machos mantenidos en condiciones naturales, el comportamiento sexual dependiente de la secreción de testosterona disminuye durante la primavera y el verano, y el volumen del eyaculado y el número total de espermatozoides/ml disminuyen, y es el fotoperiodo el principal factor del medio ambiente que sincroniza la actividad sexual(6).
Se conoce que al someter a las cabras Alpinas de estas latitudes a otros fotoperiodos, como los de zonas tropicales, el inicio de su actividad reproductiva fue un poco más rápido y su estación de anestro un poco más corta(7). En los machos cabríos locales del subtrópico de México (26° LN), el periodo de baja actividad sexual se extiende de enero a mayo, mientras que en las hembras, el periodo de anestro se extiende de marzo a julio(8), y es el fotoperiodo el principal factor del medio ambiente que sincroniza la actividad sexual(9).
En el norte subtropical de México (26° LN), las variaciones naturales del fotoperiodo de la región son más moderadas (13 h 41 min de luz en el solsticio de verano y 10 h 19 min en el solsticio de invierno)(10), comparadas con las latitudes templadas, además que en regiones subtropicales la nutrición puede influir en la actividad reproductiva de los caprinos y ovinos(11). En efecto, cambios en los niveles plasmáticos de hormonas metabólicas son señales importantes que informan el estado nutricional en rumiantes(12–15). Una explicación establece que la respuesta a la suplementación nutricional altera los niveles séricos de glucosa, insulina, leptina o IGF–I, y probablemente otras hormonas metabólicas o reproductivas(12,14,16–18). Por ejemplo, en los machos cabríos Cashmere de Australia (28° LS), la subalimentación provoca un retraso en el inicio de la actividad sexual, indicado por un tardío incremento del peso testicular, de la secreción de testosterona y del olor sexual en comparación con los machos bien alimentados(11). Por lo anterior es posible que la actividad reproductiva anual de los machos de la raza Alpino–Francés sea diferente a los caprinos locales de la Comarca Lagunera o de otras regiones, por lo que el objetivo de la presente investigación fue determinar la duración de la estación natural reproductiva de los machos Alpino–Francés criados y adaptados a latitudes subtropicales como la del norte de México.
El presente estudio se realizó del 1 de diciembre al 30 de septiembre del 2007, en el norte de México (26°23’ LN y 104°47’ O). Se utilizaron 11 machos jóvenes (1 año de edad) de la raza Alpino–Francés de la Comarca Lagunera. Los animales estuvieron estabulados en un área de 25 m2 y fueron sometidos a las variaciones naturales del fotoperiodo (13:41 h/luz durante el solsticio de verano y 10:19 h/luz en el solsticio de invierno) y a un sistema intensivo desde su nacimiento. La altitud de esta región varía de 1,100 a 1,400 msnm, y es caracterizada por tener clima seco, y la precipitación promedio anual es de 266 mm (163 a 504 mm) generalmente de agosto a septiembre. La temperatura tiene un promedio anual de 20° C, mostrando una temperatura máxima promedio de 37° C entre los meses de mayo y agosto, y temperaturas mínima promedio de 8° C en enero(10).
La alimentación fue a base de heno de alfalfa (17 % PC, 1.95 Mcal de EM) a libre acceso y 200 g de concentrado comercial (14 % de proteína cruda, 1.7 Mcal de EM) por día y por animal durante todo el período experimental. Las sales minerales fueron suministradas en un bloque de 25 kg (no menos de 17 % de P, 3 % de Mg, 5 %deCa, 5 % de Na y 75 % de NaCl) y el agua fue proporcionada a libre acceso. La condición corporal y peso fueron determinados cada dos semanas durante todo el estudio. Para la condición corporal se usó la técnica descrita por Walkden–Brown et al(19), la cual consiste en medir la masa muscular de la región lumbar del animal; así, el valor fue dado en escala de 1 a 4 con puntos intermedios, en donde el 1 fue para animales muy flacos, y el 4 para animales con una muy buena masa muscular y una gruesa capa de grasa subcutánea.
El peso testicular se determinó cada dos semanas mediante la técnica de palpación comparativa(20), mediante un orquidómetro, que es un collar de piezas sintéticas que tienen forma similar a los testículos de los machos y éstas tiene diferentes medidas: 25, 50. 75, 100, 125, 150, 180, 200 ml (1 ml = 1 g). Esta técnica consiste en palpar siempre el mismo testículo (izquierdo) del macho y determinar su peso por comparación con las piezas del orquidómetro. Las observaciones se realizaron por la misma persona. La circunferencia escrotal se determinó con una cinta métrica flexible graduada en milímetros, en la parte más ancha de ambos testículos.
El comportamiento sexual y las características y calidad de los eyaculados se analizaron durante los últimos siete días de cada mes del estudio(21). Se muestrearon dos días seguidos por dos de descanso y posteriormente se muestrearon otros tres días. Los datos obtenidos del primer día no fueron usados para evitar posibles errores por no haber colectado eyaculados durante un largo periodo.
Para recolectar el semen, cada macho fue expuesto durante 180 seg a una hembra intacta inducida al estro mediante la aplicación de 200 mg de cipionato de estradiol, y se utilizó una vagina artificial para obtener los eyaculados. Estos machos se acostumbraron a este manejo desde dos meses antes de empezar el estudio para que no se tuviera ninguna influencia en la obtención de los datos. En cada ocasión se determinaron aspectos cuantitativos (volumen, número total de espermatozoides por eyaculado) y cualitativos (motilidad progresiva, y porcentaje de espermatozoides vivos); además se determinó la latencia al eyaculado y el número de rechazos a eyacular en la vagina artificial(9). Para determinar la concentración espermática del eyaculado, se tomó una muestra de 0.05 ml, la cual se diluyó en 9.95 ml de una solución fisiológica con formaldehido (0.9% de cloruro de sodio y 0.1% de formaldehido, diluido en agua bidestilada), utilizando un hematocitómetro: en el cuadro central se contaron los espermatozoides que estuvieron en cinco cuadros grandes, es decir, 80 pequeños cuadros. Fue necesario contar tres muestras de cada eyaculado, y si un conteo difirió 10 % del promedio de las tres muestras, se inició nuevamente el conteo celular(8). El número total de espermatozoides por eyaculado (x109) se calculó multiplicando la concentración espermática por el volumen del eyaculado. Para determinar la motilidad progresiva individual, inmediatamente después de colectado el semen, una gota de semen no diluido, fue colocada entre un portaobjeto y un cubreobjeto y se utilizó una escala de 0 al 5: 0=sin movimiento, 5=movimiento progresivo muy rápido, en el cual las células son difíciles de seguir visualmente(10,21,22). El porcentaje de células espermáticas vivas o móviles se determinó en la misma muestra en cinco áreas de la preparación(6,10). La latencia al eyaculado se determinó como el tiempo (segundos) que transcurrió desde que el macho fue puesto en presencia de la hembra hasta la eyaculación. Se consideró como un rechazo cuando un macho fue expuesto a la hembra durante 180 seg, y éste no eyaculó en la vagina artificial.
Para el análisis se calculó el promedio en cada animal, en cuanto a número de espermatozoides/ eyaculado, motilidad progresiva, porcentaje de espermatozoides vivos, latencia, y se calculó el número de rechazos a eyacular en la vagina artificial por animal por mes. El análisis de la información consideró un análisis de varianza circunscrito a un diseño completamente al azar, considerando como factor de clasificación único al tiempo y como variables de respuesta a peso vivo (kg), condición corporal (unidades), peso testicular (g), circunferencia escrotal (cm), viabilidad espermática (%), motilidad (1–5), espermatozoides por eyaculado (n), volumen del eyaculado (ml), latencia (s) y rechazos a eyacular en la vagina artificial (n). Previo al análisis de varianza se examinó si las observaciones mostraban una distribución normal para lo cual se empleó la prueba Shapiro–Wilks W(23); las variables de respuesta que no cumplieron la distribución normal se transformaron utilizando el logaritmo base 10 o bien raíz cuadrada, lo cual ocurrió para el caso de las variables condición corporal, motilidad espermática y viabilidad. Se utilizó la prueba de Tukey para hacer comparaciones múltiples entre las medias de acuerdo al tiempo. También la asociación del peso testicular y la circunferencia escrotal se analizó usando una correlación de Spearman. Todos los análisis se realizaron con el procedimiento GLM del programa SAS (24).
Se presentaron variaciones estacionales en la calidad seminal y comportamiento sexual (número de rechazos a eyacular en la vagina artificial y latencia a eyacular en ésta (Figura 1). Se observó un aumento (P<0.05) en la motilidad progresiva y el porcentaje de espermatozoides vivos al pasar de 1.4 ± 0.1 y 21 ± 2 % de enero a junio, a valores de 2.5 ± 0.2 y del 49 ± 4 % durante julio a diciembre, respectivamente. La latencia a eyacular en la vagina artificial fue de 102 ± 7 seg de diciembre a julio, observando una reducción a 52 ± 1 seg entre agosto y septiembre. El volumen del eyaculado fue de 0.1 ± 0.03 ml eyaculado–1 de enero a julio, observando un incremento a 0.5 ± 0.04 ml eyaculado–1 durante agosto, septiembre y diciembre. El número total de espermatozoides por eyaculado fue de 0.9 ± 0.1 X 109 de diciembre a julio, observando un incremento a 2.9 ± 0.3 X 109 en agosto y septiembre. La concentración de espermatozoides/ml fue de 7.0 ± 0.3 X 109 de enero a agosto, mientras que éste se disminuyó a 3.5 ± 1.2 X 109 en diciembre y septiembre. El número de rechazos a eyacular en la vagina artificial fue 2.4 ± 0.02 veces, de febrero a julio, mientras que éste disminuyó a 1.0 ± 0.2 veces, en los meses de diciembre, enero, agosto y septiembre. El ANOVA reveló un efecto del tiempo en todas estas variables en estudio (P<0.001). La evolución durante el estudio de rechazos a eyacular en la vagina artificial, la latencia a la eyaculación, motilidad progresiva y el porcentaje de espermatozoides vivos de los machos Alpino–Francés se muestra en la Figura 1.
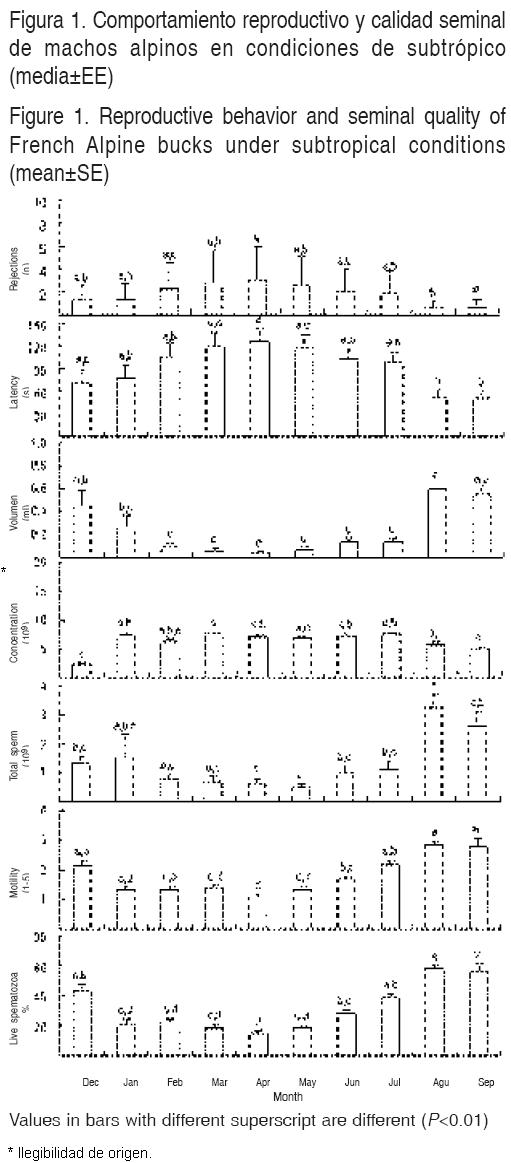
El peso testicular varió durante el estudio, registrando su menor peso a mediados de enero (69 ± 5.6 g), empezando a incrementarse a partir de febrero, alcanzando su mayor peso testicular a finales de julio (120 ± 5.4 g). El peso corporal se incrementó de 31 ± 0.7 kg de enero hasta llegar a un peso máximo de 55 ± 1.7 kg en el mes de julio, manteniéndose éste hasta el final del estudio. El ANOVA reveló un efecto del tiempo en el peso testicular, circunferencia escrotal y en el peso corporal (P<0.001). Por otro lado, el promedio global para condición corporal fue 3.2 ± 0.04, mientras que la menor condición se observó en marzo, la mejor ocurrió en julio (2.7 y 3.5, respectivamente), sin embargo, el ANOVA reveló también en esta variable un efecto del tiempo (P<0.001). La evolución durante el estudio del peso testicular, condición y peso corporal de los machos Alpino–Francés se muestra en la Figura 2. Se encontró una correlación positiva entre el peso testicular y la circunferencia escrotal (r = 0.783).
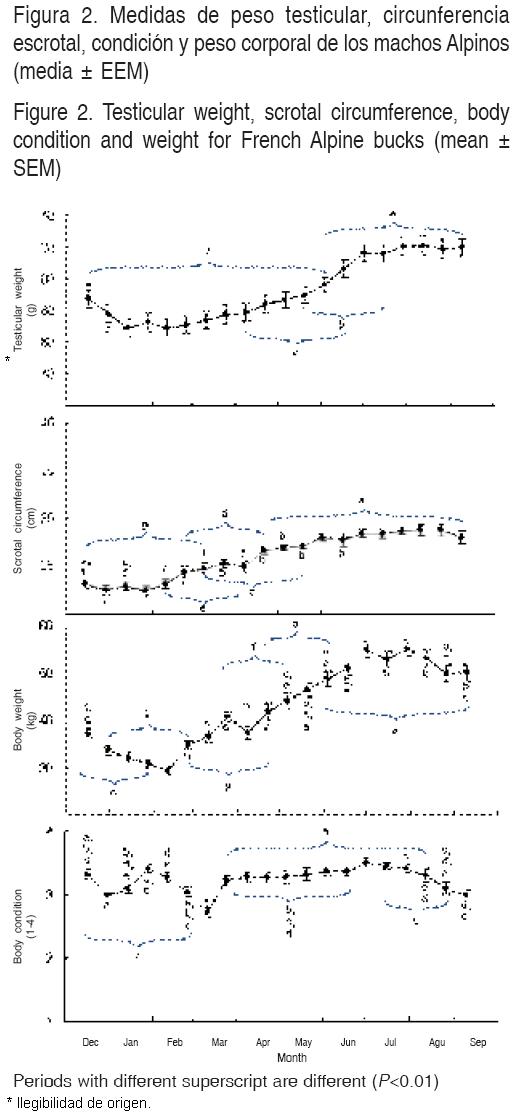
Aunque el aumento del peso testicular, circunferencia escrotal y el peso corporal tuvieron un aumento de más del 60 %, es probable que se debiera en parte a que los animales estaban todavía en crecimiento, ya que al inicio del estudio los machos tenían un año de edad(10). Sin embargo, aunque los animales sean muy jóvenes estos pueden expresar su estacionalidad reproductiva en lo que respecta a la libido, calidad y producción espermática(10,21), por otra parte al principio del estudio el peso testicular y la calidad espermática experimentaron una disminución, lo que indica que estaban en actividad y posteriormente entraron en un periodo de disminución de ésta, manteniéndose baja durante los meses de enero a julio. La mayor actividad sexual al principio del experimento (diciembre), probablemente corporal, o bien pudo ser debido al estrés del propio estudio(10,21,25). Durante este periodo la calidad seminal disminuyó drásticamente, igualmente el comportamiento sexual (los rechazos a eyacular en la vagina artificial y al tiempo de latencia a ésta), se redujo en alrededor de un 40 %, en comparación al periodo de alta actividad reproductiva. Las variaciones en la calidad espermática y el comportamiento sexual demuestran que la actividad reproductiva de estos machos es marcadamente estacional, en la cual hay un periodo del año donde el comportamiento y la calidad seminal es baja.
Estos resultados son similares a los encontrados por otros investigadores en las razas Alpinos y Saanen de las zonas templadas (45° LN), las cuales muestran un periodo de baja de la actividad sexual muy marcado (primavera – verano)(26). En estas razas, por ejemplo, el número total de espermatozoides por eyaculado aumentó al doble (2.8 X 109 en marzo, a 6 X 109 en octubre), lo cual fue similar a lo registrado en los machos del presente estudio. Asimismo en esas áreas se ha determinado que el fotoperiodo es el principal factor modulador de la actividad reproductiva(5,27). Además, es probable que aún cuando las variaciones fotoperiódicas son mayores en las zonas templadas que en las de este estudio, las variaciones en esta Región fuesen suficientes para sincronizar la actividad sexual de los machos caprinos de la raza Alpino–Francés, tal y como ocurre en las zonas templadas(5,26).
La estacionalidad reproductiva se observó aun cuando los requerimientos nutricionales fueron cubiertos satisfactoriamente. En efecto, la condición corporal se mantuvo en un nivel promedio de 3.2 durante el periodo de estudio, lo cual indica que los machos del presente estudio tuvieron una dieta adecuada que cubrió todos sus requerimientos de mantenimiento. Por ello, estos resultados sugieren que las variaciones en la actividad reproductiva de los machos son debidas más probablemente al fotoperiodo de la región; sin embargo, no se puede descartar a la alimentación como otro factor modulador de esta estacionalidad.
Además, la alta alimentación principalmente la alta concentración de proteína en la dieta pudo influir en la calidad seminal; se ha reportado que el consumo alto de proteínas decrece la calidad del semen(28), por otro lado, la dieta fue la misma durante todo el estudio y aun así la calidad seminal de los machos presentaron un periodo de buena calidad seminal, por lo que se puede descartar que la dieta pudiera haber afectado la variabilidad seminal durante el estudio. Recientemente se demostró que los caprinos locales de esta misma región presentan una estacionalidad reproductiva(29) y que ésta es dependiente del fotoperiodo: cuando los machos locales fueron sometidos a tres meses de días largos alternados con tres meses de días cortos, los niveles plasmáticos de testosterona se incrementaron en los días cortos, mientras estos disminuyeron al pasar a los días largos(29). Además, la reducción en la actividad reproductiva durante los meses de enero a mayo en los machos cabríos locales de la Comarca Lagunera fue similar a la observada en los machos Alpino–Francés del presente estudio. Esta similitud es probable que se deba a que los machos locales se derivan de la cruza de animales provenientes de zonas templadas (Alpinos, Saanen, Granadina, Nubia, etc.)(10).
Los resultados del estudio demuestran que machos cabríos Alpino–Francés jóvenes criados con un esquema intensivo a 26° LN en el subtrópico mexicano muestran un patrón estacional con respecto a calidad espermática, libido y peso testicular que se extiende de enero a julio en esta latitud.
LITERATURA CITADA
1. Ibrahim SA. Seasonal variations in semen quality of local and crossbred rams raised in the United Arab Emirates. Anim Reprod Sci 1997;(49):161–167. [ Links ]
2. Zamiri MJ, Haidari AH. Reproductive characteristics of Rayini male goats of Kerman province in Iran. Anim Reprod Sci 2006;(96):176–185. [ Links ]
3. Ahmed MMM, Makawi SA, Gadir AA. Reproductive performance of Saanen bucks under tropical climate. Small Rumin Res 1997;(26):151–155. [ Links ]
4. Al–Ghalban AM, Tabaa MJ, Kridli RT. Factors affecting semen characteristics and scrotal circumference in Damascus bucks. Small Rumin Res 2004;(53):141–149. [ Links ]
5. Chemineau P, Malpaux B, Delgadillo JA, Guerin Y, Ravault JP, Thimonier J, Pelletier J. Control of sheep and goat reproduction: Use of light and melatonin. Anim Reprod Sci 1992;(30):157–184. [ Links ]
6. Delgadillo JA. Inseminación artificial en caprinos. México: Editorial Trillas; 2005. [ Links ]
7. Chemineau P, Daveau A, Maurice F, Delgadillo JA. Seasonailty estrus and ovulation is not modified by subjecting female Alpine goats to a tropical photoperiod. Small Rumin Res 1992;8:299– 312. [ Links ]
8. Delgadillo JA, Flores JA, Véliz FG, Duarte G, Vielma J, Poindron P, Malpaux B. Control de la reproducción de los caprinos del subtrópico mexicano utilizando tratamientos fotoperiódicos y efecto macho. Vet Méx 2003;34(1):69–79. [ Links ]
9. Malpaux B, Thiéry JC, Chemineau P. Melatonin and the seasonal control of reproduction. Reprod Nutr Dev 1999;(39):355–366. [ Links ]
10. Delgadillo JA, Canedo GA, Chemineau P, Guillaume D, Malpaux B. Evidence for annual reproductive rhythm independent of food availability in male Creole goats in subtropical northern Mexico. Theriogenology 1999;(52):727–737. [ Links ]
11. Walkden–Brown SW, Restall BJ, Norton BW, Scaramuzzi RJ, Martin GB. Effect of nutrition on seasonal patterns of LH, FSH and testosterone concentration, testicular mass, sebaceous gland, volume and odour in Australian Cashmere goats. J Reprod Fertil 1994;(102):351–360. [ Links ]
12. Meza–Herrera CA, Sanchez JM, Chavez–Perches JG, Salinas H, Mellado M. Protein supplementation, body condition and ovarian activity in goats. Preovulatory serum profile of insulin. South Afric J Animal Sci 2004;34(Suppl 1):223–226. [ Links ]
13. Meza–Herrera CA, Ross T, Hallford DM, Hawkins D, Gonzalez– Bulnes A. Effects of body condition and protein supplementation on LH secretion and luteal function in sheep. Reprod Dom Anim 2007;42(5):461–465. [ Links ]
14. Gamez–Vazquez HG, Rosales–Nieto CA, Bañuelos–Valenzuela R, Urrutia–Morales J, Diaz–Gomez MO, Silva–Ramos JM, Meza Herrera CA. Body condition score positively influence plasma leptin concentrations in criollo goats. J Anim Vet Adv 2008;7(10):1237–1240. [ Links ]
15. Meza–Herrera CA, Hallford DM, Ortiz JA, Cuevas RA, Sanchez JM, Salinas H, Mellado M, Gonzalez–Bulnes A. Body condition and protein supplementation positively affect periovulatory ovarian activity by non–LH mediated pathways in goats. Anim Reprod Sci 2008;106:412–420. [ Links ]
16. Scaramuzzi RJ, Campbell BK, Downing JA, Kendall NR, Khalid M, Muñoz–Gutierrez M, Somchit A. A review of the effects of supplementary nutrition in the ewe on the concentrations of reproductive and metabolic hormones and the mechanisms that regulate folliculogenesis and ovulation rate. Reprod Nutr Dev 2006;6:339–354. [ Links ]
17. Guerra–García M, Meza–Herrera CA, Sanchez–Torres–Esqueda MT, Gallegos–Sanchez J, Torres–Hernandez G, Pro–Martinez A. IGF–1 and ovarian activity of goats in divergent body condition and supplemented with non–degradable ruminal protein. Agrociencia 2009;43(3):241–247. [ Links ]
18. Meza–Herrera CA, Gonzalez–Bulnes A, Kridli R, Mellado M, Arechiga–Flores CF, Salinas H, Luginbhul JM. Neuroendocrine,metabolic and genomic cues signaling the onset of puberty in females [in press]. Reprod Dom Anim 2009. [ Links ]
19. Walkden–Brown SW, Restall BJ, Scaramuzzi RJ, Martin GB. Seasonality in male Australian cashmere goats: Long term effects of castration and testosterone or estradiol treatment on changes in LH, FSH and prolactin concentrations and body growth. Small Rumin Res 1997;(26):239–252. [ Links ]
20. Oldham CM, Adams NR, Gherardi PB, Lindsay DR, Mackintosch JB. The influence of level of feed intake on sperm producing capacity of testicular tissue in the ram. Austr J Agric Res 1978;(29):173–179. [ Links ]
21. Delgadillo JA, Carrillo E, Morán J, Duarte G, Chemineau P, Malpaux B. Induction of sexual activity of male Creole goats in subtropical northern Mexico using long days and melatonin. J Anim Sci 2001;(79):2245–2252. [ Links ]
22. Delgadillo JA, Leboeuf B, Chemineau P. Abolition of seasonal variations in semen quality and maintenance of sperm fertilizing ability by photoperiodic cycles in goat bucks. Small Rumin Res 1992;(9):47–59. [ Links ]
23. Morris TR. Experimental design and analysis in animal sciences. CABI Publishing Wallingford, Oxon, UK. 1999. [ Links ]
24. SAS. Institute Inc. SAS/STAT user's guide, Release 6.03 edition, Cary, NC, 1992. [ Links ]
25. Delgadillo JA, Flores JA, Véliz FG, Hernández HF, Duarte G, Vielma J, Poindron P, Chemineau P, Malpaux B. Induction of sexual activity in lactating anovulatory female goats using male goats treated only with artificially long days. J Anim Sci. 2002;80(11):2780–2786. [ Links ]
26. Delgadillo JA, Chemineau P. Abolition of the seasonal release of luteinizing hormone and testosterone in Alpine male goats (Capra hircus) by short photoperiodic cycles. J Reprod Fertil 1992:(94):45–55. [ Links ]
27. Delgadillo JA, Leboeuf B, Chemineau P. Decrease in the seasonality of sexual behavior and sperm production in bucks by exposure to short photoperiodic cycles. Theriogenology 1991;(36):755–770. [ Links ]
28. Kaur H, Arora SP. Dietary effects on ruminant livestock reproduction with particular reference to protein. Nutr Res Rev 1995;(8):121–136. [ Links ]
29. Delgadillo JA, Cortez ME, Duarte G, Malpaux B. Evidence that the photoperiod controls the annual changes in testosterone secretion, testicular and body weight in subtropical male goats. Reprod Nutr Dev 2004;(44):183–193. [ Links ]














