Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.1 no.2 Mérida abr./jun. 2010
Artículos
Determinación de la fijación biológica de N2 usando la técnica de abundancia natural del N15 en tres ecotipos de cacahuate forrajero
Assessment of N2 fixation by three forage peanut ecotypes using 15N natural abundance technique
Braulio Valles de la Moraa, Georg Cadischb
a Centro de Enseñanza, Investigación y Extensión en Ganadería Tropical, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, Martínez de la Torre, Veracruz, 93600, México. Teléfono: +232 32 43941; braulio_36@hotmail.com. Correspondencia al primer autor.
b Institute of Plant Production and Agroecology in the Tropics and Subtropics, University of Hohenheim, cadisch@uni–hohenheim.de.
Recibido el 21 de abril de 2009
Aceptado para su publicación el 27 de octubre de 2009
RESUMEN
Se midió la proporción de nitrógeno atmosférico (N2) biológicamente fijado, utilizando el método de abundancia natural de N15 , en tres ecotipos de la leguminosa forrajera Arachis pintoi (Ap): CIAT 17434, 18744 y 18748, empleando el inoculante mejorado Bradyrhizobium CIAT 3101 (BS), y una mezcla de cepas nativas (NS) de un suelo de Veracruz, México. Como plantas de referencia, se usaron la leguminosa no–nodulante Arachis hypogaea, y las gramíneas forrajeras Brachiaria arrecta, Brachiaria brizantha y Cynodon nlemfuensis. El experimento se estableció en condiciones de invernadero, y se realizaron cinco muestreos. Los rendimientos más altos de materia seca se lograron con los ecotipos inoculados con BS (98.3 ± 10.0 g maceta–1) vs plantas con NS (19.9 ± 1.4 g maceta–1). Los valores de δ (delta) N15 en los ecotipos 17434, 18744 y 18748 fueron, 8.4, 5.7, 7.7 ‰; y 1.2, 1.0 y 3.5 ‰ para NS y BS, revelando estos últimos una mayor dependencia del N2 para crecer. Todas las plantas de referencia mostraron efectos positivos de BS sobre el porcentaje de N2 fijado: 92.7 ± 1.8 vs 6.5 ± 7.6 con ecotipos inoculados con NS. Se concluyó que el N2 fijado fue altamente dependiente de la cepa de Rhizobium, y Bradyrhizobium CIAT 3101 fue más eficiente para fijar N2. Los ecotipos Arachis pintoi CIAT 17434 y 18744 mostraron los más altos valores de fijación de N2. Arachis hypogea destacó como planta de referencia debido a su patrón de crecimiento similar a Arachis pintoi.
Palabras clave: Arachis pintoi, Plantas de referencia, Bradyrhizobium, Abundancia natural de N15.
ABSTRACT
The percentage of nitrogen derived from N2 fixation was measured by the 15N natural abundance method, in three Arachis pintoi (Ap) ecotypes: CIAT 17434, 18744 and 18748, using an improved Bradyrhizobium strain CIAT 3101 (BS), and a mixing of native strains (NS). As reference plants, a non–nodulating Arachis hypogaea, Brachiaria arrecta, B. brizantha and Cynodon nlemfuensis were used. The experiment was set up under greenhouse conditions, and five harvests were done. Dry matter yield was highest in Ap ecotypes and BS (98.3 ± 10.0 g pot–1), vs plants with NS (19.9 ± 1.4 g pot–1). Values of δ (delta) 15N in the ecotypes 17434, 18744 and 18748 were, 8.4, 5.7, 7.7 ‰, and 1.2, 1.0 and 3.5 ‰ for NS and BS, revealing for the later group more N2 dependence to grow. All reference plants showed positive effects of the BS on the percentage of N2 fixed: 92.7 ± 1.8 vs 6.5 ± 7.6 with ecotypes inoculated with NS. It was concluded that the N2 fixed was highly dependent of the Rhizobium strain, and Bradyrhizobium CIAT 3101 strain was more efficient to fix N2. The Arachis pintoi ecotypes CIAT 17434 and 18744 showed the highest N2 fixing values. A. hypogaea highlighted as reference plant considering its growth pattern similar to A. pintoi.
Key words: Arachis pintoi, Reference plants, Bradyrhizobium strain, 15N natural abundance method.
INTRODUCCIÓN
Las sabanas neo tropicales de América del Sur cubren alrededor de 250 millones de hectáreas, y se encuentran asociadas con otros importantes biomas como la cuenca del Amazonas y la región del Chaco en Bolivia, Paraguay y Argentina(1). Las pasturas tropicales en esta región se encuentran sujetas a deterioro y degradación debido, entre otras causas, al sobrepastoreo y la subsecuente erosión del suelo, deficiencias minerales (principalmente N y P), y por la presencia de plagas y enfermedades(2).
Desde hace muchos años, se ha propuesto en áreas tropicales, el uso de leguminosas fijadoras de N2 para mejorar la fertilidad del suelo y en consecuencia la productividad de las pasturas(3), ya que la fijación biológica de nitrógeno (N2) constituye una fuente gratuita de N, las leguminosas forrajeras tropicales representan una manera económica de disponer de N para el sistema suelo–planta–animal. Este aporte de N al sistema puede ser directo (N2 fijado en granos cosechados, o en pastoreo por el ganado) o indirecto (N proveniente de la descomposición de los residuos vegetales). Sin embargo, los beneficios al sistema no son, en muchos casos, inmediatos, ya que se requiere mejorar otros factores complementarios tales como la presencia de cepas efectivas de Bradyrhizobium(4), y la selección de leguminosas persistentes, para lograr los beneficios deseados(5).
Ninguno de los métodos actualmente disponibles, determina el N simbióticamente fijado sin introducir algún error inherente al método, y se ha mencionado que no existe una manera fácil de medir la fijación de N2, además de que debe considerarse cuidadosamente el diseño experimental, ya sea para lograr mediciones precisas o para realizar determinaciones comparativas(3). Los métodos de abundancia natural de N15 y de dilución de N15 han sido aplicados para estimar la proporción de N derivado de la fijación de N2 en leguminosas forrajeras.
La abundancia natural de N15 es un método basado en pequeñas diferencias entre el N2 atmosférico (0.3663% de átomos N15) y el N del suelo. Considerando que el N del suelo es generalmente más abundante en N15 que el N2 atmosférico, se espera que plantas no–fijadoras de N, en las cuales la fuente primaria de este elemento es el suelo, deberían tener más N15 que plantas fijadoras que toman el N2 de la atmósfera y del suelo. La precisión con este método para el N2 fijado, se ve afectado por el grado y uniformidad de la abundancia de N15 en suelos con pasturas. Algunos autores han sugerido una escala mínima de enriquecimiento entre 2 a 7 ‰ δ (delta) unidades de N15(6).
La contribución de leguminosas mejoradas como componente forrajero es más importante cuando éstas se asocian con gramíneas, ya que se benefician del N fijado por las primeras(7). En años recientes, se han evaluado nuevas leguminosas forrajeras tropicales para mejorar la productividad y calidad de las pasturas. Algunos de estos géneros son (en orden alfabético) Arachis, Centrosema, Desmodium, Mucuna y Stylosanthes. Resultados de investigaciones en zonas cálidas y húmedas de México y otras partes de América Latina han mostrado que la leguminosa forrajera Arachis pintoi CIAT 17434 es un buen prospecto para asociarlo a gramíneas, debido a su mejor persistencia en el terreno y también por su alto valor nutritivo y palatabilidad(8,9,10).
Con el fin de determinar su valor e idoneidad en el mejoramiento de los sistemas de producción animal en el trópico, y en el mantenimiento o mejoramiento de los niveles de N en el suelo, es importante la cuantificación precisa del N2 que puede ser simbióticamente fijado por estas leguminosas(11). La cepa de Bradyrhizobium CIAT 3101 se ha identificado como una cepa exitosa para inocular ecotipos de A. pintoi(12,13). Sin embargo, en el caso de cepas nativas de Rhizobium, y de acuerdo con varias experiencias(13–16), a la fecha es aun desconocido su papel para promover nodulaciones efectivas. Existe, en suelos tropicales, una gran diversidad de cepas nativas que pueden fijar N2 requerido por cultivos de leguminosas, o para proporcionar nuevos aislamientos a fin de producir inoculantes efectivos(17).
Los objetivos de este estudio fueron, cuantificar la contribución de la fijación biológica de nitrógeno (FBN) por tres ecotipos de Arachis pintoi, empleando la técnica de abundancia natural de N15, y determinar la cepa de Rhizobium más apropiada para el crecimiento y acumulación de N por los mencionados ecotipos.
Por lo anterior, se incluyeron en este experimento, cepas nativas e introducidas con el fin de adquirir experiencia acerca de su potencial para promover la fijación de N2.
MATERIALES Y MÉTODOS
El experimento se estableció en condiciones de invernadero en el Imperial College, Wye (Inglaterra), para determinar la fijación de N2 por los ecotipos de Arachis pintoi CIAT 17434, 18744 y 18748 por el método de abundancia natural de N15, usando cuatro plantas de referencia: la leguminosa nonodulante Arachis hypogaea, Brachiaria arrecta, B. brizantha y Cynodon nlemfuensis. Se usó un suelo del campo experimental de Wye College (condado de Kent), con un enriquecimiento en N15 similar (7.5 0/00) a los suelos de Veracruz, México (7.7 0/00). El suelo se combinó con 1/3 de arena, y se caracterizó por un pH de 6.8, N total de 0.38% y δ N15 de 7.5 0/00. Los valores de Ca, K y Mg fueron de 16.5, 0.8 y 0.9 cmol (+)/kg suelo; y de P, 30.9 m/g suelo, y un contenido de 11, 19, 24 y 46 % para arcilla, limo, arena fina y arena gruesa, respectivamente; clasificado como franco–arenoso. El suelo fue secado al aire y tamizado en malla de 2 mm.
Para los tres ecotipos de Arachis pintoi, A. hypogaea y B. brizantha, se empleó semilla esterilizada; y para las restantes especies se usó material vegetativo (estolones). Las semillas y estolones se sembraron en macetas esterilizadas (17.5 x 17.5 x 12.5 cm, 2 kg de la mezcla suelo–arena), y después de la emergencia de las plántulas, se dejaron sólo dos de ellas por maceta.
Después de la germinación, los ecotipos de Arachis pintoi fueron inoculados con la cepa de Bradyrhizobium CIAT 3101 (19 x 107 células maceta–1) o con una solución de suelo (1:5 suelo/ agua destilada), mezcla de cepas nativas preparada de un suelo de Veracruz, México, con vegetación nativa. Al interior del invernadero, y durante todo el experimento, la temperatura y humedad del aire fueron de 26 ºC y 70 %, respectivamente.
Diecinueve días después de la siembra, las leguminosas y las plantas de referencia se trataron con una solución nutritiva, dos veces por semana, a un volumen de 200 ml semana–1. Adicionalmente, y a la misma frecuencia, se añadió una solución de 0.5 ml L–1 de micro–nutrientes. Cuando se requería, las plantas fueron regadas a su capacidad de campo con agua deionizada.
Se realizaron cinco cortes (tallos y hojas) tanto en leguminosas como en gramíneas, estimándose su materia seca, a una frecuencia en promedio de 73 días; pero el primer corte fue a los 53 días, tiempo que se consideró suficiente para que las plantas nodularan y empezaran a fijar N2. El periodo experimental, incluyendo el tiempo de establecimiento (53 días) fue de 345 días. No se realizó corte de uniformización. El material cosechado se secó a 40 °C en estufa de aire forzado, pesado y molido con malla fina (<1 mm), usando un molino de martillos. Se tomaron sub–muestras, las cuales fueron pesadas, colocadas en cápsulas y analizadas por duplicado para N% y δ N15 0/00, usando un espectrómetro de masas (Europa Scientific 20–20, Crewe, UK) acoplado a un analizador C/N (Roboprep).
La proporción del N total atmosférico derivado de la fijación (%Ndfa) por las leguminosas se calculó usando la siguiente ecuación(3):

Donde B es el valor de δ N15 de la leguminosa que crece con N2 atmosférico como la única fuente de nitrógeno, δ N15 ref y δ N15 leg son las unidades δ N15 (0/00) para la planta de referencia y leguminosa, respectivamente. Se emplearon valores de B de los tallos y hojas correspondiente a cada ecotipo (plantas maduras). Para los ecotipos 17434, 18744 y 18748 inoculados con cepas nativas estos valores fueron (0/00), 1.11, 1.54 y 0.61; mientras que para los ecotipos con la cepa de Bradyrhizobium CIAT 3101, los valores de B, calculados de un experimento previo, fueron (0/00) 0.08, – 0.18 y –0.29, respectivamente.
Se empleó un diseño completamente al azar, en parcelas divididas, con las cepas como parcelas principales, y las leguminosas y plantas de referencia como sub–parcelas, repetidas cuatro veces (macetas). Los datos fueron sometidos a análisis de varianza, y las diferencias entre tratamientos se determinaron por diferencia mínima significativa al nivel de P≤0.01, usando el programa estadístico GenStat(18).
RESULTADOS Y DISCUSIÓN
Rendimiento de materia seca (RMS)
Los resultados de RMS fueron consistentes para los ecotipos con la cepa de Bradyrhizobium CIAT 3101 (P<0.01), comparados con las cepas nativas (Cuadro 1). Desde el segundo corte, el RMS fue siempre superior (P<0.01) para los ecotipos inoculados con la cepa 3101. En promedio, las leguminosas con cepas nativas produjeron sólo 14 % (4.0 ± 0.79 g maceta–1) del forraje producido por el otro grupo (28.6 ± 4.5 g maceta–1).
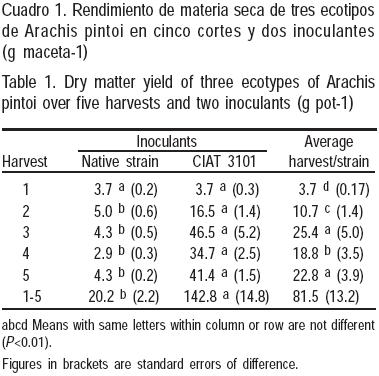
Considerando los grupos inoculados con la cepa CIAT 3101, el segundo y tercer corte mostraron un incremento significativo, probablemente debido a un mejoramiento de las condiciones ambientales y al largo del periodo de crecimiento. Se encontraron diferencias altamente significativas para las interacciones cepa/corte y ecotipo/corte. Los ecotipos de Arachis pintoi 17434 y 18744 inoculados con esta cepa mejorada, mostraron el más alto RMS acumulado, con 152.0 ± 4.3 y 162.5 ± 4.8 g maceta–1, respectivamente, y fueron diferentes (P<0.01) al ecotipo 18748 que promedió 113.8 ± 12.8 g maceta–1. No se encontró una explicación a este comportamiento, considerando que todos fueron tratados con la misma cepa.
La ausencia de diferencias en RMS por efecto de las cepas al primer corte pudo deberse a una alta disponibilidad de N mineral durante las primeras semanas del experimento. Posteriormente, las diferencias fueron más evidentes a favor de las leguminosas con la cepa CIAT 3101.
Se han reportado evidencias experimentales de la cepa mejorada Bradyrhizobium CIAT 3101, tanto sobre efectos positivos como negativos, en el rendimiento de materia seca de leguminosas. En Costa Rica, Villarreal y Vargas(19) usaron la misma cepa y los mismos ecotipos de Arachis pintoi, pero no encontraron una respuesta a la inoculación.
La presencia de cepas nativas efectivas y competitivas, o una alta disponibilidad de N mineral del suelo para las plantas, podría ser la razón para explicar esta falta de respuesta. Como aquí se observó, al final, el ecotipo 18744 fue el más productivo (644 g m2).
En Carimagua, Colombia, en suelos no perturbados, se evaluaron 31 cepas de Bradyrhizobium en kudzú (Pueraria phaseoloides), incluyendo la cepa mejorada CIAT 3101. Con esta cepa, la leguminosa produjo 49.7 mg of N planta–1, valor que fue similar al más alto obtenido con la que se consideró la mejor cepa (CIAT 3221) evaluada (54.7 mg of N planta–1)(20).
En Brasil, y en condiciones de invernadero, se probó el efecto de 11 cepas mejoradas de Bradyrhizobium, así como de cepas nativas, comparándolas con plantas fertilizadas con N mineral, sobre la nodulación y RMS en Arachis pintoi. Noventa días después de la siembra, se encontró que la cepa CIAT 3101, fue estadísticamente comparable a los tratamientos con fertilizante nitrogenado, en términos de RMS y nodulación(14). Otras referencias han destacado el papel de esta cepa para promover altos rendimientos de materia seca. También en Brasil, en un experimento donde se evaluaron 48 cepas, CIAT 3101 tuvo efectos positivos en RMS, N (%) y N total en Arachis pintoi CIAT 17434 y en el ecotipo BRA 031143, comparados con un tratamiento que incluía N mineral(12).
Rendimiento de N considerando las cepas de Rhizobium
El N producido por las leguminosas inoculadas con la cepa CIAT 3101, fue claramente mayor que el N de las leguminosas con cepas nativas (Cuadro 2). Las cantidades acumuladas de N fueron diferentes (P<0.01) entre estos dos grupos. Por corte, los ecotipos con cepas nativas acumularon una mayor cantidad de N sólo al primer corte, pero después de éste, declinó a un rango de 48 a 71 mg N maceta–1. En contraste, los ecotipos con la cepa CIAT 3101 mostraron un incremento desde el primero al quinto corte.

La producción de N, en el caso de los ecotipos con cepas nativas, mostró un patrón de disminución después del primer corte, probablemente debido a que las leguminosas usaron el N de sus semillas, así como el N mineral disponible, después de alterar el suelo al momento de la siembra, evitando, en los subsecuentes cortes, un crecimiento más vigoroso, o debido a la presencia de cepas nativas ineficientes en el suelo. Una tendencia opuesta se observó en los ecotipos con la cepa CIAT 3101.
Estos resultados concuerdan con Pinto et al(14) en Brasil, quienes observaron en condiciones de invernadero, que Arachis pintoi tuvo un alto rendimiento de N cuando se inoculó con la misma cepa; en contraste, el rendimiento de N con cepas nativas fue muy pobre. Otros investigadores, en un experimento con jarras de Leonard, encontraron que la cepa mejorada CIAT 3101 tuvo un rendimiento de N significativamente más bajo al infectar plantas de P. phaseoloides(20).
Rendimiento de N en plantas de referencia
El rendimiento de N en las gramíneas fue estadísticamente similar entre ellas y mayor que en la leguminosa no–nodulante (P<0.01; Cuadro 3); en promedio, las gramíneas produjeron 52 % más N que Arachis hypogaea durante todo el experimento. Después del segundo corte, el rendimiento de N en B. arrecta y C. nlemfuensis tendió a disminuir. La producción de N por corte en las plantas de referencia mostró diferencias (P<0.01) entre ellos, y se produjeron 56 % más N en el segundo corte que en los restantes, los que en promedio produjeron 64.3 mg maceta–1 .
Aunque el contenido de N en la leguminosa nonodulante A. hypogaea fue más alto comparado con las gramíneas, su bajo rendimiento de materia seca no permitió cantidades significativas de N (Cuadro 3). Lo contrario se observó para las gramíneas. Estas últimas, aun con un pobre contenido de N (1.2 %) presentaron altos rendimientos de materia seca, con 1.7 veces más N que A. hypogaea. El rendimiento de N logrado en el primer corte por A. hypogaea y B. brizantha fue muy bajo debido a que estas plantas fueron sembradas con semillas, por lo que al inicio del experimento su crecimiento fue más lento. Estas cantidades de N, comparadas con otras experiencias, son bajas. Se ha informado que el pasto Dichanthium aristatum produjo en un rango de 1.14 a 1.56 mg N g suelo–1 en un experimento donde se midió la tasa de N transferido por la leguminosa Gliricidia sepium a esta gramínea en un sistema silvopastoril(21).
En el segundo corte, el alto rendimiento de N registrado, se debió probablemente a que las plantas tuvieron acceso a una alta disponibilidad de N del suelo después del periodo de establecimiento. Luego de este corte, la subsiguiente caída en el rendimiento de N se debió muy probablemente a que las gramíneas agotaron el N del suelo, limitando así su rendimiento de materia seca y contenido de N; sin embargo, no hay otras evidencias disponibles.
Valores de δ N15
Los valores de δ N15, expresados como partes por millón (‰) relativos a la composición de N15 en el N2 atmosférico, de hojas y tallos de los ecotipos de leguminosas, se presentan en la Figura 1. Se encontraron claras diferencias entre los dos grupos inoculados, las cuales fueron más evidentes a partir del segundo corte (P<0.01). Los promedios para cada grupo, a lo largo de todo el experimento fueron, 7.2 ± 0.52 ‰ y 1.9 ± 0.84 ‰ para las cepas nativas y mejorada, respectivamente. En todos los casos, los valores más bajos se registraron en el último corte con 6.2 ± 0.18 ‰ y –0.11 ± 0.08 ‰ para las cepas nativas y mejorada, respectivamente.
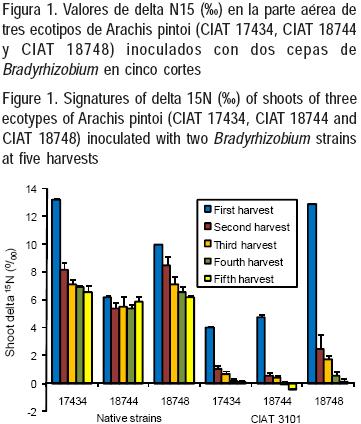
Los valores más bajos de δ N15 en hojas y tallos se encontraron en las leguminosas con la cepa mejorada de Bradyrhizobium, en comparación con el grupo de Rhizobium nativo. En las primeras, fue más evidente que desde el segundo corte y hasta el final del experimento tendieron hacia valores negativos, indicando una substancial dilución del N15 con valores más cercanos al N2 atmosférico, lo cual reveló una mayor dependencia de las plantas por esta fuente de N para su crecimiento. Los valores de δ N15 en tallos y hojas pueden variar de acuerdo a la leguminosa, tejido o cepa de Rhizobium.
Boddey et al(11) informaron de variaciones en los valores de δ N15 conforme pasaba el tiempo, en la leguminosa arborea no–nodulante Senna spectabilis en crecimiento al lado de parcelas (separados por 0.5 m) con árboles fijadores de N2 como Calliandra calothyrsus, Gliricidia sepium y Codariocalyx gyroides. Los promedios para los árboles fijadores, a 52, 65, 91 y 104 semanas postsiembra, fueron de: 4.07 4.17 4.12 y 3.63 ‰, respectivamente. Este comportamiento es similar al del presente experimento, donde, a través del tiempo, se observó una disminución en los valores de δ N15 . En Brasil, Behling–Miranda et al(22) determinaron la fijación de N2 en siete accesiones de Arachis usando como plantas de referencia a Panicum maximum cv Massai, P. repens, y las especies invasoras Solanum viarum, Sonchus spp y Sida rhombifolia. Ellos encontraron que las accesiones de Arachis presentaron una disminución en los valores de δ N15 (promedio de 1.97 0/00) en comparación con las plantas testigo (6.99 0/00). Esta última cifra sugirió que el N del suelo se enriqueció con δ N15, indicando también lo anterior, una mayor confianza en la técnica utilizada. Como sucedió en este experimento, las accesiones de Arachis pintoi inoculadas con la cepa mejorada registraron una caída en los valores de δ N15 conforme pasa el tiempo (Figura 1).
Porcentajes de N2 fijado
En los primeros dos cortes, se registró una alta variabilidad en la fijación de N2 (Figura 2), incluso con estimaciones negativas en ecotipos inoculados con la cepa nativa usando como plantas de referencia a B. arrecta y C. nlemfuensis. Sin embargo, desde el tercer corte hasta el final del experimento (Figura 3), todas las plantas de referencia presentaron un efecto positivo en el porcentaje de N2 fijado, por efecto de la cepa mejorada: 92.7 ± 1.8 %, en comparación con los ecotipos con cepas nativas (6.5 ± 7.6 %). Desde el tercer corte, los porcentajes de fijación de nitrógeno fueron altos independientemente de la planta de referencia usada. Para este grupo, no se encontraron diferencias estadísticas en la interacción planta–cepa.

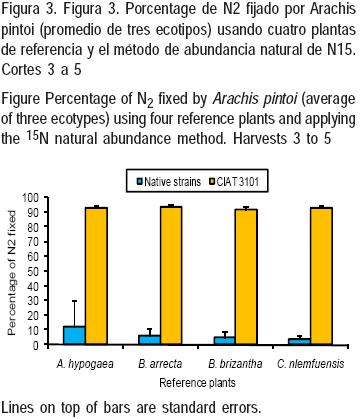
El efecto de la cepa de Bradyrhizobium es evidente, independientemente del ecotipo de leguminosa, y las diferencias en el porcentaje de fijación de N2 son considerables entre los dos grupos, promediando: 21.6 ± 3.2 y 86.2 ± 2.4 % (P<0.01), respectivamente. Los promedios de N2 (%) fijados por ecotipo (17434, 18744 y 18748), fueron, para los ecotipos inoculados con la cepa mejorada de Bradyrhizobium, los valores fueron: 91.2, 89.5 y 78.0 %, respectivamente (P<0.01). Desde el primero al quinto corte, se encontró una tendencia de incremento en la fijación de N2 (%) para los ecotipos con la cepa mejorada, con promedios de 63.1 ± 11.7, 86.5 ± 3.7, 84.6 ± 3.1, 96.0 ± 1.6 y 100.0 ± 1.3, respectivamente. Por el contrario, la tendencia fue la opuesta para los ecotipos con cepas nativas (Figura 3). Esto puede explicarse por la ineficiencia en el establecimiento de una simbiosis efectiva, por parte de las cepas nativas de Rhizobium usadas aquí.
Los mejores resultados se obtuvieron con las leguminosas inoculadas con la cepa CIAT 3101, independientemente de la planta de referencia usada. Se ha encontrado que la cepa Bradyrhizobium CIAT 3101 mostró una alta eficiencia para fijar N2, al compararla con 38 cepas nativas, donde la mitad de ellas presentaron baja efectividad o fueron inefectivas para fijar N2(14). En Veracruz, México, cepas nativas de Rhizobium provenientes de nódulos de la leguminosa arbórea Gliricidia sepium mostraron efectividad para fijar N2, y varias de ellas registraron rendimientos altos de materia seca(15).
Peoples et al(23) no encontraron diferencias en la fijación de N2 por A. hypogaea al evaluar tres cepas de Bradyrhizobium (promedio de 101 kg ha–1) en comparación con cepas nativas (98 kg ha–1). Ellos atribuyeron esta falta de respuesta, a la presencia en el suelo de rhizobio efectivo naturalizado. También con A. hypogaea no–inoculada, se ha informado de valores de N2 fijado de 53 y 21% en el primero y segundo año, respectivamente, usando cacahuate no–nodulante como planta de referencia(24). En un experimento con especies de Sylosanthes no–inoculadas, se observaron aceptables niveles de N2 fijado (%): 82, 73, 77 y 64, para S. capitata, S. guianensis, S. macrocephala y S. scabra, respectivamente, lo cual sugirió la presencia de una población eficiente de Rhizobium nativo(25).
También, se evaluaron siete accesiones de Arachis no–inoculadas usando el método de abundancia natural de N15, sin encontrar diferencias significativas para fijación de N2 entre los materiales evaluados, y las cifras oscilaron de 36 % (BRA15121, equivalente a Arachis pintoi CIAT 18748) a 90 % (BRA31128), con 26 y 99 kg N ha–1, respectivamente(22). Los autores atribuyeron esta alta variación como un resultado de las diferentes capacidades de las accesiones evaluadas en relación con el establecimiento de simbiosis con cepas nativas de Bradyrhizobium, considerando que las plantas no fueron inoculadas al momento de la siembra; como el terreno presentaba un gran número de leguminosas nativas, se asumió que el suelo tenía una población estable de Bradyrhizobium. El bajo nivel de N2 fijado por Arachis pintoi CIAT 18748(22) fue similar al encontrado en este experimento.
La selección de una apropiada planta de referencia constituye todavía un dilema, debido a que los resultados no siempre son consistentes(26). Considerando que este experimento se realizó en condiciones de invernadero, algunos de los criterios de selección para plantas de referencia, como es la "zona de enraizamiento", no se pueden aplicar aquí, ya que las plantas que crecen en macetas no siempre muestran su verdadera arquitectura radicular, como es la proliferación de raíces finas o adventicias, y finalmente, un limitado volumen de raíces.
El grado de dependencia en la fijación de N2 con la cepa mejorada y usando la leguminosa nonodulante A. hypogaea como planta de referencia fue alta, comparado con un informe de Cadisch et al(24) quienes no encontraron diferencias al usar A. hypogaea (49 %) o maíz (48 %) como plantas de referencia durante el primer año en un experimento de campo. Estas últimas cifras son similares al dato de 47 % reportado por Peoples et al(23) usando también planta de cacahuate nonodulante. Varios investigadores han informado acerca del uso de gramíneas forrajeras tropicales como plantas de referencia. En un experimento donde se empleó B. decumbens y Paspalum plicatulum como plantas de referencia para cuatro especies de Stylosanthes, se encontró que las leguminosas fijaron más N2 con Paspalum plicatulum (80 %) que con B.decumbens (71 %) como planta de referencia(25).
Considerando que no siempre es posible comparar resultados de fijación de N2 obtenidos en invernadero, con aquellos realizados en campo, esto nos lleva a hacer algunas observaciones de experiencias en campo. En esta condición, se evaluó la respuesta a la inoculación del ecotipo de Arachis pintoi BRA 031143 (CIAT 22160) con cepas de rhizobio seleccionadas, encontrándose que la cepa Bradyrhizobium CIAT 3101 fue inefectiva para esta leguminosa. La pobre respuesta fue atribuida a un alto nivel de N en el suelo(27).
Los valores de N2 fijado reportados por Soares et al(28) con A. repens BR 31861 y 31801, A. pintoi 31828 y 31496, fueron menores (70 %) a los aquí encontrados. Ellos mencionaron que estas leguminosas tuvieron un mejor desempeño, y destacaron que el 75 % del rendimiento de materia seca producida fue debido al nitrógeno fijado. Otros autores han mencionado que a altas tasas de fijación, cuando en las leguminosas los valores de d15N son cercanos al 0 ‰, la metodología llega a ser relativamente insensible a cambios en los valores de d15N en la planta de referencia(6,29).
CONCLUSIONES E IMPLICACIONES
Las tasa de fijación de N2 estimadas por el método de abundancia natural, fueron más que aceptables; aunque el riesgo de errores está presente, cuando las plantas de referencia no son las adecuadas para una leguminosa en particular. Los cortes sucesivos confirmaron la idoneidad de Arachis hypogaea como planta de referencia debido a su similar patrón de crecimiento y sistema radicular. La cepa mejorada Bradyrhizobium CIAT 3101 fue más eficiente para fijar N2 que las cepas nativas.
AGRADECIMIENTOS
A la Universidad Nacional Autónoma de México (UNAM), y al Consejo Nacional de Ciencia y Tecnología (CONACYT) por su apoyo para la realización de estos estudios. A Jonathan Fear (Imperial College, Wye, UK) por su apoyo técnico en los análisis de isótopos.
LITERATURA CITADA
1. Vera RR. Research in agropastoral systems: Background and strategies. In: Guimaraes, EP Editores. Agropastoral systems for the tropical savannas of Latin America. CIAT publication No. 338. Cali, Colombia. 2004:3–10. [ Links ]
2. Silva JE da, Resck DVS, Corazza EJ, Vivaldi L. Carbon storage in clayey Oxisol cultivated pastures in the "Cerrado" region, Brazil. Agr Ecosyst Environ 2004;103:357–363. [ Links ]
3. Unkovich M, Herridge D, Peoples M, Cadisch G, Boddey R, Giller, K, Alves B, Chalk P. Measuring plant–associated nitrogen fixation in agricultural systems. ACIAR Monograph No. 136, 2008. [ Links ]
4. Sanginga N, Thottappilly G, Dashiell K. Effectiveness of rhizobia nodulating recent promiscuous soyabean selections in the moist savanna of Nigeria. Soil Biol Biochem 2000;32:127–133. [ Links ]
5. Giller KE, Cadisch G. Future benefits from biological nitrogen fixation: An ecological approach to agriculture. Plant Soil 1995;174:255–277. [ Links ]
6. Unkovich MJ, Pate JS, Sanford P, Armstrong EL. Potential precision of the delta 15N natural abundance method in– field estimates of nitrogen fixation by crop and pasture legumes in South–West Australia. Aust J Agric Res1994;45:119–132. [ Links ]
7. Tessema Z, Baars RMT. Chemical composition, dry matter production and yield dynamics of tropical grasses mixed with perennial forage legumes. Tropical Grasslands 2006;40:150–156. [ Links ]
8. Castillo–Gallegos E. Improving a native pasture with the legume Arachis pintoi in the humid tropics of México [Ph.D. Thesis]. Wageningen, Netherlands: Wageningen University; 2003. [ Links ]
9. Ascencio L, Valles B, Castillo E, Jarillo J. Dinámica de población de plantas de Arachis pintoi CIAT 17434, asociada a gramas nativas en pastoreo, en el trópico húmedo de México. Téc Pecu Méx 2005;43(2):275–286. [ Links ]
10. Castillo GE, Valles B, Mannetje L, Aluja A. Efecto de introducir Arachis pintoi sobre variables del suelo de pasturas de grama nativa del trópico húmedo mexicano. Téc Pecu Méx 2005;43(2):287–295. [ Links ]
11. Boddey RM, Peoples MB, Palmer B, Dart PJ. Use of the 15N natural abundance technique to quantify biological nitrogen fixation by woody perennials. Nutr Cycling in Agroecosystems 2000;57:235–270. [ Links ]
12. Purcino HMA, Festin PM, Elkan GH. Identification of effective strains of Bradyrhizobium for Arachis pintoi. Trop Agric 2000;77:226–231. [ Links ]
13. Thomas RJ. Rhizobium requirements, nitrogen fixation, and nutrient cycling in forage Arachis. In: Kerridge KC, Hardy B editors. Biology and agronomy of forage Arachis pintoi. Cali, Colombia: CIAT publication No.240;1994:84–94. [ Links ]
14. Pinto PP, Carneiro JA, Vargas MAT, Purcino HA, Sá NMH. Indigenous rhizobia associated with Arachis pintoi in Cerrado soils of Brazil. Pasturas Tropicales (Colombia) 1999;21(2):25–28. [ Links ]
15. Melchor–Marroquin JI, Vargas HJJ, Ferrera CR, Krishnamurthy L. Screening Rhizobium spp strains associated with Gliricidia sepium along an altitudinal transect in Veracruz, Mexico. Agroforestry Systems 1999;46:25–38. [ Links ]
16. Castro S, Permigiani M, Vinocur M, Fabra A. Nodulation in peanut (Arachis hypogaea L.) roots in the presence of native and inoculated rhizobia strains.Appl Soil Ecol 1999;13:39–44. [ Links ]
17. Mendez NJRC, Mayz FJ. Comportamiento simbiótica de poblaciones rizobianas nativas de suelos de sabana en Arachis hypogaea L. Rev Fac Agron (LUZ, Venezuela) 2000;17:36–50. [ Links ]
18. GenStat Discovery. GenStat Discovery Edition 3. VSN International, UK. [on line] http://www.vsni.co.uk/downloads/genstat–discovery/. Accessed Feb 22, 2009. [ Links ]
19. Villarreal M, Vargas W. Establecimiento de tres ecotipos de Arachis pintoi utilizando material vegetativo e inoculación en condiciones del trópico. Reunión Latinoamericana de Rhizobiologia. Santa Cruz, Bolivia. 1996:133–135. [ Links ]
20. Sylvester–Bradley R, Mosquera D, Asakawa NM, Sanchez G. Promiscuity and responses to rhizobial inoculation of Tropical Kudzu (Pueraria phaseoloides). Field Crop Res 1991;27:267– 279. [ Links ]
21. Sierra J, Nygren P. Transfer of N fixed by a legume tree to the associated grass in a tropical silvopastoral system. Soil Biol Biochem 2006;38:1983–1903. [ Links ]
22. Behling–Miranda CH, Vieira A. Cadisch G. Determinaçăo da fixaçăo biológica de nitrogęnio no Amendoim Forrageiro (Arachis spp.) por intermédio da abundância natural de 15N. Rev Bras Zoot 2003;32:1859–1865. [ Links ]
23. Peoples MB, Bell MJ, Bushby HVA. Effect of rotation and inoculation with Bradyrhizobium on nitrogen fixation and yield of peanut (Arachis hypogaea L, Cv Virginia Bunch). Aust J Agric Res 1992;43:595–607. [ Links ]
24. Cadisch G, Hairiah K, Giller KE. Applicability of the natural 15N abundance technique to measure N2 fixation in Arachis hypogaea grown on an Ultisol. Neth J Agric Sci 2000;48(1):31–45. [ Links ]
25. Behling–Miranda CH, Fernandes CD, Cadisch G. Quantifying the nitrogen fixed by Stylosanthes. Pasturas Tropicales (Colombia) 1999;21(1):64–69. [ Links ]
26. Chalk PM, Ladha JK. Estimation of legume symbiotic dependence: an evaluation of techniques based on 15N dilution. Soil Biol Biochem 1999;31:1901 1917. [ Links ]
27. Purcino HMA, Sa NMH, Viana MCM, Scotti MR, Mendes IC, Vargas MAT. Response of Arachis pintoi to inoculation with selected rhizobia strains in Brazilian Cerrado soils under field conditions. Pasturas Tropicales (Colombia) 2003;25(2): 26–29. [ Links ]
28. Soares PG, Silva de Resende A, Urquiaga S, Campello EFC, Franco AA. Estabelecimento, produçăo de fitomassa, acúmulo de macronutrientes e estimativa da fixaçăo biológica de nitrogęnio em Arachis. Pasturas Tropicales (Colombia) 2006;28(2):18–25. [ Links ]
29. Danso SKA, Hardarson G, Zapata F. Misconceptions and practical problems in the use of 15N soil enrichment techniques for estimating N2 fixation. Plant Soil 1993;152:25–52. [ Links ]














