Introducción
En el Altiplano y el Bajío del Centro de México el frijol se ve limitado por factores abióticos como sequía intermitente en temporal y en áreas específicas del Bajío por altas temperaturas que afectan el rendimiento y calidad del grano bajo riego, así como factores bióticos (plagas y enfermedades) que causan bajos rendimientos (Anaya et al., 2021). Estudios recientes, mostraron abundante presencia de la bacteria causante del tizón de halo (Psph) en semilla de variedades del acervo Andino producidas en Sinaloa (Félix-Gastelum et al., 2016), variedades que al ser sembradas en Guanajuato durante la época lluviosa sucumben ante el patógeno, así como las variedades criollas del tipo Cacahuate Bola o japonés. Los productores siembran este tipo de variedades por el alto precio en el que pueden vender su grano, y por el ciclo corto y la facilidad de manejo de plantas de hábito determinado en condiciones de riego y temporal (Kelly, 2000).
Los primeros síntomas del tizón de halo aparecen como pequeñas manchas angulares, a medida que crecen se vuelven marrones y aparece un halo característico de color verde-amarillo alrededor de la mancha. Ese halo se debe a la acción de una toxina producida por la bacteria (phaseolotoxina). Bajo condiciones favorables para el desarrollo de la enfermedad la toxina se mueve de forma sistémica dentro de la planta también ataca las vainas (Álvarez-Morales et al., 2018), donde se apreció un exudado blanco cremoso dentro de las manchas que produce la bacteria.
La infección penetra a las semillas durante el proceso de maduración de las vainas. En esa etapa se observaron manchas amarillas y amarillo-marrón en las semillas (Navarrete-Maya, 2013). En la actualidad no se cuenta con variedades de tipo Azufrado y Cacahuate Bola resistentes a Psph, ni se conocen las razas presentes en el país; en el Bajío y Sinaloa se ha detectado a la raza 6 que vence a todas las variedades diferenciales (Félix-Gastelum et al., 2016).
Estudios recientes sobre colecta y caracterización de aislamientos de Psph en Canadá (Chatterton et al., 2014) y estados del medio oeste de los EE. UU (Lamppa et al., 2002) han indicado la presencia de las razas 2, 6 y 8 (Gishing et al., 2016), la particularidad de la raza 6 es que produce síntomas en todas las variedades diferenciales de frijol y a la fecha solo se ha descrito un genotipo resistente, PI 150414 de El Salvador (Taylor et al., 1996).
La raza 6 fue descrita por Félix-Gastelum et al. (2016) como responsable de dañar el frijol de tipo azufrado en Sinaloa. También se han colectado y estudiado la distribución y daño de las bacterias atacando al cultivo en África (Chataika et al., 2011). Por otra parte, en México se han desarrollado numerosas variedades mejoradas de frijol y algunas han sido descritas como resistentes a la infección natural por el tizón de halo en campo; sin embargo, la reacción de resistencia descrita no fue producto de inoculación controlada, eso indica que no se conoce a qué razas son resistentes (Anaya et al., 2021).
Con el fin de generar variedades de frijol resistentes a tizón de halo se han desarrollado marcadores moleculares para usarse en la selección. Estos marcadores se asociaron con los principales genes de resistencia predichos en el genoma del frijol mediante análisis de resistencia de progenie de cruzas dirigidas de un genotipo resistente por uno susceptible (Fourie et al., 2004; Miklas et al., 2009; Miklas et al., 2011). El objetivo de esta investigación fue identificar genotipos de frijol con resistencia al tizón de halo para utilizarlos en cruzamientos con genotipos susceptibles y verificar la utilidad de seis marcadores moleculares descritos en la literatura como asociados a tres genes de resistencia, esto permitió implementar la selección asistida para transferir la resistencia a las principales variedades que se utilizan en el Bajío.
Materiales y métodos
Invernadero. Se incrementó en invernadero la semilla de las ocho variedades diferenciales utilizadas para la identificación de razas de Psph: Canadian Wonder, Red Mexican UI 13, A 52 (ZAA 54), GUA 196B, Tendergreen, A 43 (ZAA 12), A 53 (ZAA 55) y Tépari 1072 (Phaseolus acutifolius).
En el laboratorio de fitopatología se procesaron dos muestras aisladas en Guanajuato (consideradas como agresivas contra diferentes tipos de frijol en inoculaciones previas), siguiendo el procedimiento descrito por Taylor et al. (1996) que al ser inoculadas sobre el juego de variedades diferenciales resultaron ser las razas 2 (vence seis diferenciales), cepa aislada de muestra colectada en Salvatierra y la 6 (vence las ocho diferenciales) de muestra colectada en Celaya, respectivamente (Miklas et al., 2009).
Posteriormente, se inocularon 84 variedades mejoradas descritas como resistentes a la infección natural por Psph, que incluyeron materiales con diferentes tipos de grano. Debido a limitaciones de espacio en el invernadero y considerando la procedencia de las variedades, estas se dividieron en dos grupos de 28 y 56 y se sembraron en macetas para su inoculación con los aislados de las razas 2 y raza 6, respectivamente.
Las plántulas fueron inoculadas en las hojas primarias siguiendo la metodología estándar propuesta por Mills y Silvernagel (1992), mediante el uso de jeringas de insulina a los ocho días después de su emergencia, el inóculo fue a una concentración de 1 x 108 unidades formadoras de colonias totales (ufc), se colocó una gasa empapada del inóculo en el envés de las hojas a las que se les causó lesión con agujas montadas en un abatelenguas para que lo absorbieran, de cada material inoculado se dejó una maceta como testigo con plántulas inoculadas con agua estéril.
Cada maceta contenía seis plántulas y cada una se consideró como una unidad experimental. Se realizaron tres lecturas de la reacción a la inoculación, a los 11, 16 y 21 días, para describir la reacción se utilizó la escala de Innes et al. (1984), para el análisis estadístico se utilizaron las lecturas tomadas a los 21 días.
Ensayos de campo
En ensayos establecidos en 2013 se calificó la reacción a la infección natural por Psph con la escala de 1 a 9 (Shoonhoven y Pastor-Corrales, 1987), en donde del 1 al 3 se considera resistente, del 4 al 6 reacción intermedia y del 7 al 9 como susceptible. Los recorridos de campo para evaluar la incidencia de Psph se realizaron en la etapa reproductiva. Se hicieron cruzamientos entre variedades susceptibles y resistentes para obtener Fs1 (variedades de raza Nueva Granada como hembras y plantas resistentes de otras razas como fuente de resistencia). Los progenitores y las plantas F1 se inocularon en las hojas primarias como se describe arriba.
Identificación de los marcadores moleculares asociados a resistencia
De las plantas de las diferenciales sembradas se colectó en la etapa vegetativa tejido del trifolio más joven para extracción de ADN, siguiendo el procedimiento CTAB descrito por Doyle y Doyle (1987). Para la cuantificación y determinación de la pureza del ADN se utilizó un espectrofotómetro NanoDrop 8000®, colocando 2 μl de ADN en el pedestal y configurando el programa para una densidad óptica de 30 nanogramos por microlitro y absorbancia a 260 nm.
Se utilizaron seis marcadores de tipo sitios con marca de secuencia (STS) asociados a tres genes de resistencia al tizón de halo descritos por Fourie et al. (2004); Miklas et al. (2009, 2011). Para determinar la utilidad de esos marcadores se sembraron 10 semillas de cada diferencial y se realizó una mezcla equivalente en peso de tejido foliar para la extracción de ADN de las plántulas de cada una. El ADN se usó para amplificar por PCR los seis marcadores siguiendo las indicaciones de Fourie et al. (2004); Miklas et al. (2009, 2011). Los productos de amplificación se separaron por electroforesis en geles de agarosa al 1.5% con amortiguador TBE. Los geles se dejaron correr 2 h a 120 V, se revelaron con bromuro de etidio y documentaron por fotografía en un transluminador UV.
Resultados y discusión
Identificación de genotipos resistentes en invernadero
La inoculación con las razas 2 y 6 de Psph mostró heterogeneidad de reacción en los síntomas de las plántulas de algunas variedades; es decir, en un mismo material hubo plantas con reacción susceptible y resistente. Asimismo, hubo genotipos resistentes uniformes. También se identificaron genotipos de reacción intermedia de acuerdo con la escala utilizada 0 a 1 son resistentes y de 2 a 3 intermedios y 4 susceptibles) (Innes et al., 1984). Por la diversidad de los genotipos resistentes, de diferentes tipos, al parecer ambas razas son de amplia distribución en México. Los genotipos resistentes a la raza 6 fueron: Pinto 168, Bayo 66 y Bayo 161, de raza Jalisco, Azufrado Tapatío, Lagunero 80 y Pinto Saltillo, de raza Durango y Bayo Azteca de raza Mesoamericana. En este grupo se incluyeron variedades de tipo Azufrado y todas resultaron susceptibles.
A través de la inoculación con dos aislamientos de Psph (Razas 2 y 6) se identificaron cinco variedades resistentes a la raza 2, y ocho a la raza 6, ninguno de tipo Azufrado (Cuadro 1).
Cuadro 1 Genotipos de frijol resistentes a la inoculación independiente con Psph razas 2 y 6 bajo condiciones contraladas en invernadero. Reacción de 0-1 en la escala de (Innes et al., 1984).
| Resistentes a la raza 2 | Resistentes a la raza 6 | |
|---|---|---|
| Pinto Anzalduas | Pinto 168 | Pinto Saltillo |
| Flor de Mayo Anita | Bayo 66 | Flor de Mayo M38 |
| Pinto Durango | Azufrado Tapatío | Bayo Azteca |
| Flor de Mayo M38 | Pinto Lagunero 80 | Bayo 161 |
| Negro Altiplano | ||
Guising et al. (2014, 2016) caracterizaron la reacción de 283 accesiones de frijol por su resistencia a la raza 6 e identificaron cinco resistentes, sugirieron su uso como fuentes de resistencia, entre ellas un frijol nativo de Puebla, México. En Guanajuato, solo las variedades Flor de Mayo M38 y Pinto Saltillo se han utilizado en cruzas, el resto de los materiales resistentes por sus características agronómicas no deseables como tipo de grano sin valor comercial, ciclo largo y de hábito de crecimiento trepador no se han utilizado. Asimismo, para la selección en poblaciones segregantes, ésta deberá realizarse a través de la inoculación con las razas presentes en la región para la cual se estén desarrollando las variedades y no solo basarse en reacción de campo donde pueden ocurrir escapes (Ghising et al., 2014).
Reacción de genotipos azufrados establecidos en campo
En campo, los 10 materiales de tipo azufrado establecidos en junio mostraron un severo ataque por el tizón de halo (datos no mostrados). En este ensayo la precipitación fue alta en la fase vegetativa durante Julio, y las temperaturas favorables para el desarrollo del tizón de halo (Figura 1). Debido al salpicado de la lluvia de plantas infectadas hacia plantas sanas, la infección por Psph fue uniforme. También es probable que Psph estuviera presente en el suelo por siembras anteriores con frijol en el sitio.
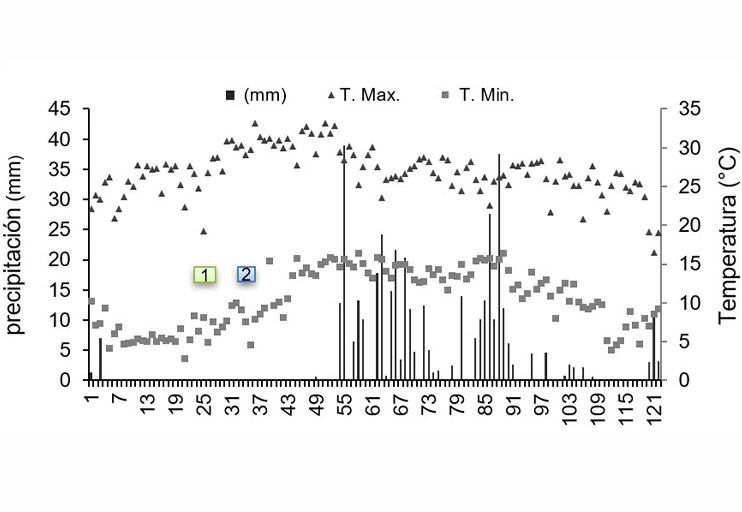
Figura 1 Temperatura máxima, mínima y precipitación decenal de enero a noviembre de 2018 en Celaya, Guanajuato. 1 y 2 indican las fechas de siembra.
En el ensayo con 16 materiales establecido en Julio, la incidencia de la enfermedad fue menor, esto se comprobó́ porque las variedades testigo fueron las mismas en los dos ensayos, JANASA, Azufrasin y Azufrado Higuera, las que mostraron menor incidencia en el segundo ensayo (Cuadro 2). Esto indica que las condiciones ambientales influyen en la incidencia de la enfermedad, ya que la fecha de siembra de fines de julio y un período de sequía a mediados de agosto, no favorecieron el desarrollo temprano del tizón de halo, para los testigos de ambos ensayos se utilizó́ la misma fuente de semilla.
Cuadro 2 Reacción de 16 materiales de frijol a la incidencia natural de tizón de halo durante el ciclo de temporal. CEBAJ, Celaya, Guanajuato 2018.
| Genealogía | Reacción | Genealogía | Reacción |
|---|---|---|---|
| L6/L11(Mo)-M-7-1-1-1-M | 2.71 | (G17421/Az.26) //FME)-1-6-2 | 2.8 |
| L6/L11(Mo)-M-7-1-1-2-M | 3 | Univ. Puerto Rico 10 | 3.2 |
| L6/L11(Mo)-M-6-2-1-M | 3 | Univ. Puerto Rico 11 | 3 |
| (G17421/Az26//FME)-1-8-1 | 1.5 | Univ. Puerto Rico 12 | 3.2 |
| (G17421/Az26//FME)-1-8-2 | 1.5 | Minimi-UACH | 2.7 |
| (G17421/Az26//FME)-1-57-1 | 2.5 | Azufrado Higuera (T) | 4 |
| (G17421/Az26//FME)-2-6-1- | 2.7 | Azufrasin (T) | 3 |
| (G17421/Az26//FME)-1-10-2 | 1.5 | JANASA (T) | 3 |
1= escala de 1 a 9 (Shoonhoven y Pastor-Corrales, 1987), promedio de 4 repeticiones.
En el ensayo de 16 genotipos (Cuadro 2) hubo dos sobresalientes con incidencia < 3, los dos derivados de la misma cruza: (G17421/AZ 26// FME)-1-8-2 y (G17421/AZ 26// FME)-1-8-1. La cruza y la selección en la población segregante de la cual se derivaron estas líneas se realizó en la localidad de prueba, estos genotipos deberán ser inoculados bajo condiciones controladas para verificar su resistencia. En la actualidad, la producción de Azufrado Higuera en Sinaloa se realiza bajo riego y con semilla certificada y se utiliza protección química a las plantas contra patógenos (Félix-Gastelum et al., 2016).
En cuanto a los cruzamientos realizados para incorporar resistencia a las variedades de tipo azufrado, se obtuvo semilla F1 y F2 de las cruzas: Aluyori x Flor de Mayo Dolores, Azufrasin x Minimi, Azufrasin x Flor de Mayo Dolores, Azufrasin x Junio León, San Rafael x Janasa y Raramuri x Janasa. Estas poblaciones se incorporaron al programa de mejoramiento local para continuar con su evaluación.
Uso de marcadores asociados a genes de resistencia a Psph
En las variedades diferenciales, con excepción de Tepari 1072, se determinó la presencia de los seis marcadores disponibles en la literatura (Fourie et al., 2004; Miklas et al., 2009; Miklas et al., 2011) y de estos solo tres produjeron los amplicones esperados ST8, B10 y SW13 (Cuadro 3), mientras que R13, SAE 15 y H11 presentaron amplicones diferentes, lo que puede deberse a diferencias en el fondo genético de los locus que etiquetan estos marcadores. De hecho, dos de los últimos tres marcadores, R13 y H11, marcan el mismo gen que ST8 y sus desarrolladores (MIklas et al., 2009) indican que sólo funcionan en material Andino y en los tipos negro y rojo de la raza Mesoamérica.
Cuadro 3 Presencia de marcadores STS en siete variedades diferenciales para el tizón de halo, Psph.
| Variedad diferencial | Marcador | Resistencia a razas | ||
|---|---|---|---|---|
| T8 | B10 | SW13 | ||
| Red Mexican UI 13 | + | + | - | 1, 5, 7, 9 |
| A 52 (ZAA 54) | - | + | - | 5 |
| GUA 196B | + | + | + | 1, 3, 4, 5, 7, 9 |
| Tendergreen | - | - | + | 3, 4 |
| A 43 (ZAA 12) | - | - | + | 3, 4 |
| A 53 (ZAA 55) | - | + | - | 5 |
| Canadian Wonder | - | - | - | 0 |
La resistencia reportada en las diferenciales corresponde a los genes Pse-1 y Pse-3, estos no poseen resistencia a las razas 2, 6 y 8. Es decir, los marcadores no funcionan en la selección contra esas razas; por lo tanto, su utilidad se limita a las razas 1, 3, 4, 5, 7 y 9 (Miklas et al., 2009). Los tres marcadores que mostraron la respuesta esperada permiten identificar genotipos de frijol resistentes a las razas 1, 3, 4, 5, 7 y 9 (Miklas et al., 2009), mismos que serán útiles para incorporar resistencia a las variedades de mayor demanda de los tipos Azufrado y Cacahuate Bola, pero no en contra de las razas 2 y 6 que se han aislado en Guanajuato y Sinaloa.
Estudios recientes de Trabanco et al. (2014); González et al. (2016); Took et al. (2017) indican la presencia de diferentes genotipos resistentes a la raza 6, con resistencia de raza no especifica que al ser combinada con alelos de raza específica pueden resultar en resistencia duradera. En el caso del genotipo resistente US14HBR6 de tipo pinto, se determinó que la resistencia contra la raza 6, es mono génico (Duncan et al., 2014). De los materiales estudiados, Flor de Mayo M38, Pinto Saltillo y Pinto Lagunero 80 con reacción de resistencia a la raza 6, no poseen los tres marcadores, de ello se infiere que poseen algún otro gen de resistencia.
Estos resultados sugieren la necesidad de desarrollar nuevos marcadores para poder utilizar la selección asistida en forma eficiente (Miklas et al., 2009) o basarla en la inoculación en condiciones controladas. Recientemente Took et al. (2017) señalaron que la resistencia a la raza 6 incluye tanto alelos con efecto de raza no-específica (efectos cuantitativos), como específica (efecto cualitativo) y que la combinación de ambos tipos de alelos proveerá resistencia duradera.
En cuanto a las cruzas entre variedades resistentes y susceptibles, se observó que el marcador B10 está presente en todos (resistentes y susceptibles); es decir, no servirá para la selección asistida en este grupo de progenitores (Cuadro 4). La variedad susceptible Azufrasin, presentó dos de los tres marcadores, en este caso ninguno de los tres marcadores será de utilidad para la selección en cruzas con esta variedad. Los resultados de los progenitores demuestran que los marcadores, sobre todo T8 y SW13, se presentan de manera heterogénea en algunos; es decir, en diferentes proporciones (Cuadro 4).
Cuadro 4 Presencia de tres marcadores asociados con dos genes de resistencia al tizón de halo en plantas individuales F1 y sus progenitores.
| Cruza | Marcador | ||
|---|---|---|---|
| T8 | B10 | SW13 | |
| F1 Aluyori/Flor de Mayo Dolores | 5/101 | 10/10 | 6/10 |
| F1 Azufrasin/Minimi | 10/10 | 10/10 | 10/10 |
| F1 Azufrasin/ Flor de Mayo Dolores | 4/4 | 4/4 | 4/4 |
| F1 San Rafael/ Janasa | 0/10 | 10/10 | 10/10 |
| F1 Rarámuri/Janasa | 0/10 | 7/7 | 7/7 |
| F1 Aluyori/ Rarámuri | 3/4 | 3/4 | 3/4 |
| F1 Azufrasin/Andino 28 | 0/5 | 5/5 | 0/5 |
| Rarámuri (Raza Durango) | 0/5 | 3/5 | 0/5 |
| Aluyori (Raza Nueva Granada) | 0/9 | 9/9 | 0/9 |
| Azufrasin (Raza Nueva Granada) | 8/8 | 8/8 | 8/8 |
| San Rafael (Raza Durango) | 0/10 | 10/10 | 9/10 |
| Flor de Mayo Dolores (Raza Jalisco) | 10/10 | 3/10 | 10/10 |
| Janasa (Raza Nueva Granada) | 0/10 | 10/10 | 3/10 |
1= numerador, plantas con el marcador, denominador el total de plantas en la prueba.
Esto sugiere su uso para homogenizar la presencia de estos en esos genotipos. Asimismo, la no presencia del marcador correspondiente en plantas F1 de la cruza de Aluyori por Flor de Mayo Dolores indica la presencia de autofecundaciones. Recientemente, diversos autores han realizado estudios para identificar fuentes de resistencia de tipo cuantitativa considerando que esta, en combinación con resistencia de raza específica puede ser más duradera (Trabanco et al., 2014; González et al., 2016). Took et al. (2017) mapearon alelos de resistencia a Psph raza 6 de diferentes fuentes y mostraron evidencia de resistencia durable al combinar alelos de raza no-específica con alelos de raza específica. Sugieren el uso de marcadores moleculares para el mejoramiento de la resistencia, sobre todo del alelo de raza no específica.
Las variedades Flor de Mayo M38 y Pinto Saltillo se han utilizado extensivamente en cruzas con materiales similares, deberían utilizarse en cruzas con materiales de los tipos Cacahuate Bola y Azufrado. La selección en las poblaciones segregantes deberá realizarse a través de la inoculación con las razas presentes en la región para la cual se estén desarrollando las variedades. En el caso de la región del Bajío, región con ciclos consecutivos de cultivo de riego y temporal, la posibilidad de mantener semilla sana de variedades susceptibles como los Azufrados y Cacahuate Bola es limitada y está comprometida por el reúso de grano como semilla por los productores.
Conclusiones
A través de la inoculación con dos aislamientos de Pseudomonas syringe pv phaseolicola se identificaron cinco variedades resistentes a la raza 2 y ocho a la raza 6. En ensayos de campo, Psph dañó severamente materiales del tipo azufrado (raza Nueva Granada, Acervo Andino) establecidos en campo bajo condiciones de temporal, daño relacionado con la susceptibilidad inherente de los materiales y las condiciones climáticas de alta humedad y temperatura templada que favorecieron el desarrollo de la enfermedad. La selección con el uso de los marcadores moleculares disponibles puede ser funcional en contra de razas de Psph menos agresivas que las razas 2 y 6.











 texto en
texto en 


