Introducción
Brosimum alicastrum (conocido localmente en México como ramón) es una especie del bosque tropical siempre verde, muy abundante y ampliamente distribuida en las selvas tropicales de Mesoamérica (CONABIO, 2014), donde se le conoce localmente por más de 50 nombres comunes, entre ellos ramón, ojite, ojoche, capono, uhi, apomo y otros (Pardo-Tejeda y Sánchez-Muñoz, 1980). Esta especie ha atraído un gran interés por los servicios ambientales que brinda, incluida la mitigación del cambio climático y un alto potencial de producción de alimentos (Subiria-Cueto et al., 2019).
La expresión sexual en B. alicastrum no se ha esclarecido por completo y es un tema de investigación abierto. Estudios realizados en el siglo XX la describen como una especie monoica que presenta polinización anemófila y geitonogama, por lo que se favorece la fertilización cruzada (López-Mata, 1987). Puleston (1968) informó que B. alicastrum florece dos veces al año, con una producción de semilla de 32.6 kg año-1.
Otros autores han informado que cada árbol puede producir de 50 a 75 kg de fruto, con aproximadamente 32.6 kg de semilla año-1 (Martínez, 1936; González, 1939; Puleston, 1968; Peters y Pardo-Tejeda, 1982). En esta investigación se encontró que los árboles con más de 25 años cultivados en el estado de Yucatán producen alrededor de 163 kg año-1 de follaje y de 95 kg de semillas año-1, y de 300 a 350 semillas por kilogramo. Por lo tanto, una plantación de 250 árboles ha-1 puede producir entre 20 y 25 ton ha-1 año-1 de semilla. También se encontró que los árboles comienzan a producir flores siete años después de la siembra (Hernández-González et al., 2015).
Peters (1989) examinó 51 árboles de B. alicastrum, de los cuales 23 (45%) eran hembras y 28 (55%) machos; estos produjeron 30 kg árbol-1 año-1 de semillas. El mismo señaló que los árboles hembras cambian de sexo a medida que crecen, de modo que los árboles de estatura media son en su mayoría hembras, mientras que los más altos son machos. Se sabe que la expresión sexual en las plantas está regulada por reguladores del crecimiento vegetal (RCV) y otros factores del ambiente (Khryanin, V. N. 2002). Los RCV son un grupo de sustancias que influyen en los procesos fisiológicos de las plantas en concentraciones muy bajas (Davies, 2010). Por ejemplo, las giberelinas promueven la supresión de las partes reproductoras masculinas en las flores del maíz (Chen y Tan, 2015).
El ácido abscísico (AAB) regula el inicio de la floración, la senescencia y la abscisión (Wang et al., 2002). Otro RCV es el gas etileno, que regula la apertura y senescencia de las flores. Los estudios realizados en pepino, melón y sandía muestran que el aumento de la concentración de etileno estimula el desarrollo de flores femeninas (Martín et al., 2009; Guo et al., 2010; Manzano et al., 2014). Dado el interés en establecer plantaciones comerciales de B. alicastrum, este estudio se realizó con el fin de cuantificar las proporciones de sexos en árboles adultos en plantaciones establecidas en el Estado de Yucatán, detectar procesos de cambio de sexo, determinar niveles de RCV que pudieran influir en la expresión sexual y estimar el potencial de producción de semillas y el período de retención de hojas.
Materiales y métodos
La primera parte del estudio se realizó en tres plantaciones de B. alicastrum. La primera plantación comprendió un total de 312 árboles adultos y se ubicaba en la avenida Paseo de Montejo de la ciudad de Mérida (20° 59’23.86” latitud norte, 89° 36’59.02” longitud oeste). La segunda plantación fue conformada por 74 árboles adultos y se localizaba en el camino de entrada a la Hacienda Chichi Suárez (20° 59’57.12” latitud norte, 89° 33’7.92” longitud oeste), cerca de la ciudad de Mérida. A través de la observación de la textura y diámetro de los troncos, se estimó una edad de 40 años en los árboles. La tercera plantación se encontraba en la Hacienda Xoccheila en el municipio de Sacalum (20° 33' latitud norte, 89° 34' longitud oeste); compuesta por 69 árboles de distintas edades, todos de al menos 10 m de altura y más de 25 años, según informes de los propietarios.
Los árboles fueron sexados por observación directa: los árboles masculinos tienen la inflorescencia típica descrita por (López-Mata, 1987), mientras que los árboles femeninos dan frutos. Estos árboles crecen en un suelo tipo Leptosol (según la clasificación de WRB; Ek-lu’um según la clasificación de suelos maya), en un clima tropical subhúmedo con una temporada de lluvias de verano (tipo de clima Aw, según la clasificación de Köppen y Geiger). A una muestra que consta de 30 árboles previamente sexados (20 árboles en la plantación Xoccheila y 10 en el campus del Centro de Investigaciones Científicas de Yucatán) se le dio seguimiento durante 10 años para identificar cualquier cambio de sexo.
Muestreo
Para evaluar la producción de semillas, se seleccionaron seis árboles adultos (de más de 30 años, según información local) en la ciudad de Mérida, específicamente en el campus del Centro de Investigaciones Científicas de Yucatán (21° 01’ 54.8” latitud norte y 89° 37’ 21.2” longitud oeste). Se colocaron redes de plástico alrededor de los árboles para recolectar los frutos y semillas producidos. Se extrajo el pericarpio de los frutos y se pesaron las semillas mediante una balanza granataria marca Ohaus.
Para estimar el tiempo de la primera floración y determinar el sexo de cada árbol, se estableció una plantación experimental ad hoc de 50 árboles jóvenes en el año 2009. Las semillas se sembraron en bolsas con composta vegetal; las plántulas se cultivaron durante un año bajo 50% de sombra en condiciones de campo y posteriormente se establecieron en el sitio de plantación.
Las plántulas de 50 cm de altura, se plantaron en cepas de 40 cm con un espaciamiento entre plantas de 5 m entre sí y recibieron riego suplementario una vez a la semana en la estación de verano durante los dos primeros años para asegurar su supervivencia. A partir del tercer año después del trasplante, el crecimiento se dio bajo condiciones de secano. A la plantación se le dio seguimiento regularmente; tanto la floración como el sexo de cada árbol se registraron mediante observación directa. Para estimar el período de retención de hojas, se seleccionaron y marcaron cuatro plantas durante 40 meses. Todas las hojas producidas (entre 9 y 10 hojas por árbol; 38 hojas en total) fueron marcadas a medida que se desplegaban. Las hojas se contaron semanalmente durante 40 meses. Los datos de supervivencia fueron convertidos en arcoseno y después sometidos a un análisis de supervivencia, utilizando el software SPSS versión 23.
Instrumentos para el análisis de RCV
La concentración de RCV se determinó de acuerdo con el método descrito por Salazar et al. (2021) y se utilizó un cromatógrafo de líquidos Agilent modelo 1 100 equipado con un muestreador automático modelo 1200 y detector de arreglo de diodos. Se utilizó una columna Zorbax SB-C8 de 4.6 x 75 mm, el sistema de fase móvil fue agua con ácido trifluoroacético (A) a 0.1% y acetonitrilo con ácido trifluoroacético (B) a 0.1%. El análisis se llevó a cabo usando de 22 a 50% de B en un gradiente de 1.5 min. El flujo fue de 3.0 mL min-1 a 60 ºC, con el detector ajustado a 254 nm. Se utilizaron estándares comerciales Sigma-Aldrich como referencia para construir curvas de calibración para los RCV: ácido giberélico, indolacético, indolbutírico absícico y cinetina.
Extracción y contenido total de reguladores de crecimiento vegetal (RCV)
Se seleccionó una muestra de 20 árboles de tamaño similar, previamente sexados, de 20 a 30 años de la plantación Hacienda Xoccheila en el municipio de Sacalum (20° 32’43.1” latitud norte, 89° 33’27.5” longitud oeste). Se recogió una muestra de hojas de 5 g de cada árbol y se congeló inmediatamente en nitrógeno líquido para su transporte al laboratorio. Las muestras de tejido foliar se liofilizaron, molieron finamente y se almacenaron inmediatamente en la oscuridad a 4 oC hasta la extracción de los RCV.
Se utilizó el método de extracción propuesto por Xiangqing et al. (2010). Se pesaron submuestras de 100 mg por triplicado y luego se transfirieron a tubos de polipropileno cónicos de 2 mL que contenían 500 µL de una solución de extracción de 2-propanol: agua: HCl concentrado (2:1: 0.002, v / v). Los tubos se agitaron a 100 rpm durante 30 min a 4 ºC, luego se añadió 1 mL de cloruro de metileno de grado HPLC y los tubos se agitaron de nuevo durante 30 min. Los tubos se centrifugaron a 13 000 rpm durante 5 min. Se recogió una alícuota de 900 µL de la fase inferior, se evaporó el disolvente a 100 µL con una corriente de nitrógeno y añadieron 500 µL de metanol de calidad HPLC. Se inyectó una alícuota de 100 µL de la muestra en el cromatógrafo.
Análisis estadístico
Los contenidos de RCV se expresaron como la media (± error estándar) de tres repeticiones. Se realizaron análisis de varianza (Anova) seguidos de las pruebas de comparación múltiple de Tukey para evaluar las diferencias entre las medias, utilizando un nivel de significancia de p< 0.05.
Resultados
Sexado de árboles adultos en plantaciones
Los árboles de la primera plantación establecida en Paseo de Montejo (González, 2011) continuaron con la producción de flores más de 100 años después (2019), lo que confirma la gran capacidad de fructificación de B. alicastrum, convirtiéndose este estudio en una primera referencia para esta especie. Los registros sobre los 312 árboles de esta plantación también mostraron que 208 (66.6%) árboles no produjeron frutos y se registraron como árboles masculinos, mientras que 104 (33.3%) árboles produjeron frutos y se registraron como árboles femeninos.
En la plantación de 74 árboles Chichi Suárez, 45 (60.8%) árboles eran machos y 29 (39.2%) eran hembras. Estos árboles de más de 40 años también mantuvieron su plena capacidad para producir inflorescencias masculinas y femeninas. La plantación de Xoccheila comprende árboles de más de 20 años; los resultados mostraron que 40 (58%) de los 69 árboles monitoreados eran machos y los otros 29 (42%) hembras. Destaca que la proporción de sexos en esta población de edad desigual fue muy similar a la encontrada en las otras plantaciones.
Cuando se combinan los datos de las tres plantaciones, 293 (64.4%) de los 455 árboles examinados no produjeron frutos y se clasificaron como árboles masculinos, mientras que 162 (35.6%) fueron hembras. Por tanto, uno de cada tres árboles es hembra (Figura 1). Esta información es relevante y debe tenerse en cuenta cuando se establece una nueva plantación con fines de producción de semillas, ya que se deberán implementar métodos como la micropropagación o el injerto para propagar árboles productores de semillas.

Figura. 1 Proporción de sexos e inicio de la floración en árboles de ramón (Brosimum alicastrum) que crecen en condiciones de campo. La muestra inicial comprendió un total de 50 árboles.
Tiempo requerido para la primera floración
El tiempo necesario para la producción de la primera flor se registró en una plantación experimental de 50 árboles establecida para este propósito. Los árboles se produjeron a partir de semillas y luego se plantaron al sitio de campo, esta condición no afectó la expresión sexual de los árboles. El período juvenil terminó cuando los árboles comenzaron a producir flores, con un tiempo que varió notablemente entre los árboles, como se muestra en la (Figura 1), 15 (30%) de los 50 árboles comenzaron a producir flores siete años después de su establecimiento, 19 (38%) lo hicieron después de 8 años, 14 (28%) después de nueve años y 2 (4%) después de diez años.
Los árboles que florecieron más temprano fueron todos machos; de los que florecieron después de ocho años, diez eran hembras y nueve eran machos. En resumen, 33 (66%) de los árboles eran machos y 17 (34%) hembras. Un hallazgo importante en este estudio es que los árboles masculinos comienzan a producir flores antes que los árboles femeninos; esto permitió sexar árboles desde el primer evento de floración. Es difícil explicar por qué el inicio de la floración no fue simultáneo, sino que ocurrió en diferentes momentos posterior al establecimiento de la plantación, a pesar de que todos los árboles habían sido producidos en vivero bajo las mismas condiciones.
Se plantea la hipótesis de que, al tratarse de árboles producidos de semilla de árboles silvestres, existe una alta variación genética entre ellos. Además, no se documentó la procedencia de las semillas utilizadas para producir el árbol. Una causa adicional puede ser la alta variabilidad del suelo en el sitio de la plantación, evidenciada por su alto contenido de piedras y la disponibilidad heterogénea de agua y nutrientes. Los resultados obtenidos en una plantación ad hoc difieren de los reportados por Peters (1989) para las poblaciones naturales estudiadas en 1981 y 1982 en selvas tropicales.
Las observaciones mostraron que, después de 10 años de seguimiento: 1) no se observó ningún cambio de sexo en los árboles; 2) la definición del sexo tuvo lugar desde el primer evento de floración, sin que se observaran cambios de sexo en los años siguientes; y 3) se registraron árboles machos desde que tenían 7 años, 4 m de altura y 7 cm de diámetro. Con base en estos datos, se considera que el sexo de los árboles es independiente de su edad y altura.
Producción de semillas
La Figura 2 muestra los valores de cosecha de semillas para una muestra de seis árboles adultos. La producción media de semillas fue de 145.6 kg árbol-1 año-1. Tres de los árboles produjeron más de 150 kg de semilla, el árbol menos productivo rindió 117 kg. Estos resultados confirman los reportados por Hernández-González et al. (2015) de 100 kg árbol-1año-1. Esta información es valiosa para planificar el uso de B. alicastrum como fuente de semillas para su uso como alimento. Estudios anteriores habían reportado valores de producción de semilla inferiores a los obtenidos en la presente investigación.
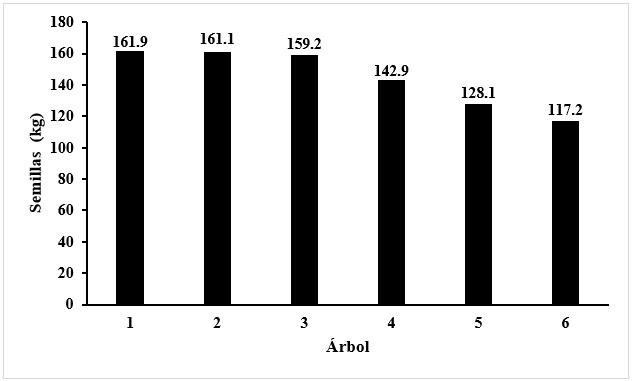
Figura 2 Producción de semillas en seis árboles adultos de B. alicastrum, en el campus del Centro de Investigaciones Científicas de Yucatán.
González (1939); Pardo-Tejeda y Sánchez (1980); Peters y Pardo-Tejeda (1982) señalan valores que oscilan entre 32 y 95 kg árbol-1 año-1, muy por debajo del volumen de producción (145 kg árbol-1 año-1) registrado en este estudio. Este valor es alto en comparación con el volumen de producción de semillas comestibles registrado para otras especies de árboles como: nogal pecanero (Carya illinoinensis (Wangenh.) K. Koch) que produce 100 kg año-1 (Tarango, 2012), olivo (Olea europea L.) con 22 kg año-1 (Grijalva et al., 2009), pistacho (Pistacia vera L.) 15 kg año-1 (De León et al., 2020), piñonero mexicano (Pinus cembroides Zucc.) 0.9 kg año-1 (Sánchez et al., 2005) y el castaño dulce (Castanea sativa Mill.) 50 kg año-1 (Enrique, 2022).
Retención de hojas
Como B. alicastrum es un árbol de hoja perenne, se consideró importante examinar la retención de hojas, ya que es probable que éstas sean el órgano de la planta que muestre la mayor plasticidad, lo que permite adaptarse morfológica, anatómica y fisiológicamente a las interacciones con diferentes entornos. Por ejemplo, se ha demostrado que las hojas que crecen con poca luz retienen sus hojas por más tiempo en el árbol (Coste et al., 2011; Craven et al., 2011; Kitajima et al., 2013).
Los resultados muestran que la mediana del período de retención de hojas en B. alicastrum fue de 25.82 meses (787 días). No hubo diferencias significativas en el lapso medio de retención de hojas entre las cuatro plantas monitoreadas [Log Rank (Mantel-Cox), p= 0.229]. La Figura 3 muestra el patrón de retención de hojas en los cuatro árboles examinados. Como puede observarse, las primeras tres hojas (8%) se desprendieron después de 15 meses (457 días) y las últimas permanecieron en los árboles hasta el final del experimento (40 meses o 1217 días). Estos resultados son consistentes con los reportados para la misma especie en un bosque de la península de Buena Vista, Panamá, es decir, un lapso de retención promedio de 614 días para las hojas de árboles que crecen en claros de bosque y 1 028 días para aquellos en bosque cerrado (Kitajima et al., 2013).
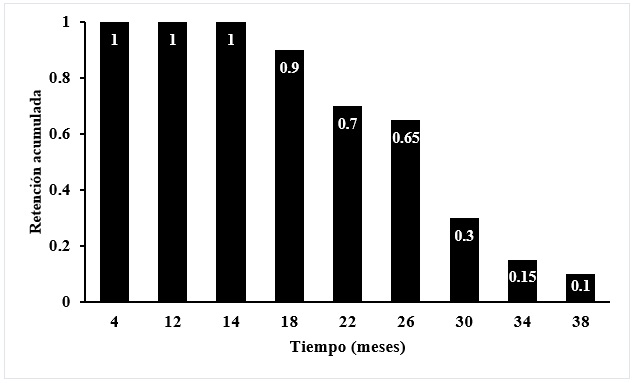
Figura 3 Patrón de retención foliar en árboles de B. alicastrum. Los valores mostrados son el promedio de 38 hojas en cuatro árboles.
Aunque en este estudio las hojas se retuvieron hasta por 40 meses, una planta se considera de hoja perenne incluso si su período de retención de hojas es más corto, pero se reemplazan continuamente. Es decir, la condición de perenne depende de todo el dosel de la planta y no de las hojas individuales (Kikuzawa y Lechowicz, 2011). Esta información es útil para el establecimiento de plantaciones comerciales, especialmente porque la biomasa de las hojas se puede utilizar como alimento para el ganado (Peters y Pardo-Tejeda, 1982).
Niveles de RCV
Se estudió la acumulación de RCV en el follaje para determinar niveles endógenos en árboles masculinos y femeninos. En general, el follaje de los árboles hembras tuvo un mayor contenido de giberelinas (AG) en relación con los machos Cuadro 2. No hubo diferencias significativas entre sexos en el contenido de la auxina ácido indolacético (AIA). El ácido abscísico (ABA) es otro RCV identificado como participante en la diferenciación sexual en plantas (Wang et al., 2002). Sin embargo, no se encontraron diferencias significativas en el nivel de ABA entre sexos (Cuadro 2). Donde sí se detectaron diferencias altamente significativas fue en el contenido de citocininas (CT), ya que el contenido en árboles hembra fue 8.7 veces más alto en comparación con el de los árboles macho (Cuadro 2).
Cuadro 2 Niveles de reguladores del crecimiento vegetal en árboles hembras y machos de B. alicastrum de la localidad de Xoccheila, Mérida, Yucatán.
| Sexo | AG | CT | AIA | ABA |
| Hembra | 93.11 ± 7.57 a | 465.12 ± 79.29 a | 5.12 ± 2.63 a | 0.509 ± 0.25 a |
| Macho | 66.07 ± 7.83 b | 53.33 ± 14.23 b | 4.15 ± 3.87 a | 0.274 ± 0.04 a |
*Valores en ng mg-1 de peso seco. AG= ácido giberélico; CT= citocininas; AIA= ácido indolacético; ABA= ácido abscísico. Letras diferentes en la misma columna denotan diferencias significativas (p< 0.05) entre árboles machos y hembras.
Discusión
La determinación del sexo de los árboles de B. alicastrum que formen parte de plantaciones forestales destinadas a la producción de semillas es crucial. Ramón es una planta monoica, por lo que las hembras son las que producen y contienen frutos. Estudios recientes sobre los mecanismos de asignación de sexo en plantas han demostrado claramente que las angiospermas, incluidas las plantas de cultivo, poseen mecanismos de asignación de sexo que involucran varios factores genéticos (cromosomas sexuales) y epigenéticos tales como: RCV, intensidad de luz, fotoperíodo, entre otros (Khryanin, 2002; Golenberg y West, 2013).
Con respecto al sexo que los árboles expresaron por primera vez después del trasplante, se encontró 66% de árboles machos y 34% de hembras en la muestra de 50 árboles, similar a la proporción de sexos general encontrada en los 456 árboles de las tres plantaciones examinadas: 64% machos y 36% hembras. Las observaciones muestran que el sexo de los árboles no cambia ni con la edad ni con la altura de la planta (Hernández et al., 2015). La determinación de árboles masculinos o femeninos se dio al alcanzar al menos siete años, 4 m de altura y más de 7 cm de diámetro a la altura del pecho (dap).
El sexo registrado por primera vez no cambió durante los siguientes 6 años, tiempo en el cual finalizó este estudio. Estos resultados contradicen lo reportado por Peters (1989), quien no observó árboles jóvenes o machos bajos en poblaciones naturales. Los árboles estudiados crecieron en condiciones naturales, lo que no pareció haber afectado la asignación por sexo. Según Khryanin (2002), se sabe que el equilibrio entre citocininas y giberelinas desempeña un papel central en la asignación de sexos en las plantas. Se ha citado que las giberelinas favorecen la diferenciación de plantas masculinas, mientras que las citocininas estimulan la diferenciación de plantas femeninas (Golenberg y West, 2013) este patrón; sin embargo, no ocurre en todas las especies.
En este estudio, los árboles hembras tenían un contenido de giberelinas significativamente mayor que los árboles machos Cuadro 2. Tal tendencia se opone a la observada por Khryanin (2002), quien señala que un mayor contenido de giberelinas promueve la diferenciación sexual hacia el género masculino en plantas anuales. La evidencia recopilada desde la década de 1980 muestra que la aplicación de citocininas en especies como la uva (Vitis vinífera L.) favorece el desarrollo de inflorescencias femeninas. Más recientemente, se ha demostrado que los niveles altos de citocininas tienen un efecto feminizante en Arabidopsis (Riefler et al., 2006). En este estudio se encontraron diferencias altamente significativas entre sexos en el contenido de citocininas.
Las hojas de los árboles hembras tuvieron concentraciones de citocininas mucho mayores que las de los árboles machos. Esto sugeriría que las citocininas tienen un papel feminizante en B. alicastrum, un hecho consistente con los hallazgos de Khryanin (2002) para otras especies. La información recopilada en este estudio de 10 años será muy útil para planear en un futuro el establecimiento de plantaciones comerciales destinadas a la producción de semillas o biomasa, contribuyendo así a mejorar la seguridad alimentaria.
Conclusiones
En el árbol B. alicastrum existe una mayor predominancia de árboles masculinos, la cual está ligada a los contenidos de reguladores de crecimiento presentes en los árboles, principalmente de las citocininas y que no existe un cambio de sexo a través del tiempo como se ha reportado. El inicio de la floración ocurre entre los siete y diez años posterior al establecimiento en los sitios de plantación, con mayor y menor ocurrencia entre los ocho y diez años respectivamente, la producción media de semillas de árboles adultos fue de 145.6 kg árbol-1año-1 y las hojas en los árboles pueden durar hasta un periodo de tiempo de 40 meses.
Con los resultados del estudio también se demuestra que B. alicastrum tiene una alta productividad, por lo tanto, se pueden establecer plantaciones comerciales para la producción de forraje y semillas que pueden utilizarse para consumo humano.











 texto en
texto en 


