P. cinnamomi se ubica en la clase de los oomycetes, son eucariontes que pertenecen al grupo protista (filamentosos), su forma de alimentación es como saprofitos, biótrofos, hemibiótrofos o necrótrofos (Engelbrecht et al., 2013). La descripción taxonómica del género Phytophthora se base en su morfología y características estructurales (esporangio, anteridio, oogonio o micelio) autores refieren como Martínez (2015); McGowan et al. (2018). Phytophthora pertenece al reino chromista orden peronosporales (Rays y Brett, 2012; Sharma et al., 2021). Las especies de Phytophthora devastan ecosistemas nativos, bosques, plantas ornamentales y cultivos agrícolas intensivos (Kurbetli et al., 2020a). Es considerado uno de los fitopatógenos de suelo con mayor grado de afectación en la fruticultura, por los impactos que ha causado a las unidades de producción comercial, con pérdidas de 45 a 90% (Ramírez, 2018; Sánchez et al., 2019).
El aguacate (Persea americana Mill.) es afectado por la enfermedad de la tristeza del aguacate causada por P. cinnamomi Rands (Berg et al., 2021). En condiciones favorables el patógeno afecta raíces y base del tallo de los árboles de aguacate (Zapata et al., 2018). En la raíz ingresa por el poro radicular y espacios intercelulares, daña las paredes primarias de las células de la endodermis, que integran a la banda de Caspary, invade los haces vasculares y toma los nutrientes para su desarrollo, altera la fenología y fisiológica del frutal (Osorio et al., 2017; Zapata et al., 2018).
En el tejido celular induce el estrés hídrico, propicia marchitez, secamiento de las estructuras vegetales y finalmente induce muerte descendente del árbol (Osorio et al., (2017). Los síntomas se reconocen por la manifestación de hojas pequeñas con presencia de clorosis, el crecimiento vegetativo se detiene, inicia la defoliación parcial de las hojas y la producción de fruta disminuye (Osorio et al., 2017). En ausencia de hospedero, el microorganismo tiene la facultad de alimentarse de materia orgánica en descomposición y prevalece en el suelo hasta por seis años (Toapanta et al., 2017; Ruiz et al., 2019), de acuerdo con Kurbetli et al. (2020a, 2020b), en el mundo, la enfermedad se encuentra distribuida en zonas de producción de aguacate. En condiciones favorables las unidades de producción comercial son devastadoras (Almaraz et al., 2016; Gómez, 2018).
Las alternativas de manejo de la enfermedad y del agente causal, cada vez son más agresivas con los factores bióticos y abióticos que interactúan con el desarrollo del cultivo (Ramírez, 2018). Con base a lo anterior, este ensayo consiste en dar a conocer el estatus epidemiológico de P. cinnamomi en interacción con P. americana y las alternativas de manejo fitosanitario autorizadas.
Riesgos fitosanitarios de Phytophthora spp. en frutales
Kurbetli et al. (2020a) reportaron que Phytophthora spp., fue detectado en árboles de granada con 10 años de producción, la incidencia de la enfermedad fue 4.59%; es decir, por cada cien árboles, cinco estaban infectados por P. nicotianae y P. palmivora. Los daños se expresaron afectando el cuello de la raíz causando muerte descendente de los árboles. Además, Dai et al. (2019) mencionan que P. hibernalis afecta los haces vasculares de los cítricos, causa podredumbre parda y genera gomosis, que es expulsada por las lenticelas del tallo. En California y Florida, USA, la producción se vio afectada en 46%, con pérdidas económicas de 30 a 60 millones de dólares (Sáenz et al., 2019). En China, desde 2007 P. hibernalis es considera plaga cuarentenaria (Dai et al., 2019). En el 2015, China detectó la presencia del patógeno en cítricos que ingresaron por Shanghain y suspendió las importaciones que provenían de Tulare, California (Dai et al., 2019). Sánchez et al. (2019) mencionan que los valles del norte de la Patagonia, P. cactorum, P. inundata, P. rosacearum, P. lacustris y P. termopila causan pudrición en cuello de la raíz o base de la corona de árboles de pera.
Fisiología del parasitismo
Phytophthora sp., forma clamidosporas, esporangios y oospora que le permiten vivir en el suelo como saprófito hasta por seis años (Toapanta et al., 2017). En temperaturas de 21 a 28 °C, humedad de 78%, textura de suelo, pH 6-7 y suelos saturados o inundados inicia la fase asexual (Toapanta et al., 2017), en este sentido, la presencia de agua es fundamental para la fase de multiplicación y diseminación en el hospedero (Vicent et al., 2016). El esporangio maduro libera entre 30 a 40 zoosporas, se propagan a través del agua mediante la acción mecánica de los flagelos (Almaraz et al., 2016; Zentmyer, 1985).
Las zoosporas son atraídas por los exudados de aminoácidos de la zona de elongación, misma, que segregan las raíces secundarias y vellosidades de adsorción (García et al., 2016; Pliego et al., 2016; Zapata y Leal, 2018). En interacción con el tejido radicular, las zoosporas se enquistan y se anclan a la epidermis de la raíz, dando lugar a la etapa de penetración e infección de la epidermis, endodermis y haces vasculares de la radícula, debido a la presencia del tubo germinativo o células patógenas de las hifas que componen el micelio del oomiceto, el proceso de colonización de las estructuras primarias de la radícula dura 24 h en promedio (Zapata y Leal, 2018).
El micelio del fitopatógeno alcanza su óptimo desarrollo, posterior al parasitismo del cambium, enseguida se dirige a los haces vasculares y por la proliferación de hifas causa taponamiento de xilema (Huaman et al., 2015; Hardham y Blackman, 2018). Las obstrucciones de los haces vasculares limitan la movilización de agua y nutrientes, estimula el estrés hídrico y desnutrición del árbol por la falta de agua y nutrición, en consecuencia, el tejido de la radícula se necrosa (Huaman et al., 2015; Hardham y Blackman, 2018). Más tarde, el micelio invade la base de la corona o haces vasculares del cuello de la raíz, donde se expresa la enfermedad del cancro, misma, que alcanza hasta 2 m de altura, a partir de la base de la corona se observa coloración café claro a oscuro, más exudado acuoso (Andrade et al., 2015). Durante este proceso, el micelio dará origen a clamidosporas, dando formación al tubo germinativo, para formar el esporangio, donde se producirán las zoosporas y cuando el esporangio madura libera zoosporas y forma varias generaciones de la producción asexual (Hardham y Blackman, 2018) (Figura 1).
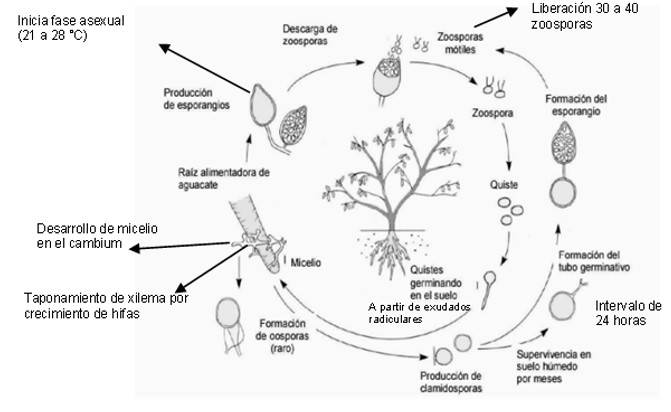
Figura 1 Ciclo de vida y fisiología del parasitismo de Phytophthora cinnamomi modificado dePegg et al. (2002).
La fase sexual inicia en el micelio maduro, Ainswort (1985) describe que en la fase sexual P. cinnamomi forma estructuras de resistencia llamados gametangios, donde el oogonio se une con el anteridio; a través, de un tubo de fecundación y se fusiona con el núcleo del óvulo. Las oosferas segregan una pared para formar las oosporas, después de un periodo de reposo, las oosporas son liberadas, enseguida producen un tubo germinativo que dará origen al esporangio, mismo que en condiciones favorables dará lugar a las siguientes generaciones del fitopatógeno (Alexopoulus y Mims, 1985).
Impacto económico por el comportamiento epidemiológico de la tristeza del aguacate
De acuerdo con Rodríguez et al. (2017) la tristeza del aguacate es la principal limitante de producción del cultivo de aguacate, en condiciones favorables, el riesgo epidemiológico de afectación en huertas comerciales es de 75%, con pérdidas anuales hasta 30 millones de dólares (Kurbetli et al., 2020b). La distribución espacial de la enfermedad se ha diseminado en las diferentes regiones del mundo, donde se cultiva P. americana. A partir de los primeros brotes epidemiológicos de P. cinnamomi, el incremento de la enfermedad ha crecido de forma exponencial (Ramírez, 2018).
En América Latina, la tristeza del aguacate eliminó importantes áreas de producción comercial de aguacate en México, Perú, Colombia y Chile (Toapanta et al., 2017). En 1942, el patógeno fue aislado de raíces de aguacate por Tucker (Zapata y Leal, 2018). En el mismo año, en California, USA. fue aislado de huertas de aguacate (Serrano y Garbelotto, 2020) y en 1980, en USA, la enfermedad devastó 1 500 ha de aguacate (Flores, 2015; Kurbetli et al., 2020b). En Sudamérica, 1950, en Perú detectaron 50 000 árboles enfermos (Flores, 2015).
En Colombia las pérdidas de plántulas fueron de 50% y en plantaciones de aguacate 47% (Pérez et al., 2014). En la zona aguacatera de Chile, esta enfermedad también es limitante en el cultivo del aguacate (Sepúlveda et al., 2013). En 1986, P. cinnamomi Rands se presentó en plantaciones de aguacate de Ecuador, donde fue clasificada como la enfermedad de fácil propagación con alta incidencia y de control obligatorio (Toapanta et al., 2017).
En 1965, en Australia los suelos forestales también fueron positivos a la presencia de P. cinnamomi Rands (Flores, 2015) en un millón de ha, el oomiceto destruyó más de 400 hospederos (Almaraz et al., 2013).
En 1970, en Sudáfrica con la introducción del cultivo de aguacate, el número de huertos infectados creció de forma exponencial, y las pérdidas se estimaron 20% de la producción total (Flores, 2015). También, en la región de Andalucía, España 40% de huertos de aguacate se vieron afectados por P. cinnamomi (Kurbetli et al., 2020b). En 1982 se identificó la enfermedad de la tristeza de aguacate, aumentando la incidencia en huertas de aguacate de Israel (Kurbetli et al., 2020b).
Actualmente, la enfermedad de la tristeza del aguacate ha traspasado fronteras y continentes (Gómez, 2018). Derivado de este ensayo, en la Figura 2 se hace el aporte con la distribución espacial de la enfermedad con brotes epidemiológicos, donde destacan Australia, Nueva Zelandia, África, Israel, España, Marruecos, USA y México (Gómez, 2018).
Situación fitosanitaria de la tristeza del aguacate en México
En 1952, en México los primeros brotes epidemiológicos de la tristeza del aguacate causada por P. cinnamomi alcanzó pérdidas de 90% en huertas de aguacate (Almaraz et al., 2016). En 1994, en Uruapan, Michoacán la enfermedad causó la muerte de 100 100 árboles de aguacate Hass (Andrade et al., 2017); De acuerdo con Ochoa et al. (2015) 4 000 ha de aguacate están afectadas por P. cinnamomi. También, en Atlixco, Puebla han desaparecido grandes áreas productoras de aguacate (Ochoa et al., 2015). En la actualidad Puebla, Chiapas, Veracruz, Nayarit, Morelos y Michoacán presentan esta enfermedad con diferentes grados de afectación en huertas productoras de esta Lauraceae (Gómez, 2018). Ramírez (2018) menciona que, en zonas productoras de aguacate de la República Mexicana, presentaron incidencia de 5% de la enfermedad de la tristeza del aguacate.
Medidas fitosanitarias para el control de la tristeza del aguacate
Para el control de la enfermedad e incrementar la tolerancia del hospedero durante el periodo crítico de infección, se requiere implementar el manejo integrado a base de control cultural, biológico, genético, físico y químico (Andrade et al., 2017). De acuerdo con Ramírez et al. (2014), la aplicación de especies de microrganismos del género Pseudomonas, Trichoderma y hongos micorrízicos tienen efecto de exterminio sobre P. cinnamomi y progreso en el crecimiento del árbol de aguacate. Además, el género Trichoderma sp., tiene propiedades antagónicas para el control de Phytophthora sp., Rhizoctonia sp., Sclerotium sp., Pythium sp. y Fusarium sp., presentes en el suelo, quienes causan enfermedades fúngicas (Andrade et al., 2017).
El modo de acción de Trichoderma sp., se incrementa por competencia directa con los fitopatógenos, por espacio y nutrientes, producción de metabolitos volátiles o no volátiles y parasitismo (Andrade et al., 2017). La alternativa del mejoramiento genético se basa en obtener patrones de aguacate tolerantes a P. cinnamomi (Pérez et al., 2015). También, los materiales tolerantes se injertan en variedades criollas como P. americana var. drymifolia, S. F. Blake, Duke 6, Duke 7 y Thomas, materiales que son resistentes a enfermedades de raíz (Rincón et al., 2011).
Otra alternativa es el control físico, donde se utiliza la solarización para reducir la prevalencia del patógeno, se basa en retirar la copa del árbol a una altura de 1.5 m, el tronco y ramas se pintan con sal, cal y agua, el cajete se limpia de residuos, el suelo se nivela alrededor el árbol, en un radio de 4 m, enseguida se aplica riego a capacidad de campo y por último se coloca plástico negro calibre 150 de 6 x 6 m sobre la superficie del suelo, a partir del centro del árbol a la periferia, lo que permite el incremento de temperatura a 32 °C y 65 °C, en este sentido, el efecto invernadero es letal para el patógeno, así mismo aumenta la población de microorganismos saprófitos, mismos que compiten por espacio y se genera antagonismos para el fitopatógeno (Flores, 2015).
En el control cultural se realizan camellones de 0.5-1 m de altura para aumentar el drenaje del agua, esto tiene como objetivo asegurar que las raíces se ubiquen en el suelo y que no esté compactado (Sepúlveda et al. (2010). Entre las principales prácticas se deben realizar riegos adecuados para reducir el exceso de humedad y evitar la inundación de la cepa o cajete del cultivo (Sepúlveda et al., 2010). En el control químico, se aplican fungicidas específicos como acilalaninas o fenilamidas, para patógenos del reino Straminipila (Leal et al., 2014). Las moléculas destruyen el desarrollo de Phytophthora sp., su mecanismo de acción es sobre la biosíntesis del ADN; sin embargo, existe alto riesgo de generar resistencia, para evitar que el oomiceto genere resistencia a las moléculas, se sugiere la combinación con fungicidas de amplio espectro Benalaxil, Furalaxil y Metalaxil (Leal et al., 2014).
También se pueden aplicar fosfonatos, por el mecanismo de acción sistémico (Sepúlveda et al., 2010). En este grupo se encuentra fosetil-al y el ácido fosforoso, mismos, que han mostrado efectividad en follaje, suelo y por inyección en el árbol para el control de Phytophthora sp., (Sepúlveda et al., 2010). Otro de los tratamientos que se pueden aplicar son los fosfitos, su acción es sistémica, la aplicación es por aspersión directa en hojas, suelo y también se busca que el suministro sea por vía inyección. Entre los beneficios más sobresalientes son el crecimiento de raíz y la altura de las plantas (Rodríguez et al., 2016).
Endoterapia
Ante esta problemática fitosanitaria, la endoterapia es un método alternativo de control y de bajo impacto ambiental (Espinosa et al., 2013). El mecanismo de acción consiste en la translocación y disposición del ingrediente específico dirigido a los haces vasculares del árbol y a las estructuras botánicas colonizadas por el oomiceto (Espinosa et al., 2013; Alayón et al., 2015). La endoterapia es una técnica que inicia en la época helenística, se utilizó para fines terapéuticos a partir de mediados del siglo veinte (Estévez et al., 2011). De acuerdo con García (2011) la endoterapia fue utilizada por Leonardo Da Vinci, en árboles de manzana, quien aplicó las primeras pruebas con arsénico y así evitó el robo de los frutos (Estévez et al., 2011).
Desde hace 30 años, en regiones de Asia, América Latina y África, la endoterapia se utiliza con éxito contra plagas y enfermedades en palmeras, también en datileras o cocoteros para el control del picudo rojo (Estévez et al. 2011). En Egipto y el Golfo, esta práctica se aplica a partir de 20 años a la fecha y en España por 10 años consecutivos es herramienta habitual para el control y manejo de la enfermedad (Estévez et al., 2011). La aplicación en los árboles implica intervalos de 30 s hasta 10 min, el tratamiento es específico, actúa a partir de la capacidad de flujo de savia que se presenta en el interior de los tejidos vasculares (xilema) (García, 2011).
Para optimizar la efectividad de la técnica se han diseñado diferentes equipos de inyección micro y macro, mismos que han servido para investigaciones, control y prevención de enfermedades y plagas (Li y Nangong, 2021). La primera técnica, consiste en la aplicación por microinyección (Doccola y Wild, 2012; Tanis y McCullough, 2016). El sistema utiliza boquilla de salida o inyector tipo aguja, se aplica volumen bajo (1 a 3 ml) de producto sistémico, en presentación líquida (Doccola y Wild, 2012; Tanis y McCullough, 2016). El orificio es menor de 4.9 mm de diámetro y profundidad máxima de 30 mm (Doccola y Wild, 2012; Tanis y McCullough, 2016).
Por cada inyección se aplica aire/hidráulico con presión baja de 172 a 1 379 kilopascal (kPa) o 40 libras por pulgada cuadrada (PSI) (Doccola y Wild, 2012; Tanis y McCullough, 2016). Este sistema se inyecta en los tejidos de albura y cambium del tejido leñoso, la uniformidad de distribución del producto es en pocas horas misma, que se incrementa de acuerdo con la transpiración, y se relaciona con la pérdida de agua; además, la endoterapia reduce riesgo de fugas químicas, derrames y heridas en los árboles (Cibrián, 2021; Li y Nangong, 2021).
El sistema de macroinyección, tiene en la punta del inyector un cono metálico, que permite hacer orificios de 9 mm y con profundidad máxima de 70 mm, además se emplea válvula de taquete expansor; esta técnica inyecta mayor volumen durante la aplicación del tratamiento sistémico, evita que el producto se derrame y potencialmente mejora la translocación del fungicida en los haces vasculares del árbol (Arriola et al., 2014; Arriola et al., 2014; Tanis y McCullough, 2016; Cibrián, 2021). El sistema puede durar hasta tres años, por presentar alta precisión, se reduce el volumen del producto, la permeabilidad se incrementa y el fungicida se absorbe con mayor velocidad (Li y Nangong, 2021).
También se utiliza el sistema de infusión método de flujo por gravedad o inyección pasiva en este sentido la presión externa, no es necesaria y la efectividad biológica dependerá del fungicida mismo, que será introducido hasta los haces vasculares (Cibrián, 2021). Finalmente, el sistema de implantes consiste en realizar la perforación de epidermis y endodermis, hasta alcanzar el xilema y cambium del hospedero (Cibrián, 2021). En el conductor se incrusta una cubierta de agar con la mezcla del fungicida sistémico, el ingrediente activo se libera a través del agua, lo que permite la translocación del producto hasta la zona de afectación, es decir el producto se libera y transloca a la parte afectada del árbol (Cibrián, 2021).
Conclusiones
A nivel mundial, el comportamiento epidemiológico de P. cinnamomi, agente causal de la tristeza del aguacate se encuentra distribuido en las zonas productoras de aguacate. El incremento de la enfermedad ha crecido de forma exponencial, además, es la principal limitante de producción del cultivo de P. americana. Dada la situación fitosanitaria que expresa la producción de aguacate es necesario implementar alternativas de manejo sustentables, como la endoterapia; a través, de la inyección de productos selectivos en dosis específicas, que controle la enfermedad, sin afectar la calidad e inocuidad del fruto.











 texto en
texto en 



