Introducción
La nanotecnología ha ganado una gran atención con el tiempo y promueve la aplicación de nanopartículas en una amplia gama de campos de la industria agrícola. Las nanopartículas (NPs) tienen un tamaño promedio <100 nm y se componen de carbono, metal, óxidos metálicos o materia orgánica (Hasan, 2015). Se pueden sintetizar por métodos, como el método sol-gel, deposición química de vapor, precipitación, descomposición térmica o síntesis hidrotermal (Salama et al., 2019).
El tamaño de estos materiales permite que manifiesten propiedades físicas, químicas y biológicas diferentes a las del mismo material con tamaños de partícula mayores, debido principalmente a dos razones: las nanopartículas poseen mayor superficie específica por unidad de volumen y por tanto mayor reactividad (Ealia y Saravanakumar, 2017).
Las nanopartículas de óxido de zinc (NPs-ZnO) por sus propiedades opto-eléctricas, físicas y antimicrobianas presentan efectos positivos en las plantas (Faizan et al., 2020). Varios estudios sugieren que las NPs-ZnO tienen la capacidad de mejorar el crecimiento en diferentes especies de plantas. En la germinación de semillas aumenta con la aplicación de NPs-ZnO en concentraciones bajas; sin embargo, en concentraciones altas sucede un efecto negativo en la germinación (Raskar y Laware, 2014; Afrayeem y Chaurasia, 2017). Por ejemplo, Lin y Xing. (2007) encontraron que la aplicación de dosis altas de NPs-ZnO >2 000 mg L-1 inhibían la germinación de semillas de Lolium perenne. Dhoke et al. (2013) observó que las NPs-ZnO, como fertilizante de micronutrientes, mejoraron el crecimiento de plántulas de Vigna radiata y Cicer arietinum a concentraciones bajas en rangos de 1-20 mg L-1.
La lechuga (Lactuca sativa) pertenece a la familia de las Asteráceas, y es uno de los principales cultivos del mundo considerada como la verdura de hoja más importante y conocida como la verdura fresca cortada más común (Abdalla et al., 2021). Con base a lo anteriormente descrito, el objetivo de este estudio fue sintetizar y caracterizar nanopartículas de ZnO por un método convencional de precipitación química controlada, así mismo, evaluar el efecto de estas nanopartículas en la germinación de semillas de lechuga (Lactuca sativa).
Materiales y métodos
El presente estudio fue desarrollado en la Universidad Politécnica de la Región Laguna, México. Localizada a una latitud 25° 46’ 59.8” latitud norte, 103° 11’ 30.1” longitud oeste.
Síntesis de nanopartículas de ZnO
Se sintetizaron mediante una modificación del método descrito por Aquino et al. (2018). Se utilizó acetato de zinc Zn(CH3COO)2 como precursor y la producción de nanopartículas consistió en una precipitación controlada con NaOH. Se disolvió NaOH 0.1 M en 250 ml bajo agitación constante y a una temperatura de 70 °C en una parrilla de calentamiento con agitación magnética Labnet. Luego de obtener la temperatura deseada se añadieron 25 ml de Zn(CH3COO)2 0.5 M gota por gota con calentamiento y se continuó agitando durante 2 h. Se obtuvo una solución de color blanco. Este compuesto se filtró y se lavó varias veces con agua desionizada para eliminar cualquier impureza. Se secó en una estufa a una temperatura de 70 °C durante 24 h. La muestra se llevó a calcinación a una temperatura de 500 °C por 3 h en una mufla Novatech MD-12-ESP. El polvo blanco resultante se trituró con un mortero para obtener NPs-ZnO.
Caracterización de nanopartículas de ZnO
Las NPs-ZnO sintetizadas se caracterizaron por medio de diversas técnicas analíticas que incluyen difracción de rayos X (XRD), microscopía electrónica de barrido (SEM), espectroscopía UV-visible y espectroscopía infrarroja transformada de Fourier (FTIR). El análisis XRD se llevó a cabo en un difractómetro de rayos-X PANalytical, Empyrean con radiación K( de cobre con longitud de onda, (= 1.5406Å con el propósito de conocer la pureza de la muestra. El goniómetro se operó desde 5° hasta 90° en 2( y la velocidad de barrido fue de 30 s con un paso de 0.026º. Las fases presentes se identificaron mediante las cartas de difracción ICSD (Inorganic Crystal Structure DataBase) y el software HighScore Plus.
Las imágenes para la determinación de la morfología superficial se realizaron con un microscopio electrónico de barrido TESCAN MIRA con emisión de campo FEG, la muestra se recubrió con oro-paladio mediante sputtering. Las propiedades ópticas de la muestra se estudiaron con un espectrofotómetro UV-visible Jenway 7305 utilizando agua como disolvente de referencia. El espectro FTIR se registró con un aparato Nicolet IR 100 Thermo Scientific en un intervalo de 4 000-400 cm usando la técnica de pastilla en KBr.
Prueba de germinación de semillas
Las pruebas se realizaron utilizando semillas de lechuga roja sangría (Lactuca sativa) de la compañía Rancho Los Molinos. Las semillas fueron desinfectadas con etanol al 75% durante 5 min y se lavaron con agua desionizada (Li et al., 2019). Las pruebas de germinación se realizaron colocando 10 semillas por cada placa Petri de 90 mm de diámetro las cuales contenían papel filtro humedecido con 5 ml de cada solución preparada de NPs-ZnO.
Los tratamientos fueron divididos en: (control) agua desionizada, 25, 50, 75, 100 y 125 mg L-1 de NPs-ZnO para probar cómo diferentes concentraciones pueden afectar la viabilidad de la semilla. Se prepararon cuatro réplicas por cada muestra respectivamente. Las placas Petri se sellaron con papel Parafilm y se colocaron en una cámara de crecimiento artificial Novatech CA-550 a 25 ±2 °C con un ciclo día/noche de 12 h por un periodo de siete días (Liu et al., 2016).
Medición de índices fisiológicos
Se realizó la medición de índices fisiológicos que incluye el vigor de semillas (%), el porcentaje de germinación (%), la longitud de la radícula (mm), peso fresco de plúmula y radícula (mg) (Li et al., 2019). El peso fresco de la plúmula y la radícula se pesaron en una balanza analítica AND HR-250AZ y se reportó en miligramos por plúmula.
Porcentaje de germinación. Después de siete días, se registró el número total de semillas germinadas, y el resultado se expresó como se muestra en la siguiente ecuación:
1).
Vigor de semillas. Al cuarto día después de la siembra, se realizó el primer conteo para la toma de datos de semillas germinadas (plántulas que tienen bien desarrolladas la radícula y la plúmula, con desarrollo total de 2 cm en promedio) (Ramírez-Rodríguez et al., 2021). Para determinar el vigor de la semilla, expresando el resultado en porcentaje según la ecuación:
2).
Determinación del contenido de clorofila (Chl) y carotenoides
Se determinó clorofila a (Chla) y b (Chlb) y carotenoides (Car) después de la aparición de 3 a 4 hojas verdaderas a los 20 días del desarrollo de las plántulas por el método de Lichtenthaler y Wellburn (1983) suspendiendo 0.5 g de muestra fresca en 10 ml alcohol etílico al 95%. El homogeneizado se centrifugó a 1500 ×g durante 20 min y se recogió el sobrenadante. Luego se registraron las lecturas de absorbancia a 665, 649 y 470 nm en un espectrofotómetro UV-visible Jenway 7305. El contenido se reportó según las ecuaciones (Lichtenthaler y Wellburn, 1983): Chla= 13.95 A665 - 6.88 A649 3); Chlb= 24.96 A649 -7.32 A665 4); Car= (1 000 A470 - 2.05 Chla -114.8 Chlb)/245 5).
Contenido total de fenoles
Se mezclaron 2 g de muestra fresca (hojas verdaderas) en 10 ml de etanol al 80%, y se dejaron en agitación constante por 24 h a 70 rpm y 5 °C. El extracto fue centrifugado a 3 000 rpm durante 5 min y el sobrenadante fue extraído para los análisis (Salas-Pérez et al., 2016). Los compuestos fenólicos totales se cuantificaron por el método de Folin-Ciocalteu (Singleton et al., 1999). Los resultados se reportaron en mg de ácido gálico equivalente por 100 g de peso fresco (mg equiv AG 100 g-1 PF).
Análisis estadístico
El experimento se realizó mediante un diseño completamente al azar con seis tratamientos y cuatro repeticiones. La normalidad y la homogeneidad varianzas de los datos para cada variable de respuesta se verificó con la prueba de Bartlett y Kolmogorov-Smirnov. Los resultados obtenidos se analizaron mediante análisis de varianza y comparación de medias con la prueba de Tukey (p≤ 0.05) utilizando el paquete estadístico Statistical Analysis System Institute (SAS) versión 9.4. Las variables que se reportan en porcentaje (vigor y germinación) se normalizaron aplicando la transformación de arcoseno y raíz cuadrada.
Resultados y discusión
Síntesis de nanopartículas de ZnO
La síntesis de las NPs-ZnO se llevó a cabo siguiendo el mecanismo de precipitación. El Zn(CH3COO)2puede convertirse en Zn(OH)2coloidal bajo una solución alcalina (pH= 13-14). Durante el proceso hidrotermal, parte del Zn(OH)2coloidal se disocia a Zn2+ y OH-. Cuando la concentración de Zn2+y OH-alcanzan el grado de súper saturación, se forman núcleos de ZnO (Aquino et al., 2018). La calcinación a 500 °C favorece la formación del ZnO, además de la cristalización y el crecimiento de las nanopartículas.
Caracterización de nanopartículas de ZnO
De acuerdo con el difractograma obtenido mediante difracción de rayos X (Figura 1a) no se detectaron impurezas en este patrón, la muestra contiene solo óxido de zinc en su fase zincita, cuya estructura es hexagonal (ICSD, 98-005-7478), lo que implica que se obtuvieron NPs-ZnO puras.
Las micrografías SEM de las NPs-ZnO (Figura 1b) se exhibieron de manera muy uniforme presentando una morfología semiesférica y poligonal compatible con la naturaleza cristalina del ZnO, cuyo tamaño oscila entre 67.37 y 71.1 nm. Las propiedades ópticas de las NPs-ZnO estudiadas por espectroscopia UV-visible (Figura 1c) muestran un pico de absorción centrado en 378 nm, característico de la estructura hexagonal de ZnO. Las NPs-ZnO sintetizadas sometidas a FTIR (Figura 1d) indican los picos característicos del grupo funcional presente, se infiere que la primera banda se observa a partir de 400 a 500 cm-1 debido a las vibraciones del enlace Zn-O.
Efecto de las NPs-ZnO en la germinación de semillas
Índices fisiológicos
El Cuadro 1 muestra el efecto de la exposición de NPs-ZnO en la germinación de las semillas de L. sativa. La aplicación de NPs-ZnO tuvo efectos significativos entre los tratamientos y el control (p≤ 0.05). En el parámetro de vigor, podemos observar que se obtuvieron resultados positivos al aplicar concentraciones de 25 mg L-1. Mientras que al aplicar 50 mg L-1 se mostró una disminución del 9.32% respecto al control, esta pequeña reducción se puede considerar como un efecto inhibidor del crecimiento relacionado con un elevado potencial osmótico por las dosis de NPs (Hojjat et al., 2017; Tovar-Jimenez et al., 2020). En el porcentaje de germinación, los tratamientos aumentaron respecto al control, a excepción del tratamiento de 125 mg L-1 el cual no mostró diferencia significativa. El mejor tratamiento fue el de 50 mg L-1 incrementando hasta 36.97%. En cuanto al peso fresco de la plúmula y el peso fresco de radícula incremento significativamente en comparación con los otros tratamientos/grupo control, con la dosis de 50 mg L-1.
Cuadro 1 Comparación de medias en la germinación, vigor, peso fresco de plúmula, radícula y la longitud de la radícula cuando se aplican NPs-ZnO.
| NPs-ZnO (mg L-1) | Vigor (%) | Germinación (%) | Peso fresco de plúmula (mg) | Peso fresco de radícula (mg) | Longitud de radícula (mm) |
| Control | 46.44 ±2.88 cd | 50.76 ±0 c | 9.2 ±0.38 cd | 1.66 ±0.29 c | 21.25 ±0.5 d |
| 25 | 60.11 ±3.83 a | 60.11 ±3.83 b | 8.32 ±0.3 d | 1.16 ±0.06 d | 25.5 ±1 b |
| 50 | 42.11 ±3.33 d | 69.53 ±4.06 a | 11.4 ±0.56 a | 2.71 ±0.09 a | 32 ±0.81 a |
| 75 | 52.27 ±3.01 bc | 65.46 ±4.06 ab | 9.78 ±0.14 bc | 2.1 ±0.11 b | 25 ±0.81 b |
| 100 | 53.77 ±3.47 ab | 65.46 ±4.06 ab | 9.79 ±0.52 bc | 1.23 ±0.15 d | 23.25 ±0.5 c |
| 125 | 46.44 ±2.88 cd | 50.76 ±0 c | 10.22 ±0.4 b | 1.29 ±0.27 cd | 10.25 ±0.5 e |
Valores con letras distintas dentro de una misma columna, indican diferencia significativa de acuerdo con la prueba de Tukey (p≤ 0.05). Los valores son el promedio de cuatro repeticiones. Medias (n= 24) ± desviación estándar.
Dicho efecto podría atribuirse con un aumento en el nivel de Zn dentro de las semillas de lechuga y su interacción en los procesos bioquímicos (Rawashdeh et al., 2020). En la longitud de la radícula también hubo diferencia significativa y el mejor tratamiento fue el de 50 mg L-1 respecto a los tratamientos/grupo control. Sin embargo, debido a la forma, el tamaño, la carga superficial, la composición química y la concentración de las nanopartículas pueden provocar diferentes impactos en la germinación de semillas y el crecimiento de plántulas (Szőllősi et al., 2020).
Los resultados obtenidos en este estudio señalan que el mejor tratamiento de aplicación de NPs-ZnO fue de 50 mg L-1, comparado con otros autores que señalan una respuesta positiva al aplicar 25 mg L-1 NPs-ZnO sobre la germinación y la biomasa en semillas de L. sativa reportado por Rawashdeh et al. (2020). Las semillas de lechuga embebidas en NPs pueden mostrar un crecimiento acelerado en comparación con las semillas de control no tratadas. Una vez que los iones están dentro de las semillas, modulan la síntesis y el metabolismo de proteínas, el contenido de carbohidratos y mayor actividad de enzimas antioxidantes (Rawashdeh et al., 2020).
Clorofila y carotenoides
Se cuantificó el contenido de clorofilas incluyendo Chla y Chlb de las plántulas tratadas con NPs-ZnO como se muestra en la Figura 2a. El análisis estadístico de los resultados de la variable de Chla del presente trabajo no mostró diferencia significativa (p≤ 0.05) en concentraciones de 0, 25, 50, 75 y 100 mg L-1 de las NPs-ZnO aplicadas; sin embargo, se observa un cambio con 125 mg L-1 NPs-ZnO que redujó hasta 40.49% Chla respecto al control.
Además, la aplicación de NPs-ZnO cambió significativamente (p≤ 0.05) el contenido de Chlb, las comparaciones de medias mostraron que la Chlb más alta se encontró en el tratamiento de 50 mg L-1 NPs-ZnO, incluso las concentraciones de 25 y 75 mg L-1 NPs-ZnO superaron al control. Sin embargo, a 100 y 125 mg L-1 NPs-ZnO disminuyó el contenido de Chlb en las plántulas alrededor de 31.25% y 37.5%, respectivamente.
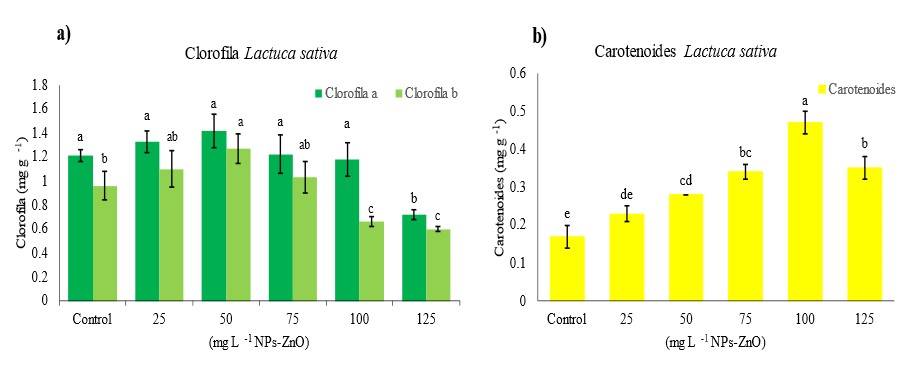
Figura 2 Contenido de clorofila (a) y contenido de carotenos (b) de L. sativa después de cada tratamiento. Los datos se muestran como medias (n= 24) ± desviación estándar. Valores con letras distintas indican diferencia significativa de acuerdo con la prueba de Tukey (p≤ 0.05).
El Zn es un elemento pesado y, al igual que otros metales pesados, en grandes cantidades es tóxico para muchas plantas, y la degradación de la clorofila en estas circunstancias es evidente (Mohsenzadeh y Moosavian, 2017). Estos resultados demuestran que las NPs-ZnO a altas concentraciones disminuyen drásticamente el contenido de clorofila, parece que tal vez la reducción en la cantidad de clorofila se deba a la prevención o degradación de los precursores de estos pigmentos.
El contenido de clorofila se considera un índice importante de la cantidad total de complejo captador de luz y los componentes de transporte de electrones, se relaciona positivamente con la tasa fotosintética (Li et al., 2019), por lo que puede usarse como un indicador para medir el grado de estrés causado por las NPs (Yan et al., 2021). La fotosíntesis de los cloroplastos se altera, lo que hace que el oxígeno se convierta en un aceptor de electrones y se produzcan especies reactivas de oxígeno (Yan et al., 2021). Por otra parte, el tratamiento con NPs-ZnO incrementó significativamente (p≤ 0.05) el contenido de carotenoides en las plántulas de L. sativa (Figura 2b). El contenido de carotenoides más alto se encontró en la concentración de 100 mg L-1 NPs-ZnO, con un aumento de hasta 176.4% respecto al control.
Los carotenoides están presentes en los plastos de los tejidos vegetales y en el estrés ambiental desencadenan el estrés oxidativo, son los encargados de proteger los tejidos fotosintéticos, especialmente la clorofila. Según los resultados obtenidos en este estudio, parece que cierta cantidad de zinc induce estrés oxidativo y provoca la síntesis de carotenoides (Mohsenzadeh y Moosavian, 2017). Lo que sugiere que la reducción en la fotosíntesis es causada por la reducción del contenido de clorofilas. Los resultados corroboran los hallazgos encontrados por Wang et al. (2016) de la exposición de NPs-ZnO en la acumulación de biomasa y la fotosíntesis en Arabidopsis.
Fenoles
En este estudio, la aplicación de concentraciones de 75 y 125 mg L-1 NPs-ZnO no mostraron diferencia significativa en el contenido de fenoles totales de las plántulas de L. sativa. Mientras que la aplicación de 25, 50 y 100 mg L-1 NPs-ZnO incrementaron significativamente respecto al tratamiento control (p≤ 0.05) (Figura 3). El papel del zinc en el uso del carbono para producir compuestos fenólicos en el ciclo del ácido shikímico y el acetato puede ser una de las razones de este aumento (Misra et al., 2006). El zinc induce el estrés oxidativo y conducirá a la producción de radicales libres en la planta, la planta conducirá al estrés y superará a estas especies.
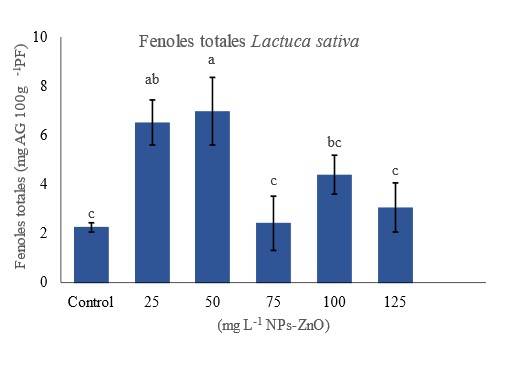
Figura 3 Contenido de compuestos fenólicos totales de L. sativa después de cada tratamiento. Los datos se muestran como medias (n= 24) ± desviación estándar. Valores con letras distintas indican diferencia significativa de acuerdo con la prueba de Tukey (p≤ 0.05).
En respuesta a este estrés, las plantas liberan varios compuestos defensivos conocidos como metabolitos secundarios antioxidantes incluyendo diferentes grupos de polifenoles (Paramo et al., 2020). Así, mejora este parámetro relacionado con el sistema antioxidante de las plántulas, lo cual concuerda con lo reportado por otros autores (Faizan et al., 2018; Paramo et al., 2020; Ramírez-Rodríguez et al., 2021).
Conclusiones
La caracterización realizada demostró que la síntesis de NPs-ZnO mediante un proceso químico permitió obtener tamaños de partícula de 67.31-71.1 nm. Este estudio analizó soluciones de NPs-ZnO en un rango de concentraciones de 25 a 125 mg L-1 en plántulas de lechuga y proporciona datos valiosos y evidencia para aumentar la productividad de cultivos al aumentar la concentración de compuestos útiles, como antioxidantes y metabolitos secundarios. Las NPs-ZnO podrían ser una buena alternativa para mejorar la calidad de las plántulas; sin embargo, se necesita más investigación para aclarar los efectos de los NPs-ZnO ya que existen factores que dependen de la especie y la concentración.











 texto em
texto em 



