Introducción
El hierro (Fe) es un micronutriente indispensable para los seres vivos; en las plantas participa en la fotosíntesis, respiración, procesos enzimáticos, conversión del estado de oxidación, ciclo celular, transporte y almacenamiento de oxígeno, síntesis de hormonas y ADN (Zhou y Tan, 2017). A pesar de que en la corteza terrestre se encuentran altas concentraciones de Fe, existen deficiencias de este elemento en los cultivos ya que no siempre está en formas disponibles para las plantas (Konate et al., 2018).
Lo anterior causa que los alimentos de origen vegetal presenten baja concentración de este oligoelemento generando problemas de salud a dos millones de personas en el mundo, siendo la anemia la principal patología nutrimental (43% niños, 40% mujeres embarazadas y 33% mujeres no embarazadas) (Lowry et al., 2019). La ingesta diaria para prevenir déficit de Fe es de 0.27 a 10 mg día-1 para niños y 11 a 27 mg día-1 para adultos (Abbasifar et al., 2020). Las alternativas utilizadas para mitigar esta situación incluyen el uso de suplementos de Fe y productos fortificados, los cuales no han logrado reducir el déficit de este oligoelemento, debido principalmente al costo de los productos (Tripathi y Mishra, 2020).
La utilización de nanopartículas metálicas, han demostrado incrementos en la germinación, resistencia al estrés, aumento en la absorción de nutrimentos y crecimiento de la planta (Yusefi-Tanha et al., 2020). Además, disminuyen la contaminación y degradación del suelo provocado por el uso excesivo de fertilizantes químicos (Wang et al., 2018). Las nanopartículas de Fe (NPs Fe) pueden incrementar la producción y la calidad de los cultivos (Hu et al., 2017) ya que son altamente efectivos al ser asperjados en las plantas, reduciendo así el impacto de los productos químicos en el ambiente (Sega et al., 2019).
Rui et al. (2016) afirma que las NPs de Fe pueden sustituir a los fertilizantes de Fe en plantas de Arachis hypogaea. Diversos estudios demuestran que las de NPs de óxido de hierro (NPs Fe2O3) incrementan la biomasa y el rendimiento hasta un 48% en plantas de Glycine max (Sheykhbaglou et al., 2010). Así como, los azúcares, proteínas y clorofila en Cucumis melo L (Wang et al., 2016), también incrementa el nivel de fitohormonas en Oryza sativa (Li et al., 2021). Algunos estudios han reportado la interesante participación del Fe en la generación de radical hidroxil (OH) a través de la reacción de Fenton que causa daño en las plantas (Konate et al., 2018).
También afecta el contenido de Malondialdehido (MDA), actividad de las enzimas antioxidantes incluyendo superóxido dismutasa (SOD), catalasa (CAT) y peroxidasa (POD), así como, en otros compuestos bioactivos en la planta (Moradbeygi et al., 2020). Actualmente se ha reportado el efecto positivo de aspersión foliar de las NPs de Fe en el crecimiento, desarrollo y producción calidad de algunos cultivos; no obstante, muchas rutas metabólicas no se han comprendido en su totalidad (Xiong et al., 2017).
Por lo que, es necesario realizar mayores investigaciones para comprender el efecto de las NPs en la producción agrícola (Shakoor et al., 2022), debido a que su efecto depende de la especie química utilizada, la concentración, tamaño de NPs, biosíntesis, la vía y etapa de aplicación (Lu et al., 2020). Por otro parte, el cultivo de pepino (Cucumis sativus L.), ocupa 10% de la superficie total de los invernaderos en México (Valencia et al., 2018). Además, sus frutos contienen diversas propiedades organolépticas, los cuales son una fuente de minerales, fibra, vitaminas y compuestos con actividad antioxidante (Preciado-Rangel et al., 2019). Por lo tanto, el objetivo de esta investigación fue evaluar el efecto de la aplicación foliar de NPs Fe2O3 en el rendimiento y calidad nutraceútica en el cultivo de pepino.
Materiales y métodos
Sitio de estudio y material vegetativo
El experimento fue establecido en un invernadero ubicado en la Universidad Autónoma Agraria Antonio Narro (UAAAN)-Unidad Laguna. Se usaron semillas de pepino de la variedad Poinsett 76 (Southhern Start Seeds), de crecimiento indeterminado. El cultivo fue establecido por siembra directa en bolsas negras de polietileno con capacidad de 10 L, el sustrato utilizado fue arena y perlita en relación 80:20. El cultivo se guío a un solo tallo, el riego y la nutrición fue con la solución nutritiva (SN) Steiner (1961), la cual presentaba una conductividad eléctrica de 2 dS m-1 y un pH de 5.5.
Caracterización de las nanopartículas
Las nanopartículas de óxido de hierro (NPs Fe2O3), fueron donadas por la Compañía Mexicana Investigación y Desarrollo de Nanomateriales SA de CV. Las NPs utilizadas fueron sintetizadas por método químico húmedo en la forma de nanopartículas de óxido de hierro (maghemita: γ-Fe3O3), el tamaño de las nanopartículas tiene un promedio menor a 50 nm, un nivel de pureza de 99.7% y una densidad de 5.81 g cm-3 (Gutiérrez-Ruela et al., 2021).
Diseño experimental y tratamientos
El diseño experimental utilizado fue unos bloques al azar. Los tratamientos consistieron en la aplicación foliar de NPs Fe2O3 (0, 50,75 y 100 mg L-1) con seis repeticiones. La aplicación foliar de las NPs fue realizada en cuatro ocasiones en las primeras horas de la mañana cada 15 días después de la siembra. La cosecha de los frutos fue realizada a partir de los 70 días después de la siembra. Se evaluaron el rendimiento, la calidad comercial y nutracéutica, adicionalmente se cuantifico la acumulación de Fe en los frutos.
Variables evaluadas
Los frutos de diez plantas de cada tratamiento fueron cosechados, contabilizándose el peso, longitud y diámetro de los frutos. Posteriormente, de cada tratamiento se seleccionaron al azar ocho frutos para el análisis de la calidad comercial y nutraceútica.
Biomasa, rendimiento, sólidos solubles totales y firmeza
El rendimiento (RE), se determinó cosechando el total de frutos por planta, utilizando una balanza digital (VE-CB2000, Velab), expresando el rendimiento en kilogramos por planta. La firmeza del fruto (FF) se midió utilizando un penetrómetro (FHT200, Extech instruments) con el émbolo de ocho mm en cuatro frutos de cada repetición, los frutos fueron colocados en una superficie plana y dura, se hicieron tres penetraciones, mismas que fueron promediadas registrándose como fuerza máxima de compresión (N). Los sólidos solubles de los frutos (SST), fueron cuantificados en tres frutos por repetición para realizar una muestra compuesta, se colocaron tres gotas del jugo en un refractómetro (MASTER-53α, ATAGO®) para promediarse y se obtuvo la lectura expresada como Brix.
Índice de clorofila
El índice de contenido relativo de clorofila se midió a los 30 días después del trasplante usando el equipo Minolta SPAD-502. Se tomaron cinco hojas completamente expandidas (sin daños físicos y evitando las nervaduras) de cada planta y cuatro plantas por tratamiento en las etapas de floración y cosecha. Los resultados fueron expresados en unidades de SPAD.
Pigmentos fotosintéticos
Los pigmentos fotosintéticos se determinaron de acuerdo con la metodología reportada por Palacio-Márquez et al. (2021). Se tomaron muestras foliares durante la floración de siete mm de diámetro, evitando las nervaduras, se pesaron 0.125 g en tubos de ensayo. Después, se agregaron 10 ml de metanol y se dejó reaccionar por 24 h en la oscuridad. Finalmente, se leyó a una absorbancia de 666, 653 y 470 nm en un espectrofotómetro UV-Vis (VE-5100UV, VELAB). Los resultados se expresaron en mg g-1 de peso freso (PF) y calculados con las siguientes fórmulas: Chla= [15. 65(A666)-7. 34(A653)]. Chlb= [27. 05(A653) -11. 21(A666)].
Preparación de extractos para la calidad nutracéutica
La extracción de las muestras para la determinación de Fenoles totales, Flavonoides y actividad antioxidante se realizó siguiendo la metodología reportada por (Cardeño, 2007), 2 g de muestra fresca fueron homogenizados con 10 ml de etanol al 80% (v:v). Se agregó la muestra homogenizada en tubos de ensayo y se agitaron durante 30 s en Vortex, se dejaron reposar durante 24 h en un agitador rotatorio (HZ-300) a 70 rpm y a temperatura ambiente. Las extracciones se realizaron por tratamiento y triplicado cada repetición.
Compuestos bioactivos
Fenoles totales
El contenido fenólico se determinó mediante una modificación del método colorimétrico de Folin-Ciacalteau (Singleton et al., 1999). 50 μl, se diluyeron en 3 ml de H2O destilada, después se agregaron 250 μl de Folin-Ciocalteau, se usó un vortex por 30 s y se dejaron reaccionar por 3 min. Subsecuentemente, 750 μl de Na2CO3 (7.5%) y se agregaron 950 μl de H2O destilada. Se cuantificaron por triplicado por repetición en el espectrofotómetro (VE-5100UV, Velab) con la absorbancia a 765 nm, se preparó una solución estándar de ácido gálico, los resultados se expresaron en mg equivalentes GA 100 g-1 de peso fresco (PF).
Flavonoides totales
Los flavonoides totales se determinaron mediante un método colorimétrico reportado (Singleton et al., 1999). Se tomaron 250 µl de extracto, se mezclaron con 1.25 ml de agua destilada y 75 µl de NaNO2 (5%). Se dejaron reposar 5 min, se agregaron 150 µl de AlCl3 (10%) (Sigma-Aldrich, St. Louis, MO, EE UU). Después se agregaron 500 µl de NaOH 1M, 275 µl de agua destilada y se agitó vigorosamente. Las muestras se cuantificaron por triplicado por repetición en el espectrofotómetro (Velab, VE-5100UV) con la absorbancia a 510 nm, se preparó una solución estándar de quercetina. Los resultados se expresaron en mg QE g-1 PF.
Actividad antioxidante
La capacidad antioxidante se determinó utilizando el método de DPPH+ (Aldrich) in vitro según Brand-Williams et al. (1995). Una solución de DPPH+ (Aldrich) en etanol fue preparada a una concentración de 0.025 mg ml-1. 50 μl del extracto se mezcló con 1.95 μl de la solución de DPPH+, después se dejó en reposo por 30 min. Se cuantificaron por triplicado por repetición en el espectrofotómetro (VE-5100UV, VELAB) con la absorbancia a 517 nm. Los resultados se expresaron µM equivalente de Trolox 100 g-1 PF.
Vitamina C
La vitamina C (ácido ascórbico) se determinó por el método de acuerdo con Hernández-Hernández et al. (2019). 10 g de pulpa se trituro con 10 ml de ácido clorhídrico (2%), después se filtró y se aforo con 100 ml de H2O destilada. Se tomaron 10 ml de la solución filtrada y se tituló utilizando una solución de 2,6 diclorofenolindofenol (1×10-3 N). La concentración se expresa en mg 100 g-1 PF.
Proteínas totales
Para la determinación de la proteína total, 3 g de muestra fresca fueron homogenizados en un mortero colocado sobre hielo, agregando 0.1 g de polivinilpolipirrolidona (PVP) y 3 ml de una solución de sodio-potasio (100 mM, pH 7 y 0.1 mM de EDTA) como buffer de extracción, después se centrifugó a 1 200 rpm a 5 °C por 5 min. El sobrenadante fue usado para determinar la proteína total por medio del método de Bradford (1976) usando albúmina de suero bovino como estándar. Los resultados se expresaron en mg g-1 PF.
Contenido foliar de hierro
El contenido se determinó mediante una digestión ácida. Se pesó 0.5 g de tejido foliar y 1 g de pulpa seca en un crisol de porcelana, después, se colocaron en una mufla horno (Thermo Scientific, Thermolyne) por 4 h a 600 °C, las cuales se empezaron a contar a partir de la temperatura de 200 °C. Al término del tiempo, se pre-calcinaron las muestras en un mechero, finalmente se le añadió 5 ml de HCl a una concentración de 20% y se filtró usando papel filtro ultrafino (Whatman) en matraces volumétricos de 50 ml aforando con agua desionizada. La concentración de hierro se midió con un espectrofotómetro de plasma óptico inductivamente acoplado (ICP-OES) serie 700 Agilent Technologies. Los resultados se expresaron en mg kg-1 de materia seca (MS).
Resultados y discusión
Rendimiento
La aspersión foliar de NPs Fe2O3 afectó el rendimiento y la calidad de los frutos de pepino (Cuadro 1). Con la aplicación de 75 mg L-1, se logró la mayor longitud del fruto, SST y RE superando en 38.99% al control. Drostkar et al. (2016) aplicaron NPs Fe en el cultivo de Cicer arietinum como resultado se observó un incremento en el RE en comparación con los tratamientos sin la aplicación de NPs. Los resultados anteriores se explican por el tamaño de la nanopartícula el cual facilita su absorción, así como, su concentración adecuada para el metabolismo de la planta (Kandpal et al., 2014).
Cuadro 1 Rendimiento, longitud de fruto, firmeza, sólidos solubles totales, SPAD, clorofila y proteína total en frutos de pepino, debido a la aplicación foliar de NPs Fe2O3.
| NPs Fe2O3 (mg L-1) | Rendimiento (kg ha-1) | Longitud del fruto (cm) | Firmeza (N) | SST (°Brix) | SPAD | Clorofila total (µg ml-1) | Proteína total (mg ml-1) |
| 0 | 2.18 c | 16.76 c | 0.21 c | 3 c | 29.93 c | 30.32 c | 0.023 c |
| 50 | 2.55 b | 20.11 a | 0.38 a | 4.16 ab | 35.01 b | 39.07 b | 0.027 bc |
| 75 | 3.03 a | 20.66 a | 0.3 b | 4.68 bc | 37.76 b | 42.99 b | 0.036 ac |
| 100 | 2.3 b | 18.71 b | 0.25 b | 3.83 abc | 40.98 a | 48.73 a | 0.039 a |
Valores con letras iguales en cada columna son estadísticamente similares (Tukey p≤ 0.05).
Por consiguiente, el RE y crecimiento del fruto podría verse afectado por las NPs alterando sus actividades biológicas provocando las variaciones (Kanwar et al., 2019). Por lo tanto, son necesarios mayores estudios para poder explicar los efectos fisiológicos que tiene el uso de NPs metálicas, al mismo tiempo, es importante optimizar la dosis de NPs Fe considerando el impacto que tiene este elemento en la nutrición y desarrollo del cultivo (Yuan et al, 2018; Shakoor et al., 2022).
Calidad comercial de frutos
El mayor tamaño de los frutos de pepino fue obtenido con la aplicación foliar de 75 mg L-1 de NPs Fe2O3, superando en 23.26% al tratamiento sin aplicación de NPs (Cuadro 1). Nuestros resultados fueron similares dentro de los rangos para la comercialización. El tamaño adecuado de los frutos de pepino para su comercialización fluctúa entre los 20 a 25 cm, no debe ser inferior a 15 cm de longitud, mientras que el diámetro ecuatorial debe ser de 5 a 5.7 no excediendo los 6 (Valencia et al., 2018).
En cambio con una dosis superior de NPs (100 mg L-1), disminuye el tamaño de los frutos, esto podría ser debido a la biodisponibilidad y alta solubilidad de las NPs de Fe2O3, la cual mientras la dosis de NPs sea mayor, la absorción y facilidad de transporte de los nutrientes en la planta podría ser menor (Moradbeygi et al., 2020). Respecto a la firmeza y los SST, estos fueron afectados positivamente por la aspersión foliar de NPs Fe2O3 (Cuadro 1), obteniendo la mayor firmeza en el fruto con 50 mg L-1 y en SST con la dosis de 100 mg L-1. De acuerdo con Valencia et al. (2018), el promedio de 4.76 °Brix es el estándar adecuado para la calidad del fruto de pepino.
El incremento del contenido de TSS según Rawat et al. (2017) es debido a la aplicación foliar de NPs Fe2O3 lo cual induce a una mejor eficiencia en la regulación de la enzima Rubisco afectando en un incremento el contenido de clorofila, por ende, aumentando la foto-asimilación en los frutos por el rango de fotosíntesis obteniendo un mejor crecimiento y bioacumulación.
Valores SPAD y clorofila total
La aspersión foliar de NPs Fe, afectó significativamente el índice de clorofila y la clorofila total. Con la aplicación de 100 mg L-1 superó 35.24% en valores SPAD y 60.71% en la clorofila total en comparación al tratamiento control (Cuadro 1). Se ha reportado por Rui et al. (2016) un incremento en las unidades SPAD, al incrementar la dosis de NPs Fe2O3 y por Wang et al. (2019) un aumento en el contenido de clorofila total con la aplicación de NPs Fe, lo que significa según la dosis aplicada se puede corregir rápidamente la deficiencia de Fe en plantas. También, Sharma et al. (2012) reportó un incremento del contenido de clorofila en B. juncea tratadas con 100 mg L-1 de NPs metálicas.
Es evidente que el Fe tiene influencia directa en la concentración de clorofila y esta se ve afectada según la concentración de NPs (Kanwar et al., 2019). No obstante, se ha demostrado que la tendencia del contenido de clorofila a través de las etapas se encuentra en un constante decrecimiento-incremento-intercambio (Wang et al., 2019). Entonces, según Rawat et al. (2017) dependiendo de la concentración, etapa de la planta y el tiempo de aplicación se promueve la concentración de compuestos como el contenido de clorofila.
Proteínas totales
La aspersión foliar de NPs Fe2O3, afectó significativamente el contenido de proteínas totales (Cuadro 1). Con la dosis de 100 mg L-1 se superó 69% a los valores obtenidos sin la aplicación de NPs Fe2O3. Se ha reportado en Pisum sativum con la aplicación de NPs Fe, en comparación del tratamiento control (Gutiérrez-Ruelas et al., 2021). Las proteínas solubles totales son producidas por las plantas para adaptarse al ambiente (Shang et al., 2013), a su vez se producen cuando existe un estrés ambiental aumentando la concentración de proteínas o antioxidantes, estos últimos son claves para eliminar los radicales libres (Wang et al., 2019).
Compuestos bioactivos
Con la aplicación foliar de NPs Fe2O3 se obtuvo un incremento en la biosíntesis de compuestos bioactivos (Figura 1). Los compuestos fenólicos y flavonoides, son reconocidos por los beneficios en la salud humana (Elkhatim et al., 2018). En el presente estudio, la mayor concentración de compuestos fenólicos fue lograda con las dosis de 50 mg L-1 superando 27.12 % al control (Figura 1a). Mientras que los flavonoides obtuvieron la mayor concentración con 75 mg L-1 superando un 30.18% al control (Figura 1b). Similares resultados son reportados en investigaciones por Mogazy et al. (2022) en Fragaria ananassa y en Cucumis melo L (Wang et al., 2019). En Arachis hypogaea se reporta una mayor actividad antioxidante (Rui et al., 2016); sin embargo, altas concentraciones de NPs Fe, reducen los antioxidantes no enzimáticos.

Figura 1 Efecto del NPs Fe2O3 sobre el contenido de compuestos fenólicos (a) y flavonoides (b) en frutos de pepino. Las columnas con letras diferentes difieren estadísticamente entre ellas (Tukey p≤ 0.05).
Los anteriores resultados se pueden explicar mediante el funcionamiento regulador del hierro en: 1) catalizador de la sobreproducción de ROS tal como H202 por Haber-Weiss, por consiguiente, afectando a la línea de defensa enzimática (CAT, POD y SOD) y en la reacción de Fenton (Mosa et al., 2018); 2) formación de MDA, peroxidación lipídica (Konate et al., 2018); y 3) interacción en la cera cuticular debido a la aplicación foliar de NPs de Fe, así como, también los genes involucrados en la síntesis de cera intracelular y el transporte (Hu et al., 2017).
La respuesta de los cultivos a las NPs de Fe depende de la dosis ya que esta puede afectar diversas rutas metabólicas (Yuan et al., 2018). Otros reportes indican que el efecto positivo de las NPs de Fe es más evidente cuando existe un estrés (Moradbeygi et al., 2020). Por lo tanto, se considera que el Fe es un elemento de regulación en cultivos dependiente de la dosis permitiendo mecanismos de adaptación metabólica y fisiológica mientras no pase su límite de toxicidad, ya que funciona como una respuesta al estrés oxidativo causado por los radicales bajo las condiciones de estrés (Hasanuzzaman et al., 2020).
Capacidad antioxidante y vitamina C
La aspersión foliar de NPs Fe2O3 afectó positivamente la capacidad antioxidante y el ácido ascórbico (Figura 2). La mayor concentración de capacidad antioxidante se obtuvo con la aplicación de 50 mg L-1 de NPs de Fe2O3 superior en 39.18% al control, con esta misma dosis se obtuvo el mayor contenido de vitamina C superando un 50% al contenido en los frutos del control. Wang et al. (2019) reportaron un incremento de 46.95% el contenido de vitamina C. Las NPs Fe producen un estrés oxidativo, lo que activa una serie de mecanismos antioxidantes estimulando la formación de ROS (Konate et al., 2018).
Contenido de Fe
La aspersión foliar de NPs Fe2O3, aumentó significativamente el contenido foliar de Fe en el cultivo de pepino (Figura 3). La mayor concentración de Fe en hojas y en fruto se encontró con la dosis de 100 mg L-1, superando en 52.3% y 71.37% al control. Se reporta que la aspersión foliar de 100 mg L-1 NPs Fe2O3 en Citrus maxima incrementó 44.7% el contenido de Malondialdehido (Hu et al., 2017), el contenido de Fe en 103% en Raphanus sativus (Shakoor et al., 2022).
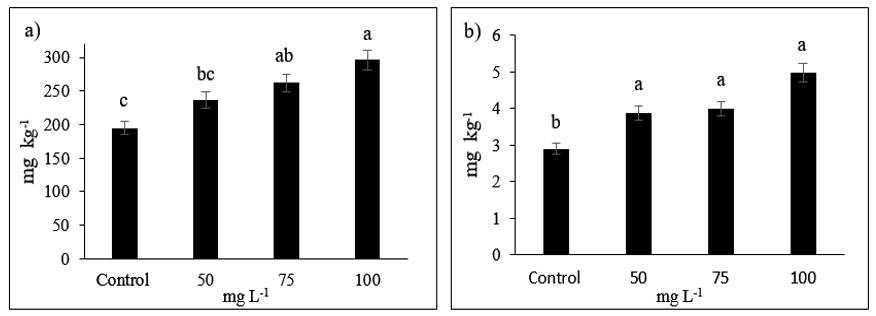
Figura 3 Contenido mineral de hierro foliar (a) y fruto (b) con la aplicación de NPs de Fe2O3. Las columnas con letras diferentes difieren estadísticamente entre ellas (Tukey p≤ 0.05).
Por consiguiente, los resultados anteriores se deben a que la mayoría de las NPs están atrapadas en la cera superficial promoviendo la formación de racimos y aglomerados (Hu et al., 2017). Por lo cual, la aspersión de NPs Fe2O3 afecta el desarrollo de la planta, estos se asocian a la aplicación de la dosis y su integración a su sistema vía foliar (Lu et al., 2020). La nanobiofortificación del cultivo de pepino es una alternativa para complementar la nutrición humana al incrementar el contenido de Fe en los frutos, el cual puede ser utilizado por humanos para la producción de energía, utilización/transporte de oxígeno y proliferación celular (Lynch et al., 2018).
Las dosis utilizadas podrían aportar a satisfacer los requerimientos diarias de 7.8-10 mg día-1 para infantes, adolescentes de 11-15 mg día-1 y adultos de 10-20 mg día-1 (Blanco-Rojo y Vaquero, 2018). Evitando riesgos cardiovasculares, enfermedades crónicas, disminuyendo los casos de anemia y mortalidad (Blanco-Rojo y Vaquero, 2018).
Conclusiones
La aplicación foliar con NPs Fe2O3 mejoró el rendimiento, el contenido de compuestos bioactivos y su bioacumulación, así como el contenido de Fe en frutos de pepino. El mayor rendimiento y biosíntesis de compuestos bioactivos fue logrado con los tratamientos de 50 y 75 mg L-1 de NPs Fe2O3 50, mientras que con 100 mg L-1 se logró la mayor concentración de Fe en hojas y frutos. La aspersión foliar de NPs Fe2O3 es una alternativa para incrementar la producción y la biosíntesis de compuestos bioactivos, además de propiciar su bioacumulación de Fe en frutos de pepino.











 texto en
texto en 



