Introducción
El selenio (Se) es un oligoelemento importante en la nutrición humana, es esencial para formar proteínas y cofactor de enzimas antioxidantes como el glutatión peroxidasa (GPX), que protege el cuerpo humano al catalizar la reducción de las especies reactivas de oxígeno (ERO) (Schiavon et al., 2020). Además, en los mamíferos, el Se forma al menos 25 selenoproteínas que cumplen funciones antioxidantes, catalíticas, antiinflamatorias, antivirales y antitumorales (Avery y Hoffmann, 2018).
Una deficiencia de este elemento provoca problemas de salud, incluida la enfermedad de Keshan (una miocardiopatía endémica), enfermedad de Kashin-Beck (osteoartropatía deformante endémica) Ulloa et al. (2021), aceleración de procesos cancerígenos en la próstata (Sonkusre, 2020), problemas de fertilidad y debilitamiento del sistema inmunológico sistema de defensa contra enfermedades infecciosas virales como la influenza, virus de la inmunodeficiencia humana, distrofia muscular y fibrosis quística (Khurana et al., 2019). De acuerdo a la Organización Mundial de la Salud, el consumo de Se en la dieta humana debe fluctuar entre 55 y 200 μg día-1 en adultos (Górska et al., 2021). La forma más común por la cual el organismo humano adquiere el Se es a través del consumo de alimentos, tales como la carne o el pescado (Sariñana-Navarrete et al., 2021), que aportan un alto porcentaje de Se a la ingesta diaria requerida.
En el mundo, existen alrededor de mil millones de personas con deficiencias de Se, debido principalmente al consumo de dietas basadas en vegetales Błażewicz et al. (2020), las cuales contienen bajas concentraciones de Se, ya que este elemento se encuentra en pequeñas cantidades en el suelo (López et al., 2021). Por otro lado, este elemento no se considera esencial para las plantas, pero podría ser considerado un elemento benéfico debido a que en bajas concentraciones él. Se aumenta el rendimiento, el contenido antioxidante y su concentración en la parte comestible (Preciado-Rangel et al., 2021).
Una estrategia para aumentar el contenido de Se en los alimentos de origen vegetal es mediante la biofortificación que consiste en potenciar la bioactividad y el contenido de Se en las partes comestibles de las plantas Gaucin-Delgado et al. (2020). La fertilización foliar es la manera más practica de para incorporar el Se a la cadena alimenticia (Lyons, 2018). Por otro lado, el chile jalapeño (Capsicum annuum L.), una de las plantas más cultivadas en el mundo, debido a su importancia en la nutrición humana como en la industria farmacéutica (Espinosa-Palomeque et al., 2020), los frutos de son una fuente de vitaminas. (A, E y C), carotenoides, capsaicinoides y compuestos fenólicos con propiedades antioxidantes para la dieta humana (Natividad-Torres et al., 2021).
La aplicación de micronutrientes a través de la biofortificación de cultivos es una herramienta muy útil no solo para incrementar la cantidad de los micronutrientes esenciales sino, además mejorar la biosíntesis de compuestos bioactivos (Gaucin-Delgado et al., 2020). El objetivo de este trabajo fue determinar el efecto de la biofortificación foliar con Selenio sobre el rendimiento, la calidad nutracéutica y la capacidad antioxidante del cultivo de chile jalapeño.
Materiales y métodos
Material vegetal y condiciones de crecimiento
La investigación se realizó en un invernadero con un sistema de enfriamiento automático ubicado en las instalaciones de la Universidad Autónoma Antonio Agraria Antonio Narro (UAAAN) en la Ciudad de Torreón, Coahuila, México (25° 33’ 26” latitud norte, 103° 22’ 31” longitud oeste, a una altitud de 1 230 m). El cultivo de estudio fue el chile jalapeño cv. Hijo de Mitla germinó en bandejas de poliestireno con 200 huecos rellenos de turba (Premier®, México) como sustrato. Estas bandejas de plantas se cubrieron con plástico negro durante 72 h y se regaron cada 24 h. El trasplante se realizó a los 45 días de la siembra de la semilla cuando las plantas presentaron una altura promedio de 150 mm, cada planta por maceta. Las macetas eran bolsas negras de polietileno de 500 de espesor y 18 L de capacidad, rellenas con diferentes proporciones de arena:perlita (80:20 vv). La arena del río se lavó y desinfectó con una solución de hipoclorito de sodio al 5%. Las bolsas se colocaron en doble hilera a 30 cm de centro a centro entre bolsas y 1.6 m entre hileras, para obtener una densidad de plantas de 4.2 plantas m-2.
Los requerimientos de agua del cultivo fueron proporcionados por riego manual para proporcionar tres riegos por día, y cada planta recibió 0.6 L en cada riego, desde el trasplante hasta el inicio de la floración y de 2.5 a 3.5 L desde la floración hasta la cosecha. La polinización se realizó con cepillo eléctrico diariamente, desde el inicio de la floración hasta el cuajado. La temperatura mínima y máxima dentro del invernadero fluctuó entre 17.7 y 31.6 °C, respectivamente, mientras que la humedad relativa mínima y máxima osciló entre 30 y 70%.
Tratamientos y diseño experimental
Se utilizó un diseño experimental completamente aleatorizado, aplicando cinco dosis: 0, 1.5, 3, 4.5 y 6 mg L-1 de Na2SeO3 (Sigma Aldrich) (León-Morales et al., 2019). Los tratamientos con Se fueron aplicados cada 15 días con un total de seis aplicaciones a través de fertilización foliar. Se rego con solución nutritiva (Steiner, 1984), el pH y la conductividad eléctrica se mantuvieron en 5.5 y 2 dS m-1 respectivamente. Se determinó el rendimiento, la calidad nutracéutica del fruto y la acumulación de selenio en frutos. Se utilizaron diez plantas por tratamiento.
Rendimiento del cultivo
En cada unidad experimental, el rendimiento se estimó considerando el número y el peso de la fruta individual por planta, registrando los rasgos individuales de la fruta como el peso con una balanza (Ohaus 3729®, México).
Calidad nutracéutica
Extracto de preparación: para la determinación de la calidad nutracéutica (compuestos fenólicos, flavonoides y capacidad antioxidante), se mezclaron muestras de 2 g de fruto fresco con 10 ml de etanol en tubos plásticos se cerraron con tapón de rosca. Se uso un agitador tipo ‘Stuart’ para mantener la mezcla en agitación durante 24 h. Después se centrifugaron los tubos a 3 000 rpm durante 5 min (Cardeño, 2007). Los sobrenadantes se extrajeron para su análisis físico-químico.
Contenido fenólico total
Se determinó mediante una modificación del método de Folin-Ciocalteau (Singleton, 1999). Se tomaron 50 µl de extracto etanólico, se diluyeron en 3 ml de agua mQ, se agregaron 250 µl de Folin-Ciocalteau (1N), se agitó y se dejó reaccionar durante 3 min. Posteriormente, se agregaron 750 µl de Na2CO3 (20%) y 950 µl de agua mQ. La solución se dejó reposar durante 2 h y las muestras se midieron en un espectrofotómetro UV-Vis (CGoldenwall, rango de longitud de onda 340-1 000 nm y un ancho de banda espectral: 5 a 760 nm. La solución estándar se preparó con ácido gálico. Los resultados fueron expresados en mg 100 g-1 de peso fresco.
Flavonoides totales
Se determinaron mediante espectrofotometría Lamaison (1990). Se tomaron 250 µl de extracto etanólico y se mezcló con 1.25 ml de agua mQ y 75 µl de NaNO2 (5%), se dejó 5 min y se agregaron 150 µl de AlCl3 (10%). Posteriormente, se añadieron 500 µl de NaOH (1 M) y 275 µl de agua mQ. Se agitó vigorosamente y las muestras se cuantificaron en un espectrofotómetro UV-Vis (CGoldenwall, rango de longitud de onda 340-1 000 nm y ancho de banda espectral: 5 a 510 nm. El estándar se preparó con quercetina disuelta en etanol absoluto (y= 0.0122x-0.0067; r2 = 0.965). Los resultados se expresaron en mg 100 g-1 de peso fresco.
Capacidad antioxidante total
Se midió por el método DPPH + in vitro (Brand-Williams, 1995). Se preparó una solución de DPPH + (Aldrich) en etanol, a una concentración de 0.025 mg ml-1. Se mezclaron 50 µl del extracto etanólico con 1.95 µl de solución DPPH +, luego de 30 min las muestras se cuantificaron en un espectrofotómetro UV-Vis (CGoldenwall, rango de longitud de onda a 340-1 000 nm y un ancho de banda espectral: 5 a 517 nm. Los resultados se expresaron en equivalente a μM equiv Trolox 100 g m-1 peso fresco.
Capsaicina
El contenido de capsaicina se midió mediante una adaptación del método propuesto por Cisneros-Pineda et al. (2007). La absorbancia del extracto filtrado se obtuvo luego en un espectrofotómetro UV/Vis (Goldenwall, rango de longitud de onda a 340-1000 nm) previamente calibrado con acetonitrilo como blanco a una longitud de onda de 273 nm. El contenido de capsaicina se calculó mediante una curva estándar utilizando capsaicina (Sigma, St. Louis, Missouri, EE. UU.) Como estándar y los resultados se expresan en mg g-1 en peso fresco de capsaicina. Los análisis se realizaron por triplicado.
Acumulación de selenio en el cultivo
Las muestras de chile seco se molieron en un mortero de porcelana y se digirieron con ácido nítrico y perclórico (3: 1), utilizando una placa calefactora a 100 °C. La solución se filtró y se hirvió para obtener 100 ml de solución de trabajo con agua desionizada. La concentración de selenio en frutos de tomate se determinó mediante espectrofotometría de absorción atómica (Hsieh y Ganther, 1975) los resultados se expresaron en µg kg-1 de peso seco de frutos.
Análisis estadístico
La normalidad y homogeneidad de las varianzas de los datos obtenidos se verificaron mediante las pruebas de Kolmogorov-Smirnov y Bartlett, respectivamente. Posteriormente, se realizó análisis de varianza de clasificación simple y comparación múltiple de medias mediante la prueba de Tukey a una probabilidad del 5% (p≤ 0.05), con la ayuda del paquete de análisis estadístico SAS v 9.0 (SAS Institute, 2004).
Resultados y discusión
Rendimiento
La adición de Se, no afecto significativamente el rendimiento (Figura 1), debido a que el Se, no se considera elemento esencial para el metabolismo de las plantas, no se esperaría que la suplementación con Se cause cambios en el crecimiento y rendimiento de los cultivos Hernández-Hernández et al. (2019); Sin embargo, se ha reportado que al aplicar dosis altas de Se reduce el rendimiento de los cultivos, debido a que causa un estrés oxidativo en la planta, lo que puede incrementar la producción de radicales libre al defenderse del efecto toxico provocado por las ERO (Hibaturrahman et al., 2020), al contrario, al utilizar bajas dosis, se incrementa el rendimiento (Rady et al., 2020) y evita la oxidación al regular la captación y redistribución de elementos esenciales en los sistemas antioxidantes o manteniendo el equilibrio iónico y la integridad estructural de la célula (Pannico et al., 2019), permitiéndole a la planta adaptarse metabólicamente como fisiológicamente como respuesta al ataque del estrés oxidativo causado por el incremento de radicales libres bajo condiciones de estrés (Hasanuzzaman et al., 2020).
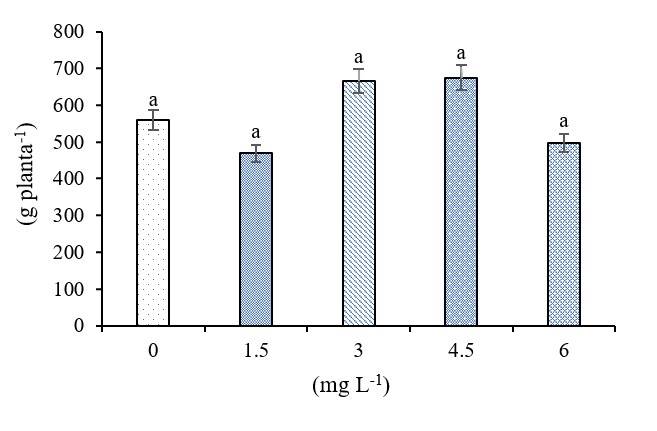
Figura 1 Efecto del Se sobre el rendimiento de frutos de chile. Los datos se muestran como media ± desviación estándar (DE) (n= 50). Columnas con letras diferentes son significativamente diferentes según la prueba de Tukey (p< 0.05).
La planta presenta respuesta diferencial al Se dependiendo de la dosis utilizada, tiene un impacto tanto positivo como negativo en las plantas, ya que en concentraciones bajas, el Se acumula como estimulante al promueven el crecimiento, la fisiología de las plantas, aumentan el rendimiento (Gaucin-Delgado et al., 2020) y en dosis altas se ejerce efectos negativos en el crecimiento y la fisiología de la planta (Silva et al., 2020) e incluso muerte celular (Shahid et al., 2018).
Compuestos bioactivos
La biosíntesis de compuestos fenólicos, flavonoides y capacidad antioxidante fue influenciada positivamente por la aplicación de Se (Figura 2 a-2c), obteniéndose los mayores valores con 6 mg L-1. Diversas investigaciones han demostrado que la aplicación de Se, puede incrementar la producción de compuestos bioactivos (Motesharezadeh et al., 2020). Resultados similares a los del presente estudio fueron obtenidos en Capsicum annuum L., donde la aplicación de Se incrementó diversos compuestos bioactivos como fenoles, flavonoides y capacidad antioxidante (Natividad-Torres et al., 2021).
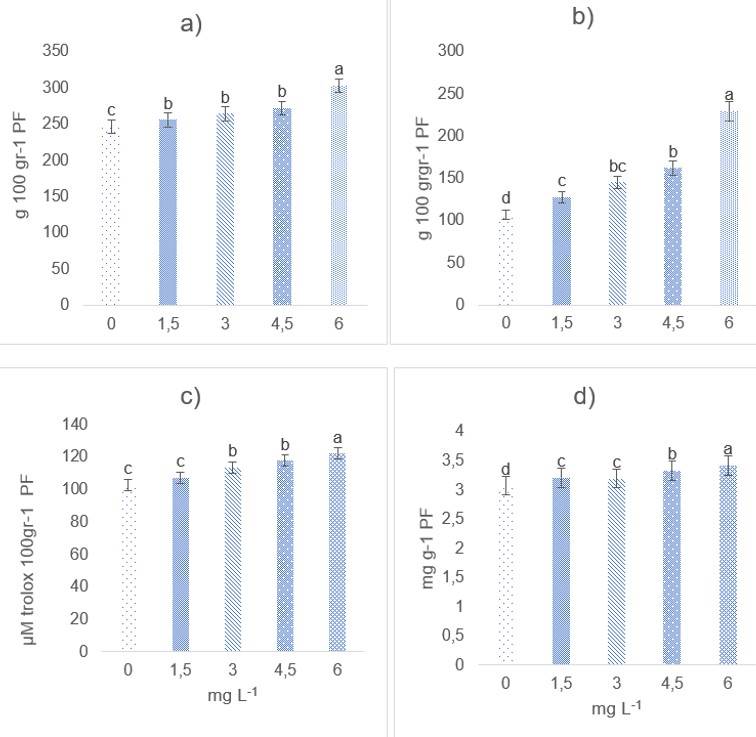
Figura 2 Efecto del Se sobre el contenido de fenólico (a); flavonoides totales (b); capacidad antioxidante (c); y capsaicina (d) en frutos de chile. Los datos se muestran como media ± desviación estándar (DE) (n= 50). Columnas con letras diferentes son significativamente diferentes según la prueba de Tukey (p< 0.05).
Esta capacidad bioactiva posiblemente sea atribuida a la acción sinérgica que tiene el Se al poder actuar como un elemento vital al alterar varios procesos fisiológicos y bioquímicos D’Amato et al. (2018), además el Se afecta directamente el sistema de defensa antioxidante al aumenta el potencial de las plantas para sobreponerse a las condiciones de estrés biótico y abiótico (Hachmann et al., 2019). Los resultados obtenidos en nuestro estudio se respaldan por (Hibaturrahman et al., 2020), quienes encontraron que la suplementación en solución nutritiva con Na2SeO4 eleva la actividad antioxidante protegiendo así a las plantas del estrés oxidativo.
La producción de alimentos ricos en compuestos bioactivos, influye directamente en las actividades celulares y fisiológicas Sabatino et al. (2019), obteniendo, tras su ingesta, un aporte beneficioso para la salud humana (Shahid et al., 2018) por sus diversas características, de protección en enfermedades de tipo coronario (Groth et al., 2020) y tras evitar el envejecimiento celular (Hernández-Hernández et al., 2019), además de ser usado como una alternativa para la prevención del cáncer (Vinceti et al., 2018).
Capsaicina
La capsaicina es una oleorresina, componente activo de los pimientos picantes (Friedman et al. (2019). La capsaicina fue afectada positivamente por las dosis de Se evaluadas (Figura 2d). La concentración de capsaicina, estuvo en concordancia con las dosis de Se empleadas, el aumento en la pungencia del chile mejora su calidad, ya que esta característica es apreciada por los consumidores (Uarrota et al., 2021). Los resultados indican una respuesta al contenido de capsaicina en los frutos de chile jalapeño al Se, aunque el mecanismo de acción en este proceso no se ha definido. La biosíntesis está influenciada por las interacciones genotipo-ambiente en frutos de Capsicum (Naves et al., 2019), fenilpropanoideds (Aza-González et al., 2011) y los transportadores ABC, las subfamilias ABCC y ABCG, que pueden estar desempeñando papeles en el transporte de metabolitos secundarios como la capsaicina y dihidrocapsaicina a las vacuolas de placenta, afectando su contenido en frutos (Lopez-Ortiz et al., 2019).
Probablemente a la interacción del Se en la planta al ocasionarle efectos estresantes Avery y Hoffmann (2018) que pudieran estar relacionados con un aumento la actividad de PAL y capsaicina sintasa aumentando la acumulación de capsaicinoides en el chile (Ulloa et al., 2021), al regular negativamente la actividad de peroxidasa a niveles apropiados (Hernández‐Pérez et al., 2020).
Aunque la biosíntesis es un rasgo genético controlado, el medio ambiente también juega un papel importante dependiendo del genotipo Scossa et al. (2019) además, esta característica también está regulada desde el punto de vista del desarrollo y del medio ambiente Naves et al. (2019). Por otro lado, la capsaicina proporciona la sensación oral picante en la mayoría de los chiles (Scossa et al., 2019); sin embargo, sus propiedades biológicas más importantes es su capacidad para actuar como antioxidantes para reducir el estrés oxidativo que conduce a la prevención de varias enfermedades degenerativas (Friedman et al., 2019).
Contenido de Selenio en el cultivo
La adición de 6 mg L-1 aumento el contenido de Se en los frutos de chile, existe una correlación positiva entre el Selenio en frutos y su disponibilidad (r2= 0.98) (Figura 3). La absorción del Se dependen de la edad de la planta, especie vegetal y la forma química del elemento que se aplica, su concentración y el método de aplicación (Yin et al., 2019). Los vegetales acumulan mayores cantidades de Se (Dai et al., 2019).
Estudios previos muestran que la biofortificación aumenta significativamente la cantidad de elementos esenciales en la parte comestible de las plantas Silva et al. (2020), la cual puede aumentar en los cultivos biofortificados con Se hasta 30% con respecto a los no tratados (Zhu et al., 2017). El Se en las plantas se metaboliza junto con el azufre dentro de los tejidos vegetales, transformándose en selenoproteinas que permiten almacenarse como Se-Met (Zhang et al., 2019), acelerando el transporte, la acumulación, la volatilización y la tolerancia al Se (Raina et al., 2020).
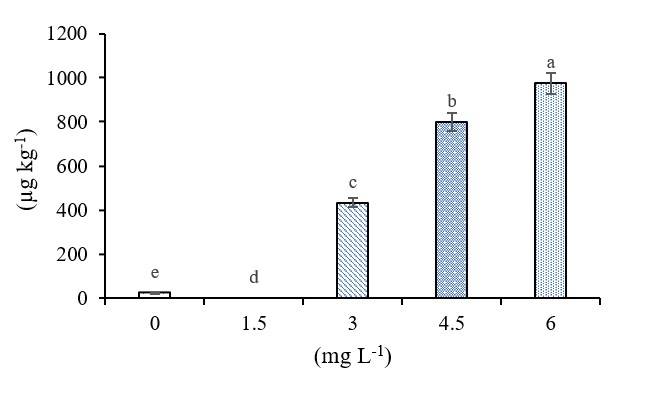
Figura 3 Concentración de Se en frutos de chile. Los datos se muestran como media ± desviación estándar (DE) (n= 50). Las columnas con letras diferentes son significativamente diferentes según la prueba de Tukey (p< 0.05).
Actuando como un potente antioxidante, al permitir menores niveles de peroxidación lipídica y mayor actividad de enzimas antioxidantes, así como una mejor resistencia al estrés oxidativo (Skrypnik et al. (2019). Según la guía alimentaria para los estadounidenses, se debe obtener la mayoría de los nutrientes requeridos con la ingesta de alimentos (Padilla-Samaniego et al., 2020). En este sentido el consumo de 0.74 g de chile jalapeño biofortificadado con selenio, suple las necesidades diarias de este oligoelemento que es de 55 mg por día en adulto (Chomchan et al., 2017; León-Morales et al., 2019).
Conclusiones
La biofortificación agronómica con selenio mejora la calidad nutracéutica y la concentración de Se, sin afectar el rendimiento del cultivo de chile jalapeño, la utilización de Se es una alternativa para obtener alimentos funcionales y aumentar la acumulación del oligoelemento en los frutos de chile jalapeño, con la posibilidad de proteger la salud humana con su consumo.











 texto en
texto en 


