Introducción
El sector agrícola enfrenta actualmente desafíos importantes de aumentar la productividad para alimentar a la población mundial en crecimiento e incrementar la eficiencia en el uso de los recursos (Rouphael y Colla, 2020). Lo anterior, ha motivado a ampliar el campo de la investigación de la nanotecnología y sus posibles aplicaciones en el campo agrícola (Usman et al., 2020). Las nanopartículas (NPs) tienen una superficie altamente reactiva, por lo tanto, son biológicamente activas, esto debido a que su área superficial es extremadamente alta proporcional a su volumen (Pestovsky y Martínez, 2017). Se sintetizan en diferentes tamaños, formas, materiales y reactividad, esto les otorga la capacidad de potenciar el sector agrícola (Fatima et al., 2021).
El cobre (Cu) es un micronutriente ampliamente distribuido en los tejidos vegetales, participa en procesos fisiológicos y es esencial para el crecimiento de las plantas (Rajput et al., 2018). Se ha demostrado que activa enzimas claves en el ciclo de Calvin, mejorando la actividad fotosintética e incrementando el rendimiento en las plantas (Pradhan et al., 2015). Las NPs de Cu pueden funcionar como reductores u oxidantes en reacciones bioquímicas dentro de la célula por lo que pueden catalizar la producción de especies reactivas de oxígeno (ROS) e inducir estrés oxidativo (Somasundaran et al., 2010). Los efectos de las NPs de Cu varían, se ha reportado que a bajas concentraciones incrementa la tasa de crecimiento y la germinación de varias plantas, por otro lado, a concentraciones altas el crecimiento es retardado (Kasana et al., 2017). Además, en aplicaciones foliares con NPs de Cu, favorecen la firmeza de frutos y contenido de antioxidantes como vitamina C, licopeno y fenoles (López-Vargas et al., 2018; Pérez-Labrada et al., 2019).
El quitosán (Cts) se ha utilizado para mejorar las defensas naturales de las plantas, entre las respuestas de defensa se incluyen la lignificación, activación de enzimas asociadas a la respuesta a patógenos en plantas, biosíntesis de fitoalexinas, generación de ROS, biosíntesis del ácido jasmónico, salicílico, abscísico y la expresión de genes relacionados con la defensa (El Hadrami et al., 2010). La aplicación del quitosán incrementa la actividad de β-1,3 glucanasa y quitinasa en diferentes especies vegetales, ayudando a hidrolizar la pared celular de hongos fitopatógenos (Rodríguez-Pedroso et al., 2009; González Peña et al., 2014).
El alcohol polivinílico (PVA) se ha utilizado ampliamente en la preparación de hidrogeles y en la inhibición del crecimiento bacteriano, además, tiene un alto potencial como un sistema de liberación controlada (Yang et al., 2016). La mezcla de PVA-Cts ha demostrado tener efectos in vitro sobre la respuesta antioxidante eliminando radicales libres, así como sobre la viabilidad de Staphylococcus aureus 8325-4 y Escherichia coli RB (Yang et al., 2018).
Actualmente existen pocos estudios sobre la aplicación de complejos de PVA-Cts-nCu. Estos complejos aplicados en forma de hidrogeles incrementan la calidad nutracéutica en frutos de tomate (Hernández-Hernández et al., 2018a). También promueven el incremento del vigor y número de racimos florales en tomate (Hernández-Hernández et al., 2017). Aplicados en sustrato incrementan el rendimiento en frutos de chile jalapeño (Pinedo-Guerrero et al., 2017). El objetivo del presente trabajo fue evaluar la respuesta del complejo PVA-Cts-nCu en el crecimiento y calidad de fruto, así como la activación del sistema de defensa de plantas de tomate.
Materiales y métodos
Síntesis del complejo PVA-Cts y PVA-Cts-nCu
Para la preparación del complejo PVA-Cts-nCu, 1.5 L de PVA (BP-05, Nacional PIM México SA de CV, peso molecular de 27 000-32 000 g mol-1) al 1% (p/v) se mezclaron con 1.5 L de Cts (Marine Chemicals, India, peso molecular de 200 000 g mol-1) al 0.5% (p/v). El nCu (1.85 g) se molió con 3 ml de Agrex® F (Agroenzymas® SA de CV) como dispersante para las NPs. El nCu presentó una morfología esférica y semiesférica y un tamaño promedio de 30 nm (Sierra-Ávila et al., 2014, 2015).
Establecimiento del cultivo
La prueba se llevó a cabo en un invernadero de tipo túnel. Se usó un sistema de cultivo sin suelo, el sustrato fue una mezcla de peat moss (Premier® Premier Horticulture LTD) y perlita (Multiperl® Grupo perlita de la laguna) (1:1 v/v). Se utilizaron plantas de tomate hibrido tipo saladett de crecimiento indeterminado Cid F1 (Harris Moran®), se colocaron en bolsas de polietileno de 14 L.
El experimento se llevó a cabo aplicando los tratamientos PVA-Cts-nCu 500 mg L-1, PVA-Cts 500 mg L-1 y un testigo absoluto con agua destilada (T0). La aplicación de los tratamientos fue foliar, con un gasto de 75 ml de solución por planta durante el ciclo productivo. Las plántulas tuvieron una aplicación dos días previos al trasplante, posterior se aplicó en intervalos de 20 días iniciando después del trasplante. Se usó como medio de nutrición la solución Steiner (Steiner 1961).
Variables de desarrollo y productividad en tomate
La evaluación de la altura de planta y diámetro de tallo se llevó a cabo a los 120 días después del trasplante (DDT). A los 120 DDT se determinó el rendimiento por planta. Además, se determinó el peso fresco aéreo, así como el peso fresco de la raíz.
Extracción de enzimas
La actividad de las enzimas fenilalanina amonio liasa (PAL), quitinasa y β-1,3 glucanasa se analizó en hojas en tres muestreos distintos, al momento del trasplante (48 h posteriores a la primera aplicación del complejo), a los 40 DDT y 80 DDT. Las hojas fueron colectadas con nitrógeno líquido.
La extracción de biomoléculas se realizó de acuerdo con Rodríguez-Pedroso et al. (2006). La actividad PAL se determinó de acuerdo con Sykłowska-Baranek et al. (2012). Los resultados se expresaron como U (producción de μmol equivalente de ácido transcinámico por mililitro por minuto) por proteínas totales (mg g-1). La actividad de quitinasa se determinó de acuerdo con Rodríguez-Pedroso et al. (2006). Los resultados se expresaron como U (producción de μg ml-1 de glucosa por minuto por proteínas totales (mg g-1). La actividad β-1,3 glucanasa se determinó de acuerdo con Rodríguez-Pedroso et al. (2006). La actividad enzimática se determinó por la medición del nivel de producción de azúcares reductores y se expresó en términos de producción de μg ml-1 de glucosa por minuto por proteínas totales (mg g-1).
Expresión del gen PR1
Las muestras de hojas se colectaron en tres tiempos diferentes, iniciando a las 48 h posteriores a la primera aplicación del complejo, después de este primer muestreo los siguientes fueron cada 40 días. Se colectaron hojas jóvenes completamente expandidas con nitrógeno líquido. La extracción de ARN se llevó a cabo con la técnica de TRIzolTM Reagent (Invitrogen).
El cDNA se sintetizó con el kit SensiFASTTM (Bioline). Los primers utilizados corresponden a un gen endógeno (Actina) y al gen PR1. ACT (fwd 5’-CCCAGGCACACAGGTGTTAT-3’; rev 5’-CAGGAGCAACTCGAAGCTCA-3’); PR1 (fwd 5’-AAGTAGTCTGGCGCAACTCA-3’; rev 5’-GTCCGATCCAGTTGCCTACA-3’). La cuantificación del gen PR1 se llevó a cabo en un equipo de PCR en tiempo real (Applied Biosystems StepOneTM versión 2.3) por el método ΔΔCt midiendo la intensidad de fluorescencia del Sybr Green (Hernández-Hernández et al., 2018b).
Análisis de datos
En la prueba en plantas de tomate se usó un diseño completamente al azar. Para las variables agronómicas se analizaron 20 unidades experimentales por cada tratamiento. En la cuantificación de la actividad PAL, quitinasa y β-1,3 glucanasa se analizaron cinco repeticiones por tratamiento y en la expresión del gen PR1 se analizaron cuatro repeticiones compuestas (10 plantas por repetición). Para detectar diferencias estadísticas entre tratamientos se realizó un análisis de varianza (Anova) y se efectuó una prueba de separación de medias según la prueba LSD de Fisher (p≤ 0.05). Todos los análisis estadísticos se realizaron en el software estadístico InfoStat v2018.
Resultados y discusión
Efecto del complejo PVA-Cts-nCu sobre variables de desarrollo y productividad en tomate
La aplicación foliar del complejo PVA-Cts-nCu tuvo efectos significativos (p≤ 0.5) en las variables relacionadas al vigor en las plantas de tomate (Cuadro 1). El tratamiento PVA-Cts-nCu presentó diferencias significativas en comparación con el testigo, incrementando el rendimiento (60.68%), el peso promedio de fruto (18.2%), el número de frutos (35.99%), el peso fresco aéreo (26.99%) y el peso fresco de la raíz (80.87%). Mientras que el tratamiento PVA-Cts aumentó el peso promedio de fruto (8.39%) y el peso fresco de la raíz (52.22%) en comparación al testigo. En la variable de altura y diámetro de tallo no se observaron diferencias significativas.
Cuadro 1 Efecto del complejo PVA-Cts-nCu y PVA-Cts sobre el crecimiento y productividad del tomate.
| Tratamiento | Altura (cm) |
DT (mm) |
Rendimiento (g planta-1) |
PPF (g fruto-1) |
NF | PFA (g planta-1) |
PFR (g planta-1) |
|---|---|---|---|---|---|---|---|
| T0 | 132.29 a | 17.02 a | 2573.31 b | 58.62 c | 43.9 b | 2384 b | 98.8 b |
| PVA-Cts-nCu | 134.78 a | 16.79 a | 4134.95 a | 69.29 a | 59.7 a | 3027.65 a | 175.8 a |
| PVA-Cts | 119.71 a | 15.04 a | 2690.92 b | 63.54 b | 42.35 c | 2299.47 b | 150.4 a |
T0= testigo; DT= diámetro de tallo; NF= número de frutos; PPF= peso promedio de fruto; NF= número de frutos; PFA= peso fresco aéreo; PFR= peso fresco de la raíz, medias con la misma letra por columna son estadísticamente iguales (LSD Fisher, p≤ 0.05).
Los resultados obtenidos en este estudio demuestran que los complejos PVA-Cts-nCu y PVA-Cts aplicados vía foliar no presentan toxicidad en las plantas de tomate. Rajput et al. (2018) mencionan que la fitotoxicidad dependerá de la concentración, tipo y tamaño de las NPs, además de la especie en donde son aplicadas, las condiciones de crecimiento y el tiempo de exposición.
Saharan et al. (2015) reportan un incremento en la biomasa en tomate tratadas con NPs de Cu-Cts. Adhikari et al. (2012) observaron que la aplicación de NPs de CuO incrementó el crecimiento de la raíz en soya y garbanzo. En el presente estudio demostró que el complejo PVA-Cts-nCu mejoró el crecimiento aumentando el peso fresco aéreo y de raíz, parámetros importantes para el desarrollo del cultivo. Este efecto pudo ser inducido por la sinergia entre el nCu y el quitosán. Ya que este biopolímero y el nCu han demostrado tener efecto sobre el crecimiento y desarrollo de las plantas (El Hadrami et al., 2010; Hernández et al., 2017; Pinedo-Guerrero et al., 2017).
En la etapa de producción, el complejo PVA-Cts-nCu aumentó el rendimiento, el número de frutos y el peso promedio de fruto. Esto coincide con lo reportado por Pinedo-Guerrero et al. (2017), quienes señalan que al aplicar el hidrogel de PVA-Cts-nCu directo al suelo en chile jalapeño, incrementó el rendimiento (8.27%) y el número de frutos (9.32%) por planta. También Hernández-Hernández et al. (2018a) reportaron que la aplicación de hidrogeles de PVA-Cts-nCu directo al sustrato se incrementó en plantas de tomate el número de frutos (20%).
Pradhan et al. (2015) evaluaron la aplicación de NPs de Cu en soja verde, donde las NPs influyeron en la actividad de enzimas claves en el ciclo de Calvin (fructosa-1, 6-bifosfato fosfatasa, ribulosa-5-fosfato quinasa y NADP-gliceraldehído-3-fosfato deshidrogenasa). Es probable que al incrementarse la actividad de enzimas relacionadas con el transporte de electrones en la fotosíntesis se modificara la tasa de producción de fotosintatos y la velocidad a la cual se movilizan, incrementándose así la producción de frutos y el peso de estos.
Efecto del complejo PVA-Cts-nCu sobre la actividad PAL
La aplicación foliar de PVA-Cts-nCu tuvo efectos significativos (p≤ 0.5) en la actividad PAL en hojas (Figura 1). El tratamiento PVA-Cts-nCu exhibe un incremento en la actividad PAL al trasplante (301.7%) y a los 80 DDT (55.04%) en comparación al testigo. A los 40 DDT el tratamiento PVA-Cts-nCu incrementó la actividad PAL en un 369.23% en comparación con PVA-Cts.
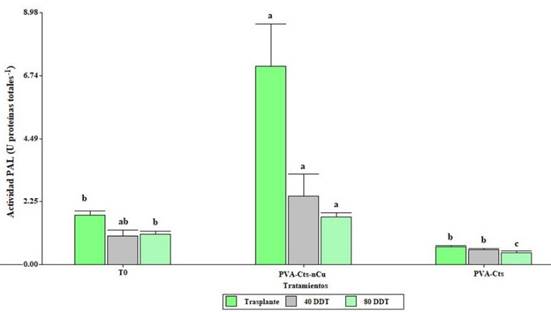
Figura 1 Actividad enzimática de fenilalanina amonio liasa en tomate con aplicación de PVA-Cts-nCu y PVA-Cts. Medias con la misma letra son estadísticamente iguales LSD Fisher, p≤ 0.05.
El quitosán y las NPs son conocidos como inductores potenciales para mejorar la defensa en las plantas ante el estrés, dando como resultado una acumulación de metabolitos relacionados con la defensa (Zhang y Liu, 2015; Usman et al., 2020), así como la generación de ROS y el incremento de la actividad de proteínas relacionadas con la defensa (González-Peña et al., 2014).
La enzima PAL es clave en la síntesis de fenoles y flavonoides, los fenoles son importantes precursores de compuestos que intervienen en el control del crecimiento vegetal, además de ser potentes antioxidantes (Santos-Sanchez et al., 2019).
El incremento de PAL puede derivarse de la interacción directa de las nCu y el Cts generando un efecto sinérgico. Cumplido-Nájera et al. (2019) aplicaron NPs de Cu de manera foliar incrementando 1.78 veces la actividad de PAL en hojas.
Falcón Rodríguez et al. (2012) reportaron que al asperjar quitosán (0.5, 1 y 2.5 g L-1) en plantas de tabaco todas incrementaron la actividad de PAL en hoja. Rodríguez et al. (2006), encontraron que al tratar previamente semillas de arroz con hidrolizados de quitosán (500 mg L-1) se estimuló la actividad de PAL en hoja. En un ensayo de Hernández-Hernández et al. (2018a) con plantas de tomate bajo estrés salino encontraron que la aplicación PVA-Cts-nCu sin estrés salino y PVA-Cts bajo estrés salino incrementaba la actividad de PAL en hoja. González-Peña et al. (2014) reportan que al asperjar quitosán (100 mg L-1) en plántulas de tomate hubo incremento de la actividad PAL. Chandra et al. (2015) aplicaron de manera foliar NPs de Cts en Camellia sinensis L. encontrando un aumento significativo en la acumulación de peroxidasa, polifenol oxidasa y PAL en hoja.
Efecto del complejo PVA-Cts-nCu sobre la actividad β-1, 3 glucanasa y quitinasa
La aplicación foliar de ambos tratamientos no tuvo efectos significativos (p≤ 0.5) con respecto al testigo; sin embargo, el PVA-Cts-nCu mostró un incremento de la actividad β-1,3 glucanasa respecto a PVA-Cts (162.85%) a los 40 DDT. A los 80 DDT el T0 incrementó la actividad por encima de PVA-Cts-nCu y PVA-Cts (Figura 2).
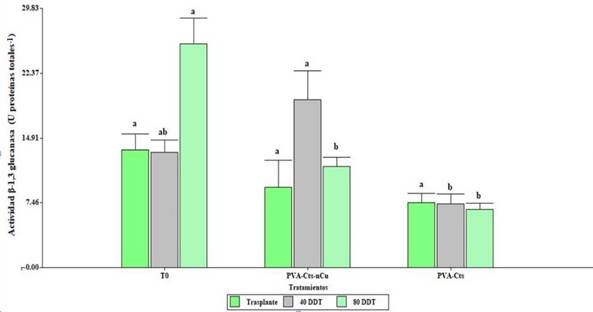
Figura 2 Actividad enzimática de β-1,3 glucanasa en plantas de tomate con la aplicación de PVA-Cts-nCu y PVA-Cts. Medias con la misma letra son estadísticamente iguales LSD Fisher, p≤ 0.05.
La aplicación foliar de PVA-Cts-nCu tuvo efectos significativos (p≤ 0.5) en la actividad de quitinasa (Figura 3). A los 40 DDT el tratamiento PVA-Cts-nCu incrementó la actividad en 121% en comparación con PVA-Cts. A los 80 DDT, T0 incrementó la actividad por encima de PVA-Cts-nCu y PVA-Cts. El tratamiento PVA-Cts-nCu incrementó la actividad en 54.67% en comparación con PVA-Cts.
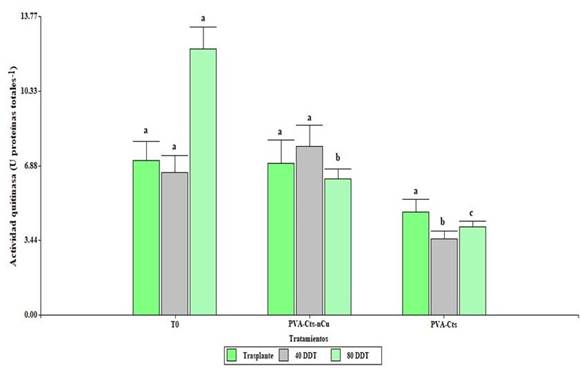
Figura 3 Actividad enzimática de quitinasa en plantas de tomate con la aplicación de PVA-Cts-nCu y PVA-Cts. Medias con la misma letra son estadísticamente iguales LSD Fisher, p≤ 0.05.
Las proteínas relacionadas a la patogenicidad (PR) como la β-1,3 glucanasa y quitinasa pueden ser expresadas de forma constitutiva e inducida en respuesta a una infección. Con respecto a la eficacia del quitosán en la inducción de la defensa en la planta, en hojas de Camellia sinensis L., aumentó la actividad de β-1,3-glucanasa 29.26%, así como el contenido de peroxidasa y polifenol oxidasa (Chandra et al., 2015). Al aplicar NPs Cts y Cts en plantas de tomate estas incrementaron la expresión relativa de los genes relacionados con la síntesis de quitinasa y β-1,3 glucanasa en comparación al testigo (Chun y Chandrasekaran, 2019).
Efecto de PVA-Cts-nCu en la expresión del gen PR1
Los resultados de la expresión del gen PR1 se presentan en la Figura 4. El tratamiento PVA-Cts-nCu sobreexpresó el gen PR1 (268.3, 0.72 y 8 veces respecto al T0) al trasplante, 40 y 80 DDT. Al igual que PVA-Cts-nCu, el tratamiento PVA-Cts sobreexpresó el gen PR1 (3.9, 1.5 y 123.2 veces respecto a T0) al trasplante, 40 y 80 DDT. Estos resultados sugieren que el complejo PVA-Cts-nCu podría jugar un papel importante en la activación de genes que codifican a la producción de proteínas PR, relacionadas con la vía de señalización del ácido salicílico y la resistencia sistémica adquirida (RSA) ligada a la tolerancia al estrés (AbuQamar et al., 2009).
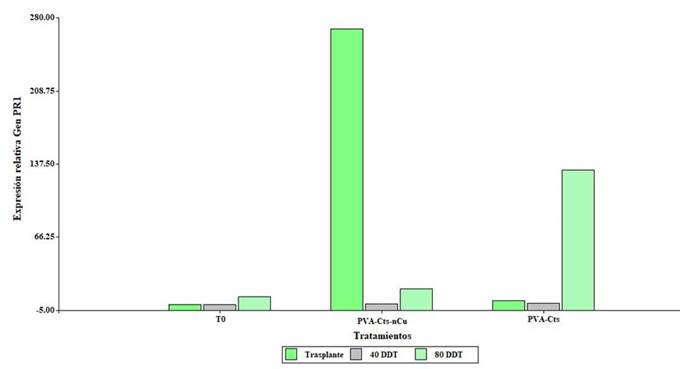
Figura 4 Expresión relativa del gen PR1 en hojas de plantas de tomate tratadas con PVA-Cts-nCu y PVA-Cts.
Existen evidencias de que el quitosán puede activar la respuesta de defensa en las plantas, incrementando la actividad de enzima PAL que está directamente relacionada con la síntesis de ácido salicílico, induciendo así la síntesis de proteínas PR, involucradas en los mecanismos de la RSA (Rodríguez-Pedroso et al., 2006; Sánchez et al., 2010; González Peña et al., 2014).
Chun y Chandrasekaran (2019) aplicaron NPs de Cts de manera foliar en plantas de tomate inoculadas con Fusarium andiyazi, estas incrementaron la expresión relativa del gen PR1 en hoja en comparación con el testigo. Hernández-Hernández et al. (2018b) aplicaron hidrogeles de PVA-Cts-nCu directo al sustrato en tomate bajo condiciones de estrés salino y encontraron que se reprimía la expresión del gen PR1 bajo condición salina y sin estrés salino, sin embargo, se sobreexpresaba el gen JA relacionado con la vía de los jasmonatos y esta mediada por la resistencia sistémica inducida (RSI).
Estos resultados arrojan que los complejos PVA-Cts-nCu y PVA-Cts pueden ser inductores potenciales para mediar la expresión de genes PR1 y JA en plantas de tomate activando la cascada de señalización de síntesis de compuesto fenólicos y enzimas que prepararan a la planta contra los efectos del estrés, ya sea por la vía del ácido salicílico (RSA) o la vía del ácido jasmónico (RSI).
Conclusiones
Este estudio demostró que el alcohol polivinílico-quitosán-nanocobre y el alcohol polivinílico-quitosán incrementaron las variables relacionadas con el vigor en las plantas, el rendimiento, además de activar el mecanismo de defensa de las plantas mediante el aumento de enzimas como PAL, β-1,3 glucanasa y quitinasa, además de incrementar la expresión del gen PR1 ligados con la tolerancia al estrés en plantas.











 texto en
texto en 


