Introducción
El melón (Cucumis melo L.) es una de las hortalizas que se cultiva en muchas regiones del mundo, en el año 2019 se reportaron 1 039 691 hectáreas, siendo China, Irán y Turquía, los principales países productores (FAOSTAT, 2020). En México se siembra en lugares que presentan climas cálidos y escasa precipitación, en el año 2019 se reportaron cerca de 20 000 ha (SIAP, 2021). En el norte del país se localiza el estado de Coahuila, donde 1 800 productores sembraron más de 6 mil ha con un alto grado de especialización, calidad e inocuidad, lo que ha permitido su exportación (Arellano et al., 2017).
El melón es un fruto caracterizado por aportar una cantidad importante de beneficios tanto para la salud como para la economía, razón por la cual es uno de los más consumidos a nivel mundial. La pulpa de melón es rica en agua, proteínas, lípidos, fuente de vitamina C y beta-carotenos (Maietti, 2012). Es una fuente de antioxidantes y polifenoles bioactivos, que proporcionan beneficios importantes para la salud, particularmente para el sistema cardiovascular (López et al., 2007). Además, es ligeramente diurético, ya que elimina las toxinas del cuerpo (Bayer, 2018).
El uso y aplicación de nanopartículas metálicas en la agricultura ha sido exitosa, sobre todo en cultivos que se producen en climas secos, ya que estimulan su crecimiento, incrementan el rendimiento y la calidad comercial de sus frutos (Prasad et al., 2014). También se reporta que inducen el estrés oxidativo en las plantas (Chandra et al., 2020) y tienen influencia en la actividad fotosintética y antioxidante (Kumar et al., 2020). En general, los efectos de los nanomateriales en las plantas varían mucho no solo por la naturaleza de los materiales sino dependiendo de la especie estudiada (Wang et al., 2015). El zinc, es un micronutriente esencial para las plantas y los seres humanos, a nivel mundial más de 30% de la población tiene deficiencia de este elemento (Amarakoon et al., 2012), afectando negativamente el desarrollo cognitivo, cerebral y reproductivo de las personas (Salgueiro et al., 2004).
Tiene un efecto directo en el crecimiento, desarrollo neurológico, conductual y en el sistema inmunológico (López de Romaña et al., 2010) además, promueve el desarrollo intelectual de los niños, acelera el crecimiento de los adolescentes, afecta el paladar, el apetito y la fertilidad masculina (Yin et al., 2012). Se han propuesto estrategias para atenuar este problema, una de ellas ha sido la biofortificación donde es posible obtener frutos enriquecidos con minerales (Restrepo et al., 2020). Reportes han mostrado que es posible obtener frutos biofortificados con minerales, incrementando su concentración en las porciones comestibles de las plantas (Neeraja et al., 2017).
Para el caso del zinc en las plantas, este es un micronutriente involucrado en la síntesis de proteínas, es un agente estabilizador para las membranas de amplia propagación y alargamiento celular (Mousavi et al., 2014), mantienen una protección contra el estrés ambiental (Sturikova et al., 2018), y ayuda a la adaptabilidad a las duras condiciones ambientales (Cakmak, 2017). La aplicación de las Nanopartículas de óxido de zinc (NPs ZnO), han demostrado tener efectos positivos sobre parámetros nutricionales y fisiológicos en algunos cultivos (Rizwan et al., 2018), además de incrementar su contenido en la parte comestible de la planta (Subbaiah et al., 2016), estos cambios pueden inducir estrés y toxicidad en las plantas y estimular los sistemas antioxidantes (García-Gómez et al., 2017).
Las NPs ZnO aplicadas vía foliar minimizan el uso de fertilizantes, aumentan la eficiencia y mayor disponibilidad de nutrientes en las plantas (Nandhini et al., 2019), además son mayores los efectos sobre el crecimiento y desarrollo de las plantas en comparación con las formas tradicionales de Zn (Kolĕncík et al., 2019). Sin embargo, la información de los efectos de su aplicación de esta manera aún es escasa, por lo que el objetivo de esta investigación fue determinar el efecto de la aspersión foliar de nanopartículas de zinc en la producción, calidad nutracéutica y su concentración de este micronutrimento en frutos de melones desarrollados en condiciones de campo abierto.
Materiales y métodos
Sitio de estudio
El experimento se realizó en suelo agrícola en el ejido Rosas, Municipio de Tlahualilo, Durango, México, se encuentra a 1 095 msnm. Se localiza en las coordenadas 26° 06’ 38’’ latitud norte y 103° 26’ 17’’ longitud oeste. Según la clasificación de Köppen modificado por García (2004): clima seco desértico o estepario cálido con lluvias en el verano e inviernos frescos. La precipitación pluvial es de 258 mm y la temperatura media anual es de 22.1 ºC, con rangos de 38.5 como media máxima y 16.1 como media mínima. La evaporación anual media es de 2 396 mm.
Nanopartículas de óxido de zinc
Las nanopartículas utilizadas fueron de óxido de zinc (NPs ZnO), con un tamaño entre 20 y 60 nm, una pureza de 97%, de color blanco y de forma estructural semiesférica y poligonal (Figura 1). Las NPs ZnO fueron sintetizadas a través de precipitación controlada de acuerdo con lo reportado por (Ramírez Barrón et al., 2019), mediante el método de hidrólisis química. 530.4 g de acetato de zinc (CH3CO2)2Zn y 24 L de etanol se virtieron en un reactor de 200 L con calentamiento mediante una caldera a una temperatura de 80 °C, utilizando un controlador de temperatura. La reacción se mantiene en agitación durante 3 h.
Posteriormente se adiciona al reactor una solución de 0.22 M de NaOH. Se deja en agitación durante 1 h para lograr la precipitación de las NPs. El precipitado obtenido se lavó varias veces con agua destilada para su posterior caracterización mediante microscopía electrónica de transmisión (TEM) para determinar el tamaño de partícula del material obtenido.
Material vegetal y cultivo
El material vegetativo utilizado fue melón (Cucumis melo L.) híbrido cv crusier tipo cantaluop (Harris Moran Seed Companyr®). La siembra directa se realizó el 20 de marzo de 2019. Se construyeron bordos a doble hilera formando una micro-parcela (cama melonera) a una distancia de 4 m entre bordos y una separación entre plantas de 30 cm para una densidad de 16 665 plantas por hectárea. De acuerdo con el paquete tecnológico para este cultivo (Cano et al., 1992), se realizó la preparación de suelo que consistió en barbecho a 30 cm de profundidad, doble rastreo, seguido de una nivelación, construcción de camas meloneras y bordos para conducción y retención del agua de riego.
La fertilización fue mecánica utilizando la fórmula química 120-60-00 (N-P2O5-K2O); se incorporó todo el fósforo y la mitad del nitrógeno al momento de la siembra y el resto del nitrógeno al momento de la floración. Los fertilizantes fueron fosfato monoamónico (NH4H2PO4) y sulfato de amonio [(NH4)2SO4]. El riego fue con agua de la presa Francisco Zarco, se aplicó un riego de presiembra de 30 cm, durante el ciclo de cultivo se dieron seis riegos de auxilio con láminas de 15 cm cada uno, en total se aplicó una lámina de 120 cm.
Tratamientos y diseño experimental
El diseño experimental fue bloques al azar considerando ocho tratamientos con cuatro repeticiones, conformando 32 unidades experimentales, cada una de ellas constituida por un área de 4 m de ancho por 10 m de largo (40 m2). Las concentraciones de NPs ZnO aplicadas fueron las siguientes: T1= control, T2= 50 mg L-1; T3= 100 mg L-1; T4= 150 mg L-1; T5= 200 mg L-1; T6= 250 mg L-1; T7= Z 40 (1 L ha-1) y T8= GZ (1 ml L-1 de agua). Los tratamientos T7 y T8, consistieron en la aplicación de fertilizantes foliares comerciales, el zinc 40 (Z40: concentración 40%) Tec-Fort® y Gro-zinc (GZ: concentración 9.66%) Grodeco®, ambos fertilizantes quelatados.
Las nanopartículas fueron aplicadas con una aspersora manual Lola de 20 L (Swissmex®). Cada concentración de NPs ZnO se disolvió en ocho litros de agua desionizada (Quimicrón®) y para una mejor adherencia se le agrego un acidificante - adherente no iónico (AF-optimus®) a una dosis de 1 - 2 ml L-1 de agua de aspersión. Se realizaron tres aplicaciones foliares de NPs ZnO y de los fertilizantes convencionales, la primera a los 20 días después de la siembra, cuando el cultivo presentaba expansión del follaje, posteriormente cada 15 días, en promedio fueron aplicados 40 ml por planta. Las aplicaciones fueron realizadas por la mañana, sin presencia de viento y mojaron toda la planta y (Trinidad y Aguilar, 1999).
Variables evaluadas
Peso, solidos solubles y firmeza de fruto
Para el análisis de todas las variables se consideraron ocho plantas por tratamiento, dos por cada repetición y los frutos cosechados considerados fueron aquellos que presentaban madurez comercial; es decir, estado firme-maduro o 3/4 desprendido, entre 1.2-1.5 kg y sin daños físicos (Beaulieu yJeanne, 2007). Para el peso de fruto (PF) se pesaron todos los frutos cosechados en una báscula digital (Adir®, USA) con capacidad de 5 000 g. Los sólidos solubles totales (SST) se midieron con un Refractómetro óptico Master T 0-53 brix AT-Master53T (Twiligth®, USA), para ello se partieron los frutos y se colocó una gota de jugo en el vidrio y se tomó la lectura. Los resultados se expresaron como ºBrix. La firmeza del fruto (FF) se midió en dos melones de cada repetición con un Penetrómetro marca Extech® Instruments modelo FHT200 (USA), se utilizó la punta o embolo de 8 mm. Se quitó el exocarpio (cáscara) y éstos fueron colocados sobre una superficie plana, se realizaron cuatro penetraciones por fruto (Azam et al., 2015) y se promediaron los resultados registrándose como fuerza máxima de compresión (N).
Rendimiento
Para esta variable se consideró el peso de todos los frutos cosechados por unidad experimental, la densidad de siembra y se extrapolo para una hectárea, los resultados fueron reportados en t ha-1.
Flavonoides totales (FLVT)
El contenido total de flavonoides se determinó mediante el método colorimétrico (Zhishen et al., 1999) y los resultados se expresaron en mg equivalentes de quercetina por 100 g, basado en el peso fresco (mg equiv Q 100 g-1 PF).
Compuestos fenólicos totales
El contenido fenólico total se midió mediante el método de Folin-Ciocalteau (Singleton et al., 1999). Las determinaciones se realizaron por triplicado y fueron reportadas en mg de ácido gálico equivalente por 100 g de peso fresco (mg equiv GA 100 g-1 PF).
Actividad antioxidante
La capacidad antioxidante se determinó utilizando el método de DPPH (1,1-difenil-2-picrilo hidracilo), desarrollado por Brand-Willams et al. (1995). Los análisis se hicieron por triplicado y se reportaron en µM equivalente de Trolox por 100 g de peso fresco (µM equiv Trolox 100 g-1 PF).
Vitamina C
El ácido ascórbico se determinó por la técnica de Doner y Hicks (1981). Las lecturas se realizaron en un HPLC Varian ProStar 320 equipado con un detector UV-Vis (ProStar 210, Varian Prostar Inc., Walnut griega, CA, EE. UU.), utilizando una columna Varian amina de 10 cm y un bucle de inyección de 20 ml, las unidades se reportan en mg por 100 gramos de peso fresco (mg 100 g-1 PF).
Contenido de zinc en fruto
Se determinó el contenido de zinc en la cascara, pulpa y semillas de seis frutos de melón por tratamiento. El método utilizado fue por espectrofotometría de absorción atómica (AOAC, 1995), utilizando un equipo marca Perkin Elmer® modelo 3110. Los resultados se reportaron en mg kg-1.
Resultados y discusión
Parámetros de calidad de frutos de melón
Las aplicaciones foliares de NPs de ZnO tuvieron efectos favorables en los frutos de melón, la concentración de 200 mg L-1 la que promovió mayor peso de frutos, rendimiento, solidos solubles y firmeza, superando en 32% al tratamiento control y con respecto a las fuentes comerciales de Zn (Z-40 y GZ) los superó 24% y 20%, respectivamente. Por otra parte, la concentración de 250 mg L-1 disminuyó 11% el peso del fruto (Cuadro 1). Respecto a rendimiento el tratamiento de 200 mg L-1, reporto el mayor rendimiento con 53 t ha-1, el tratamiento con la fuente comercial de zinc (GZ) 43.95 t ha-1 y el control 40 t ha-1.
Cuadro 1 Comparación de parámetros de calidad comercial de frutos de melón cantaloupe por efecto de la aplicación foliar de NPs ZnO en diferentes concentraciones.
| NPs ZnO (mg L-1) |
Peso fruto (kg) | Rendimiento (t ha-1) | Solidos solubles (° Brix) | Firmeza (Newton) |
|---|---|---|---|---|
| Control | 1.33 ±0.27 d* | 40.09 ±8.35 d | 11.26 ±0.38 b | 17.75 ±1.25 b |
| 50 | 1.49 ±0.11 bdac | 44.95 ±3.64 bdac | 11.37 ±0.22 b | 21.25 ±3.59 ba |
| 100 | 1.7 ±0.09 ba | 51.63 ±2.93 ba | 11.85 ±0.75 b | 22.25 ±3.59 ba |
| 150 | 1.61 ±0.23 bac | 48.93 ±7.13 bac | 11.76 ±1.05 b | 23 ±5.83 a |
| 200 | 1.74 ±0.18 a | 52.96 ±5.59 a | 12.73 ±0.31 a | 24.5 ±6.45 a |
| 250 | 1.64 ±0.16 bac | 49.73 ±5.03 bac | 11.94 ±0.48 b | 20.5 ±5.68 ba |
| Z40 | 1.4 ±0.17 dc | 42.53 ±5.36 dc | 11.65 ±0.21 b | 21.75 ±2.21 ba |
| GZ | 1.45 ±0.17 bdc | 43.95 ±5.39 bdc | 11.6 ±0.13 b | 21.75 ±3.77 ba |
*= promedios con letras distintas, dentro de una misma columna, indican diferencia significativa (Tukey; p≤ 0.05). Donde: LSD= diferencia mínima significativa.
Los rendimientos medios regionales reportados para este cultivo son de 45.2 t ha-1 y con un peso de fruto de 1.7 kg (García-Mendoza et al., 2019), en ambos casos las aplicaciones de las nanopartículas superaron estos valores. Resultados reportan para Vigna mungo (L.), con dosis de 200 ppm de NPs ZnO los mejores resultados para germinación de semillas y crecimiento de plantas (Rajitha et al., 2020). En lechuga, reportan una mejor respuesta al aplicar 20 ppm (NPs Ag) y al aplicar el doble disminuyo el peso fresco de las hojas (Jurkow et al., 2020).
En plantas de Capsicum chinense aplicaciones foliares de 1 000 mg L-1 presentaron efectos positivos en el crecimiento y con 2 000 mg L-1 existe un efecto negativo. Diversos estudios señalan que los efectos positivos de las NPs ZnO puede ser atribuido a que el zinc es indispensable para desarrollar actividades metabólicas y catalíticas en el crecimiento de las plantas (Fageria et al., 2016), regula actividades enzimáticas y reacciones bioquímicas que conducen a la formación de clorofila y carbohidratos (Gawrońska et al., 2018). Sin embargo, el efecto de las nanopartículas varía en función de sus propiedades como su tamaño, las sustancias químicas, su estructura, el recubrimiento superficial, velocidad y dosis de aplicación (Khodakovskaya et al., 2012).
Con respecto a las fuentes convencionales de zinc, se señala que los nanofertilizantes foliares pueden ser más efectivos que éstos debido a que su liberación puede ser lenta y gradual (De Rosa et al., 2010). Respecto a la disminución del peso y rendimiento de los frutos de melón, se ha señalado un efecto ambivalente de las nanopartículas (Méndez-Arguello et al., 2016). Por ejemplo, en Lycopersicon esculentum disminuyeron parámetros de crecimiento cuando se aplicaron foliarmente 200 mg L-1 de NPs ZnO (Faisan y Hayat, 2019). Las causas son diversas desde una posible toxicidad (Reed et al., 2011; Jurkow et al., 2020) o debido a factores vinculados a la forma, tamaño, periodo estacional y número de aplicaciones de las nanopartículas (Kolenčík et al., 2019).
Respecto a solidos solubles y firmeza, los valores reportados para esta hortaliza en la región son entre 6.5 a 11 °Brix y firmeza de 38 N (Moreno-Reséndez et al., 2014). El tratamiento de 200 mg L-1, supero al valor regional, pero fue inferior a firmeza. De acuerdo con estándares internacionales melones con contenidos de azúcar 12-14 °Brix son los adecuados para el mercado internacional y valores de 9 °Brix son los óptimos para la calidad interna óptima de los melones (Bower et al., 2002).
Compuestos bioactivos en frutos
Los resultados indican que el mayor contenido de flavonoides se obtuvo con las concentraciones de 50 y 100 mg L-1, superando al tratamiento control en 13.5% y a las dos fuentes de Zinc comercial en 10% (Z40) y 12% (GZ). Cabe señalar que a medida que se incrementó la concentración de las Nanopartículas los flavonoides disminuyeron en 8%. Mismo comportamiento se presentó para fenoles, capacidad antioxidante (DPPH) y vitamina C, disminuyendo en 17%, 10.8% y 9%, respectivamente (Cuadro 2).
Cuadro 2 Compuestos bioactivos presentes en frutos de melón por la aplicación foliares de NPs ZnO.
| NPs ZnO (mg L-1) |
Flavonoides (mg QE 100 g-1 PF) |
Fenoles (mg Ac. Gálico 100 g-1 PF) |
DPPH (mg equiv Trolox 100 g-1 PF) |
Vitamina C (mg 100 g-1 PF) |
|---|---|---|---|---|
| Control | 122.65 ±0.22 e* | 145.07 ±0.36 g | 63.86 ±0.29 h | 50.51 ±0.59 e |
| 50 | 141.85 ±0.55 a | 231.36 ±1.32 a | 88.14 ±0.22 a | 61.36 ±1.04 a |
| 100 | 140.18 ±3.53 a | 222.43 ±0.97 b | 81.79 ±0.77 c | 59.13 ±0.83 b |
| 150 | 135.22 ±0.45 b | 211.8 ±1.1 c | 85.29 ±0.19 b | 56.87 ±0.31 c |
| 200 | 133.21 ±0.14 b | 199.9 ±3.27 d | 78.62 ±0.22 d | 53.53 ±0.99 d |
| 250 | 130.11 ±0.77 c | 192.04 ±1.68 e | 75.32 ±0.11 e | 54.17 ±1 d |
| Z40 | 127.71 ±0.17 d | 178.44 ±6.54 f | 72.02 ±0.11 f | 53.81 ±0.5 d |
| GZ | 124.41 ±0.72 e | 150.98 ±8.39 g | 68.78 ±0.7 g | 55.9 ±0.43 c |
*= promedios con letras distintas, dentro de una misma columna, indican diferencia significativa (Tukey; p≤ 0.05). Donde: PF= peso fresco; DPPH= 1,1-Difenil-2-Picrilhidrazilo.
Las aplicaciones de las fuentes de zinc comercial superaron al tratamiento control para flavonoides en 4%, fenoles 18%, capacidad antioxidante 11.3% y vitamina C en 9.6%; sin embargo, estos porcentajes fueron inferiores a los obtenidos por las NPs ZnO. La cantidad de flavonoides presentes en el melón dependen del genotipo, maduración del fruto y la fecha de cosecha (Tadmor et al., 2010). Tienen diversas funciones, actúa como un excelente agente antioxidante, tiene compuestos antimicrobianos, protectores UV, protectores de insectos (Harborne y Williams, 2000).
Se han reportado valores de 106.18 mg 100 g-1 (Morais et al., 2015) hasta de 168 mg 100 g-1 (Ismail et al., 2010), en nuestro estudio los valores promedio fueron de 141.85 con 50 mg L-1 de NPs ZnO. Estos resultados pueden estar asociados a que la aplicación foliar de NPs ZnO tienen un mayor potencial de transporte, mayor biodisponibilidad y absorción que les permite interactuar con estructuras intracelulares que estimulan la formación de ROS (Ghosh et al., 2016; García-López et al., 2019).
Los compuestos fenólicos también desempeñan un papel muy importante en este cultivo, ya que protegen el fruto de insectos y microorganismos, y determinan el color y apariencia de los frutos (Jeong et al., 2004; Mallek-Ayadi et al., 2019). Valores de 168 mg 100 g-1 se han reportado en pulpa de melón cantaloupe (Ismail et al., 2010). El contenido fenólico está asociado a sus actividades antioxidantes debido a sus propiedades redox que le permite actuar como agente reductor y donante de oxígeno (Chang et al., 2001). En este sentido, los resultados obtenidos indican claramente que la aplicación de NP de ZnO induce un mayor contenido de compuestos antioxidantes (fenoles, flavonoides y vitamina C) en los frutos de melón.
El contenido de vitamina C en frutos de Melón (Cucumis melo L.) mostró un descenso al aumentar la concentración de NPs ZnO entre los tratamientos. El valor más alto de vitamina C se encontró en frutos de plantas asperjadas con 50 mg L-1 de NPs ZnO, esta concentración fue superior 21.48% en comparación con el tratamiento control. Las dosis de 100, 150, 200 y 250 mg L-1 NPs ZnO mostraron aumentos de 17.06, 12.59, 5.97, 7.24%, respectivamente. Mientras que las fuentes comerciales de zinc-40 (6.53%) y Gro-zinc (10.67%) en comparación al tratamiento control.
Resultados obtenidos por López-Vargas et al. (2018) mostraron que aplicaciones de 250 mg L-1 NPs de Cu aumentaron significativamente la concentración de vitamina C, lo cual aumento la calidad nutraceútica de frutos de tomate. Mathpal et al. (2015) afirman que el zinc participa en la activación de enzimas, biosíntesis de proteínas y carbohidratos. Padayatty et al. (2003) mencionan que la vitamina C, es un antioxidante cuyos efectos aminoran las enfermedades humanas como la aterosclerosis y el cáncer mismas que ocurren por daño oxidativo a los tejidos, las dietas abundantes en frutas y verduras disminuyen el riesgo de enfermedad cardiovascular, accidente cerebrovascular y cáncer.
Contenido de zinc en frutos
Las aplicaciones foliares de NPs ZnO influyeron en el contenido de zinc presente en la cascara, pulpa y semillas de los frutos de melón. En el tratamiento control la cantidad de zinc fue de 52.68 mg kg-1, la mayor cantidad de zinc se encuentra presente en la pulpa (76%), después en semilla (21%) y una pequeña cantidad en la cáscara (2.5%). Por otra parte, el tratamiento de 200 mg L-1, presentó 67.43 mg kg-1, con valores de 78%, 19% y 2.5%, respectivamente. Mientras que en los frutos con fertilización comercial (GZ) la cantidad fue 57.6 mg kg-1, con valores de 77% (pulpa), 20% (semilla) y 2.5% (cascara) (Figura 2).
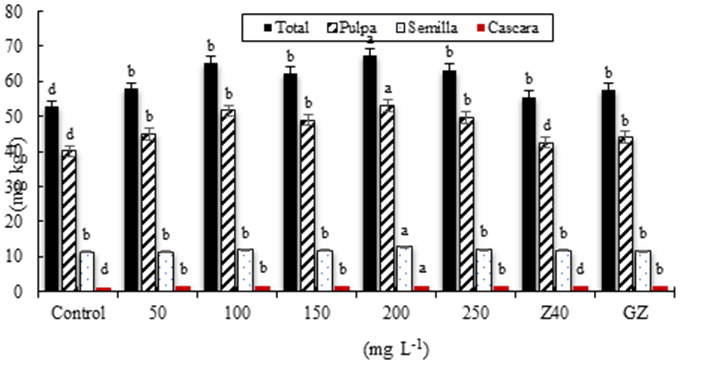
Figura 2 Contenido de zinc en cascara, pulpa y semillas de frutos de melón con aplicaciones foliares de nanopartículas de zinc y fertilizantes comerciales convencionales. Promedios con letras distintas indican diferencia significativa según la prueba de Tukey (p≤ 0.05).
El tratamiento de 200 mg L-1 NPs ZnO, fue el que presentó el mayor contenido de zinc en pulpa (52.96 mg kg-1), superando al tratamiento control 24%, y a GZ en 17%. Sin embargo, a medida que se aplicó una mayor concentración los valores de zinc en pulpa disminuyeron en 6%. En otros estudios se han reportado contenidos de zinc de 22 mg kg-1 peso seco en pulpa de melón (López-Zaplana et al., 2020).
Por otra parte, Wang et al. (2019) encontraron que al aplicar NPs Cu se incrementó el contenido de cobre en granos de trigo entre 18.86% y 30.45% en comparación con el control y con una dosis de 500 mg kg-1 de NPs TiO. Rizwan et al. (2018) observaron que al aplicar Nanopartículas de Zn y Fe hubo un incremento en las concentraciones de ambos elementos en Triticum aestivum. El Instituto de Medicina (2002) reporta un requerimiento de 11 mg día-1 de zinc en adolescentes de 14 a 18 años y de 9.4 mg para personas mayores de 19 años, no se recomienda ingerir dosis mayores de 25 mg, ya que puede causar anemia y deficiencia de cobre (Lenntech, 2021).
En este sentido, la utilización de NPs con zinc es una manera eficaz de enriquecer a los cultivos, ya que al trasladar Zn por tejidos vegetales se provocará una acumulación de este micronutrimento, lo que podría ayudar a solucionar la deficiencia de Zn en la dieta humana (Cakman y Kutman, 2018).
Conclusiones
La aplicación foliar de NPs ZnO mejora el rendimiento y la calidad comercial y nutracéutica de los frutos de melón. El rendimiento y la calidad del cultivo de melón depende de la concentración utilizada de NPs ZnO ya que dosis altas favorece el rendimiento y una mayor concentración de Zn en pulpa; en cambio on la aplicación de dosis intermedias de NPs ZnO se propicia una mayor acumulación de compuesto bioactivos. La aspersión foliar de NPs ZnO es una manera práctica de enriquecer los frutos de melón y mitigar las deficiencias de este micro nutrimento en la población.











 texto en
texto en 



