Introducción
El cultivo de fresas en el sistema semihidropónico, conocido popularmente como cultivo sin suelo, es una práctica aplicada en varias regiones del planeta (Recamales et al., 2007; Neri et al., 2012; Rampazzo, 2016). En lugar de suelo, utiliza una amplia gama de materias primas para producir los sustratos, como la perlita, la vermiculita, la turba, la corteza de pino, la cáscara de arroz carbonizada y la fibra de coco (Lieten et al., 2004; Jarosz y Konopinska, 2010; Marques, 2016). Los sustratos utilizados en el sistema semihidropónico suelen tener buenas características físicas y químicas y tienen una buena biodisponibilidad de nutrientes para el desarrollo de las plantas (Abad et al., 2005; Ilha, 2013). Además, están libres de plagas y enfermedades, proporcionan un uso más racional del agua y los nutrientes y son más ergonómicos para los trabajos (Rampazzo, 2016).
Uno de los puntos más críticos en el sistema semihidropónico de la fresa es el manejo del nitrógeno mediante fertirrigación (Othman et al., 2019). La disponibilidad de nitrógeno afecta la productividad de las fresas y la calidad de los frutos (Nestby et al., 2004; Jarosz y Konopiska, 2010). Ambas formas de nitrógeno, nitrato y sales de amonio, son absorbidas y metabolizadas por las plantas (Roosta et al., 2009) y desempeñan funciones metabólicas importantes, como el crecimiento, el desarrollo, la producción y afectan la apariencia, durabilidad y sabor de los frutos (Tabatabaei et al., 2008; Krüger et al., 2012; Samec et al., 2016).
A pesar de esto, hay poca información sobre la concentración de nitratos y amonio en soluciones nutritivas para la fresa. En las existentes, la variación es expresiva, entre 4 y 12 mmol L-1 para NO3 - y 0.2 y 2.5 mmol L-1 para NH4 + (Hennion y Veschambre, 1997; Paranjpe et al., 2003; Furlani y Fernández, 2004). Esta investigación tuvo como objetivo determinar la mejor proporción de NO3 -:NH4 + para la producción de fresas mediante el uso del sistema de fertirrigación semihidropónico.
Materiales y métodos
Esta prueba se realizó en Curitiba, estado de Paraná, Brasil (25° 24’ 38.5” S; 49° 14’ 57. 5” O). Cada corredor de fresa ‘San Andreas’, un cultivar neutro al fotoperiodo, fue plantado en macetas de polipropileno negro de 8 litros el 09/07/18, llenas con sustrato orgánico (Cuadro 1) compuesto por cáscara de arroz y corteza de pino.
Cuadro 1 Características del sustrato orgánico utilizado para el cultivo de corredores de fresa ‘San Andreas’ en un sistema semihidropónico.
| pH CaCl2 | DD (kg m-3) | EC (mS cm-1) | C (g dm-3) | TP | RAW | BS | AW | |
|---|---|---|---|---|---|---|---|---|
| (%) | ||||||||
| 5.65 | 266.78 | 399 | 151.3 | 84.4 | 7.96 | 1.59 | 9.55 | |
dd= densidad seca; tp= porosidad total; raw= agua fácilmente disponible; bs= solución amortiguadora; aw= agua disponible.
El diseño experimental aplicado fue completamente aleatorizado con cinco repeticiones por tratamiento, y cada repetición con tres macetas. Los tratamientos consistieron en proporciones de nitrato y amonio (NO3 -:NH4 +) en la solución nutritiva de 100:0; 75:25; 50:50; 25:75 y 0:100%, con 150 mg L-1 de concentración de nitrógeno aplicada en todas las macetas, con base y modificada por Furlani y Fernandes Júnior (2004) (Cuadro 2).
Cuadro 2 Macronutrientes y concentración de cloro en la solución nutricional utilizada, de acuerdo con cada proporción de nitrato: amonio.
| NO3 -:NH4 + | NO3 - | NH4 + | SO4 2- | Cl- |
|---|---|---|---|---|
| (mg L-1) | ||||
| 100-0 | 150 | 0 | 48.9 | 131 |
| 75-25 | 112.5 | 37.5 | 90 | 249.8 |
| 50-50 | 75 | 75 | 112.5 | 423.1 |
| 25-75 | 37.5 | 112.5 | 153.6 | 544.8 |
| 0-100 | 0 | 150 | 194.6 | 666.1 |
Otros nutrientes se aplicaron en las mismas concentraciones en todas las macetas: 170 mg L-1 de Ca, 200 mg L-1 de K, 40 mg L-1 de HPO4 -,40 mg L-1 de Mg, 32 μmol L-1 de Fe, 10 μmol L-1 de Mn, 30 μmol L-1 de B, 3.1 μmol L-1 de Zn, 1.3 μmol L-1 de Cu y 0.17 μmol L-1 de Mo. Para la formulación de la solución nutritiva se utilizaron las siguientes sales: Ca(NO3)2, KNO3, KH2PO4, MgSO4, NH4H2PO4, CaCl2, KCl, (NH4)2SO4, H3BO3, CuSO4, 5H2O, MnSO4H2O, ZnSO47H2O, Na2MoO4 2H2O, Fe- EDDHA (6%).
Se aplicó fertirrigación en cada maceta una vez al día, para mantener la capacidad de retención de agua del sustrato en 60%, de esta manera se aplicaron aproximadamente 500 ml diarios por maceta. La conductividad eléctrica (EC) en la solución nutricional se mantuvo entre 1 300 y 1 800 mS cm-1 y el pH en 6 ±0.2.
Las evaluaciones de las hojas se realizaron a 60 y 120 días después de la siembra (Dap), correspondientes a las etapas vegetativa y productiva, respectivamente (Nepar, 2019). El área foliar se obtuvo midiendo la longitud y anchura de los foliolos de la cuarta hoja recién desarrollada de la planta con un calibrador digital y utilizando la ecuación La= (π/4) [(L + W) / 2]2 (Pires, 1999). Donde: La= área foliar; L= longitud y W= anchura. A partir de los mismos foliolos se recogió una muestra de tejido de 0.17 g para evaluar la clorofila a, b y las hojas totales (Porra, 2002).
El material fue macerado con 10 ml de acetona al 80% y centrifugado a 12 000 rpm durante 10 minutos y se realizó una lectura del espectrofotómetro a longitudes de onda de 645 y 663 nm. El resto de la cuarta hoja recogida se utilizó para el análisis nutricional (S, Ca, K, Mg, P, Fe y Zn) mediante digestión húmeda con ácido nítrico (HNO3) y peróxido de hidrógeno (H2O2), y las lecturas se hicieron con la espectroscopía de emisión óptica de plasma acoplado inductivamente (ICP-OES) (Varian 720-ES™). El N total fue analizado por el método de combustión de Dumas en un Analizador Elemental (Carmo et al., 2000).
Todas las hojas senescentes se recogieron durante el crecimiento de las plantas y se secaron a 65 °C hasta alcanzar una masa constante. Al final del ensayo, todas las hojas que quedaban también se secaron a 65 °C hasta alcanzar una masa constante. El peso seco por planta se obtuvo añadiendo el peso seco de senescencia al peso seco final de las hojas.
Se analizaron las características físicas y químicas de los frutos en diez frutos cosechados por réplica, en tres fechas de cosecha (20/12/2017; 20/01/2018; 20/02/2018). Se eligieron aquellos con al menos 3/4 de epidermis rojiza, peso mínimo de 6 g y sin lesiones, enfermedades o deformaciones. En primer lugar, la firmeza de la pulpa se determinó utilizando un analizador de textura (Brookfield CT3™), con punta de 2 mm, penetración de 5 mm y velocidad de penetración de 5 mm s-1. Posteriormente, se extrajo el jugo de fresa, se midió el contenido de sólidos solubles usando un refractómetro. La solución del jugo se diluyó en agua al 10% y la titulación se realizó con 0.1 M de solución de hidróxido de sodio (NaOH) bajo agitación constante hasta un pH de 8.2.
Se utilizó la prueba de Bartlett para verificar la homogeneidad de las varianzas (p> 0.05) de los datos, seguida de Anova. En caso de variación significativa, se utilizó el análisis de regresión para verificar los efectos de las proporciones de NO3 -:NH4 +. Para el análisis estadístico se utilizó el software Assistat 7.7 (Silva, 2002).
Resultados y discusión
Las proporciones de NO3 -:NH4 + no afectaron la mayoría de los contenidos de nutrientes de las hojas (S = 1.19 g kg-1; Ca =10.64 g kg-1; K=18.13 g kg-1; Mg= 3.75 g kg-1; P= 2.89 g kg-1; Fe= 69.42 mg kg-1; Zn= 23.38 mg kg-1). Estos niveles de nutrientes son similares al nivel foliar en hojas de fresa reportado por otros autores (CQFS RS/SC, 2004; Nepar, 2019). Se esperaba que el nivel más alto de NH4 + en la solución nutritiva se afectaran los niveles de Ca, K y Mg; a través, de la competencia entre iones de la misma valencia, ya sea por un canal proteico o por unión a una proteína transportadora en la membrana celular (White, 2012), pero eso no ocurrió en esta investigación.
Tampoco se apreció un cambio en el pH en la rizosfera por la absorción de NH4 + (Hawkesford et al. (2012), lo que tiene un efecto directo sobre la biodisponibilidad de nutrientes (Waller y Wilson, 1984). El pH del sustrato cambió poco durante este ensayo (5.65 antes de la siembra -5.27 en 0-100% de NO3 -:NH4 +), debido a su composición orgánica. La composición del sustrato juega un papel importante dado que Choi et al. (2011) encontró una disminución del pH del sustrato, de un pH de 7 con el uso de solución nutritiva sin NH4 + a un pH de 5.8 con NH4 + y también una disminución de los niveles de K+, Ca2 + y Mg2 + en hojas de fresa utilizando un sustrato mineral.
De los nutrientes evaluados en la hoja, sólo el nitrógeno total (N) se vio afectado por las diferentes proporciones de NO3 -:NH4 + de las soluciones nutritivas. El contenido fue de 20.64 g kg-1, cuando el 100% del nitrógeno aplicado estuvo como NH4 +, que presenta un aumento de aproximadamente 14% de N en relación con la ausencia de NH4 + (Figura 1). Un resultado similar fue obtenido por Tabatabaei et al. (2008), con la aplicación de la dosis máxima de 75% de NH4 + en la variedad de fresa ‘Selva’ se encontró un aumento de alrededor de 16.8% en el contenido foliar de N y por Choi et al. (2011), con un aumento de 14.2% de N al utilizar 100% de NH4 + en la solución nutritiva.
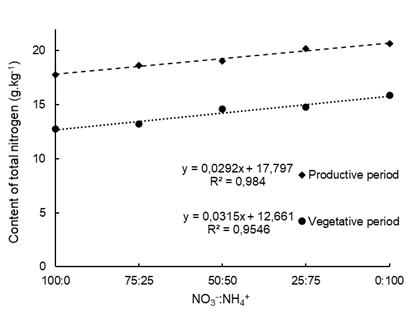
Figura 1 Contenido de nitrógeno total en hojas de fresa del cultivar ‘San Andreas’ con proporciones de NO3 -:NH4 + en la solución nutritiva, en período vegetativo (60 días después de la siembra) y período reproductivo (120 días después de la siembra), en cultivo semihidropónico.
La mayoría de las plantas absorben las dos formas de nitrógeno que están mediadas por proteínas de transporte específicas (Roosta et al., 2009). Las formas de nitrógeno pueden ser metabolizadas en la misma célula de la raíz donde fue absorbida o transladada sin cambios a la parte aérea de la planta. El NH4 + se asimila en las células de la raíz y su forma reducida se lleva a las hojas, mientras que la mayor parte de NO3 - se lleva a las hojas y luego se reduce para ser asimilado en aminoácidos. El requerimiento energético para la asimilación NH4 + es menor al requerido para la asimilación de NO3 - ya que el primero no necesita ser reducido para su incorporación en aminoácidos (Bloom et al., 1992; Hawkesford et al., 2012; Taiz y Zeiger, 2017). Posiblemente, el NH4 + asimilado en las raíces y transportado en forma de aminoácidos terminó acumulándose en las hojas y aumentando los niveles de N en estos tejidos (Majerowicz et al., 2000).
Las altas concentraciones de NH4 + en la solución nutritiva causaron necrosis en las hojas (Figura 2), aumentando la masa seca de la parte aérea (Figura 3), indicando un efecto tóxico sobre la planta. Choi et al. (2011) observaron que en altas concentraciones de NH4 + en la solución nutritiva, las hojas jóvenes de fresa presentaron un color verde mate, con bordes marchitos y rizados, mientras que las hojas viejas estaban secas y bronceadas. El mayor contenido de N en la hoja (Figura 1) favoreció la producción de NH4 + a través de la fotorrespiración, como la vía metabólica para la producción de este compuesto en plantas (Bittsánszky et al., 2015), dando lugar a la toxicidad.

Figura 2 Síntomas relacionados con el efecto tóxico de NH4 + en plantas de fresa bajo tratamiento de 0:100% de NO3 -:NH4 + en la solución nutritiva, donde: a) inicio de síntomas; b) síntoma agravado; c) vista aérea de la planta; y d) muerte de hojas.
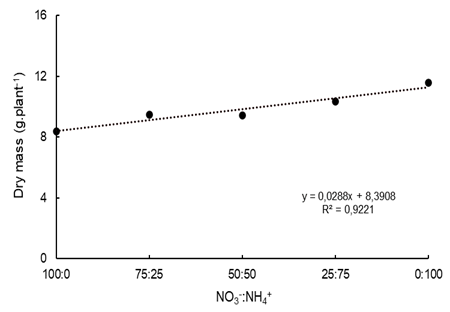
Figura 3 Masa seca del cultivar ‘San Andreas’ después de 120 días de la plantación, de acuerdo con proporciones de NO3 -:NH4 + en la solución nutritiva en cultivo semihidropónico.
La toxicidad ocurre cuando la tasa de asimilación de NH4 + en aminoácidos y amidas se vuelve más baja que la tasa de absorción. En las hojas, la acumulación de NH4 + causa daño a las estructuras del cloroplasto, bajando el pH de las células a niveles intolerables. Este hecho disipa los gradientes de protones transmembrana necesarios para el transporte de electrones en la fotosíntesis, lo que resulta en una disminución en la tasa fotosintética (Bittsánszky et al., 2015).
Los niveles de clorofila variaron de manera similar en los períodos de 60 DAP y 120 DAP, bajo las proporciones de NO3 -:NH4 + (Figura 4). Los contenidos máximos de clorofila fueron de 0.250 mg g-1 en las proporciones de 36.2% de NH4 +. Tabatabaei et al. (2008) también observaron un aumento del contenido de clorofila utilizando la proporción de 50% de NH4 + en la solución nutritiva. En el presente estudio, el aumento de la concentración de NH4 + por encima de 36% disminuyó el contenido de clorofila de la hoja, probablemente debido a la fitotoxicidad de NH4 + discutida anteriormente. Los niveles máximos de clorofila se obtuvieron con NO3 - y NH4 + en la solución de fertirrigación, en la que el protón generado por la asimilación de NH4 + puede ser utilizado para reducir el NO3 -, facilitando así que las plantas regulen el pH intracelular cuando se proporcionan ambas formas de nitrógeno (Hawkesford et al., 2012).
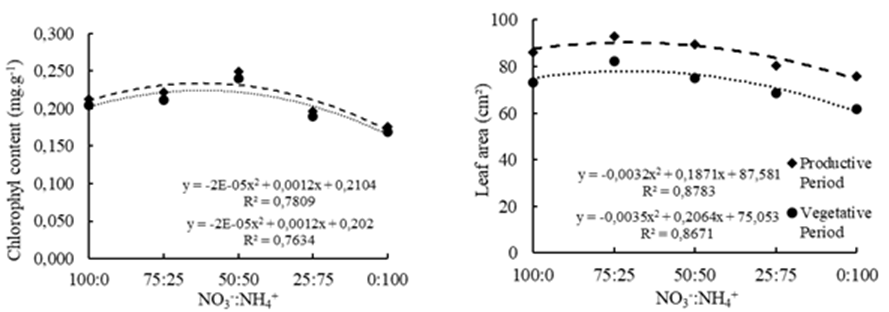
Figura 4 Contenido de clorofila y área foliar de las hojas de fresa ‘San Andreas’ con las proporciones de NO3 -:NH4 + en la solución nutritiva, en período vegetativo (60 días después de la siembra) y período reproductivo (120 días después de la siembra) en cultivo semihidropónico.
La combinación adecuada de NO3 -:NH4 + tiene un efecto estimulante en las plantas porque reduce el gasto de energía en el proceso de absorción de nitrógeno, realizado por las células de la raíz y en la asimilación en aminoácidos. Por lo tanto, la célula con su metabolismo regulado y con mayor eficiencia energética puede asimilar el nitrógeno en glutamina y glutamato, así como incorporar otros aminoácidos que juegan un papel importante en la formación de proteínas y moléculas, como la clorofila (Taiz y Zeiger, 2017).
La relación 71:29 de NO3 -:NH4 + fue la que proporcionó mayor área foliar, tanto en 60 DAP como en 120 DAP, alcanzando 93 cm² (Figura 4). Estos valores se aproximan a los estudios realizados por Tabatabaei et al. (2008); Choi et al. (2011), en el que la aplicación de 25% de nitrógeno en forma de NH4 + dio lugar a mayores áreas foliares. Fue posible una mayor expansión foliar, ya que la regulación osmótica y energética proporcionada por las dos formas de N (NO3 - y NH4 +) benefició el alargamiento celular y el crecimiento de las plantas (Cao y Li, 2003; Li et al., 2013).
Los resultados del área foliar (Figura 4) muestran la misma tendencia que los contenidos de clorofila (Figura 4), ya que la clorofila es la base para la formación de diversos componentes del aparato fotosintético de la planta, proporcionando un mayor desarrollo foliar. Sin embargo, hubo un menor crecimiento foliar en plantas suplementadas con alta concentración de NH4 + (75% y 100%), probablemente debido a una mayor demanda de carbohidratos que se canalizan para la asimilación y desintoxicación de la gran cantidad de este catión.
La firmeza de la pulpa fue la única característica fisicoquímica que guía la calidad del fruto afectada por las proporciones de NO3 -:NH4 + y disminuyó hasta 25% con el aumento de los niveles de NH4 + en la solución nutritiva (Figura 5). Es similar a los resultados encontrados por Sokri et al. (2015) en manzanas, donde la mayor concentración de NH4 + que fue probada en la solución disminuye la firmeza de la pulpa.
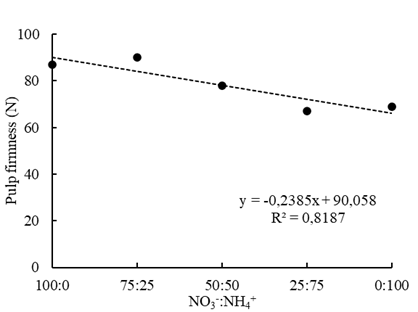
Figura 5 Firmeza de la pulpa del fruto de fresa cultivar ‘San Andreas’ de acuerdo con proporciones de NO3 -:NH4 + en la solución nutritiva en cultivo semihidropónico.
La firmeza de la pulpa está estrechamente relacionada con el Ca, ya que está ligada a ácidos poligalacturónicos como las pectinas. Ellos forman los pectatos de Ca en la laminilla media, cuya función es esencial para la formación de paredes celulares y tejidos vegetales. La degradación del pectato está mediada por la poligalacturonasa, una enzima fuertemente inhibida por altas concentraciones de Ca (Wehr et al., 2004). Así, cuando se produce una deficiencia de Ca, se incrementa la actividad de la poligalacturonasa (Konno et al., 1984). Un síntoma típico de la deficiencia de Ca es la desintegración de las paredes celulares y la descomposición de los tejidos afectados, lo que causa aflojamiento y pérdida de la firmeza del fruto (Ho y White, 2005). La reducción en la firmeza de la pulpa puede estar relacionada con menor concentración de Ca en los frutos (Alan, 1989). En este experimento, aunque las concentraciones foliares de Ca no se vieron afectadas por NH4 +, es probable que las concentraciones de Ca en el fruto hayan sido afectadas.
Los frutos presentaron valores medios de sólidos solubles totales (TSS) de 8.5, en °Brix, acidez total titulable (TTA) en % de ácido cítrico de 0.97; TSS/TTA (proporción) de 8.9 y pH de 3.5. Según Kader (1999), para que el sabor de fresa sea aceptable, la cantidad mínima de TSS es alrededor de 7 °Brix. Los valores máximos de acidez recomendados se encuentran entre 0.8% y la relación SS/TA de al menos 8.75. Se esperaba que los niveles de SST disminuyeran y los niveles de TTA aumentaran con concentraciones altas de NH4 + en la solución nutritiva.
Esto porque, según Sokri et al. (2015); Zhang et al. (2019), la aplicación de NH4 + disminuye la afluencia de K por la planta, debido al antagonismo de estos cationes. La concentración de cationes se reduce con el aumento de la concentración de amonio, que puede conducir a un aumento en la acidez de los frutos. Por otro lado, en semillas de soja y frutos de manzana (Malus domestica Borkh. cv. Fuji), la fertilización con K aumentó el TSS (Tu et al., 2017; Zhang et al., 2017). Aunque los tejidos foliares muestran síntomas de toxicidad de NH4 +, en este ensayo, el contenido de K de la hoja no varió con el aumento de NH4 +, manteniendo las características químicas de los frutos.
Conclusiones
En este trabajo, el daño causado por el exceso de NH4 + en la solución nutritiva fue mitigado mediante el uso de un sustrato orgánico en el cultivo de fresas. Teniendo en cuenta lo anterior, los mecanismos exactos de la toxicidad causada por NH4 + no son totalmente comprensibles. Se recomiendan estudios futuros para dilucidar mejor cómo afectó el NH4 + a la firmeza de la pulpa de fresa. La mejor relación de NO3 -:NH4 + para el desarrollo y la calidad de la fresa mediante el uso del sistema de fertiirrigación semihidropónica es de 71:29.











 texto en
texto en 



