Introducción
La nanotecnología es una alternativa en la agricultura moderna al producir agroproductos como nanofertilizantes, nanopesticidas, nanoherbicidas y nanosensores, que permiten incrementar el rendimiento de alimentos de manera sustentable y reducir el impacto ambiental (Lira et al., 2018). El uso de nanomateriales es de gran interés para su estudio debido a su tamaño y a las aplicaciones que pueden tener gracias a las propiedades físicas y químicas, que adquieren a escala nanométrica en comparación con el material de tamaño micro (Hojjat y Hojjat, 2015).
Entre estos nanomateriales, las nanopartículas de quitosán (NPs CS), son de gran interés ya que se obtienen gracias a la versatilidad del quitosán y disponibilidad de grupos funcionales (amino, -NH2) (Salachna y Zawadzińska, 2014; Kumaraswamy et al., 2018), no toxicidad, biocompatibilidad y biodegradabilidad (Divya et al., 2019).
En este sentido las NPs CS se han vuelto una alternativa prometedora en el cebado de semillas, debido a su actividad biológica alta ya que las NPs CS interactúan en conjunto con la célula viva (Pedroso, 2017; Divya y Jisha, 2018; Souza et al., 2019), provocando así la síntesis de varias biomoléculas como inductores que obligan al germinado a reaccionar ante ellos teniendo como consecuencia que desarrolle una mayor síntesis de metabolitos secundarios (Hidangmayum et al., 2019; Paramo et al., 2020), lo cual se ha demostrado en germinados de tomate, arroz y trigo (Colman et al., 2019; Divya et al., 2019; Li et al., 2019).
Por otro lado, los germinados son una fuente de carbohidratos, fibra, vitaminas, nutrimentos esenciales y compuestos bioactivos, los cuales se han relacionado con la prevención y tratamiento de enfermedades. La presencia de estos compuestos, en los germinados, pueden incrementarse por las condiciones de producción, calidad de las semillas y las condiciones de germinación (Dziki et al., 2015).
Recientes avances del uso de la nanotecnología en la agricultura permiten tratar de comprender el papel de las NPs Cs en germinados de triticale (x Triticosecale Wittmack), ya que este presenta actualmente un incremento interesante de 30% en la producción de alimentos a nivel mundial (Aquino y Gómez, 2019). Las NPs CS son un material prometedor para los tratamientos de semillas, por lo cual el objetivo de este trabajo fue evaluar el efecto de las NPs CS sobre la síntesis de compuestos bioactivos en germinados de triticale.
Materiales y métodos
Este estudio se realizó en un laboratorio de Biotecnología ubicado en el Instituto Tecnológico de Torreón, México en latitud 24 ° 30’ y 27 latitud norte, 102° 00’ y 104° 40’ longitud oeste.
Síntesis de nanopartículas de quitosán (NPs CS)
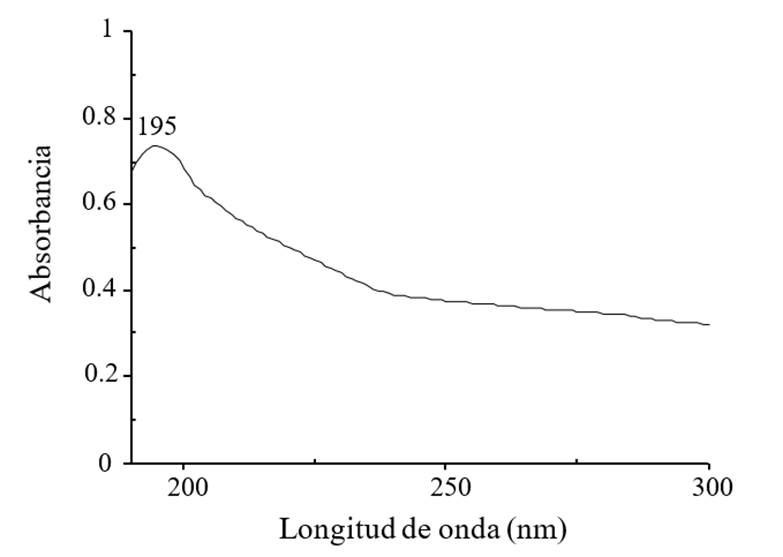
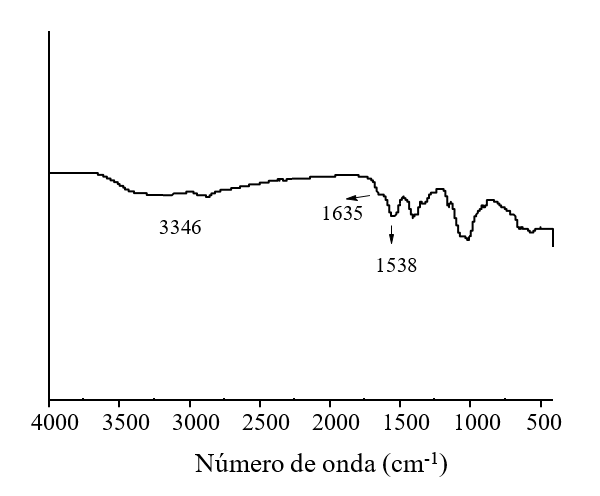
Las NPs CS fueron sintetizadas por el método de gelación iónica en el Centro de Investigación de Química Aplicada (Saltillo, Coahuila), usando quitosán (Marine, Hydrocolloids, Kerala, India) y tripolifosfato de sodio (TPP) (Sigma-Aldrich, USA) como entrecruzaste en una relación de 10:3 v/v de CS: TPP (Kumaraswamy et al., 2018) con forma esférica y un tamaño de partícula de 111 ±21 nm, las cuales se caracterizaron mediante UV-vis observándose una absorción de 195 nm (Figura 1) y por espectrofotometría infrarroja (FTIR por ATR) donde se observaron las bandas características de los grupo amino (NH2) a 3 346 cm-1 y carboxilo (C= O) a 1635 cm-1 (Figura 2), coincidentes a la estructura química del compuesto (Manikandan y Sathiyabama, 2016).
Material vegetal
Se utilizaron semillas de triticale (x Triticosecale Wittmack), de tamaño uniforme, que fueron desinfectadas con etanol al 75% por 5 min y se lavaron 4 veces con agua destilada (Li et al., 2019).
Ensayo de germinación y medición del crecimiento
Las semillas fueron divididas en cinco tratamientos principales de diez semillas: (testigo) agua destilada, 0.1, 0.2, 0.4 y 0.8 mg ml-1 de NPs CS (Colman et al., 2019; Li et al., 2019), los tratamientos se aplicaron una sola vez a la semilla durante la etapa de imbibición, las semillas de triticale fueron embebidas con las correspondientes soluciones de tratamiento durante 8 h en la oscuridad.
Posteriormente para la germinación se colocaron diez semillas por caja Petri, las cuales tenían una doble capa de papel de filtro Whatman #1 empapado previamente con 5 ml de agua destilada, las cajas Petri se sellaron con cinta adhesiva y se colocaron en una incubadora de crecimiento artificial (HGZ-150) con un ciclo día/noche de 12 h, a 25 ±2 °C respectivamente, con 60% de humedad relativa (Li et al., 2019).
La germinación de las semillas se calculó diariamente de acuerdo con los lineamientos de la Asociación Internacional de Pruebas de Semillas (ISTA) y se registraron los parámetros de crecimiento durante 7 días. La germinación de la semilla se verificó cuando la longitud del germen alcanzó la mitad de la longitud de la semilla (Faraji et al., 2018).
Parámetros evaluados durante el desarrollo del bioensayo
Porcentaje de germinación
Se determinó a los siete días después de la siembra en el segundo conteo, para lo cual se consideró el conteo total de semillas germinadas y el resultado se expresó como se muestra en la siguiente ecuación:
Vigor de semillas
Al cuarto día después de la siembra, se realizó el primer conteo para la toma de datos de semillas germinadas (plántulas que tienen bien desarrolladas la raíz y la plúmula, con desarrollo total de 2 cm en promedio). Para determinar el vigor de la semilla, expresando el resultado en porcentaje según la fórmula:
Peso fresco, brote y raíz
Se registró el peso freso del brote y la raíz en una balanza analítica (ADN modelo HR-200®) para determinar el valor de la biomasa fresca y se reportó en miligramos por germinado (Martinez et al., 2019).
Pigmentos fotosintéticos
El contenido de clorofila (Chl) en germinados de triticale se realizó de acuerdo con el método descrito por Liu et al (Liu et al., 2013). Para lo cual se pesaron 0.5 g de germinados, que fueron homogenizados en un mortero con 10 ml de etanol al 95%. El homogeneizado se centrifugó a 1 500 rpm durante 20 min y se recogió el sobrenadante, para luego medir la absorbancia a absorbancia a 665 y 649 nm, respectivamente. El contenido de Chl se calculó de acuerdo con la fórmula siguiente:
Preparación de extractos para la calidad nutracéutica
En la obtención de extractos se mezclaron 2 g de muestra fresca en 10 ml de etanol al 80%, con agitación orbital constante por 24 h a 70 rpm y 5 °C. Después los extractos fueron centrifugados a 3 000 rpm durante 5 min y el sobrenadante fue extraído para su análisis (Salas et al., 2016).
Contenido total de fenoles
Se determinó mediante una modificación del método Folin-Ciocaltea (Singleton et al., 1999), se tomaron 50 µL del extracto etanoico, diluidos en 3 ml de agua destilada y se añadieron 250 µl del reactivo Folin-Ciocalteau (1N), se agitó y dejó reaccionar durante 3 min. Posteriormente 750 µl de Na2CO3 (20%) y 950 µl de agua destilada fueron añadidos, la solución se dejó reposar durante 2 h, para luego ser cuantificadas en un espectrofotómetro UV -Vis a 760 nm. Se usaron soluciones de ácido gálico para construir la curva de calibración. Los resultados se expresaron como mg equivalentes de ácido gálico (AGE)/100 g de peso fresco.
Flavonoides totales
Fueron determinados por método colorimétrico (Colina, 2016), se tomaron 250 µl de extracto etanólico, se mezclaron con 1.25 ml de agua destilada y 75 µl de NaNO2 (5%). Después de 5 min de reposo, se agregaron 150 µl de AlCl3 (cloruro de aluminio-1-etil-3-metilimidazolio cloruro (Sigma-Aldrich, St. Louis, MO, EE. UU.).
Posteriormente 500 µL de NaOH (1M) y 275 µl de agua destilada se añadieron, las muestras se agitaron vigorosamente, para luego ser cuantificadas en un espectrofotómetro UV-Vis a 510 nm. El estándar se preparó con quercetina disuelta en etanol absoluto para obtener la curva de calibración. Los resultados se expresaron en mg QE/100 g peso fresco.
Análisis estadístico
El experimento se realizó mediante un diseño completamente al azar con cinco tratamientos y diez repeticiones. Los resultados obtenidos se analizaron mediante análisis de varianza y comparación de medias con la prueba de Tukey (p≤ 0.05) utilizando el paquete estadístico Statistical Analysis System Institute (SAS) versión 9.3. La normalidad de los datos para cada variable de respuesta se verificó con el test de Kolmogorov-Smirnov, los datos de porcentaje de germinación y las variables de capacidad antioxidante (ambas expresadas como porcentaje) se normalizaron aplicando la transformación de arcoseno y raíz cuadrada.
Resultados y discusión
Germinación de las semillas
El porcentaje de germinación y el peso fresco son unas de las principales propiedades implicadas en la calidad fisiológica de la semilla (Morales et al., 2017). Los resultados del presente trabajo muestran que las variables del porcentaje de germinación y el peso fresco de la raíz no mostraron diferencia significativa (p> 0.05) a las diferentes concentraciones que fueron aplicadas de NPs CS; sin embargo, causaron diferencia significativa en el vigor y el peso fresco del brote (Cuadro 1), siendo que el vigor de la semilla mostró una disminución de 9.75% (0.1 mg ml-1), contrario a lo que reportaron Colman et al. (2019) en semillas germinadas de tomate tratadas con 0.1 mg ml-1, con efectos positivos en el índice de vigor respecto al control.
Cuadro 1 Comparación de medias para el porcentaje de germinación y vigor, así peso fresco del brote y de raíz de semillas de triticale tratadas con NP CS.
| NPs CS (mg ml-1) | Germinación | Vigor | Peso fresco de brote | Peso fresco de raíz | |
|---|---|---|---|---|---|
| (%) | (mg) | ||||
| Control | 86 ±0.89 a | 82 ±0.81 a | 38.7 ±0.32 b | 74.2 ±0.28 a | |
| 0.1 | 82 ±0.85 a | 74 ±0.86 c | 70.4 ±0.15 a | 79.6 ±0.98 a | |
| 0.2 | 96 ±1.02 a | 80 ±0.8 ab | 55.2 ±0.25 ab | 53.2 ±0.31 a | |
| 0.4 | 88 ±1.05 a | 76 ±0.84 c | 64.8 ±0.58 a | 73.8 ±0.42 a | |
| 0.8 | 88 ±0.98 a | 80 ±0.82 ab | 56.0 ±0.35 b | 56.8 ±0.45 a | |
Valores con letras iguales en cada columna, son iguales de acuerdo con la prueba de Tukey (p≤ 0.05). Los valores son el promedio de cinco repeticiones. Medias (n= 5) ± desviación estándar.
En cuanto a la acumulación de biomasa el peso fresco del brote aumento hasta 81% con la dosis de 0.1 mg ml-1 lo que confirma el efecto positivo de las NPs CS a concentraciones bajas sobre la germinación de las semillas de triticale, dicho efecto podría atribuirse a la capacidad estimulante de la actividad metabólica de las NPs CS, logrando un aumento del potencial intrínseco en el desarrollo de la semilla con la absorción de las NPs CS (Divya et al., 2019; López et al., 2019), ya sea por imbibición, recubrimiento o cebado de las semillas (Costales et al., 2020).
Diversos estudios con concentraciones altas de NPs Cs o CS han descrito una inhibición del crecimiento de las raíces y alternativamente una promoción en la aparición de un número mayor de raíces seminales (Colman et al., 2019; López et al., 2019), como se muestra en la Figura 3 atribuyéndoselo a la estimulación de la síntesis de fitohormonas (López et al., 2019) y a la activación de genes de defensa (Rodríguez et al., 2019) como se ha observado en cultivos como tomate (Colman et al., 2019; Solórzano, 2019), salicornia bigelovii (López et al., 2020) (Lanchimba, 2019), sorgo (Holguin et al., 2020), arroz (Divya et al., 2019) y trigo (Li et al., 2019).

Figura 3 Germinación de semillas de triticale en respuesta a la aplicación de NPs CS en concentraciones de: a) control; b) 0.1; c) 0.2; d) 0.4; y e) 0.8 mg ml-1.
Pigmentos fotosintéticos
El contenido de Chl de los germinados mostró que la dosis de 0.2 mg ml-1 de NPs CS tienen efecto significativo, ya que incrementó 59% sobre el control (Figura 4). Según el trabajo reportado por Acharya et al. (2020), mencionan que el uso de nanopartículas en cebado de semillas causara toxicidad en los germinados a altas concentraciones, pudiéndose observar una disminución en los pigmentos fotosintéticos (Acharya et al., 2020) por la ruptura de la clorofila y la inhibición de la enzima p-hidroxifenilpiruvato en la biosíntesis de clorofila (Miras, 2018), causado por el estrés provocado por las nano partículas.
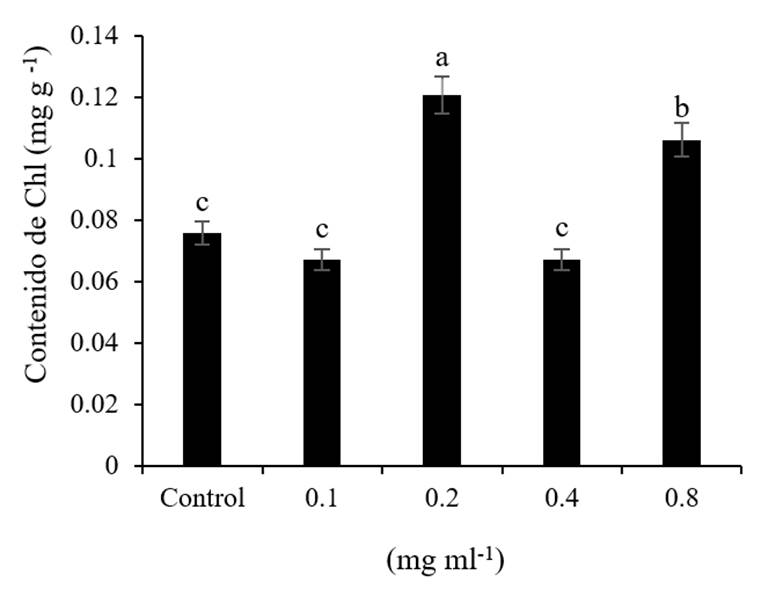
Figura 4 Efecto de las NPs CS en el contenido de clorofila en germinados de trigo. Los valores promedio en las columnas con diferentes literales difieren estadísticamente entre ellos (Tukey p≤ 0.05).
Por lo contrario, en este trabajo se demostró que el cebado con las NPs CS, aumenta los pigmentos fotosintéticos en bajas concentraciones en comparación con el control. Sin embargo, es difícil establecer un modelo de respuesta de los efectos de las NPs en los germinados ya que el efecto depende de la especie, la concentración y el tipo de NPs (Arruda et al., 2015).
Calidad nutraceútica: fenoles y flavonoides totales
La utilización de NPs CS puede actuar como agente inductor de procesos metabólicos ya que pueden incrementar el contenido de compuestos bioactivos destacado en el desarrollo y efecto estimulante de la producción de metabolitos secundarios (Xoca et al., 2017; Xoca et al., 2019; Montalvo et al., 2020).
Los resultados de la presente investigación demuestran que las variables relacionadas con la calidad nutraceútica en el germinado de triticale: fenoles y flavonoides totales son afectados por la dosis alta aplicada de las NPs CS (0.8 mg ml-1) los compuestos fenólicos disminuyeron respecto al control hasta 7% (Figura 5a), y los flavonoides aumentaron en 29% respecto al control (Figura 5b), lo que corrobora el efecto positivo de las NPs CS sobre los germinados de triticale.
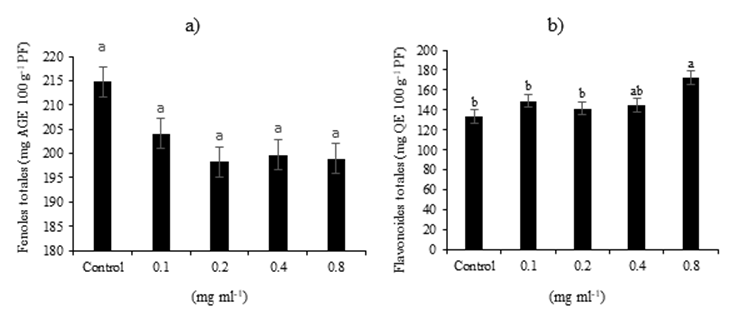
Figura 5 Efecto de NPs CS sobre el contenido de compuestos fenólicos totales (a), flavonoides totales (b) en germinados de triticale.
Dichos resultados pueden atribuirse a que las altas concentraciones de NPs CS inducen a una explosión oxidativa inicial con acumulación de peróxido de hidrógeno (H2O2) (Martínez et al., 2015), y se cree que esto puede conducir a la inducción de enzimas de defensa de las plantas y a la síntesis de metabolitos secundarios, como los polifenoles, lignina, flavonoides y fitoalexinas (Malerba y Cerana, 2016) mejorando las respuestas de defensa ante el estrés biótico y abiótico (Hidangmayum et al., 2019).
Pudiendo ser una alternativa viable para mejorar las propiedades funcionales y biológicas del germinado (Rodríguez et al., 2019); sin embargo, es difícil establecer los efectos de las NPs CS en los germinados ya que varían según la especie vegetal, las etapas de crecimiento, la dosis y a la exposición de las NPs (Medina, 2017).
Conclusiones
La aplicación de las NPs CS en germinados de triticale a dosis de 0.1 mg ml-1 afecto el peso fresco de brote, pero no el peso fresco de raíz, mientras que dosis de 0.2 mg ml-1 mostró los mejores resultados en porcentaje de vigor y contenido de pigmentos fotosintéticos, lo cual confirma que el cebado de semillas con NPs CS no provoco efectos negativos, además dosis altas de 0.8 mg ml-1 de NPs CS afectan la calidad nutraceútica aumentando el contenido de flavonoides en germinados de triticale.
Las NPs CS podrían ser una buena alternativa para mejorar la calidad de los germinados; sin embargo, se necesita más investigación para aclarar los efectos de los NPs CS ya que existen factores que dependen de la especie y la concentración.











 texto en
texto en