Introducción
El tomate (Solanum lycopersicum L.) es el fruto comestible de una planta herbácea de la familia Solanaceae, la cual incluye 3 000 especies y 90 géneros diferentes. El tomate se originó en la región andina que actualmente corresponde a parte de Chile, Bolivia, Ecuador, Colombia y Perú. Si bien, el tomate se domesticó en América, se ha sugerido que México fue la región de domesticación más probable, mientras que Perú se considera el centro de diversidad de parientes silvestres (Bai y Lindhout, 2007). El tomate tiene una gran diversidad de usos culinarios y se consume a nivel mundial. Se calcula que la producción de tomate a nivel mundial asciende a 177 millones de toneladas y se cultiva en 5 millones de hectáreas.
Entre los principales países productores de tomate esta China, India, Estados Unidos de América, Turquía y Egipto (FAOSTAT, 2016). México se ha posicionado como el décimo productor de tomate a nivel mundial aportando 2.3% a la producción mundial de la hortaliza. El tomate es el principal producto agrícola que se exporta en México y su destino comercial es Estados Unidos, que adquiere 90.1% del volumen total exportado (SIAP, 2018). Dentro de las variedades de tomate de exportación sobresalen aquellas conocidas como tomates reliquia o de herencia (heirloom).
Una característica importante de estos tomates es que no han sido cruzados, ni hibridados, por lo que conservan su sabor y textura, en comparación con los tomates híbridos, razón por la cual son demandados en el mercado de exportación (Jordan, 2007). Algunas de las variedades de tomate heirloom más comercializados son: Brandywine (BW) tomate de tamaño grande, con piel de color rosa oscuro y pulpa roja suave, de polinización abierta, indeterminado, valorado por su excelente sabor y gran tamaño (Barret et al., 2012).
Cherokee purple (CP) reliquia de Tennessee, tomate indeterminado, fruto de color rosa oscuro a púrpura, tamaño de mediano a grande, su interior multilocular varía de púrpura a marrón y verde, sabor rico, complejo y dulce (Ozores et al., 2012); striped german (SG) tomate indeterminado, fruto bicolor rojo y amarillo, de tamaño mediano a grande, con nervaduras variables, sabor afrutado y textura suave (Ozores y McAvoy, 2014). En cuanto al mercado local, la variedad Río Grande es una de las más empleadas en producción en invernadero y campo abierto en importantes estados productores a nivel nacional como lo es Sinaloa. Esta variedad se caracteriza por ser de hábito indeterminado, alto rendimiento y fruto tipo saladette (Santiago et al., 1998; García-Hernández et al., 2001).
El cultivo de tomate en el estado de Guanajuato juega un papel importante en la economía del país ya que genera de forma directa e indirecta miles de empleos al año. Sin embargo, en los últimos ciclos, la rentabilidad del cultivo ha sido seriamente amenazada por diversos factores, entre ellos los problemas fitosanitarios, que reducen los rendimientos y afectan la economía de los agricultores. Entre los problemas fitosanitarios de mayor importancia se encuentran las enfermedades causadas por hongos fitopatógenos, tal es el caso de Alternaria, agente causal del Tizón temprano (CESAVEG, 2011).
El tizón temprano en tomate, causa grandes pérdidas en el cultivo, debido a que afecta el área foliar de la planta y provoca la muerte de las hojas y que no se produzcan frutos en las áreas afectadas por el hongo (Wyenandt et al., 2006). Recientemente se ha identificado a Alternaria sp., como parte del complejo damping-off o secadera de plántulas de tomate, el cual genera pérdidas de 30% a 50% de plántulas ya establecidas (Reyes, 2017).
Para el control del tizón temprano se recurre al uso de pesticidas químicos, los cuales no sólo incrementan los gastos de producción del cultivo, sino además generan impactos negativos a la salud humana y al medio ambiente (Nesler et al., 2015). Ante este panorama, el uso productos biológicos representa una alternativa para el control de enfermedades. En este sentido, las fitocistatinas (inhibidores de cisteín proteasas) de origen natural representan una promesa para el biocontrol de hongos fitopatógenos, por ser compuestos bioactivos, amigables con el medio ambiente y que no representan un riesgo para la salud.
En las plantas, las cistatinas son inhibidores naturales y específicos de las proteasas tipo cisteín, de la familia de papaína C1A, las cuales generalmente interfieren en la actividad de estas proteasas mediante una interacción estrecha y reversible (Chu et al., 2011). A la fecha, se han propuesto varias funciones para las cistatinas en las plantas, tales como la regulación del recambio endógeno de proteínas durante los procesos de crecimiento y desarrollo, así como en la senescencia y la muerte celular programada (Díaz-Mendoza et al., 2014). También se ha documentado que las cistatinas participan en la acumulación y movilización de proteínas almacenadas en las semillas (Szewińska et al., 2016).
Otra función clave es la protección contra las plagas y enfermedades de las plantas, ya que inhiben la actividad de las cisteín proteasas que los insectos y microorganismos necesitan para su crecimiento y proliferación (Van Wik et al., 2014). En el laboratorio se aisló el gen de la cistatina de amaranto y se clonó en un vector de expresión para la producción de cistatina recombinante en Escherichia coli (Valdés-Rodríguez et al., 2007). En estudios posteriores se demostró que la cistatina de amaranto (AhCPI) inhibe el crecimiento de hongos fitopatógenos, tales como Fusarium oxysporum, Sclerotium cepivorum y Rhizoctonia solani (Valdés-Rodríguez et al., 2010). Así como hongos productores de micotoxinas como Aspergilllus parasiticus (Guzmán-de-Peña et al., 2015).
Recientemente en el laboratorio de Bioquímica y Biología Molecular de Proteínas del Cinvestav-Irapuato se demostró en ensayos in vitro que la cistatina de amaranto inhibe el crecimiento de Alternaria sp., agente causal del tizón temprano en tomate (Valdés-Rodríguez et al., 2018). En el presente trabajo se planteó evaluar el efecto de la cistatina de amaranto en la prevención y control del tizón temprano en ensayos en invernadero con diferentes variedades de jitomate.
Materiales y métodos
Preparación de suspensión de esporas de Alternaria alternata
En trabajos previos se aisló e identificó Alternaria sp., agente causal del tizón temprano en plantas de tomate (Valdés-Rodríguez et al., 2018); sin embargo, recientemente se identificó como A. alternata. El aislado purificado se creció durante 10 días en placas con medio PDA (potato dextrose agar 3.9% pH 5.6) a 28 ºC. De estos cultivos se colectaron las esporas por agitación con 10 mL de tritón al 0.01% y se contaron por observaciones al microscopio óptico (Leica Microsystems, Alemania) con el objetivo10x en una cámara Neubauer. Se prepararon diluciones con agua destilada para obtener una concentración de 1 x 105 esporas mL-1 para evaluar el efecto curativo y 6 x 105 esporas mL-1 para el efecto preventivo.
Preparación de cistatina recombinante
La cistatina recombinante se produjo con algunas modificaciones de acuerdo con el método descrito previamente (Valdés-Rodríguez et al., 2010). La cepa de E. coli productora de cistatina se creció en agitación continua a 37 °C en medio Super Broth en presencia de 100 µg mL-1 de carbenicilina y 25 µg mL-1 de kanamicina, hasta alcanzar una densidad óptica de 0.5 a 600 nm. La expresión de cistatina se indujo durante 4 h con 0.1 mM de IPTG y las bacterias recuperadas por centrifugación (12 000 rpm durante 20 min) se resuspendieron en agua desionizada estéril.
Las células bacterianas se lisaron con un sonicador (Branson Sonifier 450, USA) programado con una amplitud de onda de 40%, aplicando 10 pulsos de 30 s, con un intervalo de tiempo de 30 s entre cada pulso para evitar el calentamiento de la suspensión. Los restos celulares se eliminaron por centrifugación a 18 000 rpm durante 25 min y al sobrenadante obtenido (lisado de cistatina), se le determinó el contenido de proteína de acuerdo con el micro-método de Bradford (Bio-Rad Laboratories, USA), usando como estándar suero de albúmina bovina. Como control se preparó un lisado de E. coli, en el que no se indujo la producción de cistatina, lisado no inducido (LNI). Los lisados obtenidos se analizaron por electroforesis en geles de poliacrilamida-SDS, de acuerdo con el método de Laemmli (1970).
Condiciones de crecimiento de las plantas de tomate
En el presente trabajo se utilizaron plantas de tomate de la variedad Río Grande, así como las variedades de herencia (heirloom): Brandywine, Cherokee Purple y Striped German, las cuales fueron donadas por Agro Invernaderos Gasca SPR de RL. Las semillas germinadas en almácigos con mezcla general (tierra lama, tierra de hoja, Sunshine Mix 3, vermiculita y perlita) se trasplantaron después de 45 días a macetas de 3.5 L que contenían el mismo sustrato. Las plantas se crecieron en invernadero en la temporada otoño-invierno con una temperatura promedio de 27 °C. El riego se suministró con agua destilada de acuerdo con las necesidades de las plantas y la fertilización se llevó a cabo cada semana con Ferviafol 20-30-10 (Agroquímicos Rivas SA de CV. Celaya, Guanajuato, México).
Efecto curativo de la cistatina de amaranto sobre el desarrollo del tizón temprano en tomate
El ensayo fue un diseño experimental factorial completamente al azar, con 25 plantas (5 para cada tratamiento) de tomate variedad Río Grande de 114 días después de la siembra (dds). Para la infección, en cuatro hojas basales de las plantas se hicieron incisiones con un bisturí y se asperjaron con 1 mL de una suspensión de esporas de Alternaria alternata (1 x 105 esporas planta-1). Las plantas se cubrieron con una bolsa de polietileno para aumentar la humedad relativa.
Después de siete días de la inoculación y una vez que aparecieron los síntomas de la enfermedad, lotes de 5 plantas se asperjaron con diferentes dosis (84, 168 y 335 µg de proteína planta-1) del lisado de cistatina. Después de 21 días de la primera aspersión con cistatina, se hizo una segunda aplicación bajo las mismas condiciones. Como controles se usaron plantas asperjadas con agua y lisado celular de E. coli en el que no se indujo la producción de cistatina (LNI). Diez días después de la segunda aplicación, se evaluó de manera visual la severidad del daño causado por Alternaria de acuerdo con la escala descrita por Chaerani et al. (2007).
La severidad del daño producido por A. alternata se evaluó en todas las hojas de todas las plantas de tomate, en una escala de 0 a 5, en donde 0 representaba 0% de infección, 1: 1-10%, 2: 11-25%, 3: 26-50%, 4: 51-75% y 5: 76-100% de infección. Finalmente se consideró el valor porcentual promedio del daño observado en todas las hojas por plantas analizadas empleando la fórmula modificada de Chaerani et al. (2007).
Efecto preventivo de la cistatina de amaranto sobre la infección por Alternaria alternata
El ensayo se estableció bajo un diseño experimental factorial completamente al azar como en el ensayo anterior. En este ensayo se emplearon plántulas de tomate de 57 dds de las variedades: Brandywine, Cherokee Purple y Striped German, a las cuales se les hicieron tres aspersiones con el lisado de cistatina (335 µg de cistatina planta-1) con una periodicidad de tres y 25 días. Después de tres días de la última aplicación, las plantas se inocularon con 1 mL de una suspensión de esporas de A. alternata (6 x 105 esporas mL-1).
Las plantas se cubrieron con una bolsa de polietileno para aumentar la humedad relativa como en el ensayo curativo. Doce días después se evaluó la severidad del daño como se describió en el apartado anterior. En el ensayo se incluyeron cinco plantas por variedad para cada uno de los tratamientos. Como controles se incluyeron plantas asperjadas con agua y con el lisado de E. coli en el cual no se indujo la producción de cistatina (335 µg de proteína planta-1).
Evaluación del efecto curativo y preventivo de la cistatina en invernaderos de tomate
El efecto curativo de la cistatina de amaranto también se evaluó en Agro Invernaderos Gasca SPR de RL, ubicados en Celaya, Guanajuato, que producen y exportan las variedades: Brandywine, Cherokee Purple y Striped German. Estas plantas de tomate presentaban síntomas característicos del tizón temprano, tales como amarillamiento foliar anillos concéntricos anulares, además de áreas necróticas en el borde de las hojas.
En el invernadero se seleccionaron hileras de plantas en etapa reproductiva de cada una de las variedades antes mencionadas, distribuidas al azar. Para la variedad Brandywine se seleccionaron 9 hileras con 10 a 15 plantas cada una, para la variedad Cherokee Purple 3 hileras con 15 plantas cada una y para la variedad Striped German 2 hileras con 15 y 18 plantas cada una, las cuales se asperjaron con diferentes dosis del lisado de cistatina, cada mes durante tres meses. En el caso de la variedad Brandywine, las plantas (122) se asperjaron con 168 µg de cistatina planta-1, mientras que a las variedades Cherokee Purple (45 plantas) y Striped German (33 plantas) se aplicaron 84 y 335 µg de cistatina planta-1, respectivamente.
El efecto de la cistatina se evaluó de manera visual 10 días después de cada aplicación de cistatina y se comparó el aspecto general de las plantas tratadas con cistatina y de plantas tratadas con el control químico convencional basado en el uso de Cupravit Hidro (Bayer de México, SA de CV) en una dosis de 2 kg ha-1. El efecto preventivo de la cistatina en invernaderos de productores de tomate se evaluó bajo las mismas condiciones que el efecto curativo. En este caso, 60 plántulas de tomate de la variedad Brandywine de 60 dds fueron asperjadas con 335 µg de cistatina planta-1, 30 días después se realizó una segunda aplicación de cistatina (168 µg de cistatina planta-1). Veinte días después se evaluó de manera visual el efecto de la cistatina sobre las plantas de tomate.
Resultados y discusión
En trabajos preliminares se ha demostrado en ensayos in vitro que la cistatina de amaranto es capaz de inhibir el crecimiento y desarrollo de Alternaria sp., agente causal del tizón temprano en la zona productora de tomate en el estado de Guanajuato (Valdés-Rodríguez et al., 2018). Con base en estos resultados, en el presente trabajo se evaluó el efecto de la cistatina de amaranto en el control y prevención de esta enfermedad en ensayos de invernadero.
Cistatina recombinante
Para confirmar la presencia de cistatina en los extractos bacterianos, se realizó un análisis de electroforesis (Figura 1) en donde se observó la presencia de una banda de 28 kDa de cistatina, mientras que en el lisado celular no inducido no se percibe esta banda prominente.

Figura 1 Perfil electroforético de lisados celulares de la cepa de E. coli, productora de cistatina. Los lisados celulares se prepararon como se describe en materiales y métodos y se analizaron en geles de poliacrilamida-SDS al 12%. Carril 1, lisado celular en el que no se indujo la expresión de cistatina (4.5 µg de proteína). Lisado celular inducido 3.5 µg de proteína (carril 2) y 8.7 µg de proteína (carril3), carril 4 vacío. Marcador BenchMark Protein Ladder (Thermo Fisher Scientific Inc., Waltham, Massachusetts) (carril 5). La flecha indica la banda de Cistatina (28 kDa).
Efecto curativo de la cistatina de amaranto sobre el desarrollo del tizón temprano en tomate
Los resultados obtenidos indican que la cistatina controló el desarrollo del tizón temprano en hojas de tomate variedad Río Grande. Durante las evaluaciones de severidad del daño producido por A. alternata se observó la aparición de clorosis y necrosis en el borde de las hojas, así como anillos concéntricos de color obscuro característicos del daño por A. alternata.
No se encontraron diferencias significativas en el nivel de daño entre las plantas control asperjadas con agua y aquéllas que se trataron con el lisado no inducido, lo cual indica que el lisado bacteriano per se no produce algún tipo de protección en las plantas de tomate. Por otro lado, se encontró que conforme se aumentó la concentración de cistatina, la severidad del daño por A. alternata disminuyó, alcanzando una reducción (95%) significativa con las dosis más altas de cistatina (Figura 2).
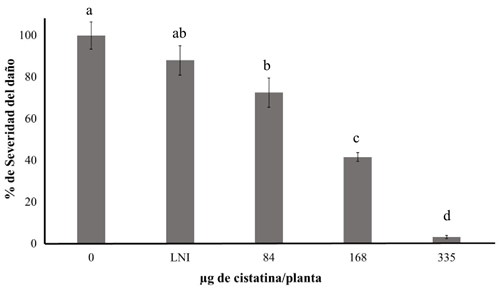
Figura 2 Severidad del daño producido por Alternaria alternata en plantas de tomate var. Río Grande tratadas con diferentes concentraciones de cistatina de amaranto. Plantas de tomate infectadas con A. alternata, se trataron con diferentes dosis del lisado de cistatina (2 aplicaciones) y después de 10 días de la última aplicación se evaluó el daño. Como controles se usaron plantas asperjadas con agua (0) y lisado celular de E. coli en el que no se indujo la producción de cistatina (LNI). Las barras sobre las columnas indican el error estándar (n= 5). Letras diferentes indican diferencias significativas entre tratamientos. Tukey (p≤ 0.05).
El efecto protector de las cistatinas frente a hongos fitopatógenos ha sido demostrado ampliamente con el uso de plantas transgénicas que sobreexpresan estos genes. Munger et al. (2012) reportaron una disminución significativa en la severidad de los daños causados por Botrytis cinerea en plantas transgénicas de papa (Solanum tuberosum) que expresaban el gen de una cistatina de maíz (CCII). Recientemente se demostró que, plantas transgénicas de tomate que expresaban el gen de una cistatina multidominio de trigo (TaMDC1) mostraron una reducción significativa del daño causado por B. cinerea y Alternaria alternata en bioensayos de hojas separadas inoculadas con los respectivos patógenos (Christova et al., 2018).
Así, también se ha reportado un efecto protector diferencial de las cistatinas cuando se evalúan en condiciones in vitro e in vivo cuando son expresadas en plantas transgénicas. Carrillo et al. (2011) reportaron que la cistatina de cebada (HvCPI-6) en ensayos in vitro mostró alta efectividad para inhibir el crecimiento de los hongos fitopatógenos Magnaporthe grisea, Plectosphaerella cucumerina y Fusarium oxysporum. Sin embargo, las plantas transgénicas de Arabidopsis que expresaban el gen de dicha cistatina (HvCPI-6) no presentaron diferencias en el daño producido por estos hongos, con respecto a las plantas control.
Hasta donde se sabe, solo existe un reporte en el que se ha aplicado directamente una cistatina para el control de enfermedades causadas por hongos. Popovic et al. (2012) reportaron que la aplicación directa de cistatina de kiwi (1.1 µg herida-1) en frutos de manzana y zanahoria, previnieron la infección y aparición de síntomas producidos por Botrytis cinerea y Alternaria radicina, respectivamente. Los resultados obtenidos en el presente trabajo indican que la aplicación de cistatina de amaranto previene y controla el desarrollo del tizón temprano en plantas de tomate.
Las plantas de tomate asperjadas con la más alta concentración de cistatina de amaranto (335 µg planta-1) redujeron 95% la severidad del daño producido por A. alternata (Figura 2). Nuestros resultados parecen ser similares a los reportado en plantas transgénicas sobreexpresantes de genes de cistatinas. Munger et al. (2012) observaron en plantas de papa transformadas con el gen de la cistatina de maíz (CCII) una reducción de 90% en la severidad del daño producido por B. cinerea, en comparación con la línea silvestre usada como control.
Efecto preventivo de la cistatina de amaranto sobre la infección por Alternaria alternata
En este ensayo plantas sanas de tomate de las variedades Brandywine, Cherokee Purple y Striped German previamente asperjadas con cistatina (335 µg planta-1) se infectaron con A. alternata. Después de 12 días se encontró que las plantas control asperjadas con agua y que posteriormente fueron infectadas con A. alternata mostraron diferente susceptibilidad a la infección. Las variedades Cherokee Purple y Striped German fueron más tolerantes a la infección por A. alternata y mostraron niveles de severidad del daño de 0.02% y 0.1%, respectivamente; mientras que la variedad Brandywine fue más susceptible con valores de 0.53% (Figura 3).

Figura 3 Severidad del daño producido por Alternaria alternata en plantas de tomate var. Brandywine, Cherokee Purple y Striped German. El daño se evaluó 12 días después de la infección en plantas de tomate asperjadas con agua y posteriormente inoculadas con A. alternata. Las barras sobre las columnas indican el error estándar (n= 9). Letras diferentes indican diferencias significativas entre tratamientos con la prueba de Tukey (p≤ 0.05).
Estos resultados coinciden con lo reportado por Smith y Kotcon (2002), quienes al evaluar la resistencia al tizón temprano en diferentes variedades de tomate tanto heirloom como híbridos comerciales, encontraron que la variedad Brandywine resultó ser de las más susceptibles ante la infección por A. alternata.
A pesar de la baja incidencia del tizón temprano, en las plantas de tomate var. Brandywine infectadas con A. alternata., se pudo observar que la aplicación de cistatina previno la aparición de los síntomas en estas plantas, comparativamente con los controles empleados en el ensayo (Figura 4). La severidad del daño fue similar entre plantas asperjadas previamente con agua y lisado celular no inducido, mientras que la aplicación de cistatina redujo significativamente la aparición de los síntomas de la enfermedad 96%. Estos resultados indican que la cistatina previno el desarrollo del tizón temprano en plantas de tomate de la variedad Brandywine.

Figura 4 Efecto preventivo de la cistina sobre el desarrollo del tizón temprano en plantas de tomate var. Brandywine. Plantas de tomate tratadas previamente con cistatina, se infectaron con A. alternata y después de 12 días se evaluó el daño. Como controles se usaron plantas asperjadas con agua (H2O) y lisado celular de E. coli en el que no se indujo la producción de cistatina (LNI). Las barras sobre las columnas indican el error estándar (n= 5). Letras diferentes indican diferencias significativas entre tratamientos de acuerdo con la prueba de Tukey (p≤ 0.05).
Efecto curativo y preventivo de la cistatina en invernaderos de productores de tomate
Estos ensayos se llevaron a cabo en Agro Invernaderos Gasca SPR de RL productores de tomate de las variedades Brandywine, Cherokee Purple y Striped German. Los resultados obtenidos sugieren que la aplicación de cistatina en plantas de tomate en invernaderos en producción también previene y controla el desarrollo del tizón temprano. Primeramente, se evaluó el efecto curativo de la cistatina en las plantas de tomate de las variedades mencionadas que presentaban síntoma de tizón temprano y que se corroboró era producido por A. alternata.
Después de tres aplicaciones de cistatina en diferentes dosis se evaluó la evolución del daño y se comparó con plantas enfermas que habían sido tratadas con un método convencional basado en el uso de sales cobre. Como se muestra en las (Figuras 5 a 7), se observó una mayor cantidad de hojas necróticas y manchas cloróticas en las plantas tratadas con el control químico convencional con respecto a las tratadas con las diferentes dosis de cistatina.
En contraste, las plantas tratadas con cistatina presentaron brotes nuevos sin síntomas de la enfermedad (verdes, sin manchas cloróticas o necróticas). Las plantas Brandywine más susceptibles al tizón temprano, mostraron un mejor aspecto con la aplicación de cistatina que con el método de control convencional, a pesar de que se aplicaron dosis intermedias de cistatina (Figura 5).

Figura 5 Planta de tomate variedad Brandywine tratada con a) control químico convencional; y b) con cistatina (168 µg planta-1).
En la variedad Cherokee Purple, las plantas tratadas con cistatina presentaron menos hojas necróticas comparadas con las plantas tratadas con el control químico convencional a pesar de que en estas plantas la concentración de cistatina fue menor con respecto a las plantas de la variedad Brandywine (Figura 6).

Figura 6 Planta de tomate variedad Cherokee Purple tratada con a) control químico convencional; y b) con cistatina (84 µg planta-1).
En cuanto a la variedad Striped German, las plantas tratadas con cistatina presentaron mayor número de hojas sanas (sin áreas necróticas ni cloróticas) comparadas con las plantas tratadas con el control químico convencional (Figura 7).

Figura 7 Planta de tomate variedad Striped German tratada con a) control químico convencional; y b) con cistatina (335 µg planta-1).
Con respecto al ensayo de efecto preventivo de la cistatina, se observó que dos aplicaciones de cistatina a plantas sanas de la variedad Brandywine fueron suficientes para prevenir la aparición del tizón temprano que afectó al resto de las plantas en el invernadero. En las plantas tratadas con cistatina las hojas no presentaron bordes necróticos comparadas con las plantas tratadas con el control químico convencional (Figura 8).

Figura 8 Planta de tomate variedad Brandywine tratada con a) control químico convencional; y b) con cistatina de amaranto (335 µg planta-1).
Los resultados obtenidos plantean la posibilidad de utilizar la cistatina de amaranto en la prevención y control del tizón temprano en tomate. Hasta el momento no existen reportes del uso de fitocistatinas de manera directa para prevenir o controlar enfermedades causadas por hongos fitopatógenos. Aunque todavía se requiere hacer análisis a mayor escala del efecto de la cistatina en tomate, así como explorar la posibilidad de utilizarla para el control de otras enfermedades fúngicas que afectan otros cultivos de importancia agronómica, los resultados obtenidos sugieren su uso potencial en el control de enfermedades, con la ventaja que la cistatina al ser un producto biológico se degrada, no contamina, ni representa ningún riesgo potencial para la salud.
Conclusiones
Los resultados demostraron que la cistatina de amaranto puede prevenir y controlar el desarrollo del tizón temprano en plantas de tomate infectadas con A. alternata. Aunque la dosis a utilizar dependerá de la susceptibilidad de la variedad al ataque del patógeno. Estos resultados son muy promisorios ya que demuestran el potencial biotecnológico de la cistatina de amaranto, el cual puede ser utilizado para el biocontrol de hongos fitopatógenos que afectan a los cultivos.











 texto en
texto en 


