Introducción
La salinidad del suelo es el principal factor abiótico limitante en la productividad de los cultivos agrícolas especialmente en las regiones áridas y semiáridas debido a las bajas precipitaciones, altas temperaturas y alta evapotranspiración, además de las malas prácticas de manejo de suelo y agua (Munns y Tester, 2008). Alrededor de 20% del área total cultivable se ve afectada por este factor con un incremento del 1 a 2% anual por altas concentraciones de sales (Munns y Tester, 2008; Plaut et al., 2013; Rizwan et al., 2015).
La salinidad afecta el crecimiento de la planta al asociarse con bajo potencial osmótico de la solución del suelo (estrés hídrico), estrés iónico y desequilibrio nutricional (Munns y Tester, 2008; Parvaiz y Satyawati, 2008; Horie et al., 2012). Altas concentraciones de iones tóxicos como Na+ y Cl- forman un desequilibrio iónico en la célula de la planta, afectan los procesos fisiológicos y enzimáticos ocasionando alteraciones en el metabolismo y disminuyen la absorción de iones esenciales como K+ y Ca2+ (Hajiboland et al., 2010).
El estrés salino afecta principalmente el proceso de la fotosíntesis perjudicando el aparato fotosintético. No solo afecta la apertura y cierre de estomas, sino que también disminuye la asimilación de CO2 (Mehta et al., 2010; Ashraf y Harris, 2013; Gupta y Huang, 2014). Además, daña los pigmentos fotosintéticos incluidos la clorofila y los carotenoides y el área foliar (Brugnoli y Lauteri, 1991; Gong et al., 2005). Por otro lado, una respuesta inmediata de la planta cuando está expuesta a elevadas concentraciones de salinidad es el cierre estomático (Tang et al., 2015).
Si bien, el cierre estomático implica una reducción de la fijación de CO2, bajo condiciones de fluorescencia puede producir sobreexcitación de los centros de reacción del fotosistema II (PSII) (Ahmed et al., 2009; Ashraf y Harris, 2013). Asimismo, cuando las plantas están afectadas por altas concentraciones de salinidad, deterioran el complejo y los centros de reacción del PSII (Naumann et al., 2010). De tal manera que estudiar el impacto de estrés abiótico como la salinidad, sequia, bajas y/o altas temperaturas en la eficiencia fotosintética de la planta, es a través de la medición de la fluorescencia de la clorofila (Zobayed et al., 2005) y el intercambio gaseoso en las hojas (Shahid et al., 2011; Li et al., 2015).
La fluorescencia de la clorofila es una medida no destructiva de manejo sencillo y respuesta inmediata. Este método proporciona información sobre la identidad de varios pigmentos, su estructura y reacciones de transferencias de electrones específicas del PSII (Ashraf y Harris, 2013).
Hattori et al. (2005) encontraron una mayor tasa fotosintética, transpiración, conductancia estomática, mayor tamaño de estomas en plantas de sorgo (Sorghum bicolor L.) cultivadas bajo condiciones de estrés salino cuando fueron tratadas con Si, en comparación a plantas que no recibieron Si. Resultados similares se encontraron en cultivares de maíz (Zea mays) (Parveen y Ashraf, 2010) y en plantas de okra (Albemoschus esculentus) (Abbas et al., 2015).
Por otro lado, Chen et al. (2011) reportaron un incremento en la eficiencia fotoquímica del PSII, tasa fotosintética y tasa de transpiración en plantas de arroz (Oryza sativa L.) fertilizadas con Si en condiciones de estrés salino. Por su parte, Wang et al. (2015) encontraron una mayor tasa fotosintética y transpiración, contenido de agua en las hojas y conductancia hidráulica de la raíz en plantas de pepino fertilizadas con Si en condiciones de salinidad. Resultados semejantes han sido reportados por Shi et al. (2016) en plantas de tomate. Todos estos investigadores concluyeron que el Si aplicado a los cultivos, indujo una disminución de Na+ y un incremento en la concentración de K+ en las hojas.
El Si es el segundo elemento mineral más abundante en el suelo después del oxígeno y forma 31% de la corteza terrestre (Gong et al., 2006; Epstein, 2009). En la solución del suelo se encuentra en forma de ácido monosilícico (H4SiO4) en concentraciones que van 0.1 a 0.6 mM (Epstein, 1999; Ma y Yamaji, 2008). El H4SiO4 es absorbido por las plantas y se transporta en la planta a través del xilema (Epstein, 1999; Kazunori y Ma, 2003). Posteriormente se deposita en la pared celular como sílice amorfa (SiO2 nH2O) interactuando con pectinas y calcio mejorando su rigidez y resistencia (Epstein, 1999; Ma, 2004; Ma y Yamaji, 2008).
Las plantas contienen Si en concentraciones de 0.1 a 10% peso seco (Ma y Yamaji, 2008). El Si actúa como una barrera física y mecánica en las plantas. No solo se deposita en las paredes celulares, sino que también participa en las actividades metabólicas y fisiológicas cuando las plantas están en condiciones de estrés (Ma, 2004; Liang et al., 2007). Aunque, el Si no se considera un elemento esencial para el crecimiento y metabolismo de las plantas, es benéfico en condiciones estresantes (Liang et al., 2007; Ma y Yamaji, 2008; Epstein, 2009; Kaur et al., 2016). Algunos autores han reportado tolerancia a la salinidad mediante la fertilización de Si en diferentes cultivos como arroz, trigo (Triticum durum), tomate, pepino, cebada (Hordeum vulgare L.).
La mayor parte de Si se deposita en las células epidérmicas de las raíces, hojas y tallos aminorando la absorción de Na+ por las raíces, el Si disminuye la permeabilidad de las membranas celulares al Na+, resultando en un bajo nivel de Na+ y alto nivel de K+ en el citosol (Gong et al., 2006). La función del Si reduce la absorción de Na+ disminuyendo la transpiración en arroz (Yeo et al., 1999; Gong et al., 2006), mejora el estado hídrico del tomate (Romero-Aranda et al., 2006), incrementa la actividad enzimática antioxidante en pepino (Zhu et al., 2004) y aumenta la actividad de la H+ ATPasa de la membrana plasmática en la cebada (Liang et al., 2006). El objetivo de este estudio fue determinar el efecto de la nutrición con Si en tomate cultivado bajo condiciones de estrés salino inducido con NaCl o con solución nutritiva estándar (SNS), sobre la temperatura de las hojas, la eficiencia fotoquímica y la conductancia estomática.
Materiales y métodos
Establecimiento del experimento y condiciones ambientales
El experimento se realizó en el campo experimental del Instituto de Ciencias Agrícolas de la Universidad Autónoma de Baja California ubicado en el Ejido Nuevo León, Mexicali en el periodo comprendido de marzo a junio de 2017. Se utilizó un invernadero de cubierta con techo de policarbonato de baja tecnología, sin control de temperatura y sin calefacción. Se utilizó el cultivar de tomate Amalia tipo saladette. El trasplante se realizó el día 31 de marzo utilizando dos plantas por macetas de 9 L. El sustrato empleado fue arena corriente de arroyo con granulometría menor a 0.5 cm. La aplicación de la solución nutritiva fue a través de riego presurizado tipo espagueti con gasto por gotero de 100 mL min-1. Se dieron entre uno y tres riegos por día. El drenaje de los riegos se ajustó a 30%.
Diseño experimental
El diseño experimental utilizado fue de parcelas divididas distribuidas al azar con cinco repeticiones. La parcela principal fueron dos condiciones de salinidad a valor de 4 dS m-1 (SNS y solución salina inducida con NaCl) y las subparcelas fueron dosis de Si (0, 4, 8 g L-1 de SiO2), para un total de doce tratamientos. Como fuente de Si se utilizó dióxido de silicio 94% (Diatomix, Bio Agrinor®, Zapopan, Jalisco México). Cada parcela principal estuvo compuesta por 12 plantas, mientras que la subparcela fue de 4 plantas.
Manejo de los tratamientos
La SNS utilizada fue la recomendada por Gómez y Sánchez (2003) y en ella se manejaron las siguientes concentraciones de nutrientes N 224, P 47, K 281, Ca 212, Mg 65, Fe 2, Mn 0.55, Zn 0.33, Cu 0.05, B 0.28 y Mo 0.05 mg L-1. Al momento del trasplante a todas las parcelas se les aplicó una SNS suficientemente diluida en agua hasta alcanzar a una conductividad eléctrica de 2 dS m-1.
Posteriormente a los 15 días después del trasplante se inició la aplicación de los tratamientos. Para el factor uno, en las parcelas del tratamiento SNS, se realizó un incremento gradual por dos días en la concentración de los macro y micronutrientes hasta alcanzar un valor de salinidad de 4 dS m-1. Lo mismo sucedió en el tratamiento salinidad con NaCl. El incremento en la salinidad de la solución se logró al agregar además de la SNS a una conductividad eléctrica de 2.0 dS m-1, la cantidad de ≈2.6 g L-1 de NaCl y alcanzar el valor de 4 dS m-1. Por otro lado, las dosis de Si se aplicaron diariamente a cada maceta en forma manual a las 12:00 del mediodía.
El pH de la solución nutritiva se mantuvo entre 5.5-6.0 unidades. Durante el tiempo que duró el experimento, la humedad relativa del invernadero se consiguió mojando el piso con agua corriente a las 10:00 y 14:00 h. La temperatura máxima dentro del invernadero a las 15 h del día alcanzó los 45 ºC y la humedad relativa a esa misma hora fue de 14.5% y fueron monitoreadas usando un termohigrómetro digital CEM DT-172 (Twin Light Instruments, Monterrey, México) colocado a 20 cm justo por encima de las plantas.
Variables evaluadas
Las variables fisiológicas evaluadas fueron temperatura foliar, eficiencia fotoquímica y conductancia estomática. Las mediciones se realizaron a los 34 días después del trasplante a las 9:00, 11:00, 13:00, 15:00 y 17:00 h del día. Para todas las variables se utilizó como referencia la cuarta o quinta hoja contabilizada del ápice hacia abajo. Todas las mediciones se realizaron sobre tres plantas por tratamiento previamente etiquetadas.
Temperatura foliar
La temperatura foliar se determinó con un termómetro digital infrarrojo de pistola láser (DAN-tronics modelo P045440, México). Las mediciones se realizaron a una distancia de 20 cm entre el sensor y la hoja.
Eficiencia fotoquímica
La eficiencia fotoquímica máxima del PSII (Fv/Fm), fluorescencia mínima (Fo) y fluorescencia máxima (Fm) se determinó con un fluorómetro portátil (Chlorophyll Fluorometer OS-30p, OPTI-SCIENCE, USA) usando una intensidad de luz actínica de 2100 µmol fotón m-2 s-1 de intensidad por un periodo de 2 s. Previo a la determinación, las hojas fueron aclimatadas por 30 min de oscuridad con pinzas de exclusión de luz para asegurar que todos los centros de reacción estuvieran abiertos (González et al., 2008).
Resultados y discusión
Temperatura de la hoja
No se identificó una respuesta en la temperatura de las hojas del cultivo de tomate por la interacción Si × S (p> 0.05) (Cuadro 1). Asimismo, la adición de Si tampoco mostró algún efecto significativo sobre la temperatura de las hojas en todos los tratamientos (p> 0.05). Sin embargo, los tratamientos de salinidad sí mostraron respuesta al incremento de temperatura de las hojas (p˂ 0.05). A las 9:00 h del día, la aplicación de NaCl, incrementó en más de 2 °C la temperatura de la hoja que las plantas tratadas con salinidad inducida por SNS, mientras que a las 13:00 y 17:00 h en efecto se invirtió.
Cuadro 1 Efecto de la aplicación de Si en dos formas de salinidad (SNS y NaCl) sobre la temperatura de la hoja de tomate hidropónico.
Factor |
9:00 h |
11:00 h |
13:00 h |
15:00 h |
17:00 h |
Temperatura (°C) | |||||
Silicio (Si) |
|
|
|
|
|
0 |
31.8 |
34.76 |
38.38 |
36.74 |
35.79 |
4 |
31.59 |
34.85 |
38.3 |
36.72 |
35.67 |
8 |
31.33 |
34.91 |
38.35 |
36.64 |
35.7 |
Probabilidad |
0.72 |
0.938 |
0.718 |
0.954 |
0.537 |
Salinidad (S) |
|
|
|
|
|
SNS 4 dS m-1 |
30.43 |
34.62 |
39.84 |
36.82 |
35.92 |
NaCl 4 dS m-1 |
32.71 |
35.06 |
36.85 |
36.58 |
35.51 |
Probabilidad |
< 0.001 |
0.212 |
< 0.001 |
0.414 |
< 0.001 |
Si × S probabilidad |
0.79 |
0.775 |
0.594 |
0.963 |
0.95 |
En este sentido, las plantas sometidas a salinidad inducida por la SNS tuvieron la capacidad de mantenerse más frescas por la mañana debido a una mayor disponibilidad de agua o mejor traspiración (Shahenshah e Isoda, 2010); sin embargo, por la tarde las plantas con NaCl se mantuvieron más frescas que las salinizadas con SNS. Lo anterior, sucede cuando el cultivo es sometido a estrés hídrico por falta de agua en el sustrato o por un escaso sistema radicular (Sánchez-Blanco et al., 2014). En cualquiera de los casos, en este estudio la salinidad restringió la conductancia estomática y en consecuencia la temperatura foliar se incrementó (Ben-Asher et al., 2006).
Eficiencia fotoquímica máxima del PSII (Fv/Fm)
En el Cuadro 2 se muestran los resultados de eficiencia fotoquímica máxima del PSII (Fv/Fm) por efecto de la aplicación de Si y dos formas de salinidad. La interacción Si × S fue significativa entre las 11:00 y las 15:00 h (p≤ 0.004). A ese mismo horario, la aplicación de Si tuvo efecto significativo sobre la Fv/Fm de las hojas de las plantas de tomate (p≤ 0.005). Durante todo el día, la salinidad causada por la SNS afectó significativamente la Fv/Fm (p≤ 0.001) manteniendo valores más altos que con la salinidad provocada por NaCl.
Cuadro 2 Efecto de la aplicación de Si en dos formas de salinidad (SNS y NaCl) sobre la eficiencia fotoquímica máxima del PSII (Fv/Fm) en hojas de tomate hidropónico.
Factor |
9:00 h |
11:00 h |
13:00 h |
15:00 h |
17:00 h |
Fv/Fm | |||||
Silicio (Si) |
|
|
|
|
|
0 |
0.75 |
0.741 |
0.672 |
0.749 |
0.734 |
4 |
0.742 |
0.714 |
0.713 |
0.726 |
0.729 |
8 |
0.741 |
0.683 |
0.624 |
0.695 |
0.727 |
Probabilidad |
0.364 |
˂ 0.001 |
0.002 |
0.005 |
0.615 |
Salinidad (S) |
|
|
|
|
|
SNS 4 dS m-1 |
0.821 |
0.797 |
0.745 |
0.795 |
0.815 |
NaCl 4 dS m-1 |
0.667 |
0.628 |
0.595 |
0.652 |
0.646 |
Probabilidad |
˂ 0.001 |
˂ 0.001 |
˂ 0.001 |
˂ 0.001 |
˂ 0.001 |
Si × S probabilidad |
0.146 |
˂ 0.001 |
˂ 0.001 |
˂ 0.004 |
0.134 |
La reducción en los valores de Fv/Fm en las plantas sometidas a salinidad con NaCl, indicaría una reducción en la eficiencia fotoquímica del PSII y una perturbación o daños en el aparato fotosintético causado por la salinidad específica del NaCl y no por la provocada por la SNS (Jiménez-Suancha et al., 2015). El efecto interactivo Si × S a las 11, 13 y 15:00 h, estuvo caracterizado por valores altos de la Fv/Fm al utilizar la dosis mayor de Si (Figura 1). A las 11:00 h, no se encontró diferencia entre el tipo de salinidad cuando no se aplicó Si. Sin embargo, conforme se utilizó Si la diferencia en la Fv/Fm fue menor en la salinidad inducida por NaCl. A las 13:00 h se repitió el mismo efecto, pero solo con la dosis mayor de Si [(8 g) (Figura 1b)]. Así mismo, a las 15:00 h (Figura 1c) el efecto del Si a dosis de 4 y 8 g fue el mismo que durante la mañana del día.
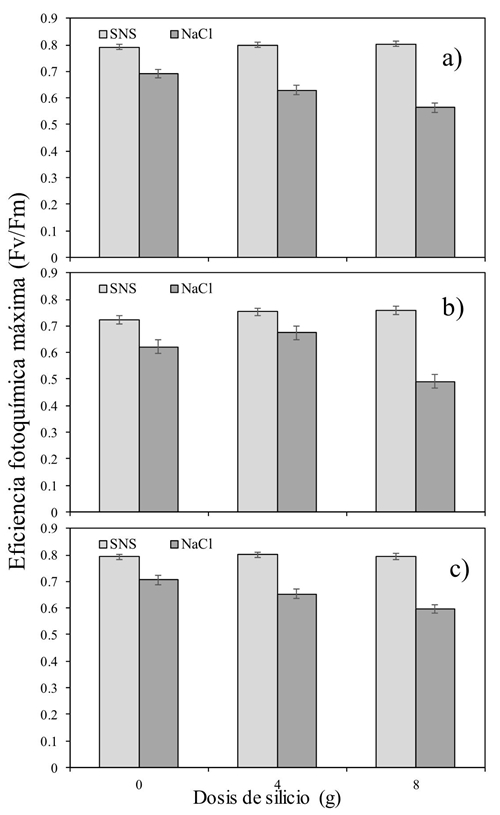
Figura 1 Efecto interactivo silicio versus salinidad (Si × S) en la eficiencia fotoquímica máxima del cultivo de tomate durante el día [a) 11:00 h; b) 13:00 h; y c) 15:00 h].
De manera general, los valores menores de Fv/Fm se encontraron a dosis mayores de Si, sobretodo en el tratamiento de salinidad inducida por NaCl. Estos resultados concuerdan con aquellos reportados por Cao et al. (2015), quienes al aplicar Si a plántulas de tomate sometidas a estrés salino, encontraron que conforme el tiempo avanzaba, los valores de Fv/Fm resultaban menores que aquellos obtenidos en plantas sin adición de Si.
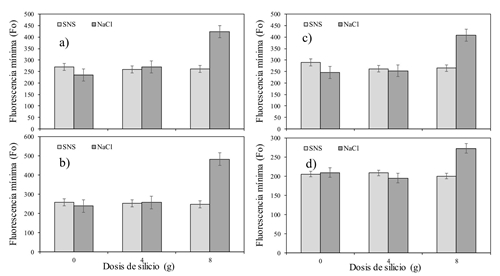
Fluorescencia mínima (Fo)
En el Cuadro 3, se observa el efecto de la aplicación de Si y el tipo de S sobre la Fo en hojas del cultivo de tomate. Se encontró un efecto significativo en la interacción entre Si × S en la mayor parte del día (p˂ 0.001). La dosis mayor de Si (8 g) aplicada a la solución con NaCl fue la que qué hizo la diferencia del resto de los tratamientos (Figura 2). Posiblemente la combinación de la dosis alta y el NaCl provocó dicha reacción. Valores altos de Fo significan daños en el centro de reacción del PSII o una reducción de la capacidad para transferir la energía de excitación de la antena hacia el centro de reacción (Baker, 2008; Khan et al., 2016). Datos contradictorios son los reportados por Maghsoudi et al. (2015) quienes estudiaron la Fo sobre la aplicación de Si en trigo sometido a estrés hídrico. Ellos explican que el estrés provocado por la falta de agua disminuyó los valores de Fo.
Cuadro 3 Efecto de la aplicación de Si en dos formas de salinidad (SNS y NaCl) sobre la fluorescencia mínima (Fo) en hojas de tomate hidropónico.
Factor |
9:00 h |
11:00 h |
13:00 h |
15:00 h |
17:00 h |
Fo | |||||
Silicio (Si) |
|
|
|
|
|
0 |
252.7 |
248.1 |
267.6 |
225.7 |
208 |
4 |
264.2 |
255.1 |
257.5 |
229.5 |
202 |
8 |
342.4 |
364.9 |
336.5 |
226 |
236.6 |
Probabilidad |
˂ 0.001 |
˂ 0.001 |
0.003 |
0.913 |
0.007 |
Salinidad (S) |
|
|
|
|
|
SNS 4 dS m-1 |
263.5 |
252.7 |
272 |
225.2 |
205 |
NaCl 4 dS m-1 |
309.3 |
326 |
302.3 |
229 |
226.1 |
Probabilidad |
0.019 |
0.004 |
0.094 |
0.651 |
0.02 |
Si × S probabilidad |
˂ 0.001 |
˂ 0.001 |
˂ 0.001 |
0.409 |
˂ 0.001 |
Fluorescencia máxima (Fm)
Se observaron diferencias significativas en el factor Si y en la interacción Si × S, sobre la Fm en los horarios de 9:00 y 15:00 h (p˂ 0.05) (Cuadro 4). Adicionalmente la salinidad provocada por la adición de NaCl incrementó los valores de Fm reflejo en la reducción de ‘cierre’ de los centros de reacción del PSII (González et al., 2008), lo que a su vez implica una mayor activación de las reacciones fotoquímicas (Jiménez-Suancha et al., 2015). Lo anterior, refuerza la hipótesis de que el daño por salinidad presentado en los cultivos es resultado de la utilización del NaCl más que por una solución nutritiva balanceada (SNS).
Cuadro 4 Efecto de la aplicación de Si en dos formas de salinidad (SNS y NaCl) sobre la fluorescencia máxima (Fm) en hojas de tomate hidropónico.
Factor |
9:00 h |
11:00 h |
13:00 h |
15:00 h |
17:00 h |
Fm | |||||
Silicio (Si) |
|
|
|
|
|
0 |
1335.9 |
1155.3 |
1057.4 |
1010.1 |
1089 |
4 |
1298.7 |
1099.8 |
966.7 |
914.1 |
1037.9 |
8 |
1440.8 |
1172.8 |
956.2 |
1043.6 |
1067.5 |
Probabilidad |
0.016 |
0.278 |
0.083 |
0.003 |
0.687 |
Salinidad (S) |
|
|
|
|
|
SNS 4 dS m-1 |
1472.3 |
1257.6 |
1099.3 |
1122.5 |
1114.4 |
NaCl 4 dS m-1 |
1244.7 |
1027.7 |
1087.3 |
856 |
1015.2 |
Probabilidad |
˂ 0.001 |
˂ 0.001 |
˂ 0.001 |
˂ 0.001 |
0.053 |
Si × S probabilidad |
0.007 |
0.392 |
0.088 |
0.003 |
0.221 |
Conductancia estomática (gs)
El Cuadro 5 muestra la interacción Si × S a la gs (p˂ 0.037) al final del día. La Figura 3c, indica que cuando se aplicó NaCl sin Si, se incrementó la gs mientras que la salinidad producida por la SNS mantuvo bajos valores de gs aún al aplicar Si. Por otra parte, el Si disminuyó significativamente la gs a las 9:00 h. Mientras que la salinidad provocada por la adición de NaCl, la incrementó a las 9:00 y 17:00 h en alrededor de 120 mmol m-2 s-1. Contrario a este estudio, Savvas et al. (2009) encontraron que la fertilización con Si promovió un incremento en la gs en plantas de calabacín (Cucurbita pepo L. cv. ‘Rival’) cuando fueron sometidas a una salinidad de 6.2 dS m-1, con NaCl. Por su parte, Romero-Aranda et al. (2006) no encontraron diferencias en la gs de plántulas de tomate cuando aplicaron diferentes combinaciones de NaCl y Si en soluciones nutritivas Hoagland a la aplicación de Si. Sin embargo, cuando las plantas cultivadas bajo salinidad (NaCl) fueron tratadas con Si, el contenido de agua en ellas incrementó en 40%.
Cuadro 5 Efecto de la aplicación de Si en dos formas de salinidad (SNS y NaCl) sobre la conductancia estomática (gs) en hojas de tomate hidropónico.
Factor |
9:00 h |
11:00 h |
13:00 h |
15:00 h |
17:00 h |
(mmol m-2 s-1) | |||||
Silicio (Si) |
|
|
|
|
|
0 |
810.2 |
915.2 |
953 |
873.4 |
796.8 |
4 |
794.7 |
912 |
967.9 |
948.2 |
703.4 |
8 |
640.5 |
833.3 |
991.6 |
887.1 |
732.4 |
Probabilidad |
0.002 |
0.5 |
0.617 |
0.307 |
0.237 |
Salinidad (S) |
|
|
|
|
|
SNS 4 dS m-1 |
679.9 |
828.5 |
966.7 |
864.3 |
681.1 |
NaCl 4 dS m-1 |
817 |
945.2 |
975 |
941.5 |
807.4 |
Probabilidad |
0.002 |
0.081 |
0.798 |
0.076 |
0.01 |
Si × S probabilidad |
0.712 |
0.539 |
0.793 |
0.07 |
0.037 |
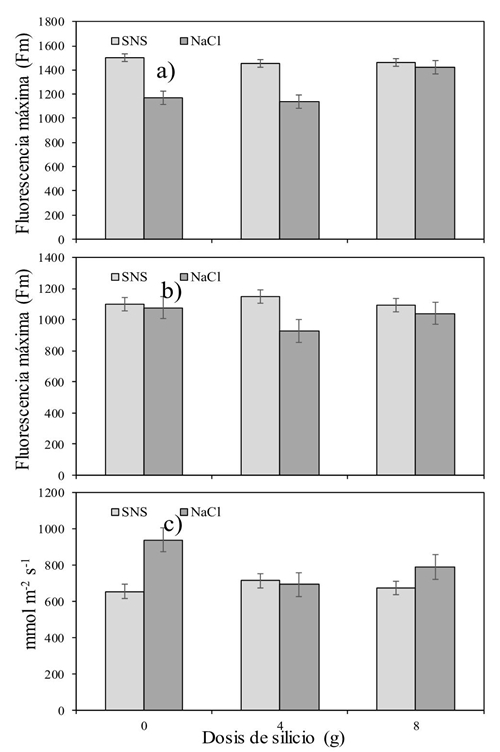
Figura 3 Efecto interactivo silicio versus salinidad (Si × S) en la fluorescencia máxima de la clorofila (Fm). a): 9:00 h; b) 15:00 h] y la conductancia estomática; y c) 17:00 h] del tomate.
La presente investigación mostró la respuesta de la planta al dos tipos de salinidad y la aplicación de Si. El uso de salinidad inducida por la SNS resultó en un incremento de la Fv/Fm expresada como luz absorbida por el PSII solo temprano y tarde del día. Este comportamiento fue el resultado valores altos en la Fo y valores bajos en la Fm provocados por el NaCl. Zribi et al., (2008) encontró resultados similares a los de este trabajo. Mencionan que existe una relación entre el uso de NaCl y la concentración de Na+ en el tejido foliar de plantas de tomate. La presencia de Na+ en el tejido foliar repercute negativamente en la cantidad de transporte de electrones, así como en la eficiencia fotoquímica del PSII.
El comportamiento de la gs tuvo la misma respuesta al tipo de salinidad que la Fo. Romero-Aranda et al. (2006) presentaron valores similares a los encontrados en este estudio, pero sin deferencia por la salinidad ni la adición de Si. En estudios subsecuentes, se deberá estudiar a más detalle el papel del NaCl y el aumento en el gs, debido a que los resultados en este estudio no permiten obtener una respuesta clara papel de este tipo de sal. Lo mismo, deberá suceder con la respuesta de la temperatura foliar a este tipo de salinidad.
El Si no logró afectar positivamente la temperatura de la hoja y la mayor parte del día afectó negativamente la Fv/Fm. El efecto interactivo del Si y el tipo de sal dejó en claro que la dosis de 8 g maceta-1 día-1, perjudicó la Fv/Fm en lugar de ayudarla (Figura 1). Algo similar sucedió con la variable Fo. La cual se incrementó al utilizar la combinación de Si a dosis de 8g y la salinidad inducida por el NaCl. Caso contrario al medir la Fm (Figura 3a y b). Más estudios serán necesarios, pero utilizando dosis menores a las planteadas en este experimento, además de considerar un periodo más prolongado de tiempo al estudiado. Con ello podría ser posible encontrar resultados más concluyentes.
Conclusiones
La eficiencia fotoquímica máxima fue mayor en la SNS y se afectó negativamente con el incremento de la dosis de Si en el tratamiento con NaCl.
La fluorescencia mínima no se modificó con la aplicación de Si en la SNS, pero en el tratamiento con NaCl se incrementó con la dosis mayor de Si.
La fluorescencia máxima resultó mayor en el tratamiento con SNS, mientras que en el tratamiento NaCl fue menor sobre todo en la dosis 0 y 4 g Si maceta-1 día-1.
A hora temprana, la conductancia estomática resultó menor conforme se incrementó la dosis de Si. Además, temprano y tarde del día, las plantas con NaCl presentaron los mayores valores que la SNS.











 texto en
texto en