Introducción
La familia Turdidae, perteneciente al orden Paseriforme, está conformada por más de 300 especies de aves, de características homogéneas, omnívoras, predominantemente diurnas entre residentes y migratorias, con distribución cuasi cosmopolita, siendo África y Eurasia los sitios con mayor diversidad seguidos por América del sur (Meller, 2013). Los recursos tróficos, así como la captura y consumo de éstos normalizan la coexistencia de los organismos (Bó et al., 2007). En aves la morfología parece estar evolutivamente asociada con la selección del hábitat, permitiendo en algunos casos conocer los mecanismos de segregación entre diversos gremios (Hernández et al., 2017).
En algunas especies de aves insectívoras, las variaciones en la disponibilidad de alimento parecen estar relacionadas con los patrones fenológicos migratorios que realizan hacia los trópicos, por lo que la estructura, conformación, distribución y ecología trófica de las comunidades avifaunísticas fluctúan estacionalmente (Michalski et al., 2011). La distribución vertical y horizontal de algunas comunidades entomológicas están influenciadas por la fisonomía vegetal existente (Wen et al., 2016).
Siendo los insectos alimento de múltiples depredadores, entre ellos las aves, mismas que han adquirido técnicas de cacería que van desde el vuelo, hasta la excavación mediante la utilización del pico (Norris y Martin, 2012) para optimizar su alimentación, algunas especies han utilizado la partición de recursos para poder coexistir (Lovette y Hochachka, 2006). Se han realizado estudios relacionados con aspectos tróficos y dietas en aves como el de Quilarque et al. (2010); sin embargo, no relacionaron las técnicas de cacería con patrones morfológicos para explicar el consumo de presas.
México alberga siete géneros y 26 especies de aves de la Familia Turdidae (Navarro y Gordillo, 2006) distribuidas desde selvas hasta ecosistemas áridos y semiáridos, particularmente bosques templados; sin embargo, sus bosques presentan diversos procesos de degradación ecológica, mismos que alteran los patrones en la distribución, abundancia y composición de especies (Almazán-Núñez et al., 2009).
Un importante remanente de bosque de Pinus cembroides (Zucc.) se distribuye en el área natural protegida peña alta (ANPPA), la cual no está exenta de perturbaciones de diversa índole que influyen en la dinámica y fisonomía vegetal de sus rodales forestales, eliminando enemigos naturales de algunos insectos provocando su proliferación, incluso convirtiéndolos en especies perjudiciales y plagas, alterando con ello, patrones en los diversos niveles tróficos del sistema (Badii y Abreu, 2006).
El ANPPA sostiene 134 especies de aves (IEEG, 2002) de las cuales la familia Turdidae está representada por cuatro especies: Catharus guttatus, Sialia mexicana, Sialia sialis y Turdus migratorius, mismas que son de vital importancia puesto que influyen directa e indirectamente en el mantenimiento del equilibrio ecológico, incorporándose y regulando diversos flujos de energía del sistema; sin embargo, dichas especies adquieren relevancia por ser de hábitos alimenticios frugívoro-insectívoro (Flores y Galindo-González, 2004) ya que ayudan a la dispersión de semillas y propagación vegetativa, así como al control biológico de insectos.
A pesar de su valor comercial, recreativo, ético, estético, científico, aportación a la estructura de los ecosistemas, eficiencia como indicadoras biológicas y específicamente el rol ecológico que desempeñan en el área de estudio asociado a su potencial amplitud trófica, es aún desconocido en bosques que exhiben diferentes condiciones de apertura de dosel resultado de diversos eventos de perturbación. El objetivo de la investigación fue determinar patrones del espectro trófico de aves insectívoras Turdidae considerando técnicas de alimentación y componentes entomológicos registrados en las dietas asociados a sus características morfológicas (grasa corporal, estructura, cráneo y pico) en un bosque de P. cembroides bajo dos condiciones de perturbación aparente en su apertura de dosel: semiconservado (BPS; en 85%) y perturbado (BPP; con 55%) del ANPPA.
Materiales y métodos
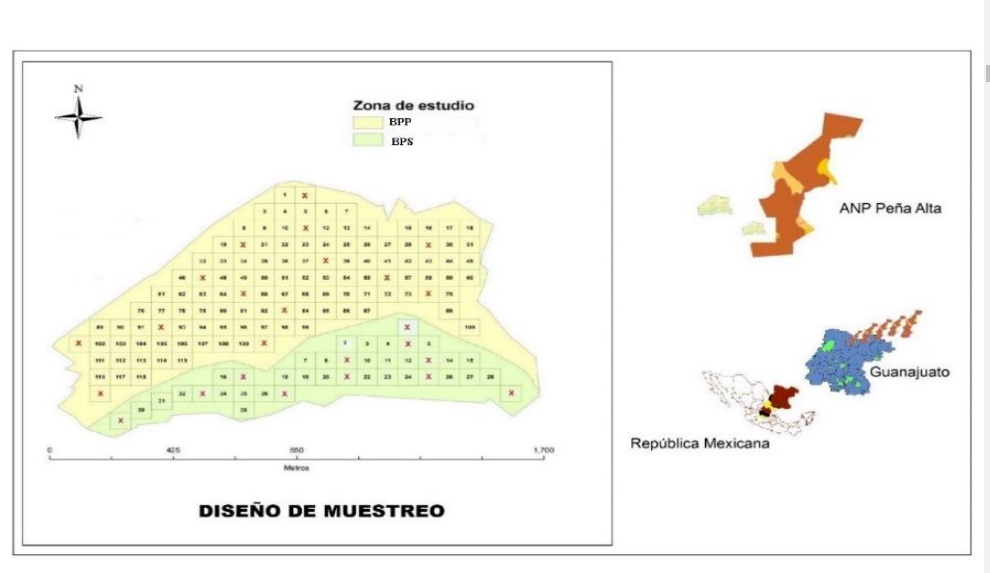
El bosque de P. cembroides (Zucc; Rzedowski, 2006) bajo estudio se localiza en la parte sur del ANPPA, en las coordenadas 21º 27’ 30.6” latitud norte y 100º 59’ 6.5” latitud oeste, entre las cotas de los 2 147 a 2 332 msnm (IEEG, 2002) en donde se eligieron dos condiciones de perturbación aparente en su apertura de dosel: BPS con 35.48 y BPP con 82.01 ha.
El diseño de muestreo implementado fue el sistemático con elección aleatoria de las unidades de elección (UEl’s); Cochran (1977), estableciéndose 11 (BPS) y 14 (BPP) UEL’s de 0.5 ha cada una, con el objetivo de obtener el número promedio de aves e insectos que son presa en cada una de ellas (Figura 1).
Las variables se registraron mensualmente durante enero a octubre de 2014, excepto la vegetación solo en: enero, mayo y septiembre; los esquemas de seguimiento se establecieron en base al diseño de muestreo y en periodos de un día para cada condición, ejecutándose paralelamente uno de otro. Las variables del hábitat se registraron con línea de Canfield en función de su longitud de ocupación porcentual sobre cada línea (Canfield, 1941).
El seguimiento de la vegetación arbórea usando cuadrantes con punto central (Cottam y Curtis, 1956) y arbustivas con Cuadros Empotrados (Oosting, 1956). La identificación de especies vegetales se realizó en el herbario ‘CHAP’ de la Universidad Autónoma Chapingo (UACH). El registro de insectos con corte y sacudida de ramas (Schowalter, 1994), obteniendo muestras entomológicas del follaje en donde las aves exhibían alguna técnica de alimentación (Johnson et al., 2005) mismas que se identificaron en el Colegio de Postgraduados y la UACH, en donde se obtuvo una colección de referencia de presas (Gámez-Virués et al., 2007).
Las técnicas de alimentación (Remsen y Robinson, 1990) y componentes entomológicos en las dietas (Rosenberg y Cooper, 1990) de Turdidae en ambas condiciones (BPS y BPP) fueron obtenidos mediante: A) Recuento en puntos con radio fijo de 25 m con búsqueda intensiva (mixto; Ralph et al., 1996), usando binoculares de 25 x 50 m (Bushnell) y B). Captura por redes de niebla mediante esfuerzo constante (Hutto et al., 1986), conteniendo físicamente al ave para registrar su morfometría y obtener su excreta por estrés fisiológico, misma que se colocó en alcohol 70% (Whitaker, 1988). En ambos casos, la identificación se realizó con guías de campo para aves de México y Norteamérica.
Se implementaron de manera paralela por ser complementarios e incrementar la probabilidad de detección en aves que son quietas, silenciosas y conspicuas, disminuyendo el sesgo en su identificación a través del canto, dado que pudieron ser buscadas y ubicadas visualmente (Karr, 1981).
La preferencia con que las aves ocurrieron en ambas condiciones para: técnicas de alimentación, uso y estructuras de sustratos insectos que conforman sus dietas (excretas, a nivel de orden, familia) se estimó con el índice de frecuencia de observación (Fo), Antúnez-Ruiz et al. (2016), modificado para la presente en cada caso de análisis, graficándose comparativamente en Microsoft Excel (2016).
Diferencias en las frecuencias de aves registradas para ambas condiciones por: técnicas de alimentación, uso y estructuras de sustratos, morfología de las aves, componentes entomológicos registrados con corte y sacudida de ramas (tallas) e insectos que conforman sus dietas (excretas, tipo), fueron determinadas con Kruskal-Wallis (Zar, 1999) en JMP IN v.14.0.1 (2018). La asociación gráfica, en ambas condiciones, entre las aves y sustratos de alimentación, tipos y familias de insectos consumidos, su morfología, se estableció mediante análisis de correspondencias múltiples para datos categóricos (ACM; Greenacre, 2002) en Xlstat v.2018.5 (Addinsoft, 2018).
La riqueza, diversidad y similitud entomológicas promedio registradas en las dietas de las aves, para Ambas condiciones, se estimó analizando los órdenes (asumidos como especies) de insectos registrados por muestreo mediante Jacknife de primer orden (Jacknife1), Shannon-Wiener, Jaccard, respectivamente (Magurran, 2004) empleando EstimateS 9.1.0 (2018) y Microsoft Excel (2016).
Para inferir si la proporción de aves es la misma en Ambas condiciones para: técnicas de alimentación, uso y estructuras de sustratos, su morfología, componentes entomológicos (tallas, tipos) que conforman sus dietas, se desarrollaron pruebas de χ2 (Agresti et al., 1990) en JMP IN v.14.0.1 (2018).
Diferencias graficas en la riqueza entomológica (considerando a las familias como especies) registrada en las dietas de aves, para ambas condiciones, fueron determinadas mediante análisis Clúster considerando la distancia Euclidiana (Hair et al., 1999) en Xlstat v.2018.5 (Addinsoft, 2018).
La asociación, en ambas condiciones, entre las variables (Y): aves (observadas), insectos (corte y sacudida de ramas), aves capturadas y las variables de la vegetación (xi) se infirió con regresión Poisson, usando modelos lineales generalizados, procedimiento de selección de variables y el criterio Akaike (AIC) González-Oreja (2003) en R v.3.5.1 (R, 2018). En todos los análisis se utilizó (= 0.05.
Resultados y discusión
Las Fo exhiben gráficamente las tendencias en las preferencias porcentuales con que las aves Turdidae ocurrieron en cada una de las variables de interés para ambas condiciones (Figura 2).
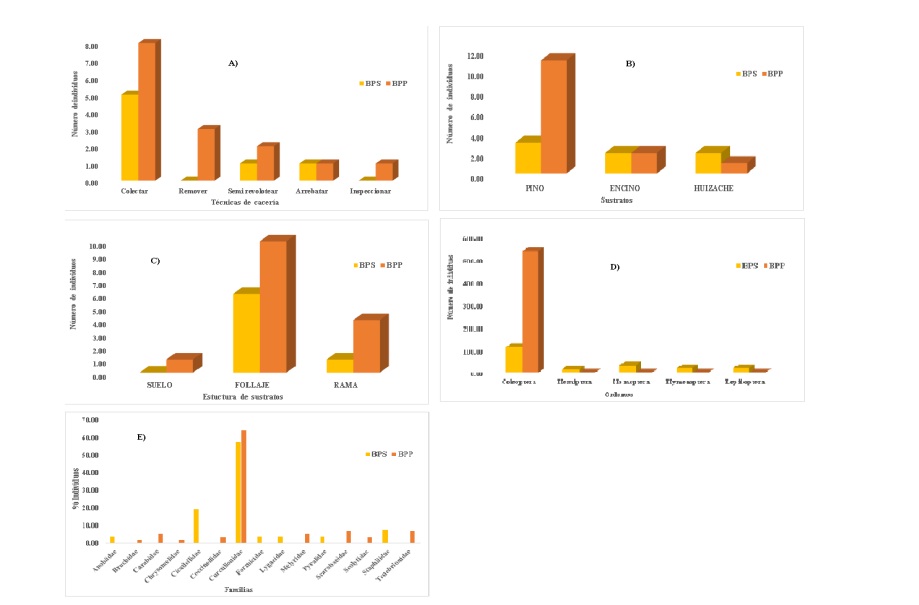
Figura 2 Fo de: A) técnicas de alimentación; B) uso; C) estructuras de sustratos, insectos que conforman sus dietas excretas; D) orden; y E) familia, para ambas condiciones del ANPPA.
Los Kruskal-Wallis permiten evidenciar que no existen diferencias significativas en cada una de las variables de interés, por lo cual, no se rechaza Ho: B1= B2, a un nivel de significancia de (= 0.05 (Cuadro 1) por lo que se concluye que estas son similares en cada caso para ambas condiciones.
Cuadro 1 Resultados de Kruskal-Wallis para ambas condiciones del ANPPA.
| Análisis | Ji cuadrada | Grados de libertad | Prob> Ji cuadrado |
| Técnicas de alimentación | 0.9136 | 1 | 0.3392 |
| Uso | 0.0119 | 1 | 0.0931 |
| Estructuras de sustratos | 0.3923 | 1 | 0.5311 |
| Morfología de aves | 0.0528 | 1 | 0.8182 |
| Tallas de insectos | 0 | 1 | 1 |
| Tipos de insectos | 0.75 | 1 | 0.3865 |
Los ACM muestran asociación gráfica entre las variables bajo estudio (las dos primeras dimensiones, dan cuenta de la inercia total), se puede evidenciar la conformación de grupos bien definidos en cada una las variables de interés para cada caso de análisis en ambas condiciones (Figura 3).
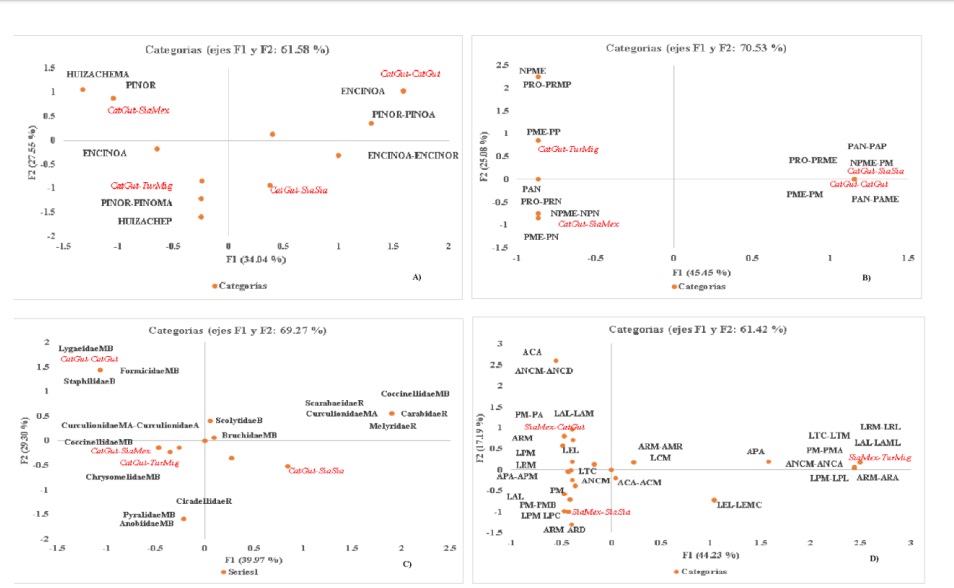
Figura 3 Representación gráfica del ACM, muestra la asociación entre las aves. A) sustratos de alimentación; B) tipos; C) familias de insectos consumidos; y D) su morfología, para ambas condiciones del ANPPA. Códigos para sustratos: poco (P); regular (R); alto (A); muy alto (MA); tipos de insectos= nada (N); muy poco (MP); medio (Me); mucho (M); medio. Siglas= plaga (P); no plaga (NP); predador (Pr); parásito (PA); familias de insectos: nulo (N); muy bajo (MB); bajo (B); regular (R); alto (A); muy alto (MA); morfología: peso (P); longitud del ala (LA); longitud envergadura (LE); longitud total (LT); ancho cuerpo (AC); longitud del pico (LP); ancho de pico (AP). Aves: Catharus guttatus (CatGut), Sialia mexicana (SiaMex), Sialia sialis (SiaSia) y Turdus migratorius (TurMig). Existen combinaciones de categorías.
El estimador de Jacknife1para ambas condiciones mostró que el número promedio de especies (órdenes entomológicos) exhibe un incremento en la curva de rarefacción. Shannon-Wiener presentó un valor de diversidad entomológica (órdenes de insectos) promedio de H’= 1.8, se pueden apreciar diferencias entre BPS y BPP. Jaccard evidencia una similitud de 36% (Figura 4).
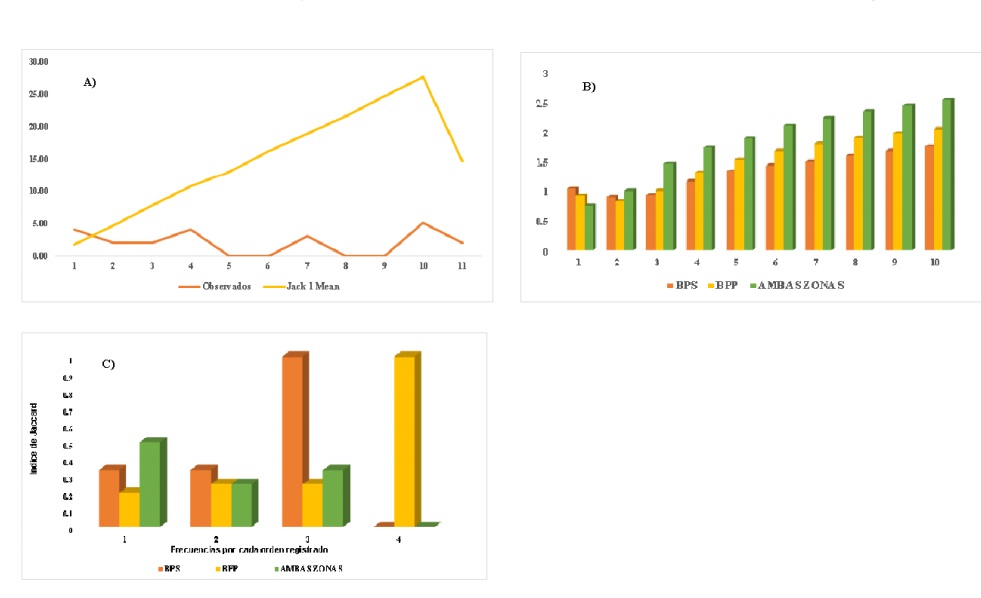
Figura 4 Resultados. A) Jacknife1; B) Shannon-Wiener; y C) Jaccard para órdenes entomológicos (asumidos como especies) registrados por muestreo para ambas condiciones del ANPPA.
Las χ2 sugieren que los valores obtenidos fueron menores a los valores de contraste, lo que sugiere que la proporción de individuos registrados para aves Turdidae son estadísticamente diferentes; es decir, los valores observados son diferentes a los esperados para cada variable de interés (Cuadro 2).
Cuadro 2 Resultados de χ2 para Ambas condiciones del ANPPA.
| Análisis | N | gl | R2 (U) | Ji2 (Pearson) | Prov> ji2 (Pearson) | χ2 de tablas (Pearson) |
| Técnicas de alimentación | 22 | 5 | 0.1143 | 4.268 | 0.5091 | 11.0705 |
| Uso | 10 | 4 | 0.1586 | 3.333 | 0.5037 | 9.4877 |
| Estructuras de sustratos | 12 | 4 | 0.1452 | 3.143 | 0.5342 | 9.4877 |
| Morfología | 22 | 21 | 0.2242 | 22 | 0.3995 | 32.6706 |
| Tallas de insectos | 8 | 7 | 0.3333 | 8 | 0.3326 | 14.0671 |
| Tipos de insectos | 8 | 7 | 0.3333 | 8 | 0.3326 | 14.0671 |
Los Clúster muestran el dendograma resultante de la clasificación para familias de insectos (concebidas como especies) registradas en las dietas de aves, mismo que evidencia la conformación de varias amalgamaciones, nótese la rotura de escala en el eje de disimilitud (Figura 5).
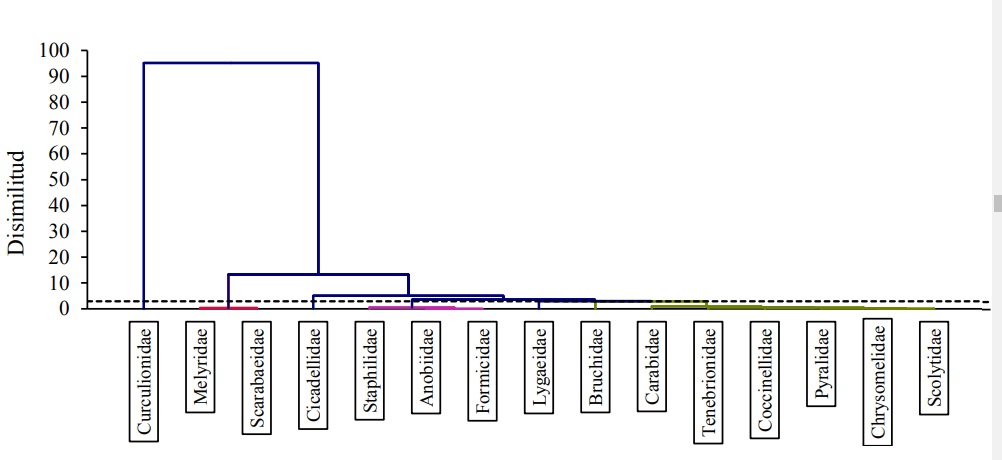
Figura 5 Clasificación para familias (especies) de insectos registradas en las dietas de Turdidae, realizado sobre la matriz de similitud de su incidencia para ambas condiciones del ANPPA.
Los ARP (Cuadro 3) muestran algunas variables (xi) de la vegetación que tuvieron cierto efecto (en términos de coeficientes estadísticamente significativos) sobre cada (Y) de interés, para cada caso de análisis; con su respectivo AIC, el cual denotó el mejor ajuste del GLM en cada uno de ellos.
Cuadro 3 Resultados del ARP mediante modelos GLM para Ambas condiciones del ANPPA.
| Coefficients | Estimate | Std. error | z value | Pr(>|z|) |
Frecuencias de las aves Turdidae (observación) | ||||
| (Intercept) | 0.77259 | 0.20268 | 3.812 | 0.000138 |
| Alth | 1.56871 | 0.58951 | 2.661 | 0.00779 |
| Coba1 | 2.54733 | 0.49874 | 5.108 | 3.26E-07 |
| Coba2 | -1.22492 | 0.45211 | -2.709 | 0.006742 |
| Cuadrante | -0.23797 | 0.07795 | -3.053 | 0.002267 |
Núm. de individuos de insectos (corte y sacudida de ramas) | ||||
| (Intercept) | -2.186819 | 1.007184 | -2.171 | 0.02991 |
| Altfustelimpio | 0.055407 | 0.026445 | 2.095 | 0.03616 |
| Coba2 | 26.206683 | 2.929844 | 8.945 | < 2e-16 |
| Cobar1 | -0.109207 | 0.024039 | -4.543 | 5.55E-06 |
| Cobar2 | 0.192335 | 0.021393 | 8.99 | < 2e-16 |
| Cobh1 | -25.088683 | 4.809564 | -5.216 | 1.82E-07 |
| Cobh2 | 57.820814 | 5.635687 | 10.26 | < 2e-16 |
| Diama | -55.573266 | 4.779572 | -11.627 | < 2e-16 |
| Dist | 0.096708 | 0.014878 | 6.5 | 8.02E-11 |
| Fecha | -0.258311 | 0.051035 | -5.061 | 4.16E-07 |
| N. indveg | -1.600049 | 0.136182 | -11.749 | < 2e-16 |
| No. ramas | 0.052769 | 0.010491 | 5.03 | 4.91E-07 |
| Punto | -0.007282 | 0.001678 | -4.341 | 1.42E-05 |
| (%) hojasnuevasxrama | 0.034107 | 0.012639 | 2.699 | 0.00696 |
| (%) hojasviejasxrama | 0.055981 | 0.014076 | 3.977 | 6.98E-05 |
Núm. de individuos de aves Turdidae por sexo | ||||
| (Intercept) | 1.827685 | 0.146741 | 12.455 | < 2e-16 |
| Coba2 | 0.896276 | 0.281814 | 3.18 | 0.00147 |
| (%) hojasnuevasxrama | -0.018168 | 0.002475 | -7.342 | 2.11E-13 |
| (%) hojasviejasxrama | -0.018109 | 0.003359 | -5.392 | 6.97E-08 |
Núm. de individuos de aves Turdidae por edades | ||||
| (Intercept) | 1.482553 | 0.142001 | 10.44 | < 2e-16 |
| Coba2 | 1.041351 | 0.220541 | 4.722 | 2.3376E-06 |
| Punto | 0.005679 | 0.001869 | 3.039 | 0.00238 |
| (%) hojasnuevasxrama | 0.019117 | 0.002121 | -9.012 | < 2e-16 |
| (%) hojasviejasxrama | 0.016094 | 0.002746 | -5.86 | 4.62E-09 |
Núm. de individuos de aves Turdidae por condición corporal o grasa | ||||
| (Intercept) | 1.77935 | 0.160919 | 11.057 | < 2e-16 |
| Alta | 0.963289 | 0.370774 | 2.598 | 0.00938 |
| (%) hojasnuevasxrama | -0.018845 | 0.00268 | -7.032 | 2.04E-12 |
| (%) hojasviejasxrama | -0.019644 | 0.002969 | -6.617 | 3.66E-11 |
Nota= coeficientes (p< 0.05) de los ARP, obtenidos mediante un logaritmo como función de vínculo entre Y y xi; con AIC= 364.14, 1894.2, 305.45, 507.46, 319.12, respectivamente.
Las tendencias en la abundancia pueden estar asociadas a la disponibilidad de recursos alimenticios y fisonomía vegetal, específicamente en los planos vertical y horizontal, mismos que aparentemente son diferentes (a nivel de dosel) en las condiciones evaluadas, a lo cual MacArthur y Levins (1964) señalan que dichos factores condicionan el establecimiento de diversas comunidades y gremios tróficos faunísticos debido a los recursos que proporcionan; particularmente a las aves insectívoras; incluso Murdoch et al. (1972) han evidenciado una estrecha relación entre la diversidad de Homópteros, la cantidad de estratos y la composición florística.
Sin embargo, la condición de apertura en el dosel pareció no tener un efecto sobre estas, según Arguedas y Céspedes (2014) dichas aves pueden establecerse en este tipo de sistemas en función de las presas disponibles para su consumo, pese a la presión antrópica que ciertos bosques reciben, tal como lo sugieren los registros de aves para la presente, cuyas tendencias son similares a las registradas en ambientes adversos, como lo reportan Almazán-Núñez et al. (2009) para bosque de pino-encino a diferentes condiciones sucesión ecológica, esto soporta la idea planteada por Platt et al. (1984) quienes señalan que la abundancia suele utilizarse para hacer interpretaciones ecológicas del estado que guardan los ecosistemas ya que es más sensible a distorsiones ambientales, incluso que la riqueza de especies por sí sola, por lo cual, esta podría potencialmente ser afectada positiva o negativamente, en función del grado de perturbación o disturbio que dicho sistema exhiba, así en la presente, las sinonimias en dicho estimador pudieron deberse a lo reportado por Stiles (1978) quien menciona que la complejidad estructural y la composición florística determinan los sustratos de forrajeo, así como la disponibilidad de alimento, específicamente en áreas con diferentes gradientes de perturbación, las cuales según Lambert (1992) son más preferidas por especies oportunistas y generalistas.
Los registros para comportamientos alimenticios mostraron que las aves evaluadas pueden coexistir, debido a que de manera gregaria o solitaria, durante su alimentación utilizan varias técnicas de captura de presas sobre los diferentes sustratos vegetales, de esta manera, Fandiño et al. (2010) señalan que dicho grupo taxonómico realiza una adecuada partición de recursos, lo que les permite disminuir la segregación trófica; así, las estrategias para su conservación en las condiciones analizadas deberán centrarse al mejoramiento de hábitat, promoviendo un mayor número de nichos de alimentación.
Sainz-Borgo (2015) sugiere contemplar la conducta alimenticia de la avifauna y su ocurrencia sobre la vegetación. Esto es imperativo, ya que la disponibilidad de estratos vegetales influye sobre la presencia de ciertas larvas e insectos presa y por ende sobre la etología trófica de las aves. En este sentido, la altura a la que se alimentaron dichas Turdidae determinó la distribución de sus presas y consecuentemente el despliegue de sus técnicas de alimentación, como lo mencionan Latta y Wunderle (1998) encontrando que algunas especies de avifaunísticas se alimentan en transiciones de ciertos estratos y sustratos, por lo que dichos factores permiten la separación de nichos ecológicos, tal como lo reporta Nocedal (1984) quien manifiesta que dicha utilización en bosques templados es selectiva a diferentes estructuras de diversos sustratos, incluyendo el dosel (follaje), lugar desde donde las especies estudiadas ubicaron a sus presas y definieron qué técnica de alimentación exhibir.
En este contexto, Ostrand (1999) soporta que éstas eventualmente forman grupos de alimentación que funcionan como indicadores catalíticos; es decir, muestran a otras especies la ubicación de áreas con alta densidad de presas, mismas que atraen a diversos depredadores que interactúan entre si, estableciendo estrategias de alimentación que les permite asegurar su permanencia y desplazar tróficamente a otras que no son capaces de competir por el mismo recurso. Esto concuerda con Mills (1998) quien menciona que dicha conducta explica el reclutamiento visual mediante el cual, los individuos que emplean técnicas prolongadas de alimentación atraen a otros por lo que dicho gregarismo, según Guariguata y Kattan (2002) promueve el establecimiento de gremios que demandan recursos semejantes, esto explica parte de la coexistencia trófica en las aves evaluadas.
Las técnicas de alimentación exhibidas parecen estar asociadas a la morfología que presentaron las aves analizadas, lo cual es explicado por Chávez et al. (2012) quienes sugieren que la morfometría del pico y patas son determinantes para la adquisición de presas, de igual forma Pyke et al. (1977) puntualizan que los depredadores evitan un gasto energético excesivo al obtener presas cercanas que les reditúen la energía suficiente para sus funciones fisiológicas vitales. De esta manera, las técnicas de alimentación registradas en la presente son similares a lo reportado por Adamík y Korňan (2004) quienes señalan que en algunas aves, el comportamiento trófico más común es el de colectar.
En contraste, Somasundaram y Vijayan (2008) sugieren que otras no necesariamente insectívoras, sostienen dietas más versátiles, lo que explica una menor utilización de otras técnicas para nichos tróficos más específicos, mismas que les permiten establecerse durante casi todo el año, debido a que estacional y fenológicamente pueden obtener diversas larvas e insectos, sobre y debajo de los sustratos, empleando diversas técnicas de alimentación, con lo que disminuyen las interacciones ecológicas negativas, promoviendo su coexistencia alimentaria.
Los sustratos y sus estructuras más utilizadas en la presente por las aves evidenciaron que estas coexisten debido a que presentan una asociación con diversos sustratos de alimentación; sin embargo, esto parece responder a la dominancia de pináceas, conducta alimenticia y morfometría de las aves, mismas que proveen algunas ventajas para aprovechar nichos tróficos específicos, esto es soportado por Becerra y Grigera (2005) quienes reportan la utilización de diversos sustratos basados en su disponibilidad, mismos que les proveen de alimento durante todo el año. La plasticidad trófica exhibida por estas aves mostró cómo optimizaron su ecología trófica en función de la utilización de distintos sustratos y estructuras de ellos portadores de alimento, ajustando sus técnicas de cacería; no obstante, el sustrato más empleado parece responder de manera similar a lo reportado por Somasundaram y Vijayan (2008) quienes aseguran que este nicho trófico, no solo les provee de alimento, sino que además les brinda protección y cobertura.
Sin embargo, Lešo y Kropil (2007) señalan que en otras regiones existen sustratos y estructuras que les pueden brindar recursos entomológicos en mayor cantidad y mejor calidad energética, los sustratos registrados juegan un papel estacionalmente preponderante sobre las técnicas de alimentación registradas; debido a que les proporcionó, de manera gregaria, mayor número de presas energéticamente más redituables y de diferente tipo como lo sugieren Albrecht y Gotelli (2001), lo que explica la presencia de aves especialistas y generalistas en la utilización de hábitats perturbados.
Las tendencias en el consumo de insectos por talla y tipo coinciden parcialmente con lo publicado por Rosas-Espinoza et al. (2008) quienes señalan que algunas especies de aves consumen insectos perjudiciales o posiblemente considerados plagas forestales, por lo que coadyuvan en su control biológico vía depredación; es imperativo señalar que los registros de insectos en las dietas de Turdidae para la presente, podrían ser explicados considerando los procesos fisiológicos de digestión de cada especie y el tiempo de consumo previo a la obtención de las excretas y su relación con el tipo y tamaño de presas consumidas, por lo que la presencia de estas aves en el ANPPA tiene un efecto controlador de ciertas poblaciones de insectos plaga como lo sugiere Gámez-Virués et al. (2007).
La condición de las aves evidenció un uso diferencial en la procuración de recursos alimenticios, técnicas de alimentación, consumo y aprovechamiento de insectos entre sexos; es decir, sus estructuras morfológicas estuvieron adaptadas a los taxas y tamaños de los insectos que consumieron, por lo que evolutivamente el pico es la adaptación clave en el consumo de presas, ligeras variaciones en sus dimensiones influyen en la tasa de ingestión, al igual que el tipo y longitud de las patas, determinan el consumo de diversos recursos alimenticios sobre variados sustratos como lo sugiere Montaldo (2005) sobre morfometría de aves y su relación con el consumo de alimento.
Dichos patrones han sido demostrados en aves frugívoras; en las que la morfología del pico y otras estructuras dependen del tamaño, forma, textura y tipo de alimento consumido y viceversa, por ello, los resultados de la presente soportan lo señalado por Levey y Stiles (1994) quienes señalan que dichas estructuras son adaptaciones clave, por lo que su tamaño, forma y fortaleza afectará su dieta, como sucedió en este estudio entre la morfología de aves y el consumo de insectos de diversas tallas.
El estrés fisiológico de las plantas pudo incrementar la presencia de aminoácidos y por ende la proliferación de insectos plaga, mismos que progresivamente diezman la densidad foliar, favoreciendo la apertura del follaje y la penetración de la luz, provocando un incremento en los sustratos vegetales disponibles para insectos fitófagos, aunado a ello, las fluctuaciones diurnas en temperatura ejercen efecto en la dinámica de insectos (son poiquilotermos) por lo tanto, en las aves insectívoras. Los insectos en la presente dependieron de diversos eventos del ANPPA determinados por su estructura y composición florística, como lo indican Medianero et al. (2003) basados en principios sobre diversidad, estructura y microclimas para insectos.
Conclusiones
Las técnicas de alimentación, uso y estructuras de sustratos utilizados por las Turdidae fueron diferenciales. Los componentes entomológicos que conforman sus dietas y la morfometría fueron semejantes. Existe efecto de algunas variables de la vegetación sobre los insectos y aves. Se determinaron patrones de su coexistencia trófica en dos condiciones de apertura del dosel del ANPP, específicamente el papel de la perturbación sobre el dosel en la presencia de insectos presas, dicha avifauna resulta relevante ya que dentro de su espectro trófico consumen insectos perjudícales y plaga, coadyuvando en el control biológico ciertos grupos entomológicos forestalmente indeseables.











 texto em
texto em