Introducción
La caña de azúcar (Saccaharum officinarum) es un cultivo afectado por varias especies de insectos plaga, entre las que destaca el salivazo o mosca pinta (Aeneolamia albofasciata) (Lallemand, 1939) (Hemiptera: Cercopidae) que se alimenta de las láminas foliares y provoca una fitotoxemia llamada quema de las hojas con la consecuente disminución de la capacidad fotosintética (Badilla 2002; Alatorre-Rosas y Hernández-Rosas, 2015).
La respuesta a estos ataques del insecto requiere un mecanismo integrado donde las señales internas y externas de la planta detectan y ocasionan una reacción apropiada en la planta (Stepanova et al., 2005). El insecto en estado de ninfa y adulto se caracteriza por tener un estilete que inserta en la lámina foliar para alimentarse, lo que provoca daño celular con la fractura inter e intracelular (daño mecánico) que induce estrés biótico (Ammar et al., 2013).
Cuando el daño mecánico es ocasionado por el insecto, la planta es capaz de poner en marcha diferentes mecanismos de defensa, cuyo objetivo es detener, aminorar o contrarrestar la infección provocada por el mismo. Existe la defensa de barrera estructural la cual consiste en la deposición de lignina como refuerzo de los tejidos que sufren daño físico y la formación de papilas en las células de la epidermis, que están compuestas por calosa (β-1,3-glucano), que buscan prevenir la penetración de patógenos (Skalamera et al., 1997).
La calosa se expresa en respuesta al daño mecánico o por invasión de patógenos en la hoja de las plantas. Es un polisacárido de origen vegetal y un elemento sumamente importante para reparar sitios con heridas mecánicas en las plantas. La calosa se produce en la pared celular a partir de enzimas llamadas calosa sintasa y esta puede ser degradada por la acción de β-1,3-glucanasas (Arcos y Narro, 2009).
Las reacciones más rápidas de defensa de las plantas al ataque de patógenos es la llamada explosión oxidativa, que induce la producción de ERO, principalmente superóxido y peróxido de hidrógeno (H2O2) en el sitio de invasión (Apostol et al., 1989). Por lo tanto, cuando los hemípteros producen una herida mecánica por la inserción de su estilete durante su alimentación, inducen un aumento en los niveles de peróxido de hidrógeno dentro de la planta, que está asociada con la ráfaga de oxígeno provocada por patógenos al momento de penetrar por dicha fractura celular (Bi y Felton, 1995; Bradley et al., 1992).
Los niveles de ERO afectan diversos procesos incluyendo el desarrollo, la respuesta hipersensible al ataque de patógenos y la respuesta al estrés (Mittler y Berkowitz, 2001; Tsukagoshi et al., 2010). Los cambios en los niveles de ERO se reconocen como firmas específicas de las plantas en respuesta a estrés biótico y abiótico (Swanson y Gilroy, 2010; Wolf et al., 2014). Esta respuesta de la planta fortifica su pared celular y protege contra el daño mecánico del insecto, donde la principal función consiste en transducir los estímulos extracelulares reconocidos por los receptores de la célula a un gran número de moléculas blanco (Ichimura et al., 2002).
Esto puede servir como un interruptor que regula la función de proteínas y vías de señalización redox en respuesta a estrés por daño o invasión de microorganismos (Corcoran y Cotter, 2013). Por lo tanto, la respuesta de la planta no es suficiente y el daño mecánico continúa debido a la succión constante de la savia mediante el estilete que se puede extender durante periodos largos de parte del adulto de mosca pinta, esto puede ocasionar la desnutrición de la hoja de la planta y la invasión de oportunistas al colonizar la zona afectada del cultivo (Gutiérrez, 2001).Estos procesos de defensa se han estudiado en diversos modelos, algunos en cítricos donde estudian el daño causado por el estilete de las ninfas de Diaphorina citri, que es el sitio de alimentación (Ammar et al., 2013). En el caso de las gramíneas existen estudios en maíz donde se observó la acumulación de calosa por presencia de aluminio debido a la exposición que tienen las raíces a dicho elemento que les induce la expresión de un daño (Arcos y Narro, 2009).
En el caso de la caña de azúcar no se habia observado la respuesta de defensa de la planta ante el daño mecánico ocasionado por el estilete de la mosca pinta. En este trabajo, se evaluó a nivel tisular la respuesta en el sitio de infección durante el ataque del insecto, el desencadenamiento de ERO y calosa a partir del daño ocasionado por adultos de mosca pinta sobre la lámina foliar de la hoja de caña de azúcar. Para ello, se emplearon técnicas de microscopia de luz transmitida, fluorescencia y confocal que permitieron visualizar las zonas afectadas y la reacción de ERO y calosa expresadas en zondas fluorescentes.
Materiales y métodos
Insectos, material vegetal, condiciones de infección
Se utilizó la especie de mosca pinta Aeneolamia albofasciata y plántulas de caña de azúcar variedad CP 72-2086. Los insectos fueron colectados en la zona de abasto del Ingenio Central El Potrero en el estado de Veracruz. El material vegetal fue obtenido de vitroplantas de la empresa VitroMotz, con un promedio de edad de 4 meses, libres de plagas y enfermedades. El material vegetal fue colocado junto con los adultos de mosca pinta, durante 5 días, dentro de cajas de plástico transparentes con ventanas de malla antiáfidos, para evitar que se introdujeran insectos no objetivo y promover la alimentación del insecto causando el daño mecánico en la lámina foliar.
Identificación del daño físico
Para la selección de muestras se observaron las zonas afectadas por daño mecánico con un microscopio de disección (Marca Nikon®) y se cortó el tejido delimitando la zona dañada. Estas zonas presentaron la sintomatología característica por afectación de adultos de mosca pinta.
Cortes histológicos
Para conocer el daño físico causado por el estilete de la mosca pinta en la hoja de caña se siguió la metodología descrita por Vázquez y Echeverría (2000). Ésta describe las etapas de preparación del material biológico vegetal para el estudio de microscopía óptica; fijación, deshidratación, inclusión, corte y contraste.
Tinción de calosa
El material vegetal expuesto a la alimentación de los insectos fue revisado y se seleccionaron partes del tejido dañado para ser tratado con una solución de azul de anilina fluorocromo Biosupplies® que reacciona con el (1-3) β Glucanos de la calosa. Se preparó la solución del colorante en agua destilada (1 mg en 10 ml) (p/v). Se incubaron las secciones de tejido a analizar (tejido fresco) con la solución de anilina fluorocromo (50 µL/sección) durante 45 min a 20 °C. Se lavaron las muestras con agua destilada y se examinaron por microscopía de fluorescencia con un microscopio invertido TE300 (Nikon®, Japón) acoplado a una fuente de iluminación de xenón (DG-4, Sutter Instruments®, Novato, CA, EE.UU.) y un obturador Uniblitz® (Vincent Associates, Rochester, Nueva York, EE.UU.). El análisis de la imagen y la cuantificación del nivel de fluorescencia se realizaron con el software ImageJ.
Tinción de ERO
El material vegetal expuesto a la alimentación de los insectos fue revisado y seleccionado por partes del tejido dañado para ser tratado con una solución de CM-H2DCFDA Molecular Probes® que se difunde pasivamente en las células.
Para la preparación del colorante se tomaron 25 µl de colorante CM-H2DCFDA más 25 µl de DMSO (Dimetthyl Sulfoxide, anhydrous, 99.9%) y se le agregaron 80 µl de medio Fahraeus (Fahraeus, 1957), se homogenizó la solución del colorante. En una caja Petri se colocaron 25 µl de colorante preparado a cada muestra de tejido vegetal y se dejaron expuestas durante 30 min, se lavaron con agua destilada y se colocaron en cajas Petri modificadas, para observarse por microscopia de epifluorescencia (microscopio invertido TE300 (Nikon®, Japón) acoplado a una fuente de iluminación de xenón (DG-4, Sutter Instruments®, Novato, CA, EE. UU.). Un obturador Uniblitz® (Vincent Associates, Rochester, Nueva York, EE. UU.) y microscopia confocal (Metálaser Zeiss LSM 510). El análisis de la imagen y la cuantificación del nivel de fluorescencia se realizaron con el software ImageJ.
Adquisición de imágenes y su procesamiento
Ambos fluoróforos fueron visualizados por medio de microscopía de fluorescencia y se obtuvieron imágenes con una cámara CCD (Sensys®, Roper Científico, Tucson, AZ, EE.UU.) conectada a un microscopio invertido TE300 (Nikon®, Japón) acoplado a una fuente de iluminación de xenón (DG-4, Sutter Instruments®, Novato, CA, EE.UU.). Un obturador Uniblitz® (Vincent Associates, Rochester, Nueva York, EE.UU.), que permitió la adquisición de la luz transmitida para cada imagen. Se utilizó el filtro con longitud de onda de excitación de 390 nm que emite a 480 nm para ambos colorantes, por lo que los espectros de emisión se tomaron usando un filtro de emisión a 440/10 nm. Todos estos sistemas fueron operados por el software MetaMorph® / MetaFluor® (Universal Imaging-Molecular Devices, Downingtown, PA, EE.UU.).
Resultados y discusión
La evidencia sugiere que el estrés oxidativo es un factor perjudicial clave en plantas expuestas a una variedad de condiciones de estrés y que estas deben resistir el estrés oxidativo mediante la inducción de enzimas antioxidantes (Cuypers et al., 2002; Verma y Dubey, 2003). En este trabajo se abordó el efecto del daño ocasionado por el estilete del adulto de mosca pinta durante el ataque de las células de la hoja de la caña de azúcar. En particular, la acumulación de calosa y la formación de ERO para poder entender de una mejor manera la relación fisiológica entre la presencia de adulto de mosca pinta y su daño por la inserción del estilete sobre la lámina foliar. Esta inserción del estilete fractura las células del tejido de la hoja por la zona vascular hasta atravesar el xilema y floema, en consecuencia, el estrés oxidativo se estimula y el sistema de defensa antioxidante se expresa (Kombrink y Schmelzer, 2001).
Cortes histológicos
El daño provocado por la alimentación del insecto en el tejido celular se observó; a través, de cortes histológicos transversales (Figura 1). Se observó como el estilete casi logra atravesar la hoja llegando a la zona vascular a través de una estoma dañando el xilema y floema. Esto causa el aplastamiento de las células entre ellas la epidermis, células buliformes y vaina perenquimática que rodean la zona dañada. De acuerdo a Hagley y Blackman (1996) observaron que Aeneolamia varia saccharina introduce su estilete utilizando los estomas de hojas de caña de azúcar, atraviesa los tejidos hasta alcanzar las células en el borde de la hoja del parénquima (envés). De la misma manera García et al. (2007) demostró que los insectos adultos de Mahanarva fimbriolata introducen sus estiletes preferentemente en los estomas de la lámina de la hoja, estos pasan a través de los cloroplastos y del soporte de las células del parénquima hasta el metaxilema de los haces vasculares.

Figura 1 Cortes de la lámina foliar de hoja de caña expuestos al estilete de la mosca pinta; a) corte transversal de tejido de hoja de caña (20X); b) corte frontal del tejido de hoja de caña (20X).
Al igual que los trabajos mencionados anteriormente, este trabajo refiere que los adultos de mosca pinta (A. albofasciata), introducen su estilete buscando los estomas al posarse en la superficie de la lámina foliar, provocando así, la ruptura celular a nivel de la cámara subestomatica celular del parenquíma y las vainas del haz, incluso hasta los límites de la epidermis inferior (envés). Con lo anterior, se observó un daño mecánico considerable, con laceración y ruptura celular, provocando la muerte celular de la lámina foliar de la hoja de caña.
Después de 5 días de exposición de las plantas a los adultos de mosca pinta se tomaron nuevas muestras de tejido y se realizaron los mismos tratamientos para la observación microscópica de luz transmitida, teniendo como resultado fotografías que muestras el daño que se va extendiendo al interior de las células del tejido de la hoja (Figura 2).
Tinción para calosa
Se obtuvieron fotografías a través del microscopio de epifluorescencia que nos permitieron visualizar la presencia de calosa en los tejidos dañados por inserción de estilete de los adultos de mosca pinta. En la Figura 3 se muestra la presencia de calosa, los valores de fluorescencia en las células dañadas varían con respecto a la presencia de calosa, debido que el colorante fluorescente evidencia la expresión de β-glucanos. En la zona de daño mecánico se puede observar que existe una mayor concentración de calosa y conforme se va alejando de la zona del daño existe menor presencia de ésta. Esto ocurre debido a que conforme nos alejamos del sitio de daño, las células se encuentran menos dañadas hasta llegar a las células sanas. Estos datos permitieron demostrar que existe una alta acumulación de calosa en los sitios entorno al daño ocasionado por la mosca pinta.
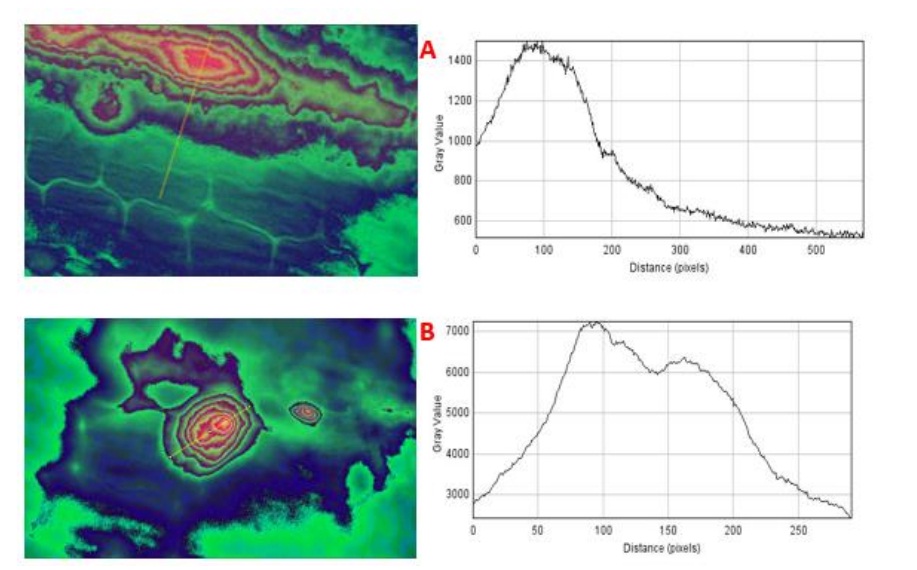
Figura 3 Expresión de calosa en la lámina foliar de hoja de caña mediante fluorescencia A. Expresión de β-1,3-glucano según la extensión del daño mecánico, se extiende de 1 000 nm a 500 nm a partir de la zona de daño. B. Expresión de β-1,3-glucano según la extensión del daño mecánico, se extiende de 3 000 - 7 000 - 2 500 nm a partir de la zona céntrica del daño.
Calosa es un amorfo de alto peso molecular β-1,3-glucano que se deposita en forma de papilas por el desarrollo de hongos y otros patógenos en el tejido de las hojas (Aist, 1976). Actúa como una barrera física contra la colonización fúngica del espacio intercelular. Dos grupos de investigación han encontrado de forma independiente que las mutaciones en el gen de la calosa sintasa de Arabidopsis thaliana, paradójicamente confieren resistencia frente a hongos (Jacobs et al., 2003; Nishimura et al., 2003). También, Nishimura et al. (2003) mencionan que la deposición rápida de calosa durante las primeras etapas del daño, pueden inhibir la respuesta de defensa que la planta pueda tener y que potencialmente puede ser perjudicial para la misma.
Si un patógeno ha desarrollado mecanismos para superar la barrera de defensa contra la calosa, las condiciones se vuelven favorables para su posterior colonización. Por otra, parte Jacobs et al. (2003) confirmaron que la deposición de tapones de calosa en los sitios de penetración fúngica es una respuesta temprana ampliamente reconocida por las plantas huésped ante el ataque microbiano; por lo tanto, los tapones de calosa están implicados en impedir la entrada del hongo o el confinamiento del desarrollo del mismo. En esta investigación, se examinó mediante fluorescencia la expresión de calosa causada como defensa de la planta ante el daño mecánico.
Tinción para ROS
Para la determinación de las ERO (ROS), las células fueron tratadas con la sonda fluorescente sensibles a ERO y se visualizó por medio de microscopía de epifluorescencia. Los datos obtenidos permitieron demostrar que existe una alta presencia de ERO en el tejido que está siendo dañado por inserción del estilete del adulto de mosca pinta. En la Figura 4 se muestran, como es semejante a ERO en las celulas dañadas ante un daño mecanico. El colorante específico para ERO solo se expresa en presencia de peróxidos presentes en la zona con daño mecánico causado por el insecto, por lo que en las imágenes se observa la zona de invasión del insecto en el tejido y como las células que rodean al daño comienzan a ser invadidas con la formación de estos radicales libres, que muy probablemente están involucrados en la muerte celular de las células del sitio de daño.
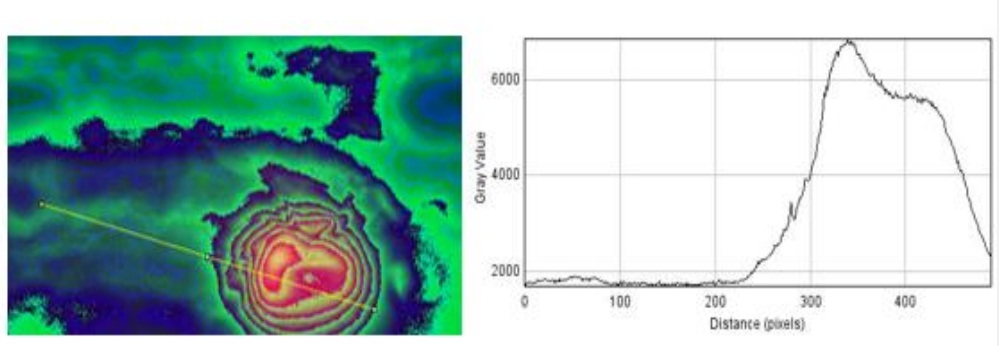
Figura 4 Expresión de ERO según la extensión del daño mecánico, se extiende de 2 000-6 500-2 500 nm a partir de la zona de daño.
Las especies reactivas de oxígeno (ERO) en las plantas juegan un papel preponderante en la respuesta a todo tipo de patógenos. Sin embargo, un número creciente de informes describen el posible papel de las especies reactivas de oxígeno (especialmente de peróxido de hidrógeno) como un mensajero celular en las vías de transducción de señales, en particular en la señalización de la respuesta de las plantas a los patógenos (Bolwell, 1999; Bowler y Fluhr, 2000; Grant y Loake, 2000). Un gran número de rutas bioquímicas están involucradas en la respuesta de la planta al ataque de patógenos, pero la respuesta de la planta comienza con el reconocimiento del elicitor o señal del patógeno en el momento del contacto de las estructuras hifales sobre el tejido y en particular, en el contacto por el daño inter e intracelular. Este reconocimiento se da por la presencia de un receptor para el elicitor en la célula vegetal.
La activación de éste receptor activa diversos procesos locales tales como la liberación de especies reactivas de oxígeno (el estallido oxidativo) al medio extra-celular. Esto a menudo resulta en respuesta a la hipersensibilidad (HR), un tipo de muerte celular programada localizada en el sitio en donde el patógeno inició el desarrollo para invadir a la planta (Bowler y Fuhr, 2000). Una respuesta tardía se produce por un mecanismo de señalización de largo alcance que más tarde provoca resistencia sistémica adquirida (SAR) por sus siglas en inglés, en la que se localiza la exposición al patógeno y da lugar a la resistencia de toda la planta a los patógenos no relacionados, este tipo de resistencia puede durar varios meses (Bowler y Fuhr, 2000). Aunque se ha observado en las hojas de caña de azúcar, que la incidencia de adultos de mosca pinta por arriba de 20 adultos en promedio por trampa en 24 h, ocasiona un daño que se expresa en manchas o líneas a todo lo largo de la lámina foliar de color rojizo a color ocre.
Posterior a este daño las células se tornan secas por la muerte celular y que en la lejanía se observa el cultivo café o rojizo. Se torna ‘quemado’ y en consecuencia esto puede ocasionar la inhibición o incluso el bloqueo de la síntesis de sacarosa. Por lo anterior, no ha sido posible medir el daño real con métodos cuantitativos sino cualitativos más que las referencias de severidad de daño establecidas por Campbell y Madden (1990). En cambio, la fluorescencia es una referencia numérica en nanómetros donde se puede asociar la severidad de daño mediante la expresión de peróxidos y cúmulos de calosa, por la inserción del estilete y tiempo de absorción de la savia, además la incidencia de los adultos sobre la lámina foliar repercute en gran medida a dicho daño.
Conclusión
Los métodos de tinciones fluorescentes establecidos para el reconocimiento de ERO y calosa en los tejidos de las hojas de caña de azúcar, permiten evidenciar el efecto por daño celular por mosca pinta para su exploración y con esto, se pudo identificar las estructuras celulares dañadas mecánicamente. Además, se pudo obtener un dato numérico del daño que fluctuó para los tejidos observados en un rango de 1 000 a 6 400 nm y de 600 a 7 000 nm y no cualitativo del daño celular, mediante la expresión de peróxidos y β-glucanos, respectivamente, que delimitan el daño real al interior del tejido y no de manera superficial del tejido de la lámina foliar.











 texto en
texto en 



