Introducción
La cochinilla Dactylopius opuntiae Cockerell (Hemiptera: Dactylopiidae) es considerada como el principal problema fitosanitario del nopal (Opuntia spp.) en México y otras partes del mundo, debido entre otros aspectos a: la presencia de una secreción cerosa, que proporciona a las hembras camuflaje, resistencia a factores climáticos adversos, protección ante enemigos naturales y reduce la efectividad de la acción de los insecticidas; las altas tasas de reproducción y ciclos de vida cortos y a la presencia de ácido carmínico, el cual tiene propiedades antialimentarias y deterrentes.
D. opuntiae es una de las 11 especies de perteneciente a la familia Dactylopiidae (Spodek et al., 2014), la cual se encuentra distribuida en 18 países alrededor del mundo (García et al., 2016). Se le ha registrado causando graves daños en la comunidad Valenciana, España (Rodrigo et al., 2010) y recientemente se ha detectado su presencia por primera vez en Israel (Spodek et al., 2014) y en Marruecos (Bouharroud et al., 2016). Asimismo, por la incidencia y severidad de los daños, durante la última década se ha convertido en la plaga más importante en las plantaciones de nopal para forraje en el noreste de Brasil (Da Silva et al., 2010; Falcao et al., 2013). En México está presente en todas las zonas nopaleras, ubicándose en 22 estados del país (Chávez-Moreno et al., 2011) lo cual da una de idea de su amplia distribución y facilidad de dispersión.
Tradicionalmente, su control se ha sustentado en la utilización de plaguicidas, entre los que destacan, malatión, paratión metílico y triclorfon (Badii y Flores, 2001), ello a pesar de que actualmente no existen insecticidas autorizados en México para emplearse en este insecto (Vanegas-Rico et al., 2010). Derivado de lo anterior, la aplicación de productos no autorizados o en las dosis no recomendadas pueden ocasionar riesgos a los consumidores, productores y daños al ambiente, tal y como se destaca en el reporte realizado por el Departamento de Salud Pública del estado de California (CDPH), por sus siglas en inglés, donde se advierte sobre el peligro del consumo de nopal proveniente de México ante la presencia de monocrotofos (5.8 ppm) un plaguicida organofosforado prohibido desde 1989. http://www.cdph.ca.gov/Pages/NR14-021.aspx.
Ante esta problemática, en México se han probado y desarrollado diversas estrategias para combatir a D. opuntiae; a través, de métodos alternativos. Por ejemplo, Mena y Rosas (2007) recomiendan el cepillado o barrido mecánico de los cladodios. También, se han evaluado productos biodegradables (Palacios-Mendoza et al., 2004), extractos vegetales (Vigueras et al., 2009), aceites esenciales (Vázquez-García et al., 2011) y aspersión de silicio orgánico e inorgánico mezclados con jabones biodegradables (Mena, 2013), entre otros; sin embargo, en todos estos métodos el éxito dependerá del estadio de desarrollo en que se encuentra el insecto.
Otra alternativa promisoria de manejo ha sido el empleo de enemigos naturales, como agentes de control biológico (Vanegas-Rico et al., 2010). Algunos de ellos han sido evaluados contra D. opuntiae tales como: Sympherobius barberi (Pacheco-Rueda et al., 2011), Chilocorus cacti, (Flores et al., 2013) e Hyperaspis trifurcata (Ramírez et al., 2013), entre otros. No obstante, muchos de estos estudios se han restringido a la fase de laboratorio, por lo que aún no se ha transferido a productores y valorado en condiciones de campo. Otro aspecto poco estudiado en el país, es la selección de cultivares resistentes a D. opuntiae, pero en Brasil ya se cuentan con programas de selección y mejoramiento con este fin (Da Silva et al., 2010).
El empleo de biopesticidas, incluyendo aquellos formulados a base de hongos entomopatógenos, están tomando importancia como una alternativa al empleo de insecticidas. En este aspecto Brasil, ha destacado al realizar estudios con B. bassiana para el control de D. opuntiae (Santos et al., 2011) y Fusarium incarnatum-equiseti (Da Silva et al., 2016) pero no existen, de acuerdo a nuestro conocimiento, estudios en México donde se aborde el empleo de diferentes cepas de hongos para su control. Por lo anterior, se pretende evaluar la patogenicidad y virulencia de tres especies de hongos entomopatógenos (Metarhizium anisopliae, Beauveria bassiana y Lecanicillium lecanii) sobre la mortalidad de ninfas de segundo instar de la cochinilla D. opuntiae.
Materiales y métodos
El experimento se llevó a cabo en el laboratorio de patología de insectos del Colegio de Postgraduados Campus Montecillo, durante el periodo comprendido de agosto 2015 a abril de 2016.
Obtención de colonias de D. opuntiae
El pie de cría inicial se obtuvo por medio de la recolección de cladodios infestados con D. opuntiae, durante el mes de julio de 2015 de una plantación comercial para la producción de tuna, ubicada en la comunidad de Cuautlacingo, Otumba, Estado de México. Los cladodios conteniendo las colonias de D. opuntiae se cortaron cuidadosamente, se revisaron para evitar la presencia de cualquier enemigo natural y posteriormente, se trasladaron y confinaron en una unidad de cría del Colegio de Postgraduados Campus Montecillo, de acuerdo al sistema propuesto por Aldama y Llanderal (2003).
Infestación de cladodios
Para obtener cohortes de D. opuntiae, una vez que las hembras adultas iniciaron la reproducción, éstas se recolectaron cuidadosamente y se introdujeron en ‘nidos de tul’, de acuerdo al método descrito por Aldama y Llanderal (2003). Posteriormente, cladodios de nopal Opuntia ficus-indica (L.) Mill. conteniendo los nidos se introdujeron en recipientes de plástico transparente: 25 x 15 x 5 cm largo, ancho y altura, respectivamente y se introdujeron en una cámara bioclimática (Thermo Scientific) a una temperatura de 25 ±1 °C y un fotoperiodo de 24 h obscuridad, durante un periodo de 72 h, a fin de asegurar el establecimiento y fijación de la ninfa migrante. Una vez obtenidas ninfas sésiles se realizaron cortes de cladodios de 5 x 5 cm, en los que se contabilizaron 30 ninfas. Cada unidad se colocó en contenedores desechables transparentes cilíndricos de 6 x 4 cm. Se establecieron 13 unidades experimentales por cada repetición.
Cultivo de aislamientos empleados
Para llevar a cabo el estudio se emplearon los siguientes aislamientos: Beauveria bassiana (GHA, Bb1), Metarhizium anisopliae (Ma129, Ma130) y Lecanicillium lecanii (974, 2009), todos ellos monospóricos, provenientes de la colección de hongos entomopatógenos del Laboratorio de Patología de Insectos del Instituto de Fitosanidad del Colegio de Postgraduados (Cuadro 1). La producción de conidios se realizó mediante el cultivo en superficie de medio solido (Butt y Goettel, 2000) empleando agar dextrosa sabouraud (BD Bioxon, México) en la siguiente proporción: dextrosa 40 g, peptona de carne 5 g, peptona de caseína 5 g y agar 15 g. Este se esterilizó previamente mediante autoclave y se transfirió a cajas Petri de poliestireno estériles de 90 x 15 mm. Para la obtención de conidios las cajas se incubaron por tres semanas a una temperatura de 25 ±1 °C y un fotoperiodo de 24 h obscuridad. La extracción de conidios se realizó por medio de raspado de la superficie y posteriormente suspendidos en solución Tween 80 al 0.03%. La cuantificación de conidios se realizó en una cámara de Neubauer, de acuerdo al método propuesto por Goettel y Douglas (1997).
Cuadro 1 Referencia de los hongos utilizados en la evaluación de patogenicidad contra D. opuntiae.
| Especie | Clave | Insecto hospedante | Localidad |
| B. bassiana | Bb1 | Hymenoptera | Jalisco, México |
| B. bassiana | GHA | Mycotrol® | USA |
| M. anisopliae | Ma129 | Tetranychus urticae | Tecomán, Colima, México |
| M. anisopliae | Ma130 | T. urticae | Tecomán, Colima, México |
| L. lecanii | *ARSEF 2009 | Toxoptera citricida | Tucumán, Argentina |
| L. lecanii | *ARSEF 974 | Afidos | Venezuela |
*= aislamientos con el prefijo ARSEF, pertenecen a la colección de aislamientos de Agricultural Research Service of Entomopathogenic Fungi, EUA.
Evaluación de patogenicidad
Para evaluar la patogenicidad de las diferentes cepas sobre la mortalidad de D. opuntiae, los cortes de nopal conteniendo ninfas de segundo instar, se colocaron en vasos desechables transparentes y se asperjaron con suspensiones de conidios de los seis aislamientos. Se aplicó una sola dosis de 1 x 108 conidios mL-1 suspendidos en solución Tween 80 al 0.03%, más un control donde se aplicó solución Tween 80 al 0.03%. Las atomizaciones se realizaron en una torre de aspersión con las siguientes características: cilindro de acrílico de 30 cm de diámetro y una altura de 50 cm, el cual tuvo una inclinación de 45° a los 30 cm de altura. Todos los tratamientos se sometieron a una presión de 10 psi. Luego de la aspersión, las unidades experimentales tratadas se introdujeron en recipientes de plástico transparente y se mantuvieron a una temperatura de 26 ±1 °C, 60% de humedad relativa y un fotoperiodo 12:12 (luz: obscuridad). La mortalidad de las ninfas se evaluó durante un periodo de 192 h con intervalos de 24 h, después de realizada la aspersión. Cada 24 h se realizó la extracción y cuantificación de insectos muertos y cada uno de ellos se colocó en una cámara húmeda para acelerar la esporulación del hongo y así poder confirmar la infección del insecto (Butt y Goettel, 2000).
Evaluación de virulencia
De acuerdo a los resultados obtenidos en el ensayo de patogenicidad, se seleccionaron los tres aislamientos que generaron mayor mortalidad (Ma130, Ma129 y 974) para evaluar su virulencia sobre D. opuntiae. Para ello, cortes de nopal conteniendo ninfas de segundo instar se colocaron en vasos desechables transparentes y se asperjaron cuatro dosis de conidios de los tres aislamientos (106, 107, 108 y 109 conidios mL-1) suspendidos en solución Tween 80 al 0.05%, más un control donde se aplicó solución Tween 80 al 0.05%. Para realizar las atomizaciones se siguió el mismo procedimiento que en el apartado anterior. Luego de la aspersión, las unidades experimentales tratadas se colocaron en recipientes de plástico transparente, los cuales se introdujeron, a su vez, en una cámara de cría con las siguientes condiciones: humedad relativa (60%), fotoperiodo (12:12) y una temperatura de 26 ±1 °C. La mortalidad de las ninfas sometidas a los tres tratamientos se evaluó por 192 h, a intervalos de 24 h después de la aspersión. Diariamente, se realizó la extracción y cuantificación de insectos muertos y se siguieron las indicaciones de Butt y Goettel (2000). El porcentaje de mortalidad se calculó de acuerdo a la fórmula de Abbott (1925).
Análisis estadístico
Respecto a patogenicidad se empleó un diseño completamente al azar, con seis tratamientos (aislamientos) más un control, tres replicas en el tiempo y dos pseudo-réplicas cada uno. En cada uno de los tratamientos se tuvieron dos repeticiones, teniendo así 12 unidades, más un control. Los porcentajes de mortalidad de ninfas se transformaron por medio de arcsen (
Resultados y discusión
Determinación de la patogenicidad
Los resultados del estudio demostraron que M. anisopliae presentó la mortalidad más alta de ninfas con 41.3%; posteriormente, le siguió L. lecanii la cual de manera global provocó una mortalidad de 34.4%. Por el contrario, la especie que obtuvo la mortalidad más baja resultó B. bassiana con solamente 19.7% (Figura 1). Cuando se evaluó la efectividad por aislamiento de manera individual, el tratamiento que obtuvo la mortalidad más alta resultó M. anisopliae con el aislamiento Ma130, el cual registró una mortalidad de 51.1%, seguido por el aislamiento 974 de L. lecanii con 38.8% de mortalidad. Los tratamientos Ma129 y 2009 pertenecientes a las especies M. anisopliae y L. lecanii, resultaron estadísticamente similares con 31.5 y 29.9%, respectivamente. Por otro lado, los aislamientos que presentaron menor efectividad correspondieron a B. bassiana, donde el aislamiento GHA obtuvo 22.6% y la menor efectividad la registró el aislamiento Bb1 con sólo 16.5% de mortalidad (Cuadro 2). El experimento registró una mortalidad menor al 10% en el testigo, lo cual lo hace aceptable y manifiesta que el protocolo de inoculación de los hongos entomopatógenos resultó efectivo respecto a la inocuidad.
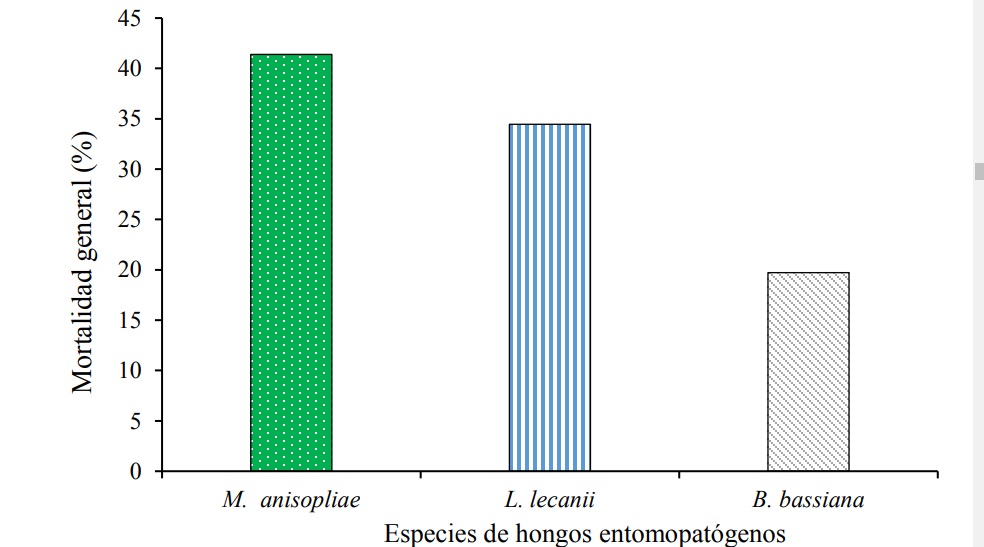
Figura 1 Mortalidad general por especie de hongos entomopatógenos sobre ninfas de segundo instar de D. opuntiae.
Cuadro 2 Mortalidad (%) de ninfas de segundo instar de Dactylopius opuntiae tratadas con seis aislamientos de hongos entomopatógenos.
| Especie | Cepas | Mortalidad (%±EE*) |
| M. anisopliae | Ma 130 | 51.12 ±2.04a |
| L. lecanii | 974 | 38.85 ±1.64b |
| M. anisopliae | Ma 129 | 31.58 ±2.06c |
| L. lecanii | 2009 | 29.98 ±0.85c |
| B. bassiana | GHA | 22.69 ±1.33d** |
| B. bassiana | Bb1 | 16.56 ±1.21e |
| Control | Control | 8.81±0.7f |
*= distintas letras indican diferencias de acuerdo a la prueba de Tukey (p≤ 0.05). EE= error estándar.
El análisis de los resultados de las seis cepas (GHA, Bb1, Ma129, Ma130, 974 y 2009) aplicadas a una sola concentración (1 x 108 conidios mL-1) mostró que todos los aislamientos presentan patogenicidad contra D. opuntiae. Los hongos que mayor efectividad presentaron son M. anisopliae y L. lecanii, en los seis aislamientos probados en el bioensayo. Los datos muestran que existen diferencias estadísticas, incluso en aislamientos pertenecientes a la misma especie, esta diferenciación puede estar asociada a las características de virulencia propias de cada aislamiento, así como a la influencia que ejerce el tipo de hospedante del cual provino su aislamiento.
El hongo más patogénico resultó M. anisopliae aislamiento Ma 130, este comportamiento se puede atribuir a que esta especie tiene la cualidad de infectar insectos y ácaros de cuerpo blando como Tetranychus urtice (Mugisho et al., 2015), además el tamaño del conidio, respecto al cuerpo de la ninfa de D. opuntiae, puede tener más influencia sobre la mortalidad, puesto que el área de contacto con el insecto es mayor, al presentar conidios más grandes, en comparación con las especies de B. bassiana y L. lecanii (Humber, 1997).
Realmente, pocos patógenos se han aislado de manera natural para emplearse en el control escamas y probablemente los hongos de mayor importancia contra estos insectos sean los pertenecientes al género Lecanicillium (Liu et al., 2009). En el caso del hongo L. lecanii se han realizado investigaciones de patogenicidad sobre insectos pertenecientes a la familia Matsucoccidae obteniendo mortalidades 61.3% en ninfas de segundo instar a una concentración de 1 x 107 conidios mL-1 (Liu et al., 2014). En el presente estudio las mortalidades obtenidas con este hongo causaron valores intermedios de mortalidad entre 29.9 y 38.8% para los aislamientos 2009 y 974, respectivamente.
En bioensayos realizados sobre escamas Phoenicococcus marlatti, se observó que el hongo B. bassiana no logró parasitar el insecto (Asensio et al., 2005). A pesar de que en este estudio los valores de mortalidad registrados resultaron los más bajos Bb1 (16.5%) y GHA (22.9%, Santos et al. (2011) al evaluar el efecto del hongo B. bassiana mezclado con agentes protectores sobre ninfas de primer instar de D. opuntiae, detectaron que al incluir un protector solar (Oxybenzone®) en la formulación del hongo, se alcanzaron valores de mortalidad de 46.5%. Dicho valor es más alto que los registrados en el presente estudio, donde B. bassiana (GHA) obtuvo una mortalidad máxima de 22.6%.
Esta diferencia puede estar asociada al hecho de que el protector solar puede acentuar su efecto en la mortalidad, al ser combinado con el hongo. Vale la pena considerar que de manera natural D. opuntiae presenta una alta tasa de mortalidad natural en ninfas de primer instar ya que aún no desarrollan su cubierta protectora, debido a ello, lo valores superiores de mortalidad obtenida por Santos et al. (2011) pueden estar relacionados a que se realizaron los bioensayos con ninfas de primer instar, mientras que en esta investigación se aplicaron en ninfas de mayor edad, las cuales presentan una mayor cantidad de filamentos cerosos, que podrían interferir en el contacto del hongo con el cuerpo del insecto. Al respecto, Vigueras et al. (2009) resaltan que al degradar la cubierta cerosa la mortalidad puede llegar hasta 35% en ninfas de primer instar.
Una de las grandes ventajas que conlleva emplear entomopatógenos es que se pueden combinar con algunos extractos vegetales en las estrategias de manejo del insecto. Da Silva et al. (2016) observaron que cuando se aplican Fusarium incartanum-equiseti y extractos acuosos de Ricinus communis pueden llegar a causar hasta 100% de mortalidad en D. opuntiae, aunque también los bioensayos se aplicaron a ninfas y no adultos. En estudios realizados con otras escamas, Jin-Hua et al. (2014) aislaron, identificaron y evaluaron la patogenicidad del hongo Fusarium incarnatum-equiseti que infecta de forma natural a la escama blanda Coccus hesperidum registrando el primer reporte del género Fusarium sobre este insecto, esto infiere que este hongo podría presentar patogenicidad sobre otros insectos escama, aunque esta especie no se evaluó en este estudio.
Este potencial se comprobó recientemente con excelentes resultados en estudios de laboratorio, en combinación con extractos vegetales, para el control de D. opuntiae en Brasil (Da Silva et al., 2016). Al probar M. anisopliae y B. bassiana, se observó que este último registró los mejores resultados sobre ninfas de D. opuntiae, resaltando además que la combinación de ambas especies podría mejorar su respuesta. Esta tendencia no se pudo confirmar en esta investigación. Una dosis similar a la empleada en este estudio, también se utilizó con B. bassiana para el control de Matamasius spinoleae, otra plaga importante de Opuntia en México, obteniendo valores de mortalidad de 85% (Tafoya et al., 2004).
Determinación de la virulencia
Para determinar la virulencia de ninfas de segundo instar de D. opuntiae en condiciones de laboratorio, se evaluaron tres aislamientos de hongos entomopatógenos de dos especies (M. anisopliae y L. lecanii) las cuales registraron los valores más altos en patogenicidad. La virulencia de cada aislamiento se determinó estimando la CL50 y CL95, expresada en conidios mL-1, con base en la mortalidad obtenida al octavo día después de la inoculación de los hongos. Los aislamientos probados ocasionaron mortalidad en D. opuntiae, siendo ésta dependiente de la concentración (Figura 2). Se encontró que el aislamiento Ma130 (M. anisopliae) presentó la mayor efectividad, seguido del aislamiento 974 (L. lecanii) y finalmente el aislamiento Ma129, con la menor efectividad de los tres aislamientos. Asimismo, se observó una relación positiva entre la concentración de los aislamientos aplicados y la mortalidad, de tal manera que a medida que la concentración aumenta se registra un incremento en la mortalidad.
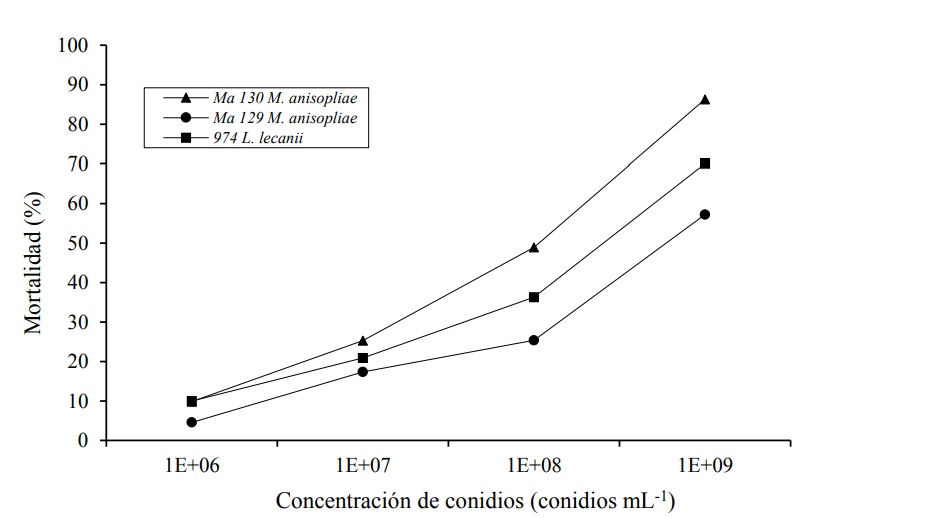
Figura 2 Mortalidad corregida (%) de D. opuntiae a diferentes niveles de concentración de conidios en tres aislamientos evaluados.
En el Cuadro 3 se presenta el promedio de la mortalidad registrada y la mortalidad corregida conforme la fórmula de Abbott (1925), donde se destaca que el aislamiento Ma130 de la especie M. anisopliae demostró una mayor efectividad en las cuatro concentraciones probadas, los valores promedio de mortalidad oscilaron entre 17.5% (1 x 106 conidios mL-1) y 87.5% (1 x 109 conidios mL-1). Las tres concentraciones más elevadas presentaron diferencias significativas, entre ellas; sin embargo, la concentración más baja (1 x 106 conidios mL-1) presentó una mortalidad promedio de 17.5% la cual resultó no diferente estadísticamente, respecto al control (8.3%).
Cuadro 3 Mortalidad observada (% ±EE*) y corregida empleando la fórmula de Abbott.
| Aislamientos concentraciones | Mortalidad observada (%) | Mortalidad corregida (%) |
| Ma 130- 109 | 87.5 ±4.59a | 86.36 |
| Ma 130- 108 | 53.33 ±4.91b | 49.09 |
| Ma 130- 107 | 31.67 ±3.47c | 25.46 |
| Ma 130- 106 | 17.5 ±3.7cd | 10 |
| Ma 129- 109 | 60.83 ±4.98a | 57.27 |
| Ma 129- 108 | 31.67 ±3.47b | 25.46 |
| Ma 129- 107 | 24.17 ±4.38bc | 17.28 |
| Ma 129- 106 | 12.5 ±3.94c | 4.55 |
| 974- 109 | 72.5 ±4.98a | 70 |
| 974- 108 | 41.67 ±2.15b | 36.37 |
| 974- 107 | 27.5 ±2.85c | 20.91 |
| 974- 106 | 17.5 ±2.85cd | 10 |
| Control | 8.33 ±0.96 | - |
*= Distintas letras, entre concentraciones de aislamientos indican diferencias de acuerdo a la prueba de Tukey (p≤ 0.05). EE= error estándar.
L. lecanii 974 registró la mejor efectividad, después del aislamiento Ma 30, ya que obtuvo valores de 72.5% a una concentración de 1 x 109 conidios mL-1. Por el contrario, la mortalidad más baja se observó en el tratamiento con la concentración de 1 x 106 conidios mL-1, donde se registró solamente 17.5%, la cual no difiere estadísticamente del control. Respecto al aislamiento Ma129 de M. anisopliae, éste presentó el valor más bajo de mortalidad, respecto a los otros dos aislamientos evaluados. El promedio de mortalidad más alto (60.83%) se obtuvo con la concentración más elevada (1 x 109 conidios mL-1) en contraste, el valor promedio de mortalidad más bajo que este aislamiento presentó (12.5%) se observó con la concentración de 1 x 106 conidios mL-1 (Figura 3).
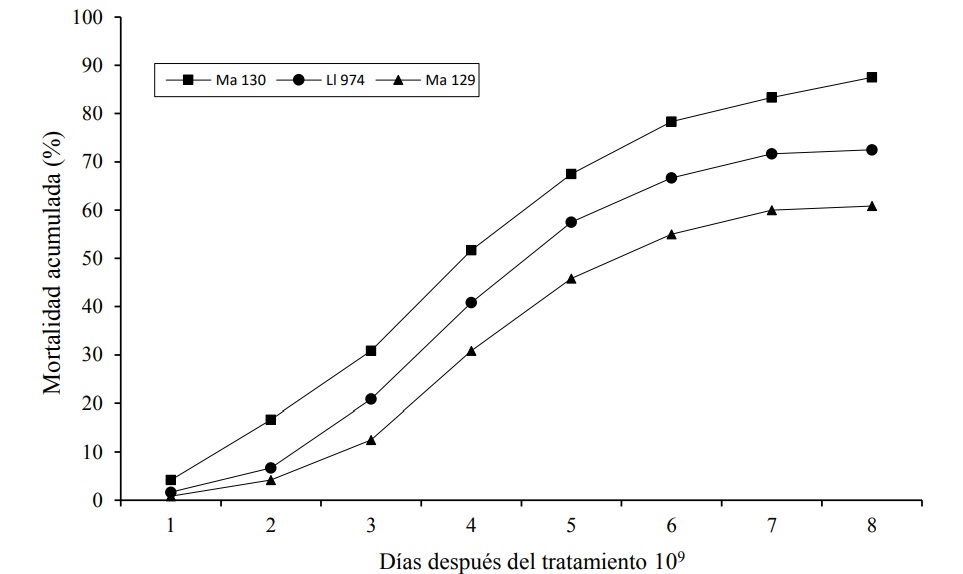
Figura 3 Mortalidad acumulada (%) de tres aislamientos de hongos entomopatógenos en ninfas de segundo instar de D. opuntiae, en condiciones de laboratorio.
En el Cuadro 4 se presentan los valores de CL50 y CL95 (incluyendo los límites de confianza) y las ecuaciones de regresión obtenidas a partir del análisis Probit. La concentración letal media (CL50) estimada para el aislamiento Ma130 (M. anisopliae) resultó en 6.63 x 107 conidios mL-1, en el caso del aislamiento Ma129 la CL50 obtuvo un valor de 6.56 x 108 conidios mL-1 y para el aislamiento 974 de la especie L. lecanii el valor estimado de la CL50 obtenido fue 2.07 x 108 conidios mL-1. Con base a esta información, es posible considerar que el aislamiento más efectivo es Ma 130, el cual muestra un menor requerimiento en la concentración para matar a 50% de la población en estudio en un periodo de tiempo determinado. En orden decreciente de efectividad le siguió la especie L. Lecanii (974) y finalmente el tratamiento con menor efectividad resultó ser el aislamiento Ma129.
Cuadro 4 CL50 y CL95 de tres aislamientos de hongos entomopatógenos sobre ninfas de segundo instar de D. opuntiae.
| Aislamiento | CL50 (95% LC) | CL95 (95% LC) | Ecuación de regresión Probit |
| Ma 130 | 6.63x107 (4.83x107-1.03x108) | 8.45x109 (3.47x109- 2.92x1010) | Y= -6.1119+0.7814 X |
| Ma 129 | 6.56x108 (3.36x108-1.67x109) | 4.01x1011 (7.04x1010-6.6x1012) | Y= -5.2041+ 0.5902 X |
| 974 | 2.07x108(1.19x108- 4.12x108) | 1.1x1011 (2.59x1010- 1.01x1012) | Y= -5.0167 + 0.6032 X |
Por su parte, Pereira et al. (2011) observaron que la DL50 de M. anisopliae var. anisopliae registró un valor de 7.3 x 106 conidios mL-1 contra ninfas de segundo instar de D. opuntiae. Lo anterior, puede estar relacionado características de virulencia del aislamiento, tales como la producción de enzimas (proteasas, quitinasas y lipasas) las cuales facilitan la penetración de la cutícula del insecto y permiten llegar hasta el interior de éste (hemocele) (Schrank y Vainstein, 2010). A pesar de que el empleo de M. anisopliae contra insectos escama ha sido poco empleado, debido a que este hongo se encuentra asociado naturalmente a miembros de otros ordenes tales como: coleópteros, isópteros u ortópteros (Shahid et al., 2012), se ha demostrado la efectividad de este hongo contra piojos harinosos (Pseudococcus viburni).
La concentración de conidios tuvo una respuesta lineal positiva con la mortalidad, dado que a mayor concentración la mortalidad se incrementó. Esto puede estar relacionado a la cantidad de esporas viables que logran posicionarse sobre la cutícula del insecto y que posteriormente germinarán, de esta manera pueden tener mayor oportunidad de infectar al insecto por la cantidad de esporas presentes (Cuadro 5).
Cuadro 5 Estimación de conidios por cada tratamiento aplicado.
| Tratamiento | Promedio de conidios |
| Ma 130- 9 | 66.67 |
| Ma 130- 8 | 25 |
| Ma 130- 7 | 11.33 |
| Ma 130- 6 | 3.67 |
| Ma 129- 9 | 42.33 |
| Ma 129- 8 | 19 |
| Ma 129- 7 | 4 |
| Ma 129- 6 | 1.33 |
| 974- 9 | 54 |
| 974- 8 | 44.33 |
| 974- 7 | 17.67 |
| 974- 6 | 11.67 |
Un aspecto importante de resaltar es que la mortalidad de las ninfas de D. opuntiae se inició a partir del primer día después de la aplicación de los hongos. Entre el tercer y sexto día se observó la tasa de mortalidad más alta en los tres aislamientos y presenta la tendencia a estabilizarse a partir del octavo día. El aislamiento Ma130 presentó una mayor efectividad de la mortalidad acumulada respecto al tiempo, al eliminar una mayor cantidad de ninfas en menor tiempo, en relación a los otros dos aislamientos evaluados (Figura 3).
Los tres aislamientos de hongos entomopatógenos evaluados, dos pertenecientes a la especie M. anisopliae y uno de la especie L. lecanii, a pesar de que muestran diferente grado de virulencia, tienen potencial de causar infección en ninfas de segundo instar de D. opuntiae. Los resultados del estudio mostraron que el aislamiento Ma130 de M. anisopliae presentó la mayor efectividad. Esta especie es el hongo entomopatógeno más empleado alrededor del mundo, dada su disponibilidad natural en el suelo y también por el alto número de especies de insectos hospedantes (Senthil-Nathan, 2015). En la investigación este aislamiento presentó una efectividad mayor en porcentaje de mortalidad, así como también la CL50 más baja (6.63 x 107 conidios mL-1), en comparación con los otros dos aislamientos evaluados.
En este estudio también se evaluó el aislamiento Ma129 perteneciente a la especie M. anisopliae, el cual mostró una efectividad inferior respecto a los otros dos aislamientos. Los dos aislamientos de M. anisopliae evaluados en esta investigación registraron su mortalidad máxima después del sexto día después de la aspersión. Una tendencia similar, observaron Oreste et al. (2016) al estudiar el efecto de un aislamiento de M. anisopliae sobre mosca blanca, registrando valores de mortalidad de 94.1%, al séptimo día después de la aplicación de los hongos.
Respecto al aislamiento 974 perteneciente a la especie L. lecanii presentó una efectividad interesante en la evaluación de virulencia, respecto a los otros dos aislamientos evaluados, ya que obtuvo un valor de la CL50 de 2.07 x 108 conidios mL-1. Esta especie tiene también un alto número de insectos hospedantes; sin embargo, es patógeno principal de hemípteros como escamas, áfidos y mosca blanca (Sujeetha y Sahayaraj, 2014). Por ejemplo, Telli et al. (2014) evaluaron la mortalidad de la escama Coccus hesperidium L. mediante la inoculación del hongo L. lecanii en condiciones de laboratorio y obtuvieron un promedio de mortalidad 47.5% a una concentración de 1 x 107 conidios mL-1. Los autores concluyen que este hongo tiene potencial de ser empleado en planes de manejo integrado de insectos fitófagos pertenecientes al orden Hemiptera.
Por su parte, Liu et al. (2014) analizaron la virulencia de dos aislamientos del hongo L. lecanii contra ninfas de segundo instar de la escama Matsucoccus matsumurae y obtuvieron valores de mortalidad que oscilaron entre 53.6 y 61.3% para los aislamientos V34504 y V34505, respectivamente, además, encontraron que los valores más altos de mortalidad se presentaron después del sexto día de inoculación, lo cual coincide con la observado en esta investigación. Asimismo, Xie et al. (2010) concluyeron que este hongo invade a los insectos escama y encontraron que los conidios dañan la cutícula y penetran el integumento por medio de una combinación de fuerzas mecánicas y enzimas degradadoras.
De acuerdo a los resultados obtenidos en esta investigación se destaca que el control de D. opuntiae mediante hongos entomopatógenos puede resultar una alternativa viable, tomando como referencia la mortalidad obtenida en condiciones de laboratorio. No obstante, es necesario considerar que la efectividad de los entomopatógenos en condiciones de campo es inferior a lo localizado en condiciones de laboratorio; sin embargo, su efectividad en campo puede incrementarse mediante el empleo de buenas prácticas de manejo en cada una de las etapas del cultivo de los hongos, entre las que se pueden considerar asegurar la calidad del producto que se va aplicar, empleo de dosis correctas, métodos y tiempo de aplicación, y monitoreo, entre otros factores.
Conclusiones
Los seis aislamientos evaluados, presentaron un comportamiento diferencial aun siendo de la misma especie, respecto a patogenicidad contra D. opuntiae, a una concentración de 1 x 108 conidios mL-1. M. anisopliae (Ma130) registró el mayor grado de mortalidad en condiciones de laboratorio.
Consistentemente, el aislamiento Ma130, resultó con la mayor virulencia contra ninfas de segundo instar de D. opuntiae. El valor de la CL50 obtenida es de 6.63 x 107 conidios mL-1. La tasa de mortalidad más alta de ninfas de segundo instar D. opuntiae se presentó entre los 3 y 6 días después de realizada la aplicación.
El aislamiento Ma130, perteneciente a la especie M. anisopliae, podría incluirse en la estrategia de manejo integrado de D. opuntiae como alternativa al empleo de agroquímicos.











 texto en
texto en 


