Introducción
El género Heliconia perteneciente a la familia Heliconiaceae es neotropical, con aproximadamente 200 especies conocidas, varias de ellas ornamentales debido a lo llamativo de sus inflorescencias (Calderón, 2009). Las heliconias son plantas monocotiledóneas, con un crecimiento rizomatoso que emite brotes o vástagos. La altura de estas plantas se encuentra entre los 0.45 m a 10 m. Crecen en áreas húmedas, subhúmedas, tropicales y subtropicales o con sistema de irrigación (Roca et al., 1991). La temperatura óptima para su desarrollo es de 28 ºC con un rango entre 25 y 32 ºC, no soportan las heladas y tampoco producen flores cuando sobrepasan los 35 ºC.
Estas flores no les afecta el fotoperíodo y su floración depende de la temperatura. Deben ser plantadas a pleno sol o en áreas con la mayor parte del día iluminadas por luz solar. El riego ayuda a solventar el déficit hídrico en zonas con precipitaciones medias o bajas al requerimiento (FHIA, 1995). La durabilidad de la inflorescencia en poscosecha varía entre las especies y cultivares, como promedio alcanza 14 días. En la planta puede tener una vida de uno a diez meses, dependiendo de la especie, tamaño y el número de brácteas (Maza et al., 2004). Heliconia stricta Huber, conocida comúnmente como platanillo, representa una alternativa de cultivo para los productores de zonas tropicales húmedas. Al igual que la planta de plátano, tienen un pseudotallo, hecho de vainas de pecíolo de hoja que se superponen para soportar el peso de las flores y las hojas.
Emiten flores generalmente de abril a diciembre en el hemisferio norte, aproximadamente dos meses después del brote del pseudotallo, dependiendo principalmente de las condiciones de temperatura y humedad, cuando el pseudotallo alcanza una altura de alrededor de un metro (Plant care today, 2019a). Cada uno de los pseudotallos florece una sola vez y cuando se completa la floración se derrumba, se seca y muere. Las hojas de la planta se parecen a las de los plátanos, con brácteas de flores que emergen de la planta como un racimo de esos frutos.
Las flores grandes, suculentas y duraderas, tienen tonos de rojo, naranja, amarillo, rosa y verde y tienen una vida de anaquel como flor cortada de 10 a 14 días si se mantienen en agua, aunque también se comercializan como plantas para maceta o jardín, en áreas tropicales o semitropicales como Florida, o incluso en interiores. Las espigas de las flores pueden tener hasta un metro de largo (Plant care today, 2019b).
Las heliconias han cobrado gran importancia en el sector económico, son especies poco conocidas y sus flores tropicales tienen potencial para la floristería (Jerez, 2007). En los últimos años existe un auge en el mundo con el consumo de plantas exóticas tropicales, de ahí que países como Colombia, Ecuador y Costa Rica, explotan mucho su comercialización. Las exportaciones de heliconias son de alrededor de 24 000 a 30 000 tallos al año, dependiendo de las variedades. Canadá, Estados Unidos de América, Holanda y Alemania son los países de destino de estas exportaciones, constituyendo un sector con alto potencial para generar empleo a nivel local y regional (Díaz et al., 2006).
De acuerdo a la importancia económica de las plantas ornamentales, en ellas se ha evaluado la aplicación de hongos micorrízicos para favorecer su aclimatación y como promotores de crecimiento (Oliveira et al., 2011). Esto se debe a que las micorrizas han demostrado tener la capacidad de proveer importantes beneficios a sus hospederos, como son incrementar la absorción de nutrientes como nitrógeno, fósforo y potasio (Bucking et al., 2012), además de favorecer la tolerancia al estrés hídrico (Meddich et al., 2015), a la salinidad (Oztekin et al., 2013) y la protección frente a enfermedades de la raíz y a nemátodos (Wehner et al., 2010; Baum et al., 2015).
Estudios previos en plantas ornamentales y de importancia comercial, pertenecientes a la familia Zingiberaceae tales como Zingiber spectabile Griff y Alpinia purpurata (Vieill.) K. Schum. (Silva et al., 2006), Tapeinochilos ananassae (Hassk.) K. Schum. (Oliveira et al., 2011) y Heliconia psittacorum L. (Santos et al., 2000), han mostrado efectos significativos en colonización micorrízica, crecimiento y obtención de nutrientes.
Los microorganismos de la rizósfera contribuyen al crecimiento vegetal, aumentando la disponibilidad de nutrientes limitantes como el fósforo y el nitrógeno, así como la composición y actividad de la agrupación bacteriana, que está fuertemente influenciada por el tipo de vegetación presente en el suelo (Pedraza et al., 2010). Por otro lado, se ha observado que la asociación micorrízica aumenta el contenido de fósforo en hojas y raíces de Poncirus trifoliata (L.) Raf. (Wu et al., 2011).
Las micorrizas arbusculares son asociaciones simbióticas entre hongos del filo Glomeromycota y la raíz de la mayoría de las plantas. Esta asociación está caracterizada por un intercambio de nutrientes y la generación de diversos beneficios para la planta (Ortíz et al., 2015), principalmente en ecosistemas terrestres y suelos en rehabilitación o restauración (Evas et al., 2012).
Estos microorganismos favorecen la absorción de nutrientes en las plantas, y tienen gran potencial en la agricultura sostenible como fertilizantes orgánicos (Garzón-Gómez y Cuervo-Andrade, 2008). Higa y Parr (2013) mencionaron que el uso de microorganismos benéficos, además de ayudar en la fijación de nitrógeno y descomponer desechos y residuos orgánicos, aumenta el crecimiento y rendimiento de los cultivos.
Los hongos micorrízicos arbusculares (HMA), modifican la morfología de las raíces para mejorar el aumento de la captación de agua y minerales (Abd-Allah et al., 2015), también ayudan a inducir las defensas de las plantas para mejorar la nutrición (He et al., 2017). Existen algunos HMA que tienden a asociarse con algunas especies de plantas hospedadoras debido a su amplia distribución y a que interactúan simbióticamente con una amplia cantidad de plantas y predominan más en asociación con especies de plantas exóticas. Un ejemplo de lo anterior es la Camellia Japonica L. (Theaceae, Theales), una planta exótica Magnoliophyta que tiene más de 3 000 cultivares ornamentales (Borriello et al., 2015).
Por otro lado, el uso de HMA puede contribuir a la fertilidad del suelo mediante la formación de agregados, gracias a su micelio y compuestos orgánicos que lo conforman como lípidos principalmente (Aguilera-Gómez et al., 2007). Montaño et al. (2012) manifiesta que las formaciones de productos fúngicos recalcitrantes contribuyen al secuestro de carbono y por ende, se mitiga la emisión de dióxido de carbono a la atmósfera. Asimismo, menciona que promueven la adaptación y sobrevivencia de las plantas hospedantes que contribuyen a atenuar el estrés abiótico.
El presente experimento se basó en la inoculación de plantas de Heliconia stricta con los HMA (Rhizophagus intraradices, consorcio Zac-19, mezcla de cepas, Acaulospora sp., Glomus callosum y Glomus sp.). Las variables de respuesta fueron altura, número de brotes y tasa fotosintética de las plantas inoculadas, así como nivel de colonización de esporas, tanto en suelo como en raíces. El objetivo de esta investigación consistió en evaluar el desarrollo fisiológico de las plantas de Heliconia stricta Huber al ser inoculadas con cuatro diferentes inóculos de HMA, los cuales fueron Rhizophagus intraradices, consorcio Zac-19, mezcla de cepas, e inóculo nativo (Acaulospora sp., Glomus callosum y Glomus sp.).
Materiales y métodos
Material vegetal
La presente investigación se realizó en el Colegio de Postgraduados Campus Campeche, en Sihochac municipio de Champotón en el estado de Campeche, México. Se ubica en las coordenadas 19° 50’ 21” latitud norte y 90° 58’ 61” longitud oeste, a una altitud de 20 msnm. Se obtuvieron 75 rizomas de un cultivar de Heliconia stricta, seleccionando sólo 50, cada uno con un peso de 250 g, los cuales se lavaron con agua potable para eliminar el suelo y residuos vegetales remanentes. Los rizomas se desinfestaron con Captan ® al 1% durante 30 min y se lavaron con agua potable. Se utilizaron macetas de plástico en color negra para la siembra de los rizomas con capacidad de 2 L.
Éstas se desinfectaron con una solución de NaClO comercial al 2% durante 10 min y se lavaron con agua potable. En cada maceta se colocaron 810 g de sustrato orgánico (Peat-Moss) estéril y se sembró un rizoma a cinco centímetros de profundidad. Las plantas estuvieron en estos recipientes hasta los 120 días después de inoculadas (DDI), donde se regaron cada tercer día y posteriormente, se trasplantaron en camas de siembra en invernadero, donde permanecieron hasta los 220 DDI.
Inóculos micorrízicos
Los HMA utilizados fueron: 1) Rhizophagus intraradices (447 esporas en 20 g de arena, 1 spp); 2) consorcio Zac-19 integrado por Glomus albidum, Claroideoglomus claroideum y Rhizophagus diaphanus (89 esporas en 20 g de arena, 3 spp); 3) mezcla de cepas de Rhizophagus fasciculatus, Funneliformis geosporum, Sclerocystis sinuosa, Glomus sp., Glomus aggregatum, Acaulospora scrobiculata , Claroideoglomus etunicatum y Sclerocystis clavispora (previamente aisladas de huertos de Citrus latifolia Tanaka, Citrus aurantium L. y Carica papaya L., de los estados de Tabasco, Yucatán y Veracruz) (59 esporas en 20 g de arena, 8 spp.), estos tres inóculos forman parte del banco de germoplasma de HMA del área de microbiología de suelos del Colegio de Postgraduados (CP) Campus Montecillo; y el 4).
Inóculo nativo (Acaulospora sp., Glomus callosum y Glomus sp.), aislado de la rizósfera de las plantas de Heliconia establecidas en el campo experimental del campus Campeche del CP (97% de colonización en raíz, 579 esporas en 20 g de suelo, 3 spp.). Los nombres científicos de las especies de HMA mencionados están de acuerdo a la clasificación propuesta por Redecker et al. (2013). Los inóculos micorrízicos no nativos y los nativos se aplicaron a razón de 20 g de inóculo (constituido por esporas, raicillas, hifas y arena) por plántula, directamente en el sistema radical, a los 30 días de emergidas.
Condiciones de cultivo en suelo
Las condiciones físico-químicas del suelo fueron las siguientes: pH de 7.5, conductividad eléctrica (CE) de 1.79 dS m-1, contenido de materia orgánica (MO) de 1.27%, fósforo (P) de 17.52 mg kg-1, potasio (K) de 1.84 cmol+ kg-1, nitrógeno (N) de 0.06%, calcio (Ca) de 48.6 cmol+ kg-1 y magnesio (Mg) 8.4 cmol+ kg-1, con 74.8% de arcilla, 15.5% limo y 9.7% de arena, y clasificación de acuerdo a su textura: arcilla. Se prepararon cinco almácigos de siembra de 12 m de largo, 1.5 m de ancho y 0.3 m de altura, bajo condiciones de invernadero.
El suelo se desinfectó cubriéndolo con polietileno negro doble de calibre 600 y aplicando el fungicida químico busan 30w para inhibir el crecimiento de las micorrizas nativas del suelo, de acuerdo a las instrucciones del fabricante. Se dejó reposar por siete días; posteriormente se removió y se permitió su aireación durante tres días más. Después de transcurrido ese tiempo, se utilizó el mismo suelo para el trasplante. Las plantas provenientes de las macetas se trasplantaron 120 DDI de los HMA en las camas previamente preparadas, considerando una profundidad de cobertura del rizoma con suelo de 5 cm y una distancia entre plantas de 30 cm. Se regó cada tercer día con un sistema de riego por goteo.
Variables de respuesta evaluadas
En la etapa de maceta se midió la altura (cm) de las plantas cada 30 días hasta los 120 DDI, tiempo en el que concluyó la etapa de maceta. Una vez realizado el trasplante en suelo, se continuaron las mediciones de dicha variable cada 20, hasta los 220 DDI. La medición de la altura consideró la longitud desde la base de la planta hasta el ápice de la misma. Además, se evaluó el número de brotes por planta, a partir del trasplante de plantas en suelo, con una frecuencia de cada 20 días hasta los 220 DDI.
Medición de la tasa fotosintética
En cada muestreo, realizado cada 20 días, se eligieron aleatoriamente cinco plantas por tratamiento. Después del trasplante en las camas de siembra en invernadero, se seleccionó una hoja por cada planta para determinar la tasa fotosintética, con un analizador de fotosíntesis IRGA, LI-COR 6400 XT (LI-COR, 2019).
La colonización micorrízica se estimó mediante el procedimiento de clareo y tinción de raíces propuesto por Phillips y Hayman (1970), con observación de las raíces en microscopio óptico LEICA®, CME 1349521X, expresada en porcentaje de colonización.
Diseño experimental y análisis estadístico
Se utilizó un diseño experimental completamente al azar, el cual comprendió cinco tratamientos consistentes de cuatro inóculos de HMA y un control sin inocular, con diez repeticiones por tratamiento. Los datos obtenidos en cada una de las variables de estudio se sistematizaron y sometieron a un análisis de varianza utilizando el programa estadístico Statistical Análisis System (SAS®) versión 2014. En los casos en los que se encontraron efectos significativos de los tratamientos se compararon los valores promedio mediante la prueba de comparación múltiple de medias propuesta por Tukey (p= 0.05).
Resultados
Las plantas inoculadas, en general, tuvieron mayor altura respecto al control durante todo el cultivo, aunque estadísticamente solo las plantas inoculadas con la mezcla de cepas de HMA presentaron mayor altura que el control a los 220 DDI (Cuadro 1) que correspondió con el punto final del experimento (Figura 1).
Cuadro 1 Altura de la planta (cm) en los muestreos, por efecto de la inoculación micorrízica en plantas de Heliconia stricta.
|
Tratamiento |
Días después de la inoculación micorrízica |
|||||||||
|
0 |
30 |
60 |
90 |
120 |
140 |
160 |
180 |
200 |
220 |
|
|
Sin inocular |
23.6a |
28.9b |
30.6b |
32.1b |
35.5b |
36.4c |
37.9c |
40.4c |
41.4c |
44.9b |
|
Rhizophagus Intraradices |
24.5a |
32.3ab |
35.3a |
37.7a |
39.1a |
40.1b |
41b |
42.3b |
44.2b |
48.3ab |
|
Glomus Zac-19 |
29.2a |
33.9a |
36.9a |
38.3a |
40.3a |
40.6ab |
42.1ab |
42.3b |
43.8b |
46.2b |
|
Mezcla de cepas |
25.6a |
34.8a |
37.2a |
38.9a |
41a |
42.2a |
42.9a |
44.2a |
46.6a |
50.6a |
|
Inóculo nativo |
27a |
33.7a |
36a |
37.7a |
39.3a |
40.2ab |
41.2b |
42.1b |
43.1bc |
47ab |
|
5.6 |
4.5 |
4.1 |
3.5 |
2 |
2 |
1.4 |
1.3 |
2.2 |
4.2 |
|
DMS= diferencia mínima significativa; Tukey, p= 0.05. Medias seguidas de la misma letra en columna no son estadísticamente diferentes
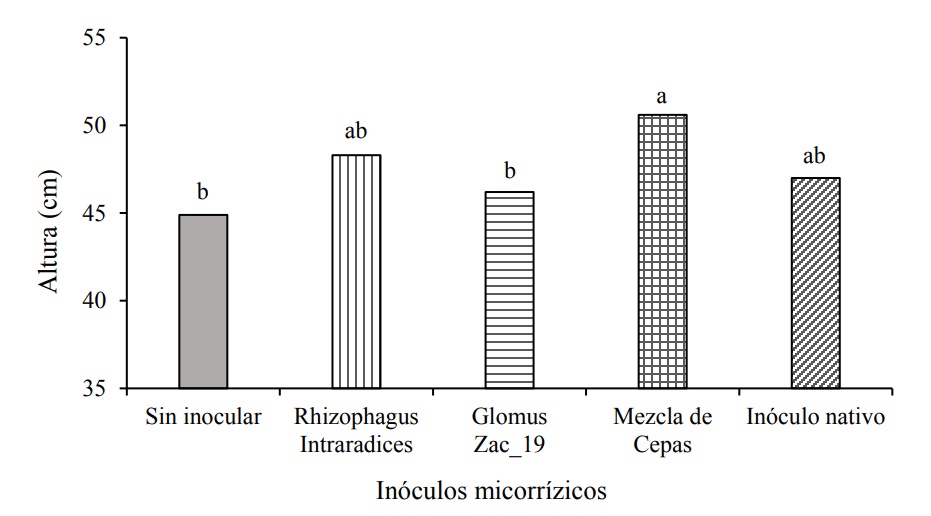
Figura 1 Efecto de la inoculación de hongos micorrízicos arbusculares en la altura de plantas de Heliconia stricta, a los 220 días después de la inoculación (DDI). Medias seguidas de letras idénticas son estadísticamente iguales (Tukey, p= 0.05).
Durante el período de muestreos de 30 a 200 DDI no se presentaron diferencias estadísticas para el número de brotes por planta (Cuadro 2). Sin embargo, a los 220 DDI el número de brotes por planta fue estadísticamente diferente entre tratamientos (Figura 2), lo que puede atribuirse al efecto de la inoculación micorrízica. El tratamiento con R. intraradices presentó estadísticamente el mayor número de brotes por planta en relación con los otros tratamientos y tanto la mezcla de cepas como el inóculo nativo, presentaron estadísticamente el mismo número de brotes que el control.
Cuadro 2 Número de brotes por planta promedio en plantas de Heliconia stricta en los diferentes muestreos, por efecto de la inoculación micorrízica.
|
Tratamiento |
Días después de la inoculación micorrízica |
|||||
|
120 |
140 |
160 |
180 |
200 |
220 |
|
|
Sin inocular |
1.7a |
4.2a |
6.6a |
8.8ab |
12.7bc |
15.4cd |
|
Rhizophagus intraradices |
2.1a |
5.3a |
7.2a |
10.3ab |
16.3a |
21.8a |
|
Glomus Zac-19 |
1.8a |
4.9a |
7.4a |
11a |
15.3ab |
20.6ab |
|
Mezcla de cepas |
1.6a |
4.2a |
6.1a |
8b |
11.9c |
13.7d |
|
Inóculo nativo |
1.5a |
3.9a |
6.3a |
8.4b |
14.1abc |
17.8bc |
|
0.7 |
1.5 |
1.8 |
2.3 |
2.8 |
3.7 |
|
DMS= diferencia mínima significativa; Tukey, p=0.05. Medias seguidas de la misma letra en columna no son estadísticamente diferentes.
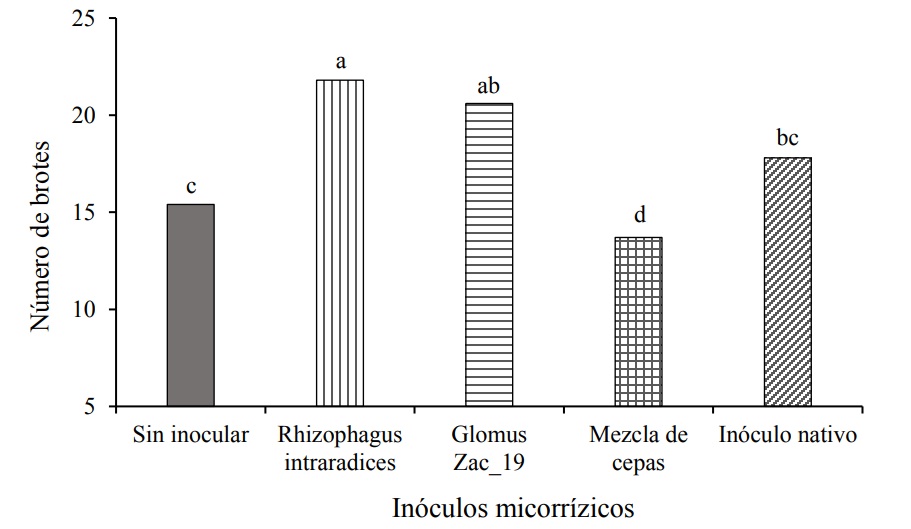
Figura 2 . Efecto de la inoculación de hongos micorrízicos arbusculares en el número de brotes por planta de Heliconia stricta a los 220 DDI. Medias seguidas de letras idénticas, son estadísticamente iguales (Tukey, p= 0.05).
Durante el período de muestreos de los 30 a los 120 DDI no se presentaron diferencias estadísticas para la tasa fotosintética de las plantas. La inoculación micorrízica produjo diferencias significativas sobre esta variable sólo a partir de los 140 DDI. Las plantas inoculadas con Rhizophagus intraradices presentaron mayor tasa fotosintética, respecto al control, lo que no se observó para Zac-19, la mezcla de cepas y el inóculo nativo. Lo anterior, puede deberse a que las plantas de heliconia tienden a asociarse más con las cepas del hongo Rhizophagus intraradices que con el resto de las cepas empleadas en el trabajo. Esta misma cepa produjo una altura y un número de brotes significativamente mayores que el resto.
A los 240 DDI las plantas tratadas con el consorcio Zac-19 mostraron estadísticamente la menor tasa fotosintética respecto a los otros tratamientos, incluyendo al control (Figura 3, Cuadro 3).
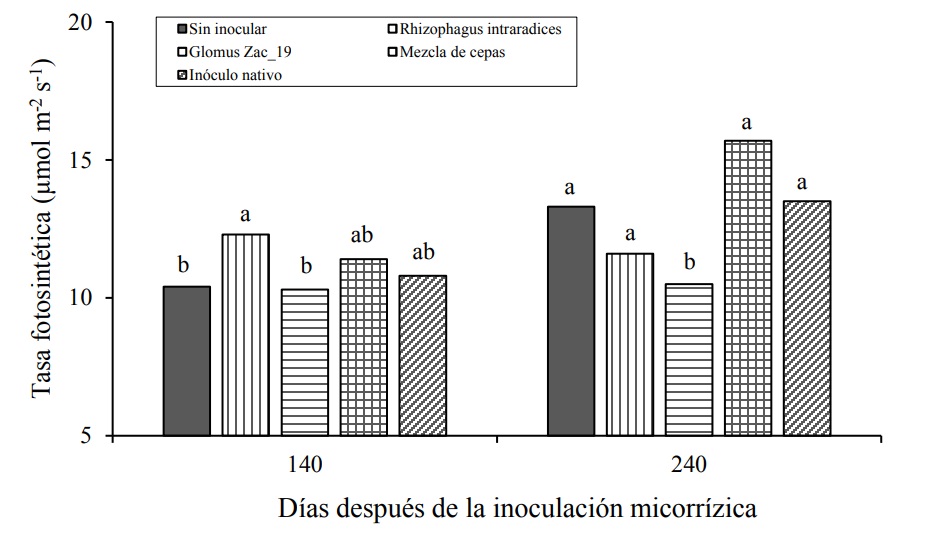
Figura 3 . Efecto de la inoculación con hongos micorrízicos sobre la tasa fotosintética (µmol m-2 s-1) en plantas de Heliconia stricta.
Cuadro 3 Tasa fotosintética promedio en plantas (hora) de Heliconia stricta en los diferentes muestreos por efecto de la inoculación.
|
Tratamiento |
Días después de la inoculación micorrízica |
|||||
|
120 |
140 |
160 |
180 |
200 |
240 |
|
|
Sin inocular |
4.2a |
10.4b |
14.6a |
8.5a |
13.9a |
13.3a |
|
Rhizophagus intraradices |
1bc |
12.3a |
10.6a |
10.2a |
13.1a |
11.6a |
|
Glomus Zac-19 |
0.8c |
10.3b |
9.1a |
11.3a |
12.7a |
10.5b |
|
Mezcla de cepas |
1.1bc |
11.4ab |
10.5a |
10.7a |
14.6a |
15.7a |
|
Inóculo nativo |
1.7b |
10.8ab |
14.6a |
13a |
13.6a |
13.5a |
|
DMS (Tukey p= 0.05) |
1.5 |
0.8 |
6.4 |
7.6 |
4.9 |
5.2 |
DMS= diferencia mínima significativa; Tukey, p= 0.05. Medias seguidas de la misma letra en columna no son estadísticamente diferentes.
Las medias, seguidas de letras idénticas sobre las barras en su correspondiente día de muestreo, son estadísticamente iguales (Tukey, p= 0.05). Cada barra corresponde a un tratamiento diferente: Control, Rhizophagus intraradices, consorcio Zac-19, mezcla de cepas e inóculo nativo, a los 140 (izquierda) y 240 DDI (derecha).
La colonización micorrízica de la raíz mostró diferencias estadísticas significativas (Tukey, p≤ 0.05) por efecto de los tratamientos de HMA únicamente a partir de los 120 DDI edad del cultivo, lo que podría explicarse por el tiempo que toman los hongos micorrízicos en infectar la raíz de las plantas de heliconia. Los tratamientos con mayor colonización micorrízica total, significativamente diferentes del testigo, correspondieron al inóculo nativo y con la inoculación de la mezcla de cepas (Figura 4). Se contempló, que las raíces del control mostraron una colonización micorrízica que se presentó de forma natural sin diferencias estadísticas significativas con la colonización de las raíces de las plantas inoculadas con R. intraradices y con consorcio Zac-19 (Cuadro 4).
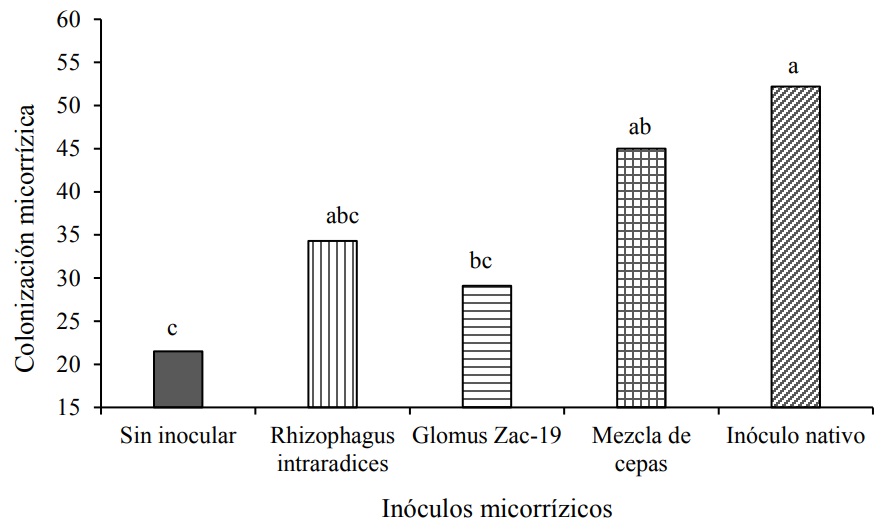
Figura 4 . Efecto de la inoculación a base de HMA sobre la colonización micorrízica (número de esporas promedio por segmento de raíz) de Heliconia stricta a los 220 DDI del cultivo. Medias seguidas de letras idénticas son estadísticamente iguales (Tukey, p= 0.05).
Cuadro 4 Colonización micorrízica (%) en raíz de plantas de Heliconia stricta en los diferentes muestreos, por efecto de la inoculación.
|
Tratamiento |
Días después de la inoculación micorrízica |
|||
|
120 |
150 |
180 |
220 |
|
|
Sin inocular |
0.1a |
1.2b |
7.2b |
21.5c |
|
Rhizophagus intraradices |
0.3a |
1.2b |
9.3ab |
34.3abc |
|
Glomus Zac-19 |
0.1a |
3.7b |
10.2ab |
29.1bc |
|
Mezcla de cepas |
0.3a |
13.3a |
25.8 |
45ab |
|
Inóculo nativo |
0.3a |
5ab |
20.3ab |
52.2 |
|
0.4 |
9.2 |
16.6 |
18.3 |
|
DMS= diferencia mínima significativa; Tukey, p= 0.05. Medias seguidas de la misma letra en columna no son estadísticamente diferentes.
Discusión
Los resultados obtenidos en el presente trabajo denotan efectos significativos de la inoculación de las plantas con diferentes cepas de hongos micorrízicos en la mayoría de las variables de respuesta evaluadas. En la altura de la planta, la mezcla de cepas de HMA produjo valores estadísticamente mayores que el tratamiento control (p≤ 0.05) a los 220 DDI. En resultados similares se han observado con la inoculación de HMA en Calendula en donde se estudió una relación entre la colonización de las raíces y el efecto del crecimiento (Vaingankar y Rodríguez, 2015).
En otros estudios existió un aumento en el crecimiento y la supervivencia de C. papaya cuando fueron inoculadas con micorrizas de consorcios nativos (Montaño et al., 2012). Vaingankar y Rodríguez (2015) también se analizó un aumento de la altura de planta en Tagetes erecta y Zinnia elegans con la inoculación de HMA. Vaingankar y Rodríguez (2015) demostraron que la aplicación de HMA tuvo un efecto significativo en la altura de la planta Crossandra infundibuliformis. El tratamiento mezcla de cepas, contiene más número de especies en comparación con los otros tratamientos; por lo tanto, se le atribuye a que por eso presentó mayor altura, aunque se percibió menor número de colonización en las raíces.
Esto se puede comparar con estudios realizados en plantas de orquídeas con respecto a la colonización, efectos de la inoculación y el crecimiento (Zhao et al., 2014) y en tomate con Glomus (Banuelos et al., 2014). Entonces no necesariamente debe tener una alta colonización para observar el efecto de los hongos en las plantas, más bien depende de la especie del hongo y el tipo de planta.
Por otra parte, las plantas no inoculadas mostraron una altura estadísticamente similar que la altura de las que fueron inoculadas con el resto de los tratamientos evaluados, en los que se presentó colonización, pero no promoción de crecimiento.
Aunque los HMA están morfológicamente restringidos a las raíces, se ha demostrado que la colonización afecta benéficamente las raíces y los brotes (Romero et al., 2017). Este mismo comportamiento se observó en el presente trabajo, en donde se verificó un aumento en el número de brotes por planta en todos los tratamientos, aunque únicamente Rhizophagus intraradices y Zac-19 indujeron valores significativamente mayores que el testigo a los 220 DDI.
En otros estudios se ha observado que, Camellia Sinensis ha demostrado colonización y una producción de brotes (Borriello et al., 2015). Vaingankar y Rodríguez (2015) y Perner et al. (2007) reportaron un aumento en el número de brotes y flores con HMA en Tagetes erecta, Zinnia elegans, Callistephus, Pelargonium y tomate. Un hallazgo significativo de estos estudios para la horticultura práctica fue el aumento del número de brotes con la inoculación con HMA. Según los estándares de calidad comercial de la planta, un mayor número de brotes es deseable puesto que cada brote constituye una flor potencial de buena calidad si el manejo en cuanto a humedad y nutrición de la planta es el adecuado. En el presente trabajo el uso de HMA produjo un mayor número de brotes y una altura de planta significativamente mayor.
Los HMA modifican a menudo el intercambio gaseoso de la planta (Augé et al., 2016). La velocidad de fotosíntesis, la conductancia estomática (gs) y la transpiración (E) son a menudo más altas en las plantas con HMA respecto a los controles. En este estudio se encontró que la tasa fotosintética a los 140 DDI en el tratamiento con Rhizophagus intraradices fue significativamente mayor que con el consorcio Zac-19 y con el testigo. Estos resultados son similares a lo encontrado en cultivos como maíz y arroz por Andrade et al. (2015). La inoculación de HMA puede mejorar la tasa fotosintética, el crecimiento y el desarrollo de las plantas (He et al., 2017).
La actividad fotosintética aumentada de las plantas con HMA podría deberse a factores no estomáticos como un mayor contenido de clorofila, y de actividad de rubisco (Porcel et al., 2015). Porcel et al. (2015) señalan que los hongos mejoran el intercambio de carbohidratos y estimulan la tasa de fotosíntesis. Los autores demostraron la modulación de la eficiencia de la fotosíntesis por la simbiosis HMA en plantas de rosa, pistacho, álamo y cítricos. El aumento en la tasa fotosintética, observada en el presente trabajo con el uso de HMA, conduce a una reducción en el ciclo de la planta, lo que en este caso resulta benéfico por reducir el tiempo a la obtención de flores. No obstante, hasta donde sabemos no existen reportes en la literatura científica que hayan evaluado ese aspecto, como tampoco su efecto en el tamaño y calidad de las flores de heliconia.
Con relación a la colonización micorrízica en raíz de las plantas de H. stricta, se observó una micorrización significativamente mayor (p≤ 0.05) con el inóculo nativo y con la mezcla de cepas, a 220 DDI, respecto al control. Estos resultados son similares con Borriello et al. (2015), quienes inocularon HMA en Camellia exóticas, encontrando altos niveles de micorrización.
En otros estudios se ha observado que las plantas de arroz son colonizadas por Claroideoglomus etunicatum (Porcel et al., 2015), lo que es comparable con los resultados encontrados en el presente trabajo, tanto con el inóculo nativo como con la mezcla de cepas, puesto que ambas colonizaron las raíces de heliconia, destacando el inóculo nativo. Cabe mencionar, que en otros estudios se ha observado que los insectos pueden influir en la colonización de raíces por HMA y por lo tanto afectar el crecimiento de las plantas (He et al., 2017).
Conclusiones
El cultivo de Heliconia stricta en invernadero se vio favorecido por la inoculación micorrízica, lo que se tradujo en mejor desarrollo de las plantas, con un crecimiento significativamente mayor, mayor número de brotes y tasa fotosintética estadísticamente más elevada. Se observó un efecto benéfico de la inoculación micorrízica sobre el crecimiento de Heliconia stricta, el cual se pudo observar en las diferentes variables de estudio evaluadas, las cuales tuvieron un comportamiento estadísticamente superior con los tratamientos mezcla de cepas e inóculo nativo. Tales efectos se tradujeron en un mejor desarrollo de las plantas, especialmente del inóculo nativo de la zona.











 text in
text in 


