Características generales de los compuestos orgánicos volátiles de las plantas
Las plantas sintetizan y emiten una gran variedad de compuestos orgánicos volátiles, los cuales poseen funciones ecológicas importantes. En la mayoría de los casos, a temperatura ambiente los compuestos orgánicos volátiles de las plantas son gases, algunos son emitidos por las plantas especialmente de las partes vegetativas cuando están expuestas a estimulo biótico o abiótico (Scala et al., 2013; Dong et al., 2016). Los compuestos orgánicos volátiles son importantes para las plantas, como mecanismos de defensa para repeler insectos o detener la colonización por bacterias y hongos patógenos, para promover la reproducción, al atraer polinizadores o dispersores de semillas, son mensajeros intraespecíficos e interespecíficos (Marín y Céspedes, 2007; Ángeles et al., 2012; Dicke et al., 2017).
Además, estos compuestos orgánicos volátiles inducidos por herbívoros, los cuáles consisten en olores liberados por las plantas, sirven como señales importantes para parasitoides y depredadores para ubicar a su hospedante o presa (Ponzio et al., 2013; Schettino, 2017). También influyen en la dinámica de la comunidad (Figura 1), al inducir señalización fitohormonal con el subsecuente arribo de otros herbívoros y por lo tanto, originando interacciones de las plantas con otros miembros de la comunidad (Dicke y Baldwin, 2010; Stam et al., 2014; Mofikoya et al., 2017).
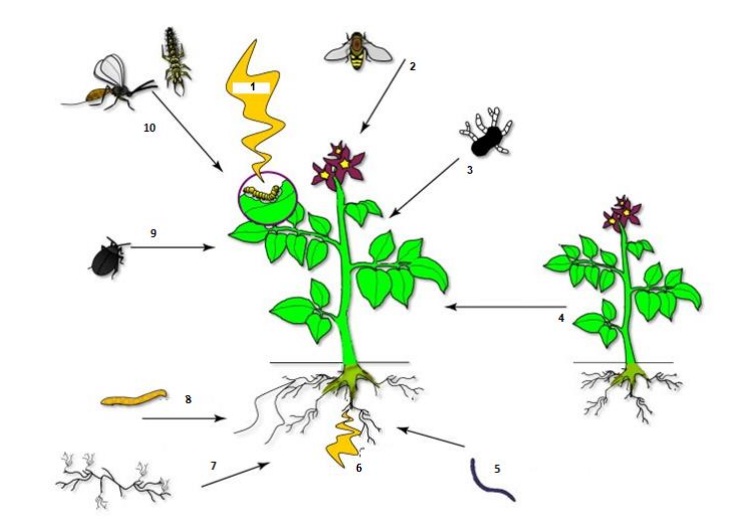
Figura 1 1) planta dañada por un herbívoro emite semioquímicos, los cuales interactúan con: 2) polinizador; 3) patógeno; 4) competidor o planta parasita; 5) nemátodo entomopatógeno; 6) producción de semioquímicos sistémicos; 7) micorriza; 8 y 9) herbívoro; y 10) entomófagos (modificado de Dicke and Baldwin, 2010).
Algunos autores mencionan, que los compuestos volátiles actúan como disuasivos de alimentación y de oviposición en insectos plaga (Ignacimuthu et al., 2011; Hijaz et al., 2016).
Por otro lado, los compuestos orgánicos volátiles en los ecosistemas no solo modulan las interacciones entre miembros de distintos niveles tróficos, sino que también juegan un papel importante en la química de la atmosfera, los herbívoros inducen una respuesta bioquímica en el lugar de daño (respuesta local inducida) y los metabolitos secundarios inducidos en este lugar pueden migrar a otros tejidos de la planta y activar la resistencia química en toda la planta (respuesta sistémica inducida) (Bautista et al., 2012a).
Los compuestos orgánicos volátiles son producidos y emitidos por hojas, frutos, flores y raíces, pero principalmente se liberan; a través, de la superficie y sitios de almacenamiento en las hojas, están influenciados por factores ambientales como temperatura, humedad y disponibilidad de nutrientes (Sharma et al., 2012; Kallenbach et al., 2014).
Con el entendimiento del papel que juegan los semioquímicos en la ecología y en los mecanismos de emisión de los compuestos orgánicos volátiles de las plantas inducidos por herbívoros, se abren caminos para desarrollar nuevas estrategias en programas de control biológico y etológico, con el objetivo de mejorar la eficacia de los enemigos naturales en la supresión de poblaciones de plagas en los cultivos (Peñaflor y Bento, 2013). Asimismo, las plantas han desarrollado habilidades perceptivas que les permiten monitorear y responder a una amplia gama de condiciones bióticas y abióticas cambiantes, influyendo profundamente en sus interacciones con otros organismos (Mescher y De Moraes, 2015).
Clasificación de los compuestos orgánicos volátiles de las plantas
La mayoría de los compuestos orgánicos volátiles de las plantas son productos o subproductos de rutas metabólicas primarias. En base a su origen biosintético, los compuestos orgánicos volátiles se dividen en cuatro principales vías metabólicas (Figura 2): 1) del shikimato-fenilalanina; 2) del ácido mevalónico (MVA); 3) del metileritritol fosfato (MEP); y 4) de la lipoxigenasa (LOX), estas vías regulan la emisión de compuestos benzenoides, penilpropanoides, sesquiterpenos, monoterpenos, hemiterpenos, diterpenos, volátiles derivados de carotenoides y metil jasmonato, así como volátiles de hoja verde (Dudareva et al., 2004; Dudareva et al., 2013).

Figura 2 Cuatro principales vías metabólicas de compuestos orgánicos volátiles de las plantas. 1) shikimato-fenilalanina; 2) ácido mevalónico (MVA); 3) metileritritol fosfato (MEP); y 4) lipoxigenasa (LOX). Las flechas apiladas ilustran múltiples reacciones enzimáticas. Abreviaturas: DAHP, 3-desoxi-D-arabinoheptulosonato-7 fosfato; DMAPP, dimetilalil pirofosfato; E4P, eritrosa 4-fosfato; FPP, farnesil pirofosfato; GGPP, geranilgeranil pirofosfato; GPP, geranil pirofosfato; IPP, isopentenil pirofosfato; NPP, neril pirofosfato; PEP, fosfoenolpiruvato; Phe, fenilalanina (modificado de Dudavera et al., 2013).
Los terpenos representan el grupo más diverso de compuestos volátiles, los cuales se clasifican de acuerdo con el número de carbonos en su cadena, incluidos hemiterpenos (C5), monoterpenos (C10), sesquiterpeno (C15), homoterpenos (C11 y C16), algunos diterpenos (C20) y triterpeno (C30), también están los compuestos de azufre orgánicos volátiles como el dimetilsulfuro y el metanotiol (Heil y Karban, 2010; Scala et al., 2013; Vivaldo et al., 2017).
Kallenbach et al. (2014), realizó una clasificación de 38 compuestos volátiles para análisis en experimentos de campo; comprende volátiles de hoja verde: 3 (Z) -hexeno-1-al, 2 (E) -hexeno-1-al, 3 (Z) -hexeno-1-ol, 2 (E) -hexeno-1-ol, Hexan- 1-ol, 3 (Z) -hexeno-1-ol-acetato, 3 (Z) -hexenilisobutanoato, 3 (Z) -hexenilbutanoato, 3 (Z) -hexenil-2-me-butanoato, 3 (Z) -hexenilvalerato, 3 (Z) -hexenil- (E) -2-me-butenoato y 3 (Z) -hexenilcaproato; monoterpenos: α-pineno, β-mirceno, (Z) -β-ocimeno, (E) -β-ocimeno, linalol, a-terpinol y geraniol; sesquiterpenos: elemeno isomero, β-cariofileno, a-duprezianeno, (E)-α-bergamoteno, sesquiterpeno 1, sesquiterpeno 2, sesquiterpeno 3, (E) -β-farneseno, sesquiterpeno 4, 5’-epi-aristolocheno, sesquiterpeno 5, sesquiterpeno 6, sesquiterpeno 7, sesquiterpeno 8, sesquiterpeno 9 y óxido de sesquiterpeno; otros compuestos: alcohol bencílico, acetona de bencilo y nicotina.
Algunos autores como Heil (2014), mencionan a pequeñas moléculas de C6, que participan en la comunicación en la misma planta y plantas vecinas. También Zhang et al. (2015), los clasifica en ácido jasmónico, ácido salicílico y vías de señalización de etileno. Martínez (2013), desarrolló una nomenclatura de semioquímicos basada en dos tipos: 1) feromonas, las cuales median interacciones entre organismos de una misma especie y la interacción en general resulta beneficiosa tanto para el emisor como para el receptor; y 2) aleloquímicos: kairomonas, median interacciones entre especies diferentes, son los compuestos que favorecen al receptor pero no al emisor alomonas, son favorables al emisor pero no al receptor y las sinomonas, que son favorables a ambos.
Técnicas de extracción y análisis de los compuestos orgánicos volátiles de las plantas
Existen varias metodologías para la extracción y análisis de los compuestos orgánicos volátiles obtenidos de las plantas, aunque la mayoría de los volátiles, para su análisis cuantitativo y cualitativo son obtenidos y analizados por cromatografía de gases y acoplado a espectrometría de masas (CG-EM) (Moraes et al., 2008). Chaverri y Cicció (2015), mediante esta técnica de CG-EM analizaron la composición química de los aceites de hojas y frutas de pimienta silvestre Pimenta guatemalensis (Lundell), obteniendo β-caryophyleno, terpinoleno, eugenol y sesquiterpenos.
Así también, Michereff et al. (2011), por CG-EM determinó alta producción de compuestos volátiles (E, E) -α-farneseno, salicilato de metilo, (Z) -3- hexenil acetato y (E) -2-octen-1-ol, en estudios realizados sobre volátiles emitidos por el daño de herbívoros en plantas resistentes, comparado con plantas susceptibles de soya (Glycine max L.), también menciona que (E) -2-octen-1-ol, no fue determinado en plantas susceptibles. En este sentido, Panighel y Flamini (2014), mencionan que la técnica de CG-EM puede ser utilizada para analizar los volátiles como monoterpenos y metoxipirazinas en uva y vino, siendo una técnica rápida y simple.
Heredia et al. (2016), utilizando esta técnica identificaron 82 compuestos en hojas de la especie vegetal Zanthoxylum pistacifolium Griseb., predominando derivados terpenoides y como compuestos mayoritarios el α-pineno (12.35%), linalol (6.68%), 2,6-dimetil-2, 4, 6-octatrieno (6.50%), limoneno (6.19%) y fitol (6.06%). Una modificación a la técnica (CG-EM), es por espectrometría de masas de ionización química suave, esta técnica ha sido desarrolladas y utilizadas principalmente por físicos y científicos analíticos, que las han utilizado en una amplia gama de áreas científicas de investigaciones; por ejemplo: aroma, biomarcadores de enfermedades, detección de compuestos peligrosos, química atmosférica (Materic et al., 2015). Vidal et al. (2016), mediante esta técnica acoplada a electroantenográfico (CG-EAG) realizaron la identificación y síntesis de la feromona sexual (Z) -tricos-11-ene, en volátiles liberados por adultos machos del escarabajo soldado Chauliognathus fallax Germar.
Otra modificación a la técnica de CG, es por microextracción en fase sólida acoplados con cromatografía de gases y espectrometría (MEFS-CGEM), Raffo et al. (2018), mediante ésta técnica identificó los compuestos (Z) - y (E) -3-hexenal, (Z) - 1,5-octadien-3-one, junto con 4-mercaptobutilo y 4- (metiltio) butil isotiocianato en hojas de eruca Eruca sativa L. y Diplotaxis tenuifolia L. También Darshanee et al. (2017), mediante esta técnica evaluaron plantas de tomate (Solanum lycopersicum L.) para determinar los compuestos químicos que atraen a mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood), identificando volátiles (Z) -3-hexen-1-ol, a-pineno, (E) - β-cariofileno, α-humuleno y azuleno. Por su parte, Souza et al. (2017), mencionan que esta técnica podría abrir nuevas perspectivas y oportunidades en estudios agrícolas y ecológicos, para la detección e identificación de emisiones de compuestos orgánicos volátiles de las plantas inducidos por herbívoros.
Aplicación de los compuestos orgánicos volátiles de las plantas
Los compuestos orgánicos volátiles de las plantas desarrollan un papel preponderante en el ciclo de vida de las plantas al transmitir y proporcionar información con el ambiente que las rodea, poseen propiedades tan diversas que generan redes interactivas complejas, con implicaciones ecológicas, fisiológicas y atmosféricas (Marín y Céspedes, 2007). También podrían explotarse como una herramienta importante para el manejo de plagas, para reducir las cantidades de insecticidas utilizados para su control, la resistencia de las plantas a los insectos, particularmente la resistencia inducida, también puede ser manipulada con el uso de elicitores químicos de metabolitos secundarios, que confieren resistencia a los insectos (Sharma et al., 2012).
También pueden ser explotados en las estrategias de un manejo integrado de plagas, como incrementar el control biológico con el fin de mejorar en el control de plagas en los cultivos (Peñaflor y Bento, 2013). Tosh y Brogan (2015), mencionan que el uso de compuestos volátiles orgánicos de plantas podría cambiar profundamente el comportamiento de los insectos que se alimentan de las mismas. Además, la defensa de las plantas contra herbívoros y patógenos implica la participación de una enorme gama de metabolitos diferentes, algunos de los cuales actúan directamente como armas defensivas contra enemigos (toxinas o disuasivos), por ejemplo, dos grupos de armas defensivas bien estudiadas son los glucosinolatos y benzoxazinoides, que desencadenan la acumulación de polisacáridos protectores como una barrera contra áfidos y patógenos (Maag et al., 2014).
Por otro lado, se ha visto que la acumulación de metabolitos secundarios volátiles en la comunicación entre plantas y otros organismos, representa una alternativa para la protección sostenible de los cultivos, la comunicación de las plantas se ha ampliado a organismos antagónicos a las plagas y de planta a planta (Pickett y Khan, 2016).
Otros compuestos volátiles como las feromonas de insectos ofrecen un potencial para controlar las plagas de los cultivos, su volatilidad e inestabilidad son problemas para el despliegue en la agricultura, pero podrían resolverse expresando genes que codifican para la biosíntesis de feromonas en las plantas de cultivo, esto se ha logrado mediante la ingeniería genética de un hexaploide en una variedad de trigo Triticum aestivum L., para incrementar la liberación de (E) -β-farneseno (Eβf) para repeler poblaciones de áfidos Sitobion avenae (Fabricius), Rhopalosiphum padi (L.) y Metopolophium dirhodum (Walker) (Bruce et al., 2015).
También el ácido salicílico induce resistencia en las plantas contra patógenos biotróficos e insectos que se alimentan del floema, las aplicaciones de ácido salicílico podrían usarse para repeler, reducir la fecundidad, longevidad y supervivencia de la mosca blanca (Bemisia tabaci Gennadius) en los cultivos, aplicaciones de ácido salicílico también aumentan la cantidad y la composición de volátiles liberados por las plantas, especialmente la cantidad de metil salicilato y δ-limoneno (Shi et al., 2016).
Bleeker et al. (2009), determinaron que los compuestos volátiles sesquiterpenos zingibereno y curcumeno, y los monoterpenos: p-cimeno, α-terpineno y α-felandreno, estaban implicados en las interacciones tomate y mosca blanca; por lo tanto, puede ser factible alterar el comportamiento de elección de la mosca blanca mediante la manipulación de la composición de terpenoides. Du et al. (2016), evaluaron siete productos químicos volátiles repelentes y sus combinaciones para reducir las densidades de población de mosca blanca B. tabaci biotipo Q, en cultivo de tomate en invernaderos, la mezcla de DLCO (D-limoneno, citral y aceite de oliva (63:7:30) tuvo un mejor rendimiento (SC50= 22.59 mg ml-1) para repeler las moscas blancas y bajo costo debido al precio más bajo del aceite de oliva que los otros productos químicos utilizados y lo señalan como un nuevo repelente con potencial para el control de las moscas blancas.
Laredo et al. (2017), menciona al ácido jasmónico induciendo resistencia local y sistémica hacia enfermedades y se espera que permita desarrollar un nuevo y efectivo agente de control de plagas que ayuden a la planta a defenderse contra sus enemigos; sin embargo, se requiere aun de una serie de investigaciones en laboratorio y campo para comprender el comportamiento biológico de este ácido. Züst y Agrawal (2016), en estudios recientes, incluyeron la identificación de proteínas salivales de áfidos involucrados en la manipulación de plantas hospedadoras y receptores de plantas involucrados en el reconocimiento de áfidos.
En estudios realizados por Mofikoya et al. (2017), los resultados indican que la adsorción pasiva y la re-liberación de un monoterpeno volátil pueden ocurrir en naturaleza; sin embargo, este proceso depende de la distancia entre la fuente emisora y las plantas receptoras, así como concentración de contaminantes atmosféricos en el aire. Por lo tanto, en el uso en campo de compuestos volátiles vegetales en el control moderno de plagas, deben considerarse los efectos de las distancias y la contaminación del aire.
Estudio de los compuestos orgánicos volátiles de las plantas en México
El estudio de los compuestos orgánicos volátiles de las plantas en el ámbito internacional se inició en la década de los ochentas, en México prácticamente inició en el nuevo milenio. La literatura reportó trabajos en diferentes áreas, en esta revisión se mencionan a continuación algunos trabajos realizados en el país. Calyecac et al. (2006), en ensayos de atracción en laboratorio e invernadero indican que la combinación de volátiles atrayentes liberados por el macho picudo del tomate de cáscara Trichobaris championi B., más los liberados por su hospedante tomate de cáscara Physalis ixocarpa Brot., proporcionan mejor estímulo de atracción para el picudo del tomate de cáscara.
También en tomate de cáscara Physalis philadelphica Lam., utilizando MEFS-CGEM, se identificaron los volátiles salicilato de metilo, β-cariofileno, β-pineno, 3-careno, alcohol bencílico, β-elemeno, decanal y germecreno D (Calyecac et al., 2007).
Por otro lado, en aguacate criollo silvestre Persea americana var. drymifolia (Schltdl et Cham.) S. F. Blake, se determinó el perfil químico foliar por cromatografía de gases acoplada a espectrometría de masas (CG-EM), los compuestos más abundantes fueron estragol (22 a 72%) y cariofileno (9 a 16%), esta variación química podría ser importante para identificar árboles con fenotipos químicos relevantes y como fuente de genes de resistencia contra insectos plaga y enfermedades de variedades comerciales de aguacate Persea americana Mill. (Torres et al., 2009). Asimismo, se realizó la extracción de compuestos volátiles de la albahaca (Ocimum basilicum L.), mediante (MEFS) y analizados en (CG-EM), se identificaron 25 compuestos volátiles como fenilpropanoides, monoterpenos, sesquiterpenos, ésteres y aldehídos (González et al., 2011).
Estudios realizados por Ángeles et al. (2012), detectaron un total de 36 compuestos orgánicos volátiles diferentes, 23 terpenoides, decanal, decano y salicilato de metilo; producidos por plantas de tomate infestadas con mosca blanca de los invernaderos. También se analizaron los componentes volátiles asociados al aroma del chile piquín (Capsicum annuum L. var. glabriusculum), mediante (MEFS) y analizados en (CG-EM); el análisis identificó compuestos ésteres, sesquiterpenos, alcoholes y alcanos (Vázquez et al., 2015).
Bautista y Espinosa (2013), evaluaron la variación de emisiones de compuestos orgánicos volátiles o uniformidad entre individuos de tomate en respuesta a diferentes daños; la identificación de los volátiles fue por (CG-EM); once compuestos volátiles fueron identificados: 3-hexanol, α-pineno, o-cymeno, β-myrceno, (+)-4- carene, α-phellandreno, α-terpineno, p-cymeno, β-phellandreno, nonanal y decanal. Por otro lado, compuestos orgánicos volátiles individuales como limoneno, linalol, nonanal, metil salicilato y metilo jasmonato, a concentraciones naturales inhibieron la germinación de conidios del hongo Colletotrichum lindemuthianum (Sacc. & Magnus) Briosi & Cavara, en frijol Phaseolus vulgaris L., fueron analizadas por cromatografía de gases acoplada a espectrometría de masas de ionización electrónica (CG-EMIES) (Quintana et al., 2014).
El frijol lima (Phaseolus lunatus L.) se ha empleado para estudiar la interacción entre las plantas, hormigas y polinizadores y sus consecuencias para la reproducción de la planta, se realizaron dos experimentos de campo en los que se manipuló la presencia de hormigas y producción de néctar por inducción con ácido jasmónico (JA), las plantas inducidas por JA sin hormigas produjeron un mayor número de semillas en comparación con las plantas tratadas con JA con hormigas (Hernández et al., 2016). En plantas de jícama cultivada Pachyrhizus erosus L. y silvestre P. ferrugineus (Piper) Sorenson, se identificaron los compuestos orgánicos volátiles mediante (MEFS) y analizados en (CG-EM), en P. erosus se encontraron 21 compuestos, siendo los más abundantes: ciclohexanona (32.8%), 3-hexen-1-ol (Z) (32.7%) y 3-hexenal (Z) (10.5%), en P. ferrugineus se encontraron 11 compuestos, los más abundantes fueron: 5-hexen-1-ol acetato (51.5%), undecanal (22.4%) y 2-hepten-1-al (14.5%) (Estrella et al., 2016).
Bautista et al. (2017), aislaron compuestos volátiles y no volátiles de cactus muérdago Rhipsalis baccifera (J. S. Muell.) Stearn, por extracción en disolvente orgánico, hidrodestilación, aireación dinámica, se identificaron y analizaron por MEFS, se detectaron metabolitos como cetonas, alcoholes, alcanos, monoterpenos, compuestos aromáticos y un éster. En otro estudio analizaron el aceite esencial de las partes aéreas de salvia Salvia ballotiflora Benth., utilizando (CG-EM), se determinó que posee propiedades insecticidas contra el gusano cogollero del maíz Spodoptera frugiperda Smith., siendo β-cariofileno y el óxido de cariofileno los principales componentes (Cárdenas et al., 2015).
Además, se analizó la composición de olores con el contenido de fenoloxidasa (PO) en machos de abeja de las orquídeas Euglossa imperialis Cockerell y la variación en el tamaño corporal entre individuos, el análisis de la composición de olores fue por (CG-EM), se determinaron 60 compuestos en 100 machos de E. imperialis, los compuestos fueron tetradecil tetradecanoato (87%), β-cubebeno (76%), Z, E-2,13-octadecadien-1-ol (65%) y eicosano (61%) (Arriaga et al., 2017).
Actualmente en el laboratorio se realiza un estudio sobre la determinación de compuestos volátiles por el método de MEFS, en plantas de soya en respuesta al ataque de mosca blanca, el análisis de los compuestos se realizará por medio de CG-EM lo anterior, como parte del programa de Posgrado en Parasitología Agrícola, de la Universidad Autónoma Agraria Antonio Narro. El estudio mencionado, está enfocado hacia los principales factores bióticos que limitan la producción de soya en México, como los insectos plaga y las enfermedades; dentro de los primeros la mosca blanca es de las más importantes, en 1994 redujo el rendimiento de 2.1 a 1.5 t ha-1 en 200 mil hectáreas en el noroeste de México (Ochoa et al., 2011). Para el control de dicho insecto actualmente se utilizan insecticidas químicos y algunos bioracionales como jabones y extractos vegetales (Cortez et al., 2005).
Perspectivas de los compuestos orgánicos volátiles de las plantas en México
El uso de la tecnología de compuestos volátiles vegetales como una herramienta adicional en los programas de manejo integrado de plagas, ofrece un enfoque nuevo y ambientalmente racional para la protección de cultivos. Esta técnica implica el desarrollo de cebos que atraen organismos benéficos y la manipulación de procesos bioquímicos que inducen y regulan las defensas de las plantas, factores clave en la mejora de los programas de control contra plagas económicamente importantes (Arab y Bento, 2006). Los volátiles de plantas también se pueden usar para protegerlas contra patógenos e insectos plaga.
Se busca en un futuro incrementar la expresión de genes involucrados en la biosíntesis de volátiles y que los volátiles puedan ser almacenados y liberados al momento del daño, para que sean utilizados como compuestos antimicrobianos o repelentes de herbívoros, esto aumentaría en gran medida la protección de las plantas en su medio natural y proporcionaría una alternativa de control natural de plagas (Marín y Céspedes, 2007).
Uno de los puntos clave en ecología química ha sido incluir la resistencia de la planta como factor clave para entender cómo funcionan y evolucionan las interacciones entre diferentes niveles tróficos. Sin embargo, ahora es necesario incluir en este esquema el manejo agronómico, para conocer y manejar el entorno en el que se desarrollan las interacciones entre planta-herbívoro-entomófago (Bautista et al., 2012b). Para estudios posteriores, el estudio del papel que desarrollan los compuestos volátiles en las interacciones tritróficas (planta-herbívoro-entomófago), plantea más preguntas sobre los procesos ecológicos y evolutivos que han modulado las interacciones que se establecen entre las plantas y los organismos de diferentes niveles tróficos (Bautista et al., 2012a).
Dado que los compuestos orgánicos volátiles de las plantas son relativamente difíciles de identificar, uno de los grandes desafíos es aislar y caracterizar, él o los que modulan interacciones de interés entre dos o más organismos (Martínez, 2013). En este sentido, los atributos defensivos directos de los compuestos orgánicos volátiles de las plantas nos proporcionan un marco útil para el diseño de estrategias de control biológico que pueden permitir la protección sostenible y rentable de nuestros cultivos (Stenberg et al., 2015).
Meiners (2015), sugiere que estudiar las interacciones multitróficas bajo condiciones más reales ayudará a identificar los mecanismos con potencial evolutivo y patrones que pueden usarse en la práctica de control biológico. Asimismo, Gish et al. (2015), mencionan que existen preguntas sobre las funciones evolutivas y ecológicas permanecen sin respuesta. Un punto importante, es la falta de información sobre las formas en que los factores ambientales, incluido el hábitat y condiciones atmosféricas influyen en los volátiles de plantas, entender estas influencias tiene implicaciones significativas para la gestión sostenible de ecosistemas naturales y agrícolas y debería ser una prioridad para investigaciones futuras. Rodrigues et al. (2014), indican que cuando se identifiquen los genes responsables de la biosíntesis de volátiles inducidos por los herbívoros, será posible usar ingeniería genética para inducir la producción de compuestos específicos o mezclas de compuestos en los cultivos que no producen naturalmente o para aumentar el flujo de estos compuestos.
En México, en la actualidad existen grupos de investigadores trabajando en el aislamiento, determinación y aplicación de los compuestos orgánicos volátiles de las plantas, aunque no hay un grupo central de investigación que trabaje en la explotación potencial de interacciones planta-herbívoro-entomófago, para que en el futuro se cuente con estrategias de biocontrol en los principales cultivos agrícolas. Estudios en compuestos volátiles de las plantas, coadyuvaría a reducir el impacto de insecticidas sobre los ecosistemas y disminuir los costos de producción de cultivos, mejorando la productividad agrícola y con ello las condiciones socioeconómicas en general de los productores agrícolas.
A medida que aumenta el conocimiento sobre las interacciones tritróficas, uno de los mayores retos es como explotar la información de los compuestos orgánicos volátiles de las plantas para desarrollar nuevas estrategias para el control de plagas. Es necesario, realizar más estudios para identificar los compuestos orgánicos volátiles que rigen el comportamiento dirigido por el olfato de insectos plaga y sus enemigos naturales, para formular estrategias para su control, para el desarrollo de variedades con resistencia constitutiva e inducida a las plagas de insectos, también la manipulación de dichos volátiles para atraer enemigos naturales de las plagas de los cultivos, para mejorar la eficiencia de agentes de control biológico en el manejo de plagas.
Conclusiones
Los compuestos orgánicos volátiles de las plantas son productos o subproductos de rutas metabólicas primarias. En base a su origen biosintético, los compuestos orgánicos volátiles se dividen en cuatro principales vías metabólicas: del shikimato-fenilalanina, del ácido mevalónico (MVA), del metileritritol fosfato (MEP) y de la lipoxigenasa (LOX). En el contexto internacional y en México, la extracción e identificación de los compuestos orgánicos volátiles de las plantas, se realiza mayormente por microextracción en fase sólida y cromatografía de gases y espectrometría (MEFS-CGEM).
En México, en la actualidad existen grupos de investigadores en universidades y centros de investigación, trabajando en la determinación y aplicación de los compuestos orgánicos volátiles de las plantas, algunos de ellos enfocados a la protección de cultivos contra enfermedades fúngicas, aunque no hay un grupo central de investigación trabajando en cuestiones relacionadas a interacciones planta-herbívoro-entomófago, que representa un gran potencial para la agricultura como estrategia de biocontrol.











 texto en
texto en 


