Introducción
El género Capsicum sp., contiene plantas nativas de América, de gran importancia por la diversidad de usos (Cardona et al., 2008). Comprende 25 especies y cinco de ellas son las más cultivadas (Hunziker, 1979). China ocupa el primer lugar en producción mundial de chiles frescos con 54%, seguido de México con 6.5% y después Indonesia, Turquía, España y Estados Unidos de América (FAOSTAT, 2014). En México, el chile es un cultivo importante, la producción anual es de 2.3 millones de toneladas, en una superficie de 136 mil hectáreas, representando 2.78% de la superficie total nacional cultivada (SIAP, 2015).
Para aumentar los rendimientos en este cultivo se sugiere mejorar aspectos como su adaptación a diversas regiones climáticas, desarrollo de genotipos con mayor producción, precoces y tolerantes a las enfermedades de raíz y mejor calidad de fruto (Ramírez, 1980). Tecnologías recientes encaminadas a mejorar la producción de chile en México involucran los microorganismos de la rizósfera, ya que algunos mejoran el crecimiento de las plantas. Tal es el caso de los HMA que contribuyen en la adaptación de la planta a condiciones de ambiente (Dakessian et al., 1986; Franco et al., 2007). En México, existen alrededor de 44 especies de HMA, equivalente a 22% del total mundial. (Chamizo et al., 1998; Varela y Trejo, 2001; Ferrera-Cerrato y Alarcón, 2004).
Los HMA, asociados con Rpcv, favorecen el desarrollo de cultivos hortícolas como el chile (Borie et al., 2008; Castillo et al., 2008; Hallett et al., 2008). Entre los beneficios de los HMA está la agregación del suelo vía la glomalina a través de micelio fúngico (Castillo et al., 2008), reducción del estrés hídrico en plantas, control de fitopatógenos de la raíz y participación además en el equilibrio ecológico. Los controladores biológicos para algunas enfermedades de las plantas de cultivo se han reportado desde 1927 (Desai et al., 2002; Bautista-Calles et al., 2010).
No existen resultados contundentes para el control biológico de P. capsici, en condiciones de campo (García, 2010; Bautista-Calles et al., 2010). El uso de HMA y Rpcv, pueden ser alternativas viables para favorecer el crecimiento del chile y controlar fitopatógenos radicales. Los objetivos del trabajo fueron determinar si las Rpcv favorecen la germinación de esporas de HMA in vitro y comprobar si el porcentaje de colonización micorrízica es incrementado por efecto de inoculación de las Rpcv, con efectos en el crecimiento y en la resistencia a P. capsici de las plantas de 23 genotipos de chile.
Materiales y métodos
Obtención de inóculos de HMA
Se propagaron seis inóculos del Área de Microbiología de Suelos-Colegio de Posgraduados, identificados como Rhizophagus intrarradices, Tabasco-Naranja, Mérida-Papaya, Jalapa I, Zac-19 y Cedro, estos últimos en fase de identificación, obtenidos en varios ecosistemas en el país. Como planta trampa se utilizó zacate ballico anual (Lolium multiflorum) cultivado en arena esterilizada en autoclave a 18 lb pulg-2 durante tres horas por dos ocasiones con intervalo de un día.
La propagación se prolongó durante 16 meses, realizando riegos semanales con agua corriente y riegos nutrimentales cada cuatro meses con solución Long Ahston (Hewitt y Smith, 1974). Se extrajeron las esporas de 100 g de muestra de cada uno de los inóculos por el método decantación en húmedo (Gerdemann y Nicolson, 1963). Se colectaron las esporas retenidas en los tamices de 43 y 73 µm de abertura. Las esporas se conservaron en refrigeración hasta su desinfestación. Después se transfirieron a una caja Petri (100 x 15 mm) de vidrio. Se observaron en un estereoscopio (Stereo Star AO), y se extrajeron con pipeta Pasteur. Se colocaron sobre papel filtro circular de 0.07 mm de espesor dentro de una caja Petri.
Desinfestación de esporas de HMA
Las esporas de HMA se sumergieron en una solución de hipoclorito de sodio® al 0.3% durante 2 min, y dos enjuagues con agua destilada estéril. Después, en una solución de cloramina T al 2% (Lorelí et al., 2002), durante 6 min y dos enjuagues en agua destilada estéril. Finalmente, fueron sumergidas en una solución de antibióticos (5 µL de penicilina y 5 µL de gentamicina mL-1) durante 3 min y tres enjuagues en agua destilada estéril. Las esporas fueron refrigeradas hasta su siembra en caja Petri.
Siembra de esporas de HMA
Se realizó en laboratorio en condiciones in vitro, colocando las esporas desinfestadas en cajas de Petri con agar-agua al 33%, dejando un cm de separación, depositando 10 esporas de cada inóculo de HMA por caja Petri.
Germinación de esporas de HMA
Se hicieron observaciones desde el día seis después de colocadas las esporas en agar-agua 33%. Se presentan resultados de la última observación realizada a los 32 DDS. Se contabilizó el número de esporas germinadas y se calculó el porcentaje de germinación para cada tratamiento.
Obtención de cepas de Rpcv
Las cepas puras de Rpcv utilizadas se obtuvieron de la Colección del Área de Microbiología de Suelos, Colegio de Posgraduados. La cepa Pseudomona tolasii (P-61), aislada de suelo cultivado con papa (Solanum tuberosum) cv Rosita, en el valle de Toluca, México, promueve crecimiento, solubiliza fosfatos, produce auxinas y controla Rhizoctonia. La cepa P. tolasii (A-46), aislada en la misma región en suelo cultivado con papa (Solanum tuberosum) cv Alpha, mismas características que P-61, además promueve micorrización e incrementa germinación. La cepa Bacilus pumilus (R-44), aislada de suelo cultivado con papa (Solanum tuberosum) cv Rosita en el valle de Toluca, México, con mismas características que P-61 y la cepa Paenibacillus sp. (BSP1.1), aislada de suelo agrícola en la región Villa de Allende, Estado de México, similar a P-61, A-46 y R-44, en la solubilización fosfatos.
Las cepas se cultivaron en caldo nutritivo con incubación a 26 ºC durante 18 h en agitación, la suspensión bacteriana se centrifugó durante 0.25 h a 7 000 rpm, el pellet de bacterias se resuspendió en 20 mL de agua destilada estéril y se hicieron diluciones decimales hasta 10-5, después se tomó con micropipeta 3 µL de la dilución 10-5 y se depositó en cada una de las esporas de HMA. Las cajas de Petri con las esporas de HMA inoculada con Rpcv se incubaron a 28 °C.
Tratamientos
Estos se establecieron bajo un diseño experimental Factorial completamente al azar con dos factores. El factor ‘A’ corresponde a la inoculación en cada una de las cuatro Rpcv, además de un tratamiento con la mezcla de las cuatro Rpcv y otro tratamiento sin inoculación. El factor ‘B’ corresponde a cada uno de los inoculantes de los HMA. Con cinco repeticiones, generando 160 unidades experimentales.
Material vegetal
Se evaluaron 23 genotipos de chile. Su descripción y procedencia: chiles tipo Pasilla: (1) variedad UAA/Ags, (2) variedad Perales 1/Zac, (3) variedad Perales 2/Zac; chiles tipo Ancho: (4) variedad UAA/Ags, (5) variedad AP Neek/SLP, (6) variedad Ancho 3 venas/Zac, (7) variedad SR 2009/Dgo; chiles Guajillo: (8) variedad Don Luis/SLP, (9) variedad Perales/Zac, (10) variedad Mirasol 3 venas/Zac, (11) variedad Don Ramón/SLP; chiles Puya: (12) variedad 91/SLP, (13) variedad Saladillo 1/Zac, (14) variedad Saladillo 2/Zac, (15) variedad Caudillo/Dgo; chiles Serrano: (16) híbrido Coloso/Tamps, (17) híbrido HS44/Tamps, (18) híbrido Centauro/Tamps; chiles Jalapeño: (19) variedad Don Benito 1/Tamps, (20) variedad Don Benito 2/Tamps, (21) variedad Don Pancho/Tamps, (22) variedad Apache/Chih, (23) variedad Isabel/Chih, procedentes de regiones agrícolas en México.
Preparación de sustrato y siembra
En semilleros de unicel de 200 cavidades se agregó turba y perlita (50:50, base V/V). Se depositaron dos semillas por cavidad a 0.5 cm de profundidad.
Inoculación con HMA y Rpcv
La inoculación con HMA, se realizó al momento de la siembra. Se mezclaron 10 g de una mezcla de los HMA en cada cavidad. La mezcla de HMA contenía 1 024 esporas y segmentos de raíz colonizados. La inoculación se realizó con una mezcla de las cuatro Rpcv. Se colocó un mL de inóculo bacteriano en cada cavidad el cual contenía 10-8 células mL-1.
Trasplante y cosecha de plantas de chile
A los 11 dds, inició la emergencia de las semillas. Se realizó el trasplante los 57 dds. El sustrato fue suelo agrícola (tamizado en malla de 0.7 mm) y perlita (40:60, base V/V). Los riegos se hicieron cada cinco días. A los 84 ddt, se separó la parte aérea y la raíz, evaluando porcentaje de materia seca y volumen de raíz.
Inoculación con Phytophthora capsici
A los 11 ddt, se inoculó tres gramos de suelo conteniendo zoosporas de P. capsici como fuente de inoculo secundario. El suelo infestado se obtuvo de lotes cultivados con chile en la región agrícola de Puebla, México.
Variables evaluadas
Se evaluó altura de planta (Ap), diámetro de tallo (Dt), peso seco (Ps), volumen radical (Vr) y porcentaje de micorrización (Pm) a los 84 ddt. Para determinar la colonización micorrízica se realizó la tinción de las raíces de acuerdo a la metodología de Phillips y Hayman, (1970), se contabilizó hifas (H), vesículas (V), esporas (E) y arbúsculos (A).
Diseño experimental
Los tratamientos en la fase de invernadero fueron establecidos bajo un diseño experimental Factorial completamente al azar con dos factores. El factor ‘A’ corresponde a los 23 genotipos de chile. El factor ‘B’ corresponde a un testigo, HMA y HMA+Rpcv. Con seis repeticiones, obteniendo 414 unidades experimentales.
Análisis estadístico
Los datos obtenidos se analizaron mediante el paquete estadístico SAS 9.0 versión español (SAS, 2002), e Infostat-componentes principales.
Resultados y discusión
Fase I. Germinación in vitro de esporas de HMA
La germinación in vitro de las esporas de los seis inóculos de HMA aumentó con la inoculación de al menos una de las cuatro cepas de Rpcv a los 32 dds (Cuadro 1).
Cuadro 1 Germinación in vitro de esporas de HMA inoculadas con Rpcv, expresado en porcentaje a los 32 días después de sembradas (dds).
| Rhizophagus intraradices | Tabasco-naranja | Mérida-papaya | Jalapa I | Zac-19 | Cedro | Media | |
| Testigo | 10 | 10 | 10 | 20 | 0 | 20 | 11.6 b |
| Bacteria P-61 | 60 | 10 | 30 | 60 | 40 | 60 | 43.3 a |
| Bacteria A-46 | 10 | 20 | 30 | 50 | 10 | 30 | 23.3 ab |
| Bacteria R-44 | 20 | 50 | 40 | 20 | 30 | 50 | 35 ab |
| Bacteria BSP1.1 | 30 | 30 | 30 | 0 | 30 | 40 | 26.6 ab |
| Todas las Rpcv | 20 | 40 | 20 | 30 | 20 | 30 | 26.6 ab |
| Media | 25 ab | 26.6 ab | 25 ab | 30 ab | 21.6 b | 38.3 a |
Medias en la misma columna y con la misma letra estadísticamente son iguales (Tukey, α= 0.05).
Se encontró diferencia entre las cepas de Rpcv para promover la germinación in vitro de las esporas de HMA, sobresaliendo la cepa Pseudomona tolasii P-61 (Cuadro 1), la cual mejoró la germinación de las esporas de Rhizophagus intraradices, Mérida-Papaya, Jalapa I y Cedro (600, 300, 300 y 300% respectivamente).
En la germinación de las esporas de Cedro, también se destacó el efecto de la Rpcv Bacillus pumilus R-44 con 250% de aumento con respecto al testigo. La germinación es considerada uno de los procesos de mayor importancia en el ciclo de vida de los HMA de ello dependerá el éxito en el proceso de simbiosis con la planta (Rai, 2001; Fernández et al., 2005) casi todas las especies son capaces de germinar en ausencia de hospederos (Giovannetti, 2000). La desinfestación de esporas es un requisito de suma importancia para lograr éxito en la formación de la micorriza en condiciones in vitro (Breuninger y Requena, 2004).
Altura de planta
En la evaluación a los 84 ddt, considerando el promedio de los 23 genotipos de chile, el tratamiento HMA+Rpcv presentó 7.19 cm, superando a los tratamientos HMA y testigo (5.97 y 5.4 cm, respectivamente). En referencia a las medias por tipo de chile (Pasilla, Ancho, Guajillo, Puya, Serrano y Jalapeño) se observó que el tratamiento HMA+Rpcv superó a los tratamientos HMA y testigo en todos los casos. Solo en los tipos de chile Puya, Serrano y Jalapeño el tratamiento HMA superó al testigo.
En 19 de los 23 genotipos de chile el tratamiento HMA+Rpcv superó al tratamiento HMA. Solamente en el genotipo 7 del tipo Ancho, el 12 del tipo Puya, el 17 del tipo Serrano y el 23 del tipo Jalapeño, se encontró que el tratamiento HMA superó al tratamiento HMA+Rpcv (Cuadro2).
Cuadro 2 Altura de planta y diámetro de tallo (84 ddt) en 23 genotipos de chile inoculados con HMA y Rpcv.
| Chile |
Altura de planta (cm) Testigo HMA HMA+Rpcv |
Media |
Diámetro de tallo (mm) Testigo HMA HMA+Rpcv |
Media | |||||
| Pasilla | 1 | 6.2 b | 5.87 b | 9.05 a | 7.04 b | 13.65 b | 12.97 b | 15.67 a | 14.1 c |
| 2 | 6.87 b | 5.2 c | 9.55 a | 7.2 a | 13.77 c | 14.65 b | 15.92 a | 14.78 a | |
| 3 | 6.2 b | 5.35 c | 7.17 a | 6.24 c | 14.7 a | 14.85 a | 14.22 a | 14.59 b | |
| Media | 6.42 b | 5.47 c | 8.59 a | 14.04 c | 14.15 b | 15.27 a | |||
| Ancho | 4 | 6.45 b | 5.65 c | 7.4 a | 6.5 a | 12.72 c | 15.7 a | 13.9 b | 14.1 c |
| 5 | 5.27 b | 5.3 b | 6.5 a | 5.69 c | 13.02 c | 14.45 b | 14.55 a | 14 c | |
| 6 | 5.2 c | 6.7 b | 6.97 a | 6.29 b | 14.32 b | 15.2 a | 14.45 b | 14.65 b | |
| 7 | 6.15 c | 7.07 a | 6.72 b | 6.5 a | 13.25 c | 16.9 a | 14.75 b | 14.96 a | |
| Media | 5.76 b | 6.18 b | 6.89 a | 13.32 c | 15.56 a | 14.41 b | |||
| Guajillo | 8 | 6.65 c | 7.77 b | 8.69 a | 7.68 a | 14.55 b | 13.55 c | 15.77 a | 14.62 a |
| 9 | 7.15 b | 5.5 c | 8.27 a | 6.97 b | 12.77 b | 12.57 b | 14.52 a | 13.29 d | |
| 10 | 5.85 b | 5.85 b | 7.3 a | 6.33 d | 14.02 b | 12.27 c | 14.52 a | 13.6 c | |
| 11 | 5.35 c | 6.9 b | 8.45 a | 6.9 c | 13.2 c | 14.45 a | 14.42 b | 14.02 b | |
| Media | 6.25 b | 6.5 b | 8.16 a | 13.62 b | 13.21 b | 14.8 a | |||
| Puya | 12 | 3 c | 6.1 a | 4.62 b | 4.57 d | 13.9 a | 13.37 a | 14.17 a | 13.81 c |
| 13 | 5.27 c | 5.82 b | 7.57 a | 6.22 c | 13.4 c | 15.27 b | 15.6 a | 14.75 a | |
| 14 | 6.1 c | 7.15 b | 7.8 a | 7.01 a | 15 a | 13.32 c | 14.55 b | 14.29 b | |
| 15 | 6.47 b | 5.17 c | 8.55 a | 6.73 b | 15.07 a | 12 c | 13.8 b | 13.62 c | |
| Media | 5.21 c | 6.06 b | 7.13 a | 14.34 b | 13.49 c | 14.53 a | |||
| Serrano | 16 | 4.72 b | 5.17 b | 6.67 a | 5.52 b | 13.1 b | 12 c | 16.55 a | 13.88 b |
| 17 | 4.3 c | 5.22 a | 5.07 b | 4.96 c | 13.8 c | 14.57 b | 14.7 a | 14.35 a | |
| 18 | 4.55 c | 5.22 b | 6.85 a | 5.64 a | 13.07 b | 14.57 a | 12.45 b | 13.36 b | |
| Media | 4.52 c | 5.4 b | 6.19 a | 13.32 b | 13.71 b | 15.46 a | |||
| Jalapeño | 19 | 3.9 c | 5.3 b | 5.9 a | 5.03 e | 13.2 b | 16.25 a | 13.65 b | 14.36 d |
| 20 | 4.65 c | 7.2 a | 7.2 a | 6.35 a | 15.55 c | 16.42 b | 17.35 a | 16.44 a | |
| 21 | 4.65 c | 5.25 b | 6.25 a | 5.38 d | 15.55 a | 15.37 a | 16.05 a | 16.65 b | |
| 22 | 4.6 c | 5.35 b | 6.9 a | 5.61 c | 12.05 b | 14.45 b | 15.37 a | 12.95 e | |
| 23 | 4.8 c | 6.72 a | 6.02 b | 5.85 b | 13.9 c | 16.82 a | 15.47 b | 15.4 c | |
| Media | 4.52 c | 5.96 b | 6.45 a | 14.05 c | 15.26 b | 15.51 a | |||
| Media general | 5.4 b | 5.97 b | 7.19 a | 13.8 b | 14.3 b | 14.88 a | |||
HMA= hongos micorrízicos arbusculares; HMA+Rpcv= hongos micorrízicos arbusculares más rizobacterias promotoras del crecimiento vegetal. Promedios en la misma fila y en la misma variable con la misma letra son estadísticamente iguales; asimismo, promedios en la misma columna y para el mismo tipo de chile son estadísticamente iguales (Tukey, α= 0.05).
En 14 de los 23 genotipos de chile se encontró que el testigo sin inoculación fue superado por ambos tratamientos inoculados (HMA y HMA+Rpcv). Estos resultados coinciden o difieren de Luna et al. (2013) al inocular plantas de pimiento morrón con Bacillus sp. MA 12, encontró un incremento de 21.31%, respecto al testigo a los 60 ddt y una media en altura de la planta de 13.43 cm y 11.07 cm, para el testigo.
Diámetro de tallo
El tratamiento HMA+Rpcv superó al tratamiento HMA y al testigo, en la evaluación a los 84 ddt, de acuerdo a valores medios para todos los genotipos de chile (Cuadro 2). Respecto a las medias de los tipos de chile solamente en los tipos Ancho, Puya y Jalapeño el tratamiento HMA+Rpcv fue superior al tratamiento HMA y al testigo. En 8 de los 23 genotipos el tratamiento HMA+Rpcv sobrepasó al tratamiento HMA y testigo. El tratamiento HMA, superó al tratamiento HMA+Rpcv en los genotipos 4, 6, 7, 11, 18, 19, 21 y 23. En nueve genotipos de chile el testigo fue superado por los tratamientos HMA y HMA+Rpcv. El tratamiento HMA+Rpcv con un valor medio de 14.88 mm, superó al tratamiento HMA y al testigo (15.26 y 14.05 mm) resultando evidente el efecto de los microorganismos.
Peso seco
En la evaluación a 84 ddt, el tratamiento HMA+Rpcv (83.98) superó al tratamiento HMA (54.51) y al testigo (46.78), de acuerdo a la media general de todos los genotipos. De los 23 genotipos de chile en 19 de ellos el tratamiento HMA+Rpcv superó al tratamiento HMA y en 17 superó tanto al tratamiento HMA como al testigo. El tratamiento HMA por su parte logró superar al testigo en los genotipos 5, 6 y 7 del tipo Ancho, 11 del Guajillo, 12, 13 y 14 del Puya, 17 del Serrano, 19, 20, 22 y 23 del Jalapeño. El testigo fue superior al tratamiento HMA en los genotipos 1 y 2 del tipo Pasilla, 7 del Ancho, 15 del Puya, 16 del Serrano y 21 del Jalapeño. En todos los casos la media por tipo de chile del tratamiento HMA+Rpcv superó a la del tratamiento HMA y a la del testigo (Figura 1).
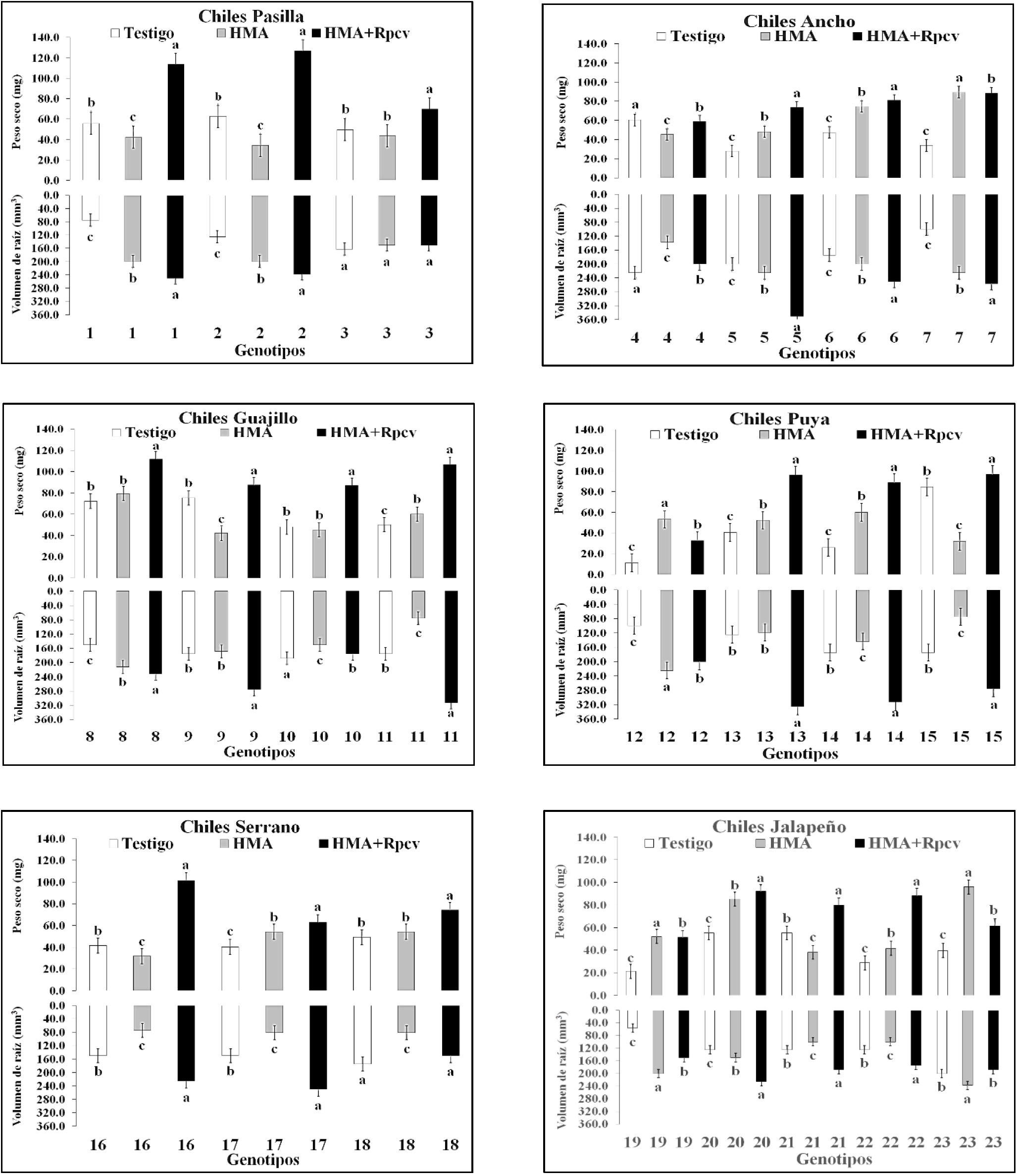
Figura 1 Peso seco de planta y volumen de raíz (84 ddt) en 23 genotipos de chile inoculados con HMA y Rpcv.
El efecto de Rpcv (Pseudomona sp. y Bacillus sp.) es reflejado en el crecimiento de las plantas tal como lo menciona (Gholami et al., 2009); asimismo, Bashan et al. (2004), establecen que hay un incremento de biomasa.
Volumen de raíz
En todos los casos considerando la media de los tipos de chile el tratamiento HMA+Rpcv excedió al tratamiento HMA y al testigo. El tratamiento HMA+Rpcv mostró superioridad en 16 de los 23 genotipos de chile evaluados (Figura 1). El tratamiento HMA, superó al testigo en 10 de los 23 genotipos de chile (1 y 2 del tipo Pasilla, 5, 6 y 7 del Ancho, 8 del Guajillo y 20 del Jalapeño). De acuerdo a las medias por tipo de chile, el tratamiento HMA+Rpcv superó al tratamiento HMA y al testigo en todos los casos (Figura 1).
Índices de vigor
El análisis de componentes principales (ACP) indicó que con el componente 1, explicó 84% de la varianza total (Castañon-Nájera et al., 2008). El ACP con los valores cuantitativos de los 23 genotipos de chile indicó que los autovectores de altura de planta, diámetro de tallo, peso seco y volumen de raíz aportaron 42, 39, 41 y 41% al Componente 1 (Cuadro 3).
Cuadro 3 Índices de vigor (Iv) en 23 genotipos de chile inoculados con HMA y Rpcv.
| Chile | Genotipo | Testigo | HMA | HMA+Rpcv |
| Pasilla | 1 | -0.92 | -0.62 | 0.58 |
| 2 | 0.18 | -0.76 | 1.37 | |
| 3 | -0.49 | -1.74 | 0.44 | |
| Ancho | 4 | -0.39 | 0.29 | -0.2 |
| 5 | -0.29 | -0.56 | 0.11 | |
| 6 | -0.87 | -1.98 | 0.93 | |
| 7 | -0.17 | -0.52 | 0.11 | |
| Guajillo | 8 | -0.56 | -0.74 | 0.47 |
| 9 | -0.81 | -0.42 | 1.11 | |
| 10 | -0.2 | -0.42 | -0.64 | |
| 11 | -1.19 | -1.51 | 1.16 | |
| Puya | 12 | -2.37 | -0.22 | -0.82 |
| 13 | -2.13 | -0.58 | 0.44 | |
| 14 | -1.11 | -0.39 | 0.25 | |
| 15 | -0.89 | -1.53 | -0.86 | |
| Serrano | 16 | -1.28 | -2.54 | 0.23 |
| 17 | -1.63 | -0.74 | 0.54 | |
| 18 | -1.31 | -2.62 | -0.8 | |
| Jalapeño | 19 | -1.69 | -1.52 | -0.12 |
| 20 | -1.76 | 0.62 | 0.73 | |
| 21 | -2.68 | -0.83 | -0.22 | |
| 22 | -1.82 | -0.99 | -0.13 | |
| 23 | -2.18 | 0.21 | -1.02 |
HMA= hongos micorrízicos arbusculares; Rpcv= rizobacterias promotoras del crecimiento vegetal.
Los valores característicos de este componente resultaron positivos en su totalidad para el Tratamiento HMA+Rpcv no así para el tratamiento HMA y el testigo los que fueron negativos como establecen Kaiser (1960); Castañon-Nájera et al. (2008). Con lo anterior, se comprueban los efectos aditivos de la coinoculación HMA+Rpcv, comparado con la inoculación de los HMA solos, como lo reportaron Kaiser (1960); Bashan (1998).
Porcentaje de colonización micorrízica
El porcentaje de colonización micorrízica se incrementó 79.07%. En 21 de los 23 genotipos de chile el tratamiento HMA+Rpcv, superó al tratamiento HMA. Solamente en dos casos el tratamiento HMA superó al tratamiento HMA+Rpcv en el genotipo 16 del tipo Serrano y genotipo 20 del tipo Jalapeño (Cuadro 4). En todos los casos considerando la media de los tipos de chile el tratamiento HMA+Rpcv superó al tratamiento HMA en el porcentaje de micorrización.
Cuadro 4 Colonización micorrízica en 23 genotipos de chile inoculados con HMA y Rpcv en condiciones de invernadero.
| Chile | Genotipo | HMA | HMA+Rpcv | Incremento (%) |
| Pasilla | 1 | 61.9 | 63.64 | 2.8 |
| 2 | 36.84 | 107.14 | 190.82 | |
| 3 | 32.31 | 73.56 | 127.7 | |
| Media | 43.68 | 81.45 | 86.44 | |
| Ancho | 4 | 31.94 | 98.33 | 207.83 |
| 5 | 40 | 71.08 | 77.71 | |
| 6 | 46.67 | 56.06 | 20.13 | |
| 7 | 24.64 | 70.59 | 186.51 | |
| Media | 35.81 | 74.02 | 106.68 | |
| Guajillo | 8 | 21.84 | 47.13 | 215.79 |
| 9 | 28.79 | 31.75 | 10.28 | |
| 10 | 27.27 | 57.58 | 111.11 | |
| 11 | 25 | 75.38 | 201.54 | |
| Media | 25.72 | 52.96 | 105.86 | |
| Puya | 12 | 29.51 | 43.28 | 46.68 |
| 13 | 21.21 | 70.77 | 233.63 | |
| 14 | 52.63 | 51.35 | -2.43 | |
| 15 | 25.42 | 77.05 | 203.06 | |
| Media | 32.19 | 60.61 | 88.28 | |
| Serrano | 16 | 22.81 | 58.21 | 155.22 |
| 17 | 42.62 | 68.18 | 59.97 | |
| 18 | 59.57 | 57.35 | 96.27 | |
| Media | 41.67 | 61.25 | 46.99 | |
| Jalapeño | 19 | 24.29 | 42.03 | 73.06 |
| 20 | 36.14 | 83.75 | 131.71 | |
| 21 | 18.46 | 53.23 | 188.31 | |
| 22 | 66.15 | 41.94 | -36.59 | |
| 23 | 36.92 | 56.36 | 52.61 | |
| Media | 36.39 | 55.46 | 52.39 | |
| Media general | 35.35 | 63.29 | 79.07 |
HMA= hongos micorrízicos arbusculares; Rpcv= rizobacterias promotoras del crecimiento vegetal.
En dos casos (chiles tipo Serrano y chiles tipo Jalapeño) el tratamiento HMA+Rpcv superó al tratamiento HMA en un porcentaje de micorrización menor al 100 por ciento con 46.99 y 52.39%. Así también para los chiles tipo Ancho y Guajillo el tratamiento HMA+Rpcv, superó al tratamiento HMA en un porcentaje mayor a 100% con 106.68 y 105.86% (Cuadro 4).
El testigo no presentó colonización micorrízica. Los resultados anteriores concuerdan con los autores (Kaiser, 1960; Bashan, 1998; Rai, 2001), que reportan aumentos en la micorrización de plantas por efecto de la coinoculación con Rpcv.
Plantas muertas por ataque de P. capsici
La tendencia en número de plantas muertas fue similar en todas las fechas de muestreo (31, 59, 84 ddt). A los 84 ddt, el testigo mostró la mayor cantidad de plantas muertas por P. capsici, equivalente a 47%, seguido del tratamiento HMA con 37% y 16% para el tratamiento HMA+Rpcv. Los chiles Pasilla, Ancho y Serrano del tratamiento HMA+Rpcv, presentaron la menor cantidad de plantas muertas respecto al testigo. La inoculación conjunta de los microorganismos (HMA y Rcpv) lograron contrarrestar el daño de P. capsici, reduciendo el ataque del fitopatógeno en la planta.
Los chiles Pasillas, mostraron mayor resistencia 19.39%, seguido de los Guajillos 21.9%, los Anchos 26.47%, los Puyas 32.04%, los Jalapeños 36%, y los Serranos 46.67%, siendo estos últimos los más susceptibles al daño de fitopatógenos (Cuadro 5).
Cuadro 5 Porcentaje de plantas muertas por ataque de P. capsici, en los tipos de chile y tratamientos de estudio.
| Chile | Tratamientos | 31 ddt (%) | 59 ddt (%) | 84 ddt (%) |
| Pasilla | Testigo | 1 | 1 | 2 |
| HMA | 1.74 | 2.61 | 4.35 | |
| HMA+Rpcv | 0 | 0 | 0.87 | |
| Ancho | Testigo | 3 | 3 | 5 |
| HMA | 3.48 | 3.48 | 6.09 | |
| HMA+Rpcv | 1.74 | 1.74 | 2.61 | |
| Guajillo | Testigo | 4 | 4 | 5 |
| HMA | 0.87 | 0.87 | 3.48 | |
| HMA+Rpcv | 0 | 1.74 | 1.74 | |
| Puya | Testigo | 5 | 7 | 11 |
| HMA | 4.35 | 4.35 | 3.48 | |
| HMA+Rpcv | 0.87 | 0.87 | 2.61 | |
| Serrano | Testigo | 3 | 4 | 7 |
| HMA | 3.48 | 5.22 | 9.57 | |
| HMA+Rpcv | 0.87 | 0.87 | 2.61 | |
| Jalapeño | Testigo | 10 | 12 | 17 |
| HMA | 3.48 | 3.48 | 5.22 | |
| HMA+Rpcv | 2.61 | 3.48 | 3.48 |
HMA= hongos micorrízicos arbusculares; HMA+Rpcv= hongos micorrízicos arbusculares más rizobacterias promotoras del crecimiento vegetal; P. capsici= Phytophthora capsici; ddt= días después de trasplante.
La protección de las plantas contra enfermedades por fitopatógenos, (Lorelí et al., 2002; SIAP, 2015) puede darse por los HMA y las Rpcv, enemigos naturales de Phytophthora, Fusarium, Rhizoctonia y otras (Rillig, 2007).
Los resultados obtenidos demuestran la respuesta de las Rpcv (Pseudomona tolasii P-61 y Bacillus pumilus R-44) en la germinación in vitro de esporas de HMA (Rhizophagus intraradices, Mérida-Papaya, Jalapa I y Cedro). Además, el efecto conjunto de los HMA y las Rpcv superior respecto a los HMA y testigo en altura de planta, diámetro de tallo, peso seco, volumen de raíz y porcentaje de colonización micorrízica. Estos microorganismos son conocidos como promotores del crecimiento vegetal (Kloepper y Schroth, 1978), pero con este estudio se sientan las bases para el desarrollo de una tecnología de coinoculación (HMA y Rpcv) para mejorar la producción de genotipos de chiles mexicanos.
Conclusiones
Los HMA asociados a las Rpcv, lograron incrementos significativos en altura de planta, diámetro de tallo, peso seco de la planta y el volumen de raíz y disminuyeron los daños causados P. capsici.
Las variables altura de planta, diámetro de tallo, peso seco y volumen de raíz guardaron una correlación positiva, donde en la medida que una mostró efecto el resto lo hacía también.
Los chiles tipo Pasilla presentaron mayor resistencia al ataque de P. capsici y Jalapeño y Serrano fueron los de menor resistencia.











 texto en
texto en 


