Introducción
La higuera (Ficus carica L.) es originaria de Asia central, de donde fue llevada al mediterráneo y de ahí al continente americano (Pereira et al., 2015). La higuera se adapta a una gran variedad de suelos, es tolerante a salinidad y sequía; sus mejores rendimientos se obtienen en áreas con clima seco y cálido en verano y con invierno fresco y húmedo, por lo que es un cultivo típico de las zonas áridas (El-Shazly et al., 2014). Turquía y Egipto ocupan el primer y segundo lugar, con 300 000 y 168 000 t año-1, respectivamente, mientras que México ocupa el lugar 19, con una producción de 7 000 t año-1, en una superficie de 1 340 ha localizadas principalmente en los estados de Morelos y Baja California Sur, lo que da un rendimiento de 5.2 t ha-1 (FAO, 2018; SIAP, 2018).
En la Comarca Lagunera de Durango hay un total 22 ha de higuera, con sistemas tecnificados de producción; cuentan con riego presurizado, cubiertas plásticas tipo macro túnel para prevenir daños por frío durante el invierno, altas densidades de plantación (2 500 árboles ha-1) y poda anual y en verde para mantener la copa del árbol compacta.
La higuera se considera un cultivo marginal, con bajos requerimientos nutrimentales (CONABIO, 2018); sin embargo, estudios como el de Brown (1994) muestra que la concentración foliar nutrimentos esenciales como nitrógeno (N), fosforo (P), potasio (K), calcio (Ca), magnesio (Mg), fierro (Fe), cobre (Cu), manganeso (Mn) y zinc (Zn), presentan cambios a lo largo del ciclo de crecimiento; por ejemplo, en árboles de alto vigor, la concentración de N disminuyó de 2.3 a 1.5%, la de P de 0.14 a 0.09% y K de 1.4 a 0.7% de mayo a octubre (de floración a postcosecha), mientras que la concentración de B aumentó de 65 a 125 y la de Mn de 80 a 150 mg kg-1 en el mismo periodo.
En nogal pecanero (Carya illinoensis, Wangenh. Koch), que también es una especie frutal caducifolia, la concentración de N, K, Ca, Mg, azufre (S), boro (B) y Fe aumentó durante el desarrollo de las hojas, mientras que la concentración de Mg y Zn disminuyó durante la formación de cotiledones (Kim y Wetzstein, 2005). Lo anterior, enfatiza la importancia de conocer la variación en la concentración de nutrimentos en las huertas con sistemas tecnificados de producción de higo de esta región, lo anterior como apoyo para definir valores de referencia de nutrimentos y épocas de muestreo foliar.
El objetivo del presente trabajo fue evaluar la fluctuación en la concentración de los nutrimentos esenciales N, P, K, Ca, Mg, Fe, Mn, Cu, Zn y níquel (Ni), durante el ciclo anual de crecimiento, en cuatro huertas con sistemas tecnificados de producción de higo. La hipótesis fue que la concentración de nutrimentos no difiere significativamente entre huertas y por lo tanto se pueden generar valores preliminares de referencia a partir del conjunto de datos de todas las huertas.
Materiales y métodos
Se seleccionaron cuatro huertas en el municipio de Gómez Palacio, Durango, las cuales estaban en su cuarto año de crecimiento; fueron plantadas a inicios del 2012 y empezaron a producir en 2014. Las huertas son: 1) Vergel-1, en macro túnel con cubierta plástica en invierno; 2) Vergel-2, sin cubierta plástica; 3) Transporte, bajo invernadero con plástico todo el año; y 4) Dinamita, sin cubierta plástica. La finalidad de la cubierta plática es prevenir daños por frío en invierno.
Las cuatro localidades se encuentran entre las coordenadas 25° 65’ 48” y 25° 77’ 12” de latitud norte y entre 103° 46’ 71” y 103° 50’ 11” de longitud oeste.
Los árboles están plantados a 2 x 2 m, para una densidad de 2 500 plantas ha-1, la copa de los arboles se mantiene compacta mediante poda anual y podas en verde. Tienen un sistema de riego por microaspersión y se aplicó una lámina de riego promedio de 95 cm en el año. Al inicio del ciclo se aplicaron de 1 a 2 kg árbol-1 de composta a base de estiércol de bovino lechero y no se aplicaron fertilizantes químicos convencionales. En cada huerta se tomaron tres túneles como repeticiones y dentro de cada repetición se seleccionaron seis árboles como unidad experimental, los árboles fueron seleccionados tomando como criterio la circunferencia promedio del tronco de 16 cm, medida a 20 cm sobre el nivel del suelo.
Para caracterizar algunas propiedades físicas y químicas del suelo, en abril de 2015 se tomó una muestra de suelo en cada uno de los árboles seleccionados por repetición, la muestra se tomó dentro del área de goteo de la copa del árbol, a una distancia de 30 cm del tronco y alternando la posición con respecto al tronco. Luego, con las muestras de cada repetición se hizo una muestra compuesta; las profundidades de muestreo fueron 0-30, 30-60 y 60-90 cm.
Las muestras se llevaron al Laboratorio de Análisis de Suelo del Campo Experimental La Laguna, del INIFAP, para su caracterización física y química. Los análisis se realizaron de acuerdo con los protocolos de la NOM-O21- SEMARNAT-2000 (SEMARNAT, 2001). Aunque hay diferencias entre huertas con respecto a los porcentajes de arena y arcilla, el suelo de las cuatro huertas corresponde a la clase textural de arcilla, con más de 45% de arcilla y menos de 32% de arena en las tres profundidades (Cuadro 1).
Cuadro 1 Caracterización física-química del suelo de las huertas de higuera seleccionadas en el estudio.
Huerta |
Profundidad |
Limo |
Arena |
Arcilla |
pH |
CEe |
MO |
N inorg. |
P Olsen |
K |
cm |
(%) |
(%) |
(%) |
(mS cm-1) |
(%) |
(mg kg-1) |
(Cmol(+) kg-1) |
|||
Dinamita |
0-30 |
25.3 |
28.4 |
46.3 |
7.6 |
3 |
1.52 |
126.1 |
41.3 |
2.5 |
30-60 |
24.9 |
28.7 |
46.5 |
7.8 |
2 |
80.4 |
26.1 |
2.4 |
||
60-90 |
22.3 |
32.4 |
44.3 |
7.9 |
1.5 |
65.7 |
14.6 |
2.2 |
||
Transportes |
0-30 |
20.9 |
20.4 |
58.7 |
7.8 |
2.2 |
1.3 |
62.5 |
6.4 |
2.1 |
30-60 |
20.2 |
17.3 |
62.4 |
7.7 |
3.6 |
42.5 |
3 |
1.5 |
||
60-90 |
20.8 |
21.7 |
55.4 |
7.6 |
3.2 |
51.5 |
4.5 |
1 |
||
Vergel-1 |
0-30 |
24.6 |
24.2 |
47.5 |
7.9 |
5.1 |
1.86 |
35.2 |
18.4 |
3.1 |
30-60 |
26 |
23.9 |
49.7 |
7.8 |
5.6 |
33.6 |
6.4 |
3.2 |
||
60-90 |
24 |
26.6 |
47.1 |
7.9 |
5 |
30.5 |
7.6 |
2.9 |
||
Vergel-2 |
0-30 |
27.4 |
24.7 |
48.4 |
7.9 |
3.8 |
1.5 |
24.7 |
8.6 |
2.4 |
30-60 |
29 |
18.5 |
53 |
8.1 |
4.8 |
30.5 |
9 |
3.1 |
||
60-90 |
28.1 |
22.7 |
45.9 |
8 |
5.2 |
22.6 |
6.4 |
4 |
||
Huerta |
profundidad |
Ca |
Mg |
Fe |
Cu |
Mn |
Zn |
|||
(cm) |
Cmol(+) kg-1 |
(mg kg-1) |
||||||||
Dinamita |
0-30 |
13.1 |
4.1 |
1.01 |
0.49 |
11.43 |
0.21 |
|||
30-60 |
16.3 |
4.3 |
0.69 |
0.07 |
8.52 |
0.18 |
||||
60-90 |
18 |
4.2 |
0.89 |
0.06 |
4.75 |
0.12 |
||||
Transportes |
0-30 |
15 |
5.2 |
0.95 |
0.28 |
7.54 |
0.15 |
|||
30-60 |
26.4 |
4.5 |
0.78 |
0.3 |
3.83 |
0.13 |
||||
60-90 |
8.6 |
3.8 |
0.65 |
0.27 |
1.86 |
0.11 |
||||
Vergel-1 |
0-30 |
28.9 |
4.7 |
0.25 |
0.4 |
8.63 |
0.26 |
|||
30-60 |
13.5 |
4.8 |
0.46 |
0.38 |
2.19 |
0.13 |
||||
60-90 |
13.4 |
4.3 |
0.21 |
0.44 |
1.54 |
0.13 |
||||
Vergel-2 |
0-30 |
19.9 |
4.2 |
0.56 |
0.34 |
4.99 |
0.21 |
|||
30-60 |
15 |
4.4 |
0.48 |
0.38 |
2.64 |
0.15 |
||||
60-90 |
10.6 |
4.5 |
0.41 |
0.36 |
0.68 |
0.12 |
||||
Los valores de pH están en el rango de 7.6 y 8.1, que corresponden a suelos moderadamente alcalinos, típicos de los suelos calcáreos de zonas áridas. Con respecto a la salinidad, la CE en la huerta Vergel-1 fue la más alta, con valores de 5 a 5.6 dS m-1, por lo que se clasifica como suelo salino. En las demás huertas la CE fluctuó de 2.2 a 3.8 dS m-1 en el estrato de 0-30 cm (Cuadro 1), valores considerados como moderadamente salinos (SEMARNAT, 2000). La materia orgánica (MO) solo se analizó en el estrato de 0-30 cm por considerar que es donde se manifiestan las diferencias al estar aplicando composta.
Los valores de MO variaron de 1.3 a 1.86% entre huertas (Cuadro 1); de acuerdo con la NOM-021-SEMARNAT-2000, valores de 1.5% o menos se clasifican bajos en MO, mientras que arriba de 1.5% son medianos en MO. La concentración de N inorgánico en el suelo fue mayor en la huerta Dinamita, con un promedio de 90 mg kg-1, en todo el perfil (0-90 cm), seguido por Transporte, Vergel-1 y Vergel-2, con valores de 52, 33 y 26 mg kg-1, respectivamente; los valores en Dinamita y Transporte se clasifican como muy altos, mientras que los de Vergel-1 y Vergel-2 se consideran valores medios (SEMARNAT, 2000). Con respecto a P, la huerta Dinamita tuvo los valores más altos, con 27.3 mg kg-1 en promedio de 0 a 90 cm, seguido por Vergel-1, Vergel-2 y Transporte con promedios de 10.8, 8 y 4.6 mg kg-1, respectivamente.
Valores de P en suelo mayores de 11 mg kg-1 se consideran altos, mientras que valores menores de 5.5 mg kg-1 se consideran bajos (SEMARNAT, 2000). La concentración de K fue de alta (>0.6 Cmol(+) kg-1) en todas las huertas y en todo el perfil. El Ca tuvo una concentración alta (>10 Cmol(+) kg-1) en todos casos, excepto en la huerta Transportes a 60-90 cm, donde alcanzó un valor medio con 8.6 Cmol(+) kg-1. De igual manera, el Mg tuvo un promedio de 4.4 (±0.4) Cmol(+) kg-1, considerado también como alto (SEMARNAT, 2000).
Las concentraciones de Fe y Zn en el perfil de las cuatro huertas se clasificaron como deficientes, con menos de 2.5 Cmol(+) kg-1 de Fe y menos de 0.5 Cmol(+) kg-1 de Zn (NOM-021-SEMARNAT-2000). La concentración de Cu se clasifica como adecuada (>0.2 Cmol(+) kg-1) en todos los casos, excepto a 30-90 cm en la huerta Dinamita, donde fue deficiente (<0.2 Cmol(+) kg-1), en el caso de Mn, la concentración fue adecuada (>1 Cmol(+) kg-1) en todos los casos, excepto en Vergel-2 a 60-90 cm, que fue deficiente con menos de 1 Cmol(+) kg-1 (NOM-021-SEMARNAT-2000).
Los muestreos foliares se realizaron mensualmente en cada uno de los arboles seleccionados en las cuatro huertas, de abril a octubre de 2015. Se tomaron tres hojas de cada árbol, de tres brotes diferentes, con el criterio de muestrear la hoja más joven completamente expandida en brotes del año, seleccionados al azar dentro del árbol, luego se obtuvo una muestra compuesta al combinar las 18 hojas de los seis árboles de cada repetición. Las muestras se lavaron con agua desmineralizada dos veces y luego se secaron a peso contante en estufa de aire forzado a 65 ºC, para posteriormente molerlas hasta pasar una malla 0.5 mm.
Se analizó N por el método micro Kjeldhal, P por el método colorimétrico con molibdato-vanadato; K, Ca, Mg, Fe, Cu, Mn, Zn y sodio (Na) por digestión acida en horno de microondas y análisis en absorción atómica (Perkin Elmer modelo AA-700). Las técnicas de análisis se realizaron según Kalra (1998). Los análisis se realizaron en el Laboratorio de Análisis de Suelo del Campo Experimental La Laguna, del INIFAP. Se realizaron análisis de varianza para detectar diferencias entre huertas, dentro de cada fecha de muestreo. El análisis de la información se realizó con el sistema de análisis estadístico SAS (versión 9.0; SAS Institute, Cary, NC).
Resultados y discusión
Concentración foliar de macronutrientes
La concentración de N en hoja fue más alta en abril en las cuatro huertas, sin que las diferencias entre ellas fueran significativas. En mayo y agosto las diferencias entre huertas fueron significativas (Cuadro 2) en mayo, las huertas Dinamita y Transporte tuvieron valores más bajos que Vergel-1 y Vergel-2, mientras que, en agosto, Dinamita tuvo valores más altos que Vergel-1 y Transportes (Figura 1).
Cuadro 2 Valores de probabilidad (p) de que las medias de la concentración foliar de cada nutrimento en las cuatro huertas sean estadísticamente iguales, de acuerdo con el análisis de varianza.
Nutrimento |
Abril |
Mayo |
Junio |
Julio |
Agosto |
Septiembre |
Octubre |
N |
0.175 |
0.001 (0.374) |
0.092 |
0.127 |
0.036 (0.335) |
0.813 |
0.533 |
P |
0.601 |
0.032 (0.022) |
0.41 |
0.522 |
0.337 |
0.031 (0.112) |
0.082 |
K |
0.032 (0.185) |
0.009 (0.592) |
0.394 |
0.058 |
0.076 |
0.09 |
0.635 |
Ca |
0.938 |
0.157 |
0.258 |
0.101 |
0.156 |
0.055 |
0.035 (0.574) |
Mg |
0.509 |
0.501 |
0.819 |
0.421 |
0.105 |
0.002 (0.036) |
0.005 (0.073) |
Fe |
0.244 |
0.773 |
0.075 |
0.404 |
0.046 (104.66) |
0.036 (121.2) |
0.468 |
Cu |
0.909 |
0.413 |
0.019 (2.431) |
0.726 |
0.058 |
0.261 |
0.04 (48.95) |
Mn |
0.827 |
0.808 |
0.022 (20.196) |
0.473 |
0.535 |
0.65 |
0.021 (12.681) |
Zn |
0.993 |
0.007 (5.52) |
0.293 |
0.36 |
0.1 |
0.007 (4.558) |
0.238 |
Ni |
0.403 |
0.14 |
0.541 |
0.011 (1.415) |
0.409 |
0.201 |
0.528 |
Donde hay diferencias significativas (p≤ 0.05), se anota entre paréntesis el valor de diferencia mínima significativa de Fisher (DMS), con un valor de α= 0.05.
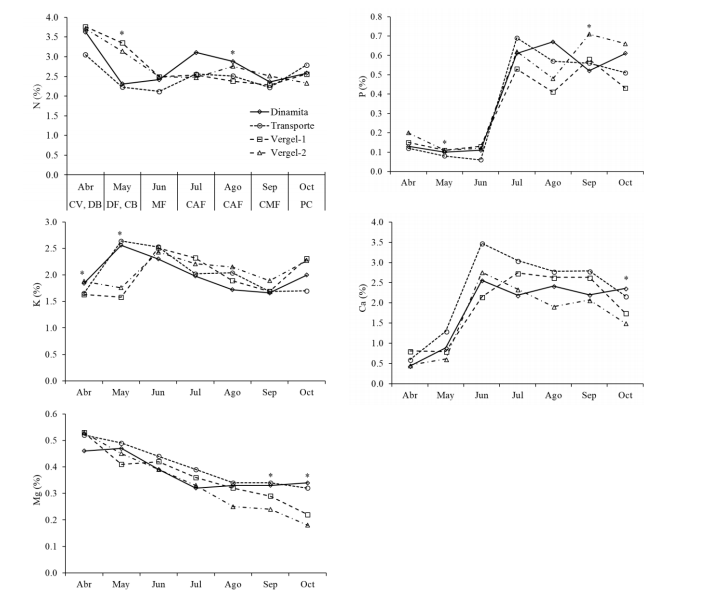
Figura 1 Variación estacional de macroelementos en el cultivo de higuera durante el ciclo de producción. CV= crecimiento vegetativo; DB= desarrollo de brevas; DF= desarrollo de frutos; CB= cosecha de brevas; MF= maduración de frutos; CAF= cosecha alta de frutos; CMF= cosecha media de frutos; PC= postcosecha. *Indica diferencia significativa entre huertas, dentro de cada fecha de muestreo, de acuerdo con la prueba de diferencia mínima significativa de Fisher (DMS), con un valor de α= 0.05).
La concentración de N permaneció estable de mayo a octubre en las huertas Dinamita y transporte, y de junio a octubre en Vergel-1 y Vergel-2. En abril, la concentración promedio (± desviación estándar) de las cuatro huertas fue de 3.54 ±0.33%, mientras que de junio a octubre el promedio fue de 2.54 ±0.23%. La disminución de la concentración de N en los primeros meses coincide con el desarrollo de los brotes y hojas, por tanto, la menor concentración de N puede deberse a un efecto de dilución (Tehryung y Wetzstein, 2005). Además, la disminución de N de mayo a junio y de agosto a septiembre puede deberse a la cosecha de brevas y de frutos, respectivamente (Brown, 1994).
Dependiendo de la especie de planta, la etapa de desarrollo y órgano, los requerimientos de N para un desarrollo óptimo pueden estar entre 2 a 5% (con base seca) de la planta (Marschner, 2012). La tendencia decreciente de la concentración de N coincidió con los resultados de Brown (1994), en árboles de higuera en California, EUA, aunque las concentraciones indicadas por este autor fueron menores, de 2.3% en mayo (floración) a 1.5% en octubre (poscosecha). Por otro lado, a pesar de las diferencias entre huertas en la concentración de N inorgánico en suelo en el presente estudio (Cuadro 1), el N foliar no varió significativamente en la mayoría de las fechas de muestreo y durante junio y julio se mantuvo dentro del intervalo de suficiencia de 2 a 2.5% indicado por Jones et al. (1991), excepto la huerta Dinamita en julio, que alcanzó 3.1%, sin que la diferencia sea significativa; lo anterior puede deberse a que la huerta Dinamita tuvo la mayor concentración de N inorgánico en el perfil del suelo (Cuadro 1).
El P en la hoja fue relativamente bajo de abril a junio, con un promedio de 0.12 ± 0.03% en mayo, las diferencias entre huertas fueron significativas (Cuadro 2), cuando la huerta Transporte tuvo menor concentración de P que las demás (Figura 1). A partir de julio la concentración de P se incrementó y se mantuvo estable hasta octubre, con un promedio de 5.7 ±0.09%. En septiembre, la huerta Vergel-2 fue significativamente superior a las demás (Figura 1).
El incremento en la concentración de P a partir de julio coincide con la cosecha alta de frutos. Valores altos de P en higuera fueron registrados por Caetano et al. (2006), quienes encontraron valores de P de 0.73% al final de la primavera. Para un crecimiento óptimo de la mayoría de las plantas, el P debe estar en el rango de 0.3 a 0.5% durante la etapa de crecimiento vegetativo (Marschner, 2012). De acuerdo con Jones et al. (1991), el rango de suficiencia de P en higuera es de 0.1 a 0.3%, lo cual coincide con los valores registrados de abril a junio en todas las huertas, a pesar de las diferencias en P en el suelo (Cuadro 1).
La concentración de K mostró diferencias significativas entre huertas en abril y mayo (Cuadro 2). En abril, el K fue mayor en Dinamita y Vergel-2, con un promedio de 1.86%, en mayo, el K fue más alto en las huertas Dinamita y Transporte, que promediaron 2.6%. A partir de junio, la concentración de K bajo de 2.44% hasta llegar en septiembre a un promedio similar al de abril, con 1.73% (Figura 1).
Los valores anteriores de K foliar en abril y mayo no tuvieron relación con el K en el suelo, ya que la huerta Dinamita tuvo valores de K en suelo más bajos que Vergel-1 (Cuadro 1) y valores más altos en el follaje. La disminución en los valores de K en hoja coincidió con el periodo de cosecha de frutos, mientras que en octubre se observó un ligero incremento en la concentración de K, cuando ya es la etapa de postcosecha. Según Marschner (2012), el K, junto con N, es el elemento mineral requerido en mayor cantidad, con un intervalo óptimo entre 2 a 5% en partes vegetativas. Sin embargo, Jones et al. (1991) indican que la concentración de K suficiente para higo es >1%.
El patrón a disminuir la concentración de K a lo largo del ciclo coincide con Brown (1994), aunque este autor obtuvo concentraciones menores, entre 1.4% en mayo y 0.7% en octubre. La concentración de K en el suelo fue alta en todas las huertas (Cuadro 1), típico de los suelos arcillosos y alcalinos (Aguado et al., 2002) como los del presente estudio, lo cual puede explicar la alta concentración de K foliar. Los valores de Ca fueron bajos en abril y mayo, con un promedio de 0.74%, para luego incrementarse hasta valores entre 2.15 y 3.48% en junio. En este periodo se dio el desarrollo y cosecha de brevas, así como desarrollo de los frutos.
A partir julio la concentración de Ca disminuyó hasta valores entre 1.5 y 2.36% en octubre, en este último mes de muestreo las diferencias entre huertas fueron significativas (Cuadro 2), registrándose los valores más altos en Dinamita y Transporte (Figura 1). La concentración de Ca en hoja no se relacionó con el Ca en el suelo, ya que la huerta Dinamita tuvo el segundo valor más bajo y Transporte tuvo el valor más alto (Cuadro 1). Brown (1994) indica que parte de la variabilidad en la concentración de nutrimentos al final del ciclo se explica por la removilización de nutrientes fuera de las hojas.
Los valores bajos en el presente trabajo (<2% de Ca) coinciden con Caetano et al. (2006), quienes registraron 1.45%. Jones et al. (1991), mencionan una concentración mayor de 3% como suficiente para este cultivo, en muestras tomadas en julio y agosto, similar a lo identificado por Brown (1994), con valores de Ca entre 2.9 y 3% de mayo a septiembre. Con respecto a la concentración de Mg, en abril se obtuvo un promedio de 0.51% y a partir de ahí bajo en promedio 0.04% cada mes, de acuerdo al modelo de regresión lineal (Mg= -0.0409X + 0.658; r2= 0.8) entre la concentración de Mg, promedio de las cuatro huertas, y el número de mes de muestreo.
Todos los valores anteriores son menores al valor crítico de suficiencia de 0.7%, señalado por Jones et al. (1991) y por Reuter y Robinson (1997); sin embargo, no se observaron síntomas de deficiencia. Marschner (2012) indicó que la concentración óptima de Mg en plantas en general está en el intervalo de 0.15 a 0.35%. En árboles de higuera en producción, Caetano et al. (2006) analizaron muestras foliares de higo a inicios de primavera y encontraron valores de Mg (0.59%) similares a los encontrados en este trabajo en el mes de abril.
Concentraciones foliares de micronutrientes
La concentración foliar de Fe no mostró una tendencia a disminuir o aumentar durante el ciclo de producción. El Fe se mantuvo en concentraciones entre 100 y 500 mg kg-1; sin embargo, en agosto y septiembre las diferencias entre huertas fueron significativas (Cuadro 2) en estos meses, Vergel-1 y Vergel-2 tuvieron las concentraciones más altas, con valores medios de 245 a 318 mg kg-1, los cuales fueron superiores a los reportadas por Brown (1994); Caetano et al. (2006).
Por otro lado, de acuerdo con Marschner (2012), los niveles de Fe encontrados en el presente estudio están dentro de parámetros normales para la mayoría de las plantas, el autor señaló que una deficiencia puede estar en el intervalo de 50-150 mg kg-1, mientras que concentraciones mayores de 500 mg kg-1 pueden ser tóxicas para algunas plantas (Figura 2).
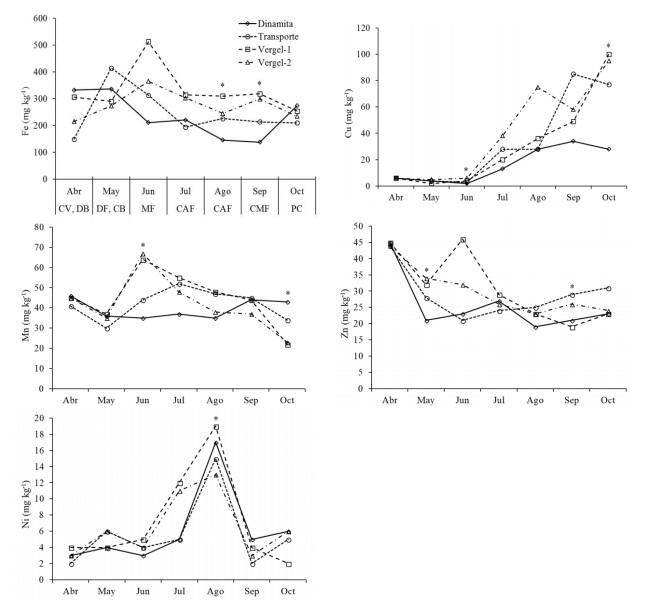
Figura 2 Variación estacional de microelementos en el cultivo de higuera durante el ciclo de producción. CV= crecimiento vegetativo; DB= desarrollo de brevas; DF= desarrollo de frutos; CB= cosecha de brevas; MF= maduración de frutos; CAF= cosecha alta de frutos; CMF= cosecha media de frutos; PC= postcosecha. *Indica diferencia significativa entre huertas, dentro de cada fecha de muestreo, de acuerdo con la prueba de diferencia mínima significativa de Fisher (DMS), con un valor de α= 0.05).
La alta concentración de Fe en hojas registrada en el presente estudio puede deberse a la aplicación de composta a base estiércol (Nikoli y Matsi, 2011).
La concentración de Cu de abril a junio varió de 2 a 6 mg kg-1, para después incrementarse gradualmente a partir de julio, hasta alcanzar valores promedio de 95 a 100 mg kg-1 en octubre. En octubre, las diferencias entre huertas fueron significativas (Cuadro 2), donde la concentración promedio más baja se registró en la huerta Dinamita (28 mg kg-1). De acuerdo con Marschner (2012) una deficiencia de Cu podría encontrase entre 1 y 5 mg kg-1, y un efecto por toxicidad en algunas plantas podría detectarse a concentraciones mayores de 30 mg kg-1, aunque hay especies de vegetación natural que pueden tener concentraciones de Cu hasta de 1000 mg kg-1.
Sin embargo, Jones et al. (1991) determinaron para higo una concentración de suficiencia >4 mg kg-1 de Cu de julio y agosto, sin especificar un nivel crítico tóxico. Al igual que Fe, la alta concentración de Cu encontrada en el presente estudio puede deberse a la aplicación de composta a base estiércol (Nikoli y Matsi, 2011). La concentración media de Mn mostró diferencias significativas entre huertas en junio y octubre (Cuadro 2). En junio, Vergel-1 y Vergel-2 tuvieron los valores promedio más altos (64 y 67 mg kg-1, respectivamente) mientras que, en octubre, la huerta Dinamita tuvo la concentración promedio más alta (43 mg kg-1).
Estas concentraciones son bajas en comparación con lo indicado por Brown (1994) y Caetano et al. (2006). Brown (1994), registró valores entre 80 y 165 mg kg-1, en diferentes etapas del ciclo y en arboles con diferente vigor. En contraste, Jones et al. (1991) estableció una concentración >20 mg kg-1 como un valor de suficiencia en higuera. La concentración promedio de Zn en abril fue de 44.5 mg kg-1, a partir de mayo el Zn bajó y se mantuvo en el rango promedio de 30.5 mg kg-1 en junio a 22.5 mg kg-1 en agosto. En mayo, la concentración de Zn en la huerta Dinamita fue significativamente menor a las demás, mientras que en septiembre, Dinamita y Vergel-1 tuvieron concentraciones más bajas de Zn, con respecto a las otras dos huertas (Cuadro 2).
Las concentraciones finales de Zn, son similares al promedio reportado por Caetano et al. (2006) en arboles de higuera. Marschner (2012), señaló que generalmente en plantas, una deficiencia de Zn podría presentarse a concentraciones por debajo de 15 a 20 mg kg-1. Sin embargo, Brown (1994) indicó una concentración entre 9 y 12 mg kg-1 para árboles de higuera con alta producción. La concentración de Ni en hoja se mantuvo entre 2 y 6 mg kg-1 de abril a junio, luego aumentó entre 5 y 19 mg kg-1 en julio y agosto, para después disminuir a valores entre 2 y 6 mg kg-1. De acuerdo con Marschner (2012), en la mayoría de las plantas, la concentración de Ni en los órganos vegetativos está en el rango de 1 a 10 mg kg-1. Wood et al. (2004) concluyeron que el síntoma visual en nogal pecanero conocido como ‘oreja de ratón’, se debió a una deficiencia de Ni, el cual puede ser severo a valores menores de 1 mg kg-1 (Figura 2). También en nogal, Smith et al. (2012) señalan un valor crítico normal de Ni ≥2.5 mg kg-1.
En general, se observaron variaciones estacionales grandes en la mayoría de los nutrimentos, sobre todos los elementos menores. Brown (1994), mostró este tipo de variación, por ejemplo, de 80 a 166 mg kg-1 de Fe entre mayo y octubre, o de 190 a 450 mg kg-1 de Mn en los mismos meses de muestreo. De acuerdo con este autor, parte de la variabilidad al final del ciclo se explica por la removilización de nutrientes fuera de las hojas. Considerando que la mayoría de los nutrimentos no observaron diferencias significativas entre huertas, los promedios mensuales pueden servir como valores de referencia preliminares para árboles en producción.
Todos los nutrimentos están dentro de valores de suficiencia reportados por Jones et al. (1991) y Reuter y Robinson (1997), excepto Ca y Mg, cuya concentración fue poco más baja que el valor de suficiencia, pero no se observaron síntomas de deficiencia. Jones et al. (1991) han sugerido que la mejor época para colectar muestras foliares en árboles de higuera es entre julio y agosto, tomando la hoja más joven completamente expandida, en diferentes brotes. Sin embargo, en esos meses se generaliza la cosecha de frutos de higo en esta región, lo cual podría influir en el contenido de nutrimentos en las hojas. Una época adecuada para esta región puede ser cuando termina la cosecha de brevas y antes de iniciar la cosecha de frutos, que en el presente estudio ocurrió durante junio. Además, en junio fue cuando se registró menor variación entre huertas (Cuadro 3).
Cuadro 3 Valores promedio por mes (± desviación estándar) de la concentración de nutrimentos en árboles de higuera.
Mes |
Abril |
Mayo |
Junio |
Julio |
Agosto |
Septiembre |
Octubre |
|||||||
N (%) |
3.54 |
±0.42 |
2.76 |
±0.55 |
2.38 |
±0.2 |
2.67 |
±0.35 |
2.63 |
±0.27 |
2.34 |
±0.33 |
2.56 |
±0.37 |
P (%) |
0.16 |
±0.05 |
0.1 |
±0.02 |
0.11 |
±0.05 |
0.61 |
±0.13 |
0.53 |
±0.19 |
0.59 |
±0.09 |
0.55 |
±0.12 |
K (%) |
1.75 |
±0.14 |
2.14 |
±0.55 |
2.44 |
±0.17 |
2.13 |
±0.19 |
1.95 |
±0.23 |
1.73 |
±0.12 |
2.07 |
±0.54 |
Ca (%) |
0.58 |
±0.65 |
0.9 |
±0.35 |
2.74 |
±0.8 |
2.58 |
±0.47 |
2.44 |
±0.54 |
2.42 |
±0.4 |
1.94 |
±0.42 |
Mg (%) |
0.51 |
±0.06 |
0.45 |
±0.06 |
0.41 |
±0.06 |
0.35 |
±0.05 |
0.31 |
±0.05 |
0.3 |
±0.04 |
0.26 |
±0.07 |
Fe (mg kg-1) |
251 |
±118 |
328 |
±153 |
350 |
±173 |
258 |
±95 |
232 |
±90 |
242 |
±104 |
243 |
±58 |
Cu (mg kg-1) |
6.1 |
±0.8 |
3.8 |
±2.1 |
3.7 |
±2 |
24.8 |
±25.4 |
41.8 |
±28.1 |
56.3 |
±30.7 |
74.7 |
±35.2 |
Mn (mg kg-1) |
44.1 |
±6.3 |
34.7 |
±9.1 |
52.4 |
±17.9 |
47.9 |
±12.7 |
41.8 |
±14.5 |
42.5 |
±9.4 |
30.8 |
±11 |
Zn (mg kg-1) |
44.6 |
±4.6 |
28.8 |
±5.3 |
30.3 |
±16.8 |
26.5 |
±3.1 |
22.7 |
±3 |
23.7 |
±4.6 |
25.3 |
±5.2 |
Ni (mg kg-1) |
2.91 |
±1.29 |
4.8 |
±1.59 |
3.85 |
±1.62 |
8.33 |
±3.89 |
15.7 |
±4.16 |
3.33 |
±1.56 |
4.67 |
±3.23 |
Conclusiones
En la mayoría de los elementos, se observó una variación a lo largo del ciclo en su concentración en hojas; N, Mg y Zn obtuvieron concentraciones más altas al inicio, mientras que P, Ca, Cu y Ni ocurrió lo opuesto, en el caso de Fe y Mn, no mostraron una tendencia definida. En general, no se observaron diferencias significativas entre huertas, con respecto a la concentración de nutrimentos, para cada fecha de muestreo. Todos los nutrimentos estuvieron dentro de los niveles de suficiencia indicados en la literatura con excepción a Ca y Mg; sin embargo, no se observaron síntomas de deficiencia. Es recomendable tomar las muestras foliares durante junio, ya que en este mes la mayoría de los elementos se observó menor variación entre huertas y es la época en que no hay cosecha de brevas ni de higos.











 text in
text in 


