Introducción
En Baja California Sur, la agricultura representa una de las actividades económicas de gran relevancia, la cual se lleva a cabo bajo sistemas de producción orgánicos o convencionales. Actualmente, existen 44 167 ha de cultivo, con más de 50 tipos de productos hortícolas y más de 12 especies de frutales distribuidas a lo largo de toda la entidad, considerados de alta prioridad estratégica, dada su elevada competitividad y su importancia socioeconómica (SAGARPA, 2017). Dentro de los principales problemas fitopatológicos, se encuentra el nematodo agallador (Meloidogyne spp.).
Su principal síntoma en las plantas, es la generación de numerosas agallas en las raíces, impidiendo la absorción y transporte de agua y nutrientes hacia el follaje, lo que se traduce en amarillamiento de hojas, retraso en el crecimiento y posteriormente la muerte de la planta, generando pérdidas en la producción de 20-50% (Zeng et al., 2017). Actualmente, la aplicación de productos químicos y el uso de variedades resistentes, son las estrategias más comunes para el control de este patógeno (Beira et al., 2016).
Sin embargo, no han mostrado la eficacia esperada. Las principales especies reportadas a nivel mundial son M. incognita, M. arenaria, M. hapla y M. javanica (Kaur y Attri, 2013). Aunque, continuamente aparecen nuevas especies relacionadas a este género, donde su severidad es mayor, ya que poseen la capacidad de romper la resistencia de los cultivos utilizados y reaccionan de manera diferente a los grupos químicos utilizados en campo, lo que dificulta el éxito de los métodos de control.
La identificación precisa de microorganismos patógenos y el uso de mapas de distribución de las especies, son una de las herramientas útiles en el diseño de programas para la implementación de estrategias efectivas de manejo (Nicol et al., 2011), que evita la aplicación indiscriminada de agroquímicos y propician la generación de especies resistentes a éstos, asi como la contaminación ambiental y la eliminación de fauna y flora benéfica del suelo (Kloepper et al., 1991).
Actualmente, en distintos estados de Mexico, se han realizado diversos estudios de identificación de especies de Meloidogyne. Sin embargo, en Baja California Sur, no existe registro de las especies asociadas a los cultivos, así como tampoco su localización en las diferentes áreas de producción, lo que sería de gran importancia para el sector agrícola. Por lo anterior, el objetivo del presente estudio fue identificar, mediante métodos moleculares y morfológicos, las especies de Meloidogyne, asociadas a los cultivos de importancia económica. Así como su distribución en las principales zonas agrícolas del estado.
Materiales y métodos
Área de estudio
Este estudio se realizó durante el ciclo agrícola 2017-2018, en el laboratorio de fitopatología del Departamento Académico de Agronomía, de la Universidad Autónoma de Baja California Sur (UABCS), localizado en las coordenadas geográficas 24° 06’ 03’’ latitud norte 110° 18’ 54’’ longitud oeste, en La Paz, Baja California Sur.
Muestreo en campo
Un total de 16 cultivos, fueron muestreados en los cuatro municipios de mayor importancia agrícola en Baja California Sur: Mulegé (26° 53’ 30’’ latitud norte 111° 58’ 51’’ longitud oeste), Comondú (25° 30’ latitud norte 112° 00’ longitud oeste), La Paz (24° 08’ 32’’ latitud norte 110° 18’ 39’’ longitud oeste ) y Los Cabos (22° 52’ 52’’ latitud norte 109° 54’ 49’’ longitud oeste). En cada campo, se obtuvieron 10 muestras de plantas al azar dirigido únicamente en aquellas que mostraban síntomas de amarillamiento, marchitez foliar y reducción en el crecimiento. Además, 10 submuestras de suelo de la rizósfera, obtenidas a una profundidad de 30 cm con la ayuda de una pala, mediante el método de zig-zag propuesto por Shurtleff y Averre III (2000).
Las sub-muestras se homogenizaron para formar una sola muestra (2 kg), se depositaron en bolsas plásticas y posteriormente se llevaron al laboratorio para el análisis correspondiente. Las coordenadas geográficas de los diferentes lugares se determinaron mediante un dispositivo de posicionamiento global (navegador, Etrex, Garmin®) y se tomó la información de campo respectiva (cultivo, etapa fenológica y tipo de manejo).
Frecuencia de ocurrencia, incidencia e índice de agallamiento en los campos muestreados
En cada área muestreada, se determinó la frecuencia de ocurrencia, incidencia e índice de agallamiento provocado por el nematodo agallador. La frecuencia de ocurrencia, se obtuvo mediante la prevalencia de Meloidogyne al calcular el número de campos con nematodos agalladores/número total de campos evaluados. Asimismo, se determinó el porcentaje de incidencia de la enfermedad, al obtener el número de plantas con agallamiento/número total de plantas evaluadas. El índice de agallamiento (IG), se evaluó de acuerdo la escala propuesta por Taylor y Sasser (1978), donde: 0= 0 agallas, 1= 1-2 agallas, 2= 3-10 agallas, 3=11-30 agallas, 4= 31-100 agallas y 5= más de 100 agallas.
Extracción de individuos para la determinación de poblaciones en suelo y raíz
La extracción de machos y juveniles se llevó a cabo, mediante la técnica de tamiz-embudo de Baerman como lo describe Southey (1986). 100 g de suelo, fueron obtenidos de cada muestra original previamente homogenizada y diluidos en 200 ml de agua destilada. Posteriormente, la suspensión se pasó; a través, de tamices (marca Fiicsa) de 200 y 325 mesh. De este último, se recuperó la suspensión y se vacío a un embudo con la ayuda de una pizeta. La determinación de juveniles en raíces, se realizó mediante el método de macerado y filtrado (Hooper et al., 2005), donde 25 g de raíces se diluyeron en 200 ml de agua, y se licuaron por 30 s.
La suspensión se decantóó a través de tamices de 200 y 325 mesh. Con la ayuda de una pizeta, los nematodos retenidos en el tamiz de 325 se transfirieron a un embudo. Después de 48 h de reposo, se extrajeron 20 ml de la solución, de donde se tomó una alícuota de 1ml y se depositó sobre un vidrio de reloj. Bajo un microscopio compuesto (Labomed modelo Lx 400), se realizaron 5 conteos de cada muestra para obtener el valor promedio de nematodos fitoparásitos.
Prueba de patogenicidad
Posterior al método de extraccíon, se determinó la patogenicidad de cada población. Semillas de tomate cv ‘Río Grande’ fueron sembradas en charolas plásticas conteniendo sustrato comercial terralite®. Al presentar la cuarta hoja verdadera, 30 plántulas se trasplantaron a macetas plásticas de 4 kg, que contenían suelo de cada sitio de muestreo. El grupo control, contenía suelo esterilizado. Las plantas se colocaron en una casa de malla sombra (40% de sombreo), bajo una temperatura promedio de 18-30 °C y humedad relativa 40-80%.
Se realizaron dos riegos por semana, y una fertilización por mes con Triple 17® (17-17-17 de nitrógeno, fósforo y potasio, respectivamente). Tres meses después, todas las raíces se examinaron para determinar la presencia de agallas y confirmar la patogenicidad de Meloidogyne spp.
Identificación morfológica de Meloidogyne spp.
La identificación de especies de Meloidogyne colectadas en cada localidad, se llevó a cabo mediante comparación de patrones perineales (Eisenback y Hirschmann, 1981). 50 hembras globosas maduras, se extrajeron al azar de raíces con agallas y se sometieron a disección de la parte posterior de su cuerpo con ayuda de una navaja fina. Posteriormente se prepararon montajes sobre portaobjetos y se examinaron bajo un microscopio compuesto a 45X (Carl Zeiss). Las especies se identificaron en base a la distribución y forma de las estrías longitudinales y transversales de la región perineal y fueron comparadas con las características de patrones perineales propuesto por Taylor y Sasser (1983); Yang y Eisenback (1983).
Identificación molecular de Meloidogyne spp.
La identificación molecular de cada una de las poblaciones de Meloidogyne, se realizó a través del método de extracción de DNA genómico de 50 hembras adultas, las cuales se obtuvieron con una aguja de disección y se depositaron en un tubo de microcentrifuga de 1.5 ml, posteriormente, se añadió una alícuota de 45 μl de buffer de lisis (NaOH 50 mM), se sometió a lisis por calor a 95 °C por 10 min, se agregó una alícuota de 45 μl de Tris-HCl (pH 8) y se centrifugó por 3 min a 10 000 rpm (Hu et al., 2011), se recuperó el sobrenadante, para proceder con la PCR. Los primers usados para el analisis del DNA genómico de las especies de nematodos se enlistan en el Cuadro 1.
Cuadro 1 Primers utilizados para la identificación molecular de especies de Meloidogyne.
| Especie | Código de primers | Secuencia de los primers 5" A 3" | Fragmento (pb) | Especificidad y fuente |
| Meloidogyne spp. | MF | GGGGATGTTTGAGGCAGATTTG | 500 | 28S rRNA Nunn (1992) |
| MR | AACCGCTTCGGACTTCCACCAG | |||
| Meloidogyne incognita | Mi-F | GTGAGGATTCAGCTCCCCAG | 900 | (SCAR), Meng et al. (2004) |
| Mi-R | ACGAGGAACATACTTCTCCGTCC | |||
| Meloidogyne javanica | Fjav | GGTGCGCGATTGAACTGAGC | 700 | (SCAR) Zijlstra et al.(2000) |
| Rjav | CAGGCCCTTCAGTGGAACTATAC | |||
| Meloidogyne enterelobii | Me-F | AACTTTTGTGAAAGTGCCGCTG | 256 | (SCAR), Long et al. (2006) |
| Me-R | TCAGTTCAGGCAGGATCAACC | |||
| Meloidogyne arenaria | Ma-F | TCGAGGGCATCTAATAAAGG | 950 | (SCAR), Dong et al. (2001) |
| Ma-R | GGGCTGAATATTCAAAGGAA | |||
| Meloidogyne hapla | Mha-F | GGCTGAGCATAGTAGATGATGTT | 1 500 | (SCAR), Dong et al. (2001) |
| Mha-R | ACCCATTAAAGAGGAGTTTTGC |
Todas las amplificaciones de PCR se desarrollaron en un total de 25 µl conteniendo 5 µl de buffer gotaq 5x, 3 µl de MgCl2 (25 mM), 0.2 µl de Taq polimerasa, 0.5 µl de dNTP, 1 µl de cada iniciador, 2 µl de DNA genomico y se complementó con agua nanopura estéril. La amplificación del ADN se llevó a cabo en un termociclador (BIO-RAD T100), bajo las siguientes condiciones de amplificación: 94 °C por 2 min, 35 ciclos de 94 °C por 30 s, 64 °C por 30 s, 68 °C por 1 min, seguidos de una extensión final a 72 °C por 5 min. Los productos de PCR se separaron por electroforesis en buffer Tris-EDTA (TAE) en gel de agarosa al 2%, teñida con gel red a 60 V por 60 min y posteriormente se visualizó bajo la luz UV.
Resultados y discusión
Frecuencia de ocurrencia e incidencia
Dieciseis cultivos en etapa de producción, fueron evaluados en cuatro de los cinco municipios del estado de Baja California Sur. 13 de éstos, eran hortalizas, tales como tomate saladette, bola, grape, cherry, chile bell, chile California, betabel, acelga y calabaza. Dos de tipo aromático (albahaca) y un frutal (higuera). 12 de los 16 cultivos, se producían bajo un sistema convencional, mientras que los cuatro restantes pertenecían a un sistema de producción orgánico. De éstos, se analizaron 160 muestras de raíces, así como 160 muestras de suelo, de las cuales 157 raíces (98%) y 160 (100%) muestras de suelo presentaron infestación del nematodo agallador.
La frecuencia de ocurrencia de Meloidogyne en Mulegé, Comondú, La Paz y Los Cabos fue de 100%, es decir, todos los campos evaluados en cada municipio, donde se realizaron los muestreos, presentaron daños por el nematodo agallador. La incidencia del nematodo agallador fue 100% en todos los cultivos evaluados excepto en higuera donde presentó 70% de daño. Esto indica que las diez plantas evaluadas de cada cultivo, mostraron presencia de agallas en sus raíces y solo siete plantas pertencencientes al cultivo de higuera presentaron agallamiento radicular.
Índice de agallamiento
Las raíces de los diferentes cultivos presentaron agallamiento diferencial (Cuadro 2). El tomate saladette tipo convencional de la zona de Mulegé, fue el cultivo con mayor índice de agallamiento presentó al mostrar una escala de 5, seguido por el tomate saladette tipo orgánico con 4.8 y uno de los cultivares de grape-1 con 4.3. Para el caso de tomate bola, grape-2 e higuera el índice de agallamiento fue menor al mostrar una escala de agallamiento de 3.3, 1.5 y 1.1, respectivamente.
Cuadro 2 Incidencia, índice de agallamiento y población de Meloidogyne spp.
| Municipio | Hospedante | Sistema de producción | (%) de incidencia | Índice de agallamiento | Población de nematodos | |
| J2/25 g de raíz | J2/100 g suelo | |||||
| Mulegé | Tomate bola | Convencional | 100 | 3.3 | 657 | 1 004 |
| Tomate grape-1 | Convencional | 100 | 4.3 | 595 | 448 | |
| Tomate saladette-1 | Orgánico | 100 | 4.8 | 770 | 216 | |
| Tomate saladette-2 | Convencional | 100 | 5 | 418 | 1 116 | |
| Tomate grape-2 | Convencional | 100 | 1.5 | 44 | 96 | |
| Higuera | Convencional | 70 | 1.1 | 130 | 72 | |
| Comondú | Tomate saladette-3 | Convencional | 100 | 3.4 | 500 | 452 |
| Betabel | Convencional | 100 | 2.1 | 35 | 126 | |
| Acelga | Convencional | 100 | 3.7 | 965 | 566 | |
| Calabaza | Orgánico | 100 | 2 | 976 | 260 | |
| Tomate cherry | Orgánico | 100 | 2.1 | 37 | 101 | |
| La Paz | Chile bell | Convencional | 100 | 4.1 | 280 | 916 |
| Tomate saladette-4 | Convencional | 100 | 4.7 | 281 | 2 284 | |
| Chile california | Convencional | 100 | 2.7 | 871 | 1 192 | |
| Albahaca-1 | Convencional | 100 | 3.3 | 753 | 1 028 | |
| Los Cabos | Albahaca-2 | Orgánico | 100 | 4.2 | 1 671 | 1 050 |
En Comondú el mayor índice de agallamiento fue de 3.7 en acelga, seguido de tomate saladette (3.4), mientras que, en betabel, tomate cherry y calabaza el daño fue menor mostrando un agallamiento en la escala de 2.1, 2.1 y 2 respectivamente. En el caso de la zona de La Paz, se observó un mayor índice de agallamiento en tomate saladette (4.7), siguiendo en orden descendente el cultivo de chile bell (4.1), albahaca (3.3) y en menor medida el cultivo de chile California (2.7). Así mismo, en Los Cabos, el cultivo de albahaca presentó un índice de agallamiento de 4.2.
Respuesta de la planta a la infección por nematodos
Las plantas de tomate desarrolladas en suelo infestado con las diferentes poblaciones de Meloidogyne, mostraron agallamiento radicular a los 60 días después del trasplante. Durante este tiempo, las agallas presentaban tamaños variables y crecían de manera individual. Sin embargo, al final de la evaluación (90 dds), las agallas se agrupaban para producir agallas mayores, cercanas a una escala de 4 ó 5, dentro de un indice de agallamiento. Esta respuesta de daño demuestra y confirma la capacidad infectiva que poseen las poblaciones de nematodos obtenidas en cada sitio de muestreo.
Población de nematodos en suelo
Las poblaciones del nematodo agallador por cada 100 g de suelo y 25 g de raíz variaron entre los sitios de muestreo (Cuadro 2). Las poblaciónes en suelo variaron de 72 a 2 284 individuos del segundo estadío (J2), mientras que en raíces fue de 35 a 1 671 nematodos. Los cultivos que presentaron la menor población del nematodo agallador en suelo fueron higuera, tomate grape-2 y tomate cherry con 72, 96 y 101 J2 respectivamente en 100 g de suelo. Seguido de éstos, se presentaron los cultivos con poblaciones mayores a 100 nematodos, tales como betabel (126), tomate saladette-1 (216) y calabaza (260).
Mientras que en tomate grape-1, tomate saladette-3 y acelga, la población superó 400 nematodos por muestra al presentar 448, 452 y 556 nematodos respectivamente en 100 g de suelo. Sin embargo, las poblaciones mayores se observaron en el cultivo de chile bell (916), tomate bola (1 004), albahaca (1 028 y 1 050), tomate saladette-2 (1 116) y chile California (1 192). En el tomate saladette-4, se presentó la máxima densidad poblacional con 2,284 nematodos en 100 g de suelo.
Población de nematodos en raíz
La máxima población de nematodos en raíz fue observada en albahaca-2, ubicada en Los Cabos, la cual mostró 1 671 nematodos, seguido por los cultivos de calabaza (976), acelga (965), chile California (871), tomate-1 (770) y albahaca-1 (753), presentes en los diferentes municipios muestreados. En el caso de tomate saladette-2, tomate saladette-3, tomate grape-1 y tomate bola, la población superó los 400 nematodos presentes en las muestras de raíces al obtener 418, 500, 595 y 657 nematodos respectivamente. Mientras que, en menor medida, la población de nematodos estuvo presente en tomate saladette-4 (281), chile bell (280), higuera (130), tomate grape-2 (44), cherry (37) y betabel (35).
Identificación morfológica
Al analizar microscópicamente la morfología del patrón perineal de las hembras adultas, los diferentes campos muestreados, revelaron la presencia de dos diferentes tipos de patrones perineales. El tipo de patrón 1, se caracterizó por presentar generalmente una forma enlongada con un arco dorsal alto y cuadrado, con estrías suaves a onduladas con algunas bifurcaciones en las líneas laterales. Esta morfología coincidió con la descrita en la literatura para M. incognita (Figura 1) (Taylor y Sasser, 1983).
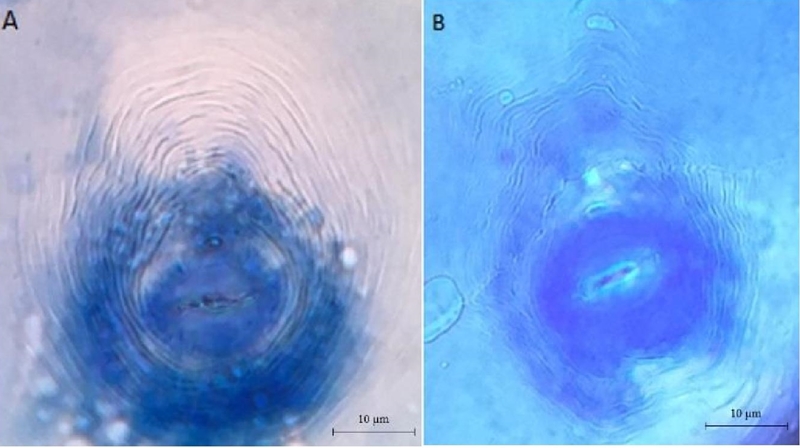
Figura 1. Microfotografía de patrones perineales obtenidos de hembras de Meloidogyne en cultivos agrícolas de Baja California Sur: Meloidogyne enterelobii: A) arco dorsal alto y redondo. Meloidogyne incognita; y B) arco dorsal alto y cuadrado. 40X.
El patrón tipo 2, presentó una morfología de ovoide a redondo, con arco dorsal alto ha redondeado, crestas laterales con estrías lisas a onduladas. Dichas características son típicas de Meloidogyne enterelobii (Yank y Eisenback, 1983).
Identificación molecular
La amplificación del DNA ribosomal, con los primers universales MF/MR produjeron un fragmento específico de 500 pb para el genero Meloidogyne en las muestras pertenecientes a todas las localidades. Los primers específicos se utilizaron para identificar y diferenciar las especies de Meloidogyne en las muestras de raíces colectadas. Una única banda específica de 256, 500 y 900 pb en tamaño se produjo; a través, de la amplificación en PCR solo para los primers específicos de M. enterelobii Me-F/Me-R de 11 poblaciones, primers universales MF/MR de Meloidogyne spp. de cuatro poblaciones y primers específicos de M. incognita Mi-F/Mi-R de cuatro poblaciones respectivamente (Figura 2).
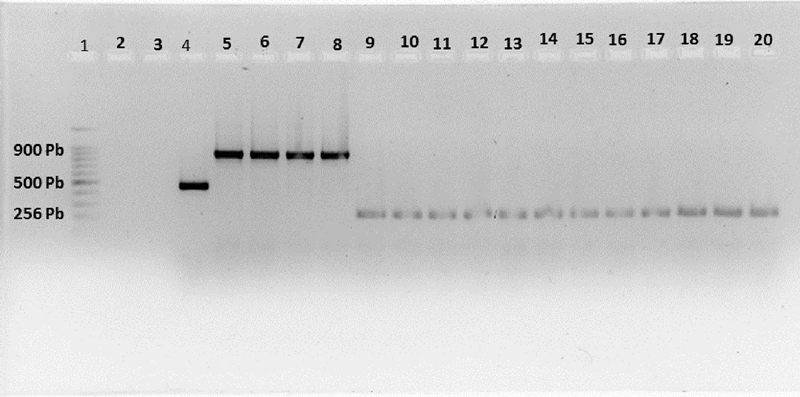
Figura 2 Producto de PCR obtenido de primers específicos y universales, a partir de DNA de poblaciones de nematodos presentes en raíces con agallas. Carril 1= marcador de DNA de 100 pb. Carril 2= control negativo. Carril 3= blanco. Carril 4= control positivo Meloidogyne spp. Carril 5-8= Mi-F/Mi-R. Carril 9-20= Me-F/Me-R.
El fragmento obtenido con los primers de M. enterelobii, coincide con Martínez et al. (2015) en sus investigaciones al obtener un producto de PCR de 256 pb durante su análisis de indentificación de especies de Meloidogyne en tomate. Mientras que en el caso de M. incognita, el amplicon generado fue de 900 pb, que corresponde a lo reportado por Meng et al. (2004). El control negativo y el blanco, como era de esperarse no amplificaron un producto de PCR con los primers utilizados.
Es importante mencionar, que la amplificación fue negativa para el resto de los primers específicos, correspondientes a las especies de M. hapla, M. arenaria y M. javanica. Cuatro de las muestras amplificaron para el género de Meloidogyne; sin embargo, no se expresó ningún amplicon para ninguna de las especies evaluadas, lo que podría indicar una especie diferente a éstas y nueva en el género. La Figura 3, muestra el resultado obtenido del análisis en las muestras de Comondú, Mulegé, La Paz y Los Cabos, donde únicamente se presentó una banda específica de 500 pb, derivada de la amplificación en PCR solo para los primers de Meloidogyne spp. MF/MR. En el resto de las muestras no mostraron alguna amplificación a las especies anteriormente evaluadas.

Figura 3 Producto de PCR obtenido de primers específicos y universales, a partir de DNA de poblaciones de nematodos presentes en raíces con agallas. Foto izquierda y derecha; amplificación de una única banda de 500 pb solo para MF/MR en los carriles 2, 8, 8 y 14. En el resto de los carriles no amplificó para alguna otra especie.
Distribución de especies
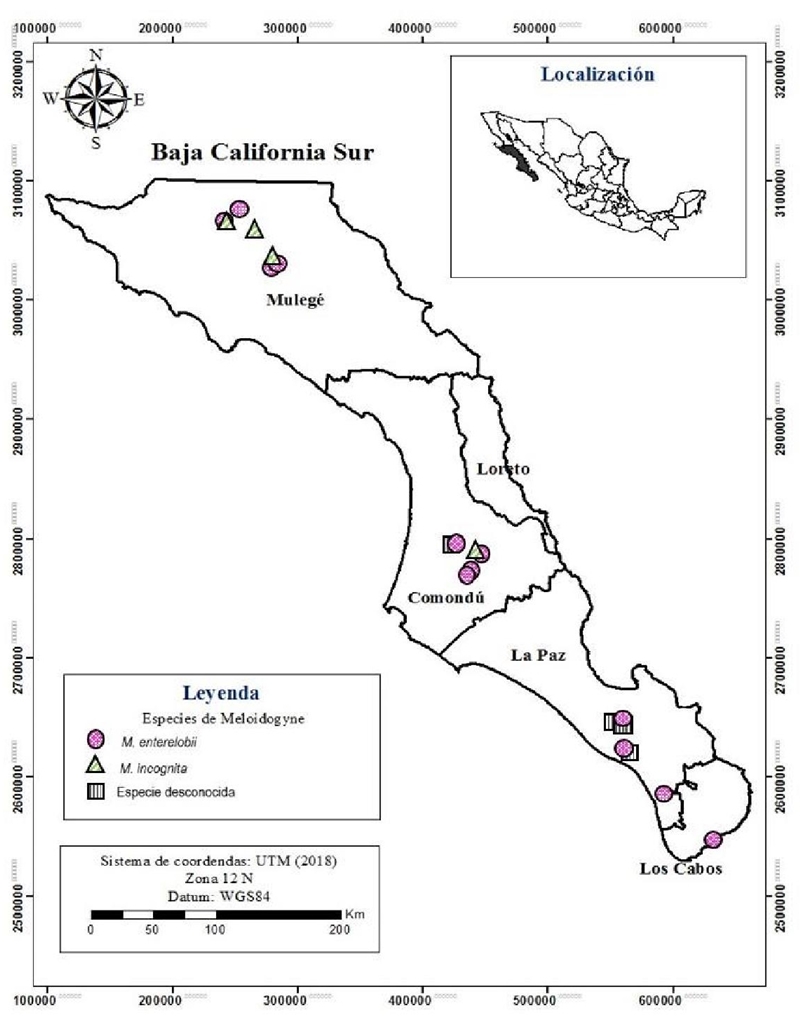
Meloidogyne incognita y Meloidogyne enterelobii se encontraron coinfectando dos (12.5%) campos de tomate evaluados, en la zona de Mulegé y Comondú. Así como dos (12.5%) de los campos fueron infestados con M. enterelobii y Meloidogyne spp. Mientras que Meloidogyne enterelobii se encontró en 12 (75%) campos de los 16 evaluados y M. incognita en cuatro (25%) unicamente. M. enterelobii, se determinó como la especie de nematodo agallador más común en Baja California Sur, al ser detectado en todos los distritos muestreados en la presente investigación tales como, Mulegé, Comondu, La Paz y Los Cabos, con el establecimiento de cultivos de tomate, chile, albahaca, betabel, acelga, calabaza e higuera. Meloidogyne incognita fue menos común y se detectó en dos distritos (Mulegé y Comondú), infectando solo tomate en cuatro campos (Figura 4).
Las especies de nematodos agalladores son morfológicamente muy similares unas de otras y la identificación a nivel de especies es difícil. Además, en diversas ocasiones más de una especie se encuentra en la misma raíz de las plantas (Devran y Sogut, 2009). Por lo tanto, la identificación rápida y precisa de estos microorganismos es necesaria para el óptimo manejo y mejoramiento de los cultivos (Powers et al., 2005). Esto, solo es posible; a través, de estudios regulares y exahustivos de la detección de las poblaciones de especies de Meloidogyne en las áreas agrícolas de cada región.
Con este objetivo, el presente estudio revela las principales especies de Meloidogyne que actualmente se encuentran presentes en las zonas productoras de diversos cultivos agrícolas en Baja California Sur. El 100% de los cultivos en estudio mostraron daño por el nematodo agallador. El mayor índice de agallamiento, lo presentó el tomate saladette al mostrar agallas grandes e irregulares en sus raíces. Esto, debido probablemente a que es una de las hortalizas más comúnes y constantes en los campos, además de que es una de las principales especies hospedantes de este patógeno (Oliveira et al., 2017).
Se ha establecido que, aunque existen cultivos de tomate con el gen de resistencia Mi, para inhibir el daño de la especie Meloiodgyne incognita, éste sigue presentando daños de agallamiento considerable que impacta en el rendimiento y costos de producción de las diferentes hortalizas (Jacquet et al., 2005). Diversos estudios han determinado que este tipo de respuesta, es debido al proceso de la presión de selección que da surgimiento a la aparición de biotipos virulentos de Meloidogyne incognita, con la capacidad de reproducirse en los cultivos comerciales establecidos en campo (Castagnone-Sereno, 2002).
Asimismo, se ha confirmado la presencia en el suelo de diversas especies de Meloidogyne (Quénéhervé et al., 2011), donde algunas están excentas del efecto de resistencia por el gen Mi y poseen la facultad de romper dicha resistencia y facilitar el incremento de la incidencia de daño en las plantas (Ornat et al., 2001; Perez-Almeida et al., 2015).
Tal es el caso de este estudio, donde las principales especies encontradas fueron M. incognita, la cual es una de las especies más comunes con amplio rango de hospedantes, infectando diversos tipos de cultivos y de amplia distribución geográfica, al establecerse en diferentes ambientes (Taylor et al., 1982). Y M. enterelobii, especie considerada una de las más destructivas y severas, debido a su capacidad de romper la resistencia que confiere el gen Mi en las plantas y a su rápido desarrollo y reproducción (Rodríguez et al., 2007).
Actualmente, ésta ultima se ha establecido como un patógeno emergente, el cual se ha distribuido rápidamente en todo el mundo causando pérdidas en la producción de hortalizas como el tomate, de hasta 70% (Freitas et al., 2017). En el presente estudio se determinó que M. enterelobii, esta distribuida en todo el estado, siendo esta especie la de mayor incidencia en los cultivos agrícolas de la región a diferencia de M. incognita.
Esta incidencia, podría estar relacionada con las características del tipo de suelo de la región y las condiciones climáticas de cada zona muestreada. Particularmente, Baja California Sur, se caracteriza por ser un estado árido y por poseer suelos arenosos, pobres en materia orgánica. Este tipo de suelo dentro de las áreas de producción, genera que se pierda rápidamente el agua en el suelo, por lo que el riego establecido en los sistemas agrícolas es constante, lo que provoca mayor humedad, facilitando estos dos factores el movimiento rápido de los nematodos hacia sus plantas hospederas, para penetrar y reproducirse rápidamente dentro de las raíces, lo que conduce al incremento de sus poblaciones en campo (Prot y Van Gundy, 1981).
La alta prevalencia e incidencia de estos nematodos sugiere su importancia como un riesgo potencial en la produccion de cultivos de interés económico, principalemnte hortalizas tales como tomate o chile, los cuales comúnmente se establecen como monocultivos y donde los productores señalan que éstos se han establecido de forma contínua por mas de 27 años en los campos evaluados.
Conclusiones
Las características en los diferentes aislados de Meloidogyne coincidieron con las descritas para M. incognita y M. enterelobii. Donde la distribución de esta última, fue mayor al presentarse en los cuatro municipios del estado muestreados. La alta tasa de reproducción de M. enterelobii y su capacidad de romper el gen de resistencia Mi puede afectar significativamente la producción agrícola del estado. Este es el primer reporte de las especies de Meloidogyne presentes en el estado de Baja California Sur. Este tipo de informacion puede formar una base para formular y diseñar estrategias de métodos de control contra este patógeno, con un uso racional de productos químicos y rotación de cultivos.











 texto en
texto en