Introducción
El tizón común bacteriano Xanthomonas axonopodis pv. phaseoli es una bacteria que ataca al cultivo de frijol (Phaseolus vulgaris) en todo el mundo (Gent et al., 2005). Está presente en 83% de las áreas de producción de semillas y hasta 79% en campos comerciales, reduce los rendimientos en un 55%, los que se incrementan a temperaturas de 27 °C, con alta humedad relativa (Fourie, 2002; Belete y Basta, 2017). Para su manejo pueden ser utilizados métodos de control químico, biológicos, cultural y genético (Francisco et al., 2013). El uso de químicos ha permitido obtener mayor producción, pero su empleo excesivo ocasiona problemas al medio ambiente, por lo que las búsquedas de alternativas al manejo de las enfermedades son de vital importancia (Zavaleta, 2000). Se ha reportado la compatibilidad en Pseudomonas sp., Bacillus cereus y Rhodococcus fascians con Rhizobium leguminosarum bv. phaseoli, cuya simbiosis ayuda desarrollando una actividad protectora contra el tizón común del frijol (Zanatta et al., 2007).
Las rizobacterias promotoras de crecimiento vegetal (RPCV), son usadas como agentes de control biológico, estas bacterias se caracterizan por su habilidad para facilitar directa o indirectamente el desarrollo de la raíz y del follaje, la estimulación indirecta del crecimiento de plantas se debe a que la bacteria permite la acción fúngica (Essalmani y Lahlou, 2003). La estimulación directa puede incluir la fijación de nitrógeno (Sessitsch et al., 2002), la producción de hormonas (Perrine et al., 2004), de enzimas (Mayak et al., 2004) y la solubilización de fosfatos (Rodríguez y Fraga, 1999). Este trabajo tuvo como objetivo determinar el comportamiento de plantas de frijol, inoculadas con Rhizobium phaseoli y X. axonopodis pv. phaseoli y su relación con la presencia y desarrollo del tizón común en la planta.
Materiales y métodos
Aislamiento de Xanthomonas spp.
Se colectaron plantas con manchas foliares necróticas irregulares rodeadas por halo amarillo, en diferentes áreas de las hojas (Fourie, 2002) en el campo experimental. El bajío de la Universidad Autónoma Agraria Antonio Narro (UAAAN). Las muestras se cortaron en trozos, se desinfectaron con hipoclorito al 1% por 3 min y se lavaron con agua destilada estéril, posteriormente se colocaron en un mortero estéril donde se maceraron en solución salina 0.85%, posteriormente se tomó una asada, que se estrió en el medio de cultivo YDC (Schaad, 1988). Las placas se incubaron a 28 °C por 48 h. Al término del periodo, se seleccionaron las colonias bacterianas con color amarillo, convexas, con bordes enteros y de aspecto mucoide (Schaad, 2001) y se purificaron por estría. La identificación se realizó por caracterización morfológica, colonial y bioquímica (Abd-Alla y Bashandy, 2008; Francisco et al., 2013; Osdaghi, 2014).
Aislamiento de Rhizobium spp.
Se colectaron muestras de nódulos de coloración rojiza de diferentes variedades de frijol, en periodo prefloración (Cuadro 1), se lavaron y se desinfectaron con hipoclorito 1% durante 3 min, enseguida se lavaron tres veces con agua destilada estéril y se colocaron en tubo estéril donde se maceraron, posteriormente se tomó una asada y se sembró en placas con el medio extracto levadura manitol agar rojo congo (ELMA-RC) (Vincent, 1970; CIAT, 1988). Las placas se incubaron a 28 °C por 4 días. Las colonias de color rojo se resembraron en placas con el mismo medio, hasta obtener cultivos puros, cada aislado se caracterizó por pruebas fisiológicas, bioquímicas, morfológicas y coloniales.
Cuadro 1 Coordenadas de localización del área del estudio.
| Localización | Coordenadas | Altitud (m) | Muestras | Cepas |
| UAAAN Buenavista, Saltillo, Coahuila. | 25° 22'' norte y 101° 02'' oeste | 1742 | Frijol, etapa de prefloración | FM-1 |
| San Andrés Tlalamac, Edo. México. | 18° 58'' 1'' norte y 98° 48'' 28'' oeste | 2 073 | Frijol, etapa de prefloración | N-2 y M-4 |
| UAAAN Buenavista, Saltillo, Coahuila. | 25° 22 norte y 101° 02'' oeste | 1742 | Frijol, etapa de prefloración | PS-3 y BJ-5 |
Reproducción bacteriana
Para incrementar las poblaciones de Xanthomonas se usó el medio YDC líquido, mientras que para Rhizobium fue ELMA líquido, propagándose en una incubadora giratoria (C25 Incubator Shaker New Brunswick Scientific) a 28 °C y 150 rpm durante 72 h, para obtener de cada bacteria un concentrado celular.
Experimento en invernadero
Para determinar la relación que guarda la presencia del tizón común y su severidad en plantas de frijol inoculadas con R. phaseoli, inicialmente se desinfectaron las semillas de frijol, para ello se usó hipoclorito de sodio al 1% durante un minuto, lavando las semillas tres veces con agua estéril. Cada semilla se impregnó por aspersión con una solución de 1 x 106 células de R. phaseoli, posteriormente se colocaron en recipientes de unicel de 1 litro de capacidad con – partes de peat moss-perlita (en proporción 3:1), una segunda aplicación se realizó 10 días después de la siembra. Cada planta representó una unidad experimental, siendo diez plantas por tratamiento (Cuadro 2).
Cuadro 2 Diseño experimental para evaluar el comportamiento de Phaseolus vulgaris a la inoculación de R. phaseoli y del tizón común.
| Tratamientos | Cepas | |||||
| FM-1 | N-2 | PS-3 | M-4 | BJ-5 | Xant-1 | |
| I. Rhizobium (FM-1) | + | - | - | - | - | + |
| II. Rhizobium (N-2) | - | + | - | - | - | + |
| III. Rhizobium (PS-3) | - | - | + | - | - | + |
| IV. Rhizobium (M-4) | - | - | - | + | - | + |
| V. Rhizobium (BJ-5) | - | - | - | - | + | + |
| VI. Irrigado solo con agua no inoculado, control absoluto(CA) | - | - | - | - | - | + |
+= aplicado; -= no aplicado
El patógeno (Xanthomonas axonopodis) se inóculo a quince días de crecimiento del cultivo, con una suspensión de 1.6 x 106 células, aplicadas por aspersión al follaje (Pastor, 1991; Abeysinghe, 2009). La evaluación se efectuó treinta días después para determinar incidencia y severidad del tizón común. acorde a la escala del grado de amarillamiento y necrosis de las plantas inoculadas: 0= ausencia de síntomas; 1= de 1 a 12.5% de área dañada; 2= de 13 a 25.5%; 3= de 26 a 38.5%; 4= de 39 a 51.5%; 5= de 52 a 64.5%; 6= de 65 a 77.5%; 7= de 78 a 90.5%; 8= de 91 a 100% de área foliar dañada (Gilberston et al.,1988; Osdaghi et al., 2009).
Experimento en campo
Para determinar el comportamiento de plantas de frijol inoculados con R. phaseoli y la presencia de tizón común en campo se estableció una parcela experimental de 10 m de largo con cinco surcos a 80 cm de distancia entre ellos. Cada aislamiento de Rhizobium se aplicó como tratamiento (Cuadro 2), para inocular la semilla y la planta se siguió el mismo procedimiento para el experimento de invernadero.
Posteriormente las semillas inoculadas se sembraron a 3 cm de profundidad intercaladas cada 10 cm en el surco en toda la parcela establecida con sistema de riego por goteo. Quince días después de la siembra se aplicó Xanthomonas axonopodis a una concentración de 1.6 x 106 ufc mL-1 al follaje del cultivo (Pastor, 1991) y 50 días posteriores se determinó la incidencia y la severidad del tizón común con la escala (Gilberston et al., 1988; Osdaghi et al., 2009).
Análisis estadístico
El comportamiento de las variables analizadas en cada experimento, así como la incidencia y la severidad del tizón común del frijol en cada planta, fue procesado bajo un diseño completamente al azar, donde cada planta se consideró como una unidad experimental, tomando datos de 10 plantas por tratamiento. La varianza entre los datos (Anova) se analizó a través de comparación de medias según Tukey (˂0.05) procesando los datos en el paquete estadístico SAS Statistical Analysis System versión 9.0.
Resultados y discusión
Se lograron recuperar cinco aislamientos de Rhizobium spp., a partir de nódulos radiculares de plantas de frijol, en el Cuadro 3 se muestran los resultados a diferentes pruebas bioquímicas y las características de forma, borde, elevación, aspecto y color, las cuales nos indican que los aislamientos tienen las características de un buen inoculante del tipo de Rhizobium phaseoli, lo que concuerda con estudios realizados por (Cuadrado et al., 2009; Berrada et al., 2012; Granda et al., 2013).
Cuadro 3 Comportamientos bioquímicos, morfológicos y coloniales de R. phaseoli.
| Cepas | Bioquímico y morfológico | Colonial | ||||||||||
| Tinción gram | Oxidasa | Catalasa | Crecimiento en NaCl 2, 3 y 5 % | Crecimiento en pH 4, 5, 7 y 9 | Crecimiento MacConckey | Crecimiento LMA- ABT | Forma | Borde | Elevación | Aspecto | Color | |
| FM-1 | - | - | - | + | + | + | + | Circular | Ondulado | Convexa | Mucoide | Rojo |
| N-2 | - | - | + | + | + | + | + | Circular | Ondulado | Convexa | Mucoide | Rojo |
| PS-3 | - | - | + | + | + | + | + | Circular | Ondulado | Planoconvexa | Mucoide | Rojo |
| M-4 | - | - | + | + | + | + | + | Circular | Ondulado | Planoconvexa | Mucoide | Rojo |
| BJ-5 | - | - | + | + | + | + | + | Circular | Ondulado | Convexa | Mucoide | Rojo |
La coloración de las colonias de los aislamientos obtenidos con una coloración beige a las 72 h, que torna en rojo intenso a los 8 días de incubación (Rojas et al., 2009) para descartar la semejanza se realizaron pruebas bioquímicas con el género Agrobacterium, se utilizó el medio levadura manitol adicionado azul de bromotimol (LMA-ABT), donde los aislamientos de Rhizobium acidificaron el medio tornándolo amarillo mientras que los reportes indican que Agrobacterium alcaliniza el medio tornándolo azul (Cuadrado et al., 2009).
A partir de hojas con síntomas de tizón común se aislaron cepas que presentaron características típicas del género Xanthomonas, tales como colonias amarillas con borde entero, convexo y un aspecto mucoide, lo que concuerda con lo descrito por (Corzo et al., 2015). Las cepas aisladas dieron negativo a la tinción de gram, producción de levana y pigmentos fluorescentes, mientras que a las pruebas de peroxidasa, catalasa, metabolismo oxidativo y fermentativo de la glucosa e hidrólisis de almidón fueron positivas, lo que nos indica que la cepa recuperada corresponde a Xanthomonas axonopodis y concuerda con las características reportadas por (Schaad, 2001; Francisco et al., 2013).
Experimento en invernadero
La inoculación de Rhizobium phaseoli en plantas de frijol indujo una mayor tolerancia a la expresión en hojas del tizón común. En la Figura 1, se muestra que la cepa Rhizobium phaseoli-BJ-5 mostró menor severidad (14.5%) a esta enfermedad en comparación al control absoluto inoculado con Xanthomonas axonopodis que registró 46% de daño.
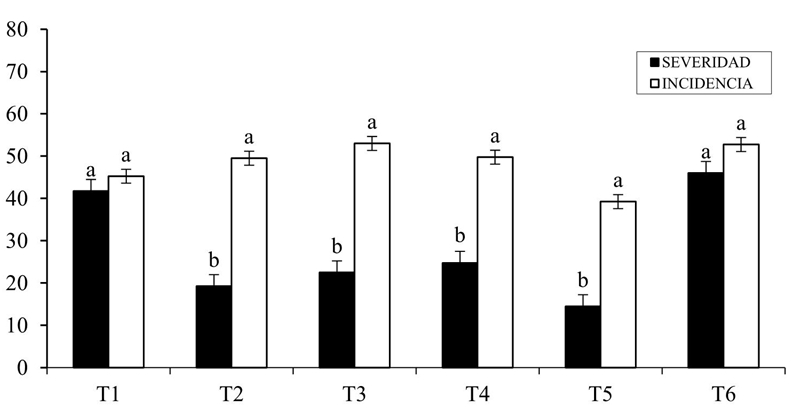
Figura 1 Efecto de la inoculación de Rhizobium phaseoli en Phaseolus vulgaris y la presencia y desarrollo del tizón común en invernadero. T1= Rhizobium (FM); T2= Rhizobium (N); T3= Rhizobium (PS); T4=Rhizobium (M); T5=Rhizobium (BJ) y T6= control absoluto (CA).
También se observó que todos los tratamientos se comportaron estadísticamente igual (p< 0.05) respecto a la incidencia del tizón común respecto del testigo, lo cual indicó que el patógeno está activo en todas las plantas infestadas y no existe diferencia entre ellas respecto de su presencia, no así en el grado de respuesta o daño en la manifestación de la enfermedad donde dos de los inoculantes de Rhizobium phaseoli T2 y T5, indujeron o redujeron el nivel de daño (Figura 1) del tizón común respecto del testigo estadísticamente (p< 0.05), resultados experimentales similares fueron reportados por Zanatta et al. (2007) quien reporta la inducción de resistencia que genera Rhizobium spp., en las plantas de frijol.
Mientras que Osdagui et al. (2011) reportan resultados similares a los del presente estudio, donde muestran diferencias significativas en la manifestación del tizón común en plantas inoculadas con Rhizobium leguminosarum pv phaseoli comparados con plantas fertilizadas con urea y el testigo.
En el Cuadro 4 se muestra la respuesta de Phaseolus vulgaris infestado con Xanthomonas axonopodis y con cinco inoculantes de R. phaseoli; a través, de biomasa vegetal producida, donde se observa que en la mayoría de las variables cuantificadas las plantas inoculadas manifestaron mayor peso, número de hojas y longitud de raíz que el testigo sin inocular, aunado a esto presentó mayor nodulación por rizobios al emplearlos como inoculantes favoreció un mayor número y la presencia de nódulos en las plantas dentro del experimento.
Cuadro 4 Comportamiento de variables agronómicas en plantas de frijol inoculadas con Rhizobium phaseoli y Xanthomonas axonopodis en invernadero.
| Tratamientos | Peso fresco (g) | Peso seco (g) | Núm. de hoja | Longitud raíz (cm) | Diámetro de tallo (mm) | Núm. de nódulos |
| Rhizobium FM-1 | 35.05 a | 5.6 a | 31.8 ab | 20.6 abc | 4.06 b | 199 a |
| Rhizobium N-2 | 25.75 ab | 4.2 a | 26.8 c | 21.6 a | 4.32 b | 120.2 b |
| Rhizobium PS-3 | 25.34 ab | 4.4 a | 27.6 bc | 21.2 ab | 5.22 a | 116 b |
| Rhizobium M-4 | 25.25 ab | 3.6 a | 28 abc | 19.2 bc | 4.08 b | 73 bc |
| Rhizobium BJ-5 | 33.09 a | 5.6 a | 32.6 a | 21 abc | 4.44 b | 228 a |
| Control absoluto | 16.82 b | 3.6 a | 29 abc | 18.8 c | 4.08 b | 48 c |
| SE ± | 1.38 | 0.25 | 0.57 | 0.27 | 0.09 | 12.61 |
| CV | 18.78 | 27.51 | 8.41 | 5.73 | 7.73 | 19.36 |
Valores con letras distintas tienen diferencias estadísticas según Tukey ˂ 0.05.
Las cepas de Rhizobium spp., utilizadas en este estudio indujeron el mejoramiento al cultivo posiblemente debido a la habilidad de los rizobios para producir hormonas como el ácido indol acético y ácido giberélico sustancias reguladoras del crecimiento en las plantas, observándose un incremento en la emergencia, vigor, biomasa y desarrollo del sistema radical (Dey et al., 2004; Perrine et al., 2004; Lugtenberg y Kamilova, 2009). Otro estudio mostró que Phaseolus vulgaris inoculado con Rhizobium etli tuvo 100% de germinación o emergencia en 4 y 8 días, respectivamente, valores con diferencia estadística en comparación con 62.5% en 7.5 días con Phaseolus vulgaris sin inocular y como control absoluto (García et al., 2016).
Experimento en campo
Como se muestra en la Figura 2, la presencia de X. axonopodis en las hojas de la planta de frijol disminuyó claramente por la inoculación de Rhizobium phaseoli cepa BJ-5 (18.4%) seguida por la cepa FM-1 (19.8%) con respecto al control absoluto (CA).
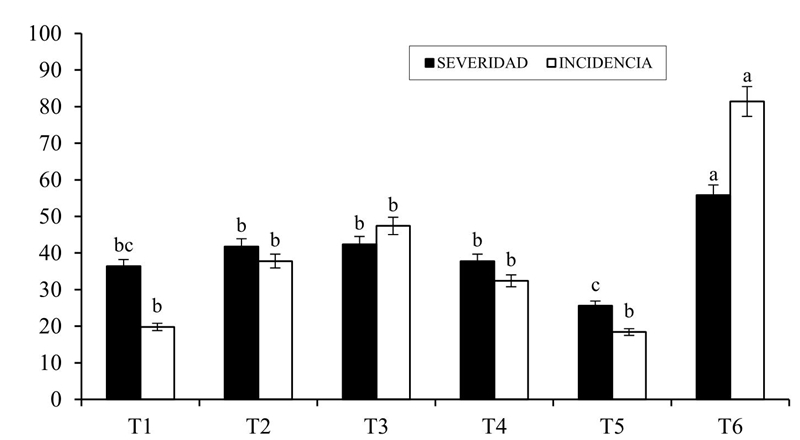
Figura 2 Efecto de la inoculación de Rhizobium phaseoli en Phaseolus vulgaris y la presencia y desarrollo del tizón común en campo. T1= Rhizobium (FM); T2= Rhizobium (N); T3= Rhizobium (PS); T4= Rhizobium (M); T5= Rhizobium (BJ) y T6= control absoluto (CA).
La severidad de la enfermedad en las hojas foliares de la planta de frijol en el cultivo fue catalogada como leve, dado a que la cepa BJ-5 (25.6%) los valores numéricos en esta fase, fueron estadísticamente diferentes comparados con el no inoculado o CA con 55.8%, el efecto que muestra la inoculación de R. phaseoli en el cultivo de frijol en presencia y severidad de la enfermedad en las hojas, recalcando la disminución en la cepa BJ-5.
Resultados similares han sido reportados por Osdagui et al. (2011). Quienes consignan que la severidad de la enfermedad en el campo evaluado a los 50 días era muy severa (necrosis completa de las hojas) en el cultivar susceptible y línea que fueron fertilizados con urea y en el grupo de control, con pérdida muy severa en el rendimiento, pero en las plantas inoculadas con R. leguminosarum pv phaseoli, la severidad de la enfermedad fue relativamente baja (p< 0.01). De acuerdo a Bartsev et al. (2004)Rhizobium spp., puede inducir resistencia en frijol común y limitar la presencia del tizón común bacteriano. Otros estudios mencionan que el tratamiento de Rhizobium spp., reduce la pudrición del tallo y la raíz en comparación con plantas no inoculadas (Bécquer, 2011; Rahman et al., 2017).
En el Cuadro 5 se presenta la respuesta de P. vulgaris en el rendimiento de biomasa a nivel plántula Rhizobium en campo donde al igual que invernadero se observó mayor rendimiento de peso fresco, seco, número de hojas, diámetro de tallo y longitud de raíz en plantas inoculadas, que las no inoculadas, resaltando la cepa Rhizobium phaseoli BJ-5 donde estas variables tuvieron mayores valores en rendimiento.
Cuadro 5 Comportamiento de variables agronómicas en plantas de Phaseolus vulgaris inoculadas con Rhizobium phaseoli y Xanthomonas axonopodis en campo.
| Tratamientos | Peso fresco (g) | Núm. de hojas | Longitud de raíz (cm) | Diámetro de tallo (mm) | Núm. de nódulos |
| Rhizobium FM-1 | 404 a | 68.2 a | 17.4 ab | 8.72 a | 54.2 ab |
| Rhizobium N-2 | 290 ab | 61.4 ab | 18.68 ab | 9.8 a | 34 b |
| Rhizobium PS-3 | 390 a | 63 ab | 17.62 ab | 8.76 a | 34.2 b |
| Rhizobium M-4 | 312 ab | 51 ab | 15.34 b | 7.9 a | 39.2 ab |
| Rhizobium BJ5 | 535 a | 69.8 a | 19.98 ab | 9.78 a | 79.8 a |
| Control absoluto | 136 b | 43.8 b | 20.2a | 8.34 a | 12 b |
| SE ± | 31.21 | 2.39 | 0.5 | 0.22 | 5.3 |
| CV | 37.51 | 16.87 | 13.26 | 12.77 | 51.78 |
Valores con letras distintas tienen diferencias estadísticas según Tukey ˂ 0.05.
El efecto promotor de crecimiento vegetal de Rhizobium phaseoli en P. vulgaris coincide con lo reportado por Yadegari (2008); Moreno et al. (2007). Otros estudios señalan que Rhizobium spp., incrementa la nodulación en las raíces y proporciona mayor fijación de nitrógeno, productividad y fertilidad en los cultivos, incluso bajo condiciones adversas del suelo, otorgando una alternativa para poder usarlo como reemplazo de fertilizantes nitrogenados (Solaiman et al., 2005; Bhattacharjee y Sharma, 2012).
Estos resultados también coinciden con los de Colás et al. (2014) quienes mencionan que todas las plantas coinoculadas con Rhizobium spp., producen mayores rendimientos y números de nódulos que en las no inoculadas, lo que demuestra el potencial del uso de inóculos mixtos para mejorar la productividad del frijol común.
Conclusiones
El empleo de inoculantes simbióticos del tipo Rhizobium phaseoli tiene el potencial para reducir y prevenir los daños causados por Xanthomonas axonopodis y la aparición de síntomas asociados a la enfermedad en el cultivo como lo son la clorosis y el tizón común bacteriano del frijol, lo cual puede considerarse una ventaja para evitar el uso de bactericidas y los fertilizantes nitrogenados químicos. El empleo de agentes microbianos pudiera ser una alternativa en el cultivo de frijol por su actividad como promotor de crecimiento vegetal y resolver problemas de orden nutricional y fitosanitario.











 text in
text in 


