Introducción
El zacate bermuda (Cynodon dactylon) se siembra en México como forraje para el ganado. Esta especie fue introducida en el continente americano desde África y debido a su colonización exitosa de hábitats, se considera una especie invasora (Van Devender et al., 2006). C. dactylon es capaz de crecer en suelos sódicos y de baja fertilidad, debido a que forma interacciones con algunos microorganismos en su rizósfera, los cuales favorecen su adaptación y promueven su crecimiento (Wang y Skipper, 2004; Singh et al., 2013).
Las especies bacteriana presentes en la rizósfera de las plantas, que crecen en, sobre o alrededor de la raíz y que estimulan el crecimiento vegetal, se conocen colectivamente como rizobacterias promotoras del crecimiento de las plantas (PGPR). Las PGPR promueven el crecimiento de manera directa; a través, de procesos tales como: fijación atmosférica de nitrógeno, solubilización de fósforo, movilización de otros minerales esenciales (por ejemplo, Zn y Fe) o regulación de los niveles de hormonas vegetales. Además, pueden ejercer un efecto indirecto por su actividad como agentes de control biológico contra patógenos, depredadores y malezas (Glick, 2012).
Uno de los principales retos del siglo XXI es la producción agrícola sustentable. El uso de bioinoculantes es una opción biotecnológica amigable con el ambiente capaz de reducir el uso de agroquímicos. En este contexto, el objetivo de este trabajo fue evaluar la actividad de promoción del crecimiento vegetal y control biológico in vitro de dos especies bacterianas provenientes de la rizósfera de zacate bermuda ruderal, mediante el análisis de la capacidad de fijación de nitrógeno, solubilización de fosfatos, producción de ácido indol-3-acético, ácido giberélico, sideróforos, actividad enzimática de fosfatasa alcalina, de ACC deaminasa y confrontación con hongos fitopatógenos.
Material y métodos
Aislamiento y selección de bacterias fijadoras de nitrógeno
En octubre de 2014, se seleccionaron y extrajeron 10 plantas sanas y vigorosas de zacate bermuda creciendo de manera ruderal en el Departamento de Agricultura y Ganadería de la Universidad de Sonora ubicado a 29° 00’ 51.72” latitud norte y 111° 08’ 01.10” longitud oeste, con una altitud de 149 MSNM, en este sitio el clima se clasifica como BW (h’) hw (e’), el cual corresponde a la categoría de muy árido, extremoso y cálido. La textura del suelo en el sitio de colecta es franco arenosa. Se eliminó la parte aérea de cada planta y se colectó aproximadamente 1 kg de suelo conteniendo las raíces.
Se eliminó la tierra y las raíces se lavaron con agua corriente. Las raíces se cortaron en segmentos de aproximadamente 1 cm y se enjuagaron 3 veces durante 10 min con agua destilada estéril. Se colocaron tres trozos de raíz en tubos de vidrio con tapa de rosca, que contenían 15 mL de medio semisólido NFb (Döbereiner y Day, 1976) libre de nitrógeno. Los tubos se cerraron, se sellaron con parafilm y se incubaron a 28 °C durante 5 días. Se recogió 1 mL de la masa microbiana desarrollada en la superficie del medio y se sembraron diluciones seriadas en placas de Petri que contenían medio NFb sólido (agar, 15 g L-1).
Después de una semana de incubación, el cambio de color azul a verde alrededor de la colonia fue indicativo de que el aislado tenía actividad fijadora de nitrógeno (Baldani et al., 2014). Se obtuvieron 12 aislados con diferentes morfologías y se eligieron dos de ellos, el 0710 y 0711, para continuar con la caracterización fenotípica y bioquímica y la identificación molecular. Los criterios de selección fueron: mayor intensidad y rapidez en el cambio de color. Los aislados seleccionados se sembraron en medio Luria-Bertani (LB) para su conservación y análisis posterior.
Caracterización fenotípica y bioquímica
Los aislados 0710 y 0711 se cultivaron en agar cuenta total para su análisis morfológico y se caracterizaron mediante las pruebas bioquímicas y perfiles de asimilación de carbono del kit comercial API 20 E System (BioMérieux Laboratory, Francia).
Identificación molecular mediante secuenciación de un fragmento del gen 16S rRNA
La extracción de ADN total de los aislados seleccionados se realizó con la técnica del fenol-cloroformo (Ausubel et al., 1994). El ADN se amplificó por medio de la reacción en cadena de la polimerasa (PCR) utilizando los iniciadores universales F2C (5’-AGA GTT TGA TCA TGG CTC-3’) y C (5-ACG GGC GGT GTG TAC-3’), los cuales amplifican un fragmento de alrededor de 1 600 pb. La mezcla de reacción contenía: 20 ng de ADN total, 12.5 μL de la enzima GoTaq® Green Master Mix (Promega), 0.5 μM de concentración final de cada iniciador y agua libre nucleasas hasta completar un volumen final de 25 μL. Las condiciones de PCR fueron: 1) desnaturalización inicial a 95 °C durante 2 min; 2) amplificación, consistente de 30 ciclos con las siguientes etapas: a) desnaturalización a 95 °C por 1 min; b) alineamiento a 55 °C por 1 min; y c) extensión a 72 °C por 2 min y por último; y 3) extensión final a 72 °C durante 5 min. Se utilizó el termociclador C1000 de BioRad.
Se realizó una segunda amplificación usando los iniciadores U1: 5’-CCA GCA GCC GCG GTA ATA CG-3’ y C, con la finalidad de obtener un fragmento más pequeño (~900 pb), adecuado para su secuenciación. Como ADN molde se usó 1 μL de los productos de PCR de la primera reacción de amplificación. El programa de amplificación fue igual que el anterior. Los productos finales se purificaron con un kit Wizard® SV Gel y PCR Clean-Up System (Promega Co.) y se secuenciaron en ambas direcciones usando de nuevo los iniciadores U1 y C por separado, con un equipo ABI PRISM® 3730 Genetic Analyzer (Applied Biosystems). Las secuencias se compararon con las de la base de datos NCBI GenBank utilizando el algoritmo BLAST y se alinearon usando el programa ClustalOmega.
Ensayo in vitro de fijación biológica de nitrógeno (FBN)
Los aislados 0710 y 0711 se cultivaron en medio enriquecido líquido (1.5 g de peptona de carne, 3 g de extracto de levadura, 6 g de peptona de gelatina y 1 g de glucosa en 1 000 mL de agua destilada-deionizada). Se tomó una muestra del cultivo y se ajustó a una concentración entre 105 y 106 UFC mL-1. Se tomaron 100 μL de la muestra ajustada de cada aislado y se inocularon por triplicado en matraces de 125 mL con 50 mL de medio tiamina-biotina libre de N. Los matraces se incubaron a 30 °C en agitación durante 7 días.
La capacidad de FBN se estimó de acuerdo a Kanimozhi y Panneerselvam (2010), mediante la determinación del amoníaco producido durante el procedimiento de digestión. Se colocaron 2 mL del cultivo en un matraz Microkjeldahl, se agregaron 2 mL de H2SO4 (d= 1.84), 1 mL de H2O2 (30%) y 1 g de mezcla digestora (100 g de Na2SO4 + 10 g de CuSO45H2O + 1 g de selenio) a 350-375 °C y se digirieron mediante ebullición por 1.5 h. Los productos de digestión se separaron por destilación con 10 mL de NaOH 10 M y el amoníaco producido se determinó por valoración con HCl 0.0025 M.
Ensayo cualitativo de solubilización de fosfatos
La prueba de solubilización de fosfatos se realizó de acuerdo a Malboobi et al. (2009). Se sumergió una punta de aguja en medio enriquecido con los aislados 0710 y 0711 se inoculó por picadura en el centro de cajas Petri con el medio sólido de Pikovskaya (15 g de agar, 10 g de glucosa, 5 g de Ca3 (PO4)2, 0.5 g de extracto de levadura, 0.5 g de (NH4)2SO4, 0.2 g de KCl, 0.1 g de MgSO47H2O, 0.1 mg MnSO42H2O, 0.1 mg de FeSO4 en 1000 mL de agua destilada). Se sembraron cinco cajas por aislado y se incubaron a 30 °C durante 7 días. El desarrollo de una zona clara alrededor de la colonia fue el indicio de solubilización de fosfato inorgánico.
Solubilización de fosfato inorgánico (IPS)
Se tomaron alícuotas de 1 mL de los cultivos 0710 y 0711 en medio enriquecido líquido y se colocaron en 3 matraces Erlenmeyer de 500 mL por cada bacteria que contenían 200 mL de medio líquido de Pikovskaya estéril. Los matraces se mantuvieron en agitación (300 rpm) a 30 °C durante 2 días. Se usó medio estéril sin inocular como control negativo. Después de la incubación, se tomaron 10 mL de cada matraz para su centrifugación. La determinación se llevó a cabo conforme a lo descrito por Pote y Daniel (2000).
Se tomaron 5 mL de cada sobrenadante y se mezclaron con 800 μL de reactivo mixto (50 mL de H2SO4 2.5 M, 15 mL de molibdato de amonio al 4%, 30 mL de ácido ascórbico 0.1 M y 5 mL de solución de tartrato de potasio 0.004 M) para cuantificar la liberación de fósforo al medio. Se elaboró una curva estándar con concentraciones conocidas (0.15, 0.3, 0.6, 0.9, 1.2 y 1.5 μg mL-1), preparada a partir de una solución madre que contenía 50 μg mL-1 de P. Se leyó la absorbancia de soluciones estándar y muestras a 880 nm en un espectrofotómetro manual Spectronic 21D (Milton Roy), utilizando un blanco de reactivos como solución de referencia. Las muestras se diluyeron proporcionalmente para su lectura en el rango gráfico.
Ensayo de la actividad enzimática de fosfatasa ácida (ACF) y alcalina (ALF)
La actividad enzimática de fosfatasa ácida y la de fosfatasa alcalina se determinó por triplicado usando la prueba modificada de Juma y Tabatabai (1988). Se realizó una mezcla de 1 mL del sobrenadante obtenido en la prueba de solubilización de fosfato inorgánico de los aislados 0710 y 0711, con 1 mL de p-nitrofenil fosfato 25 mM (pNPP) y 4 mL de búfer universal modificado [12.1 g de tris (hidroximetil) aminometano, 11.6 g de ácido maleico, 14 g ácido cítrico y 6.3 g de H3BO3 en 488 mL de NaOH 1 M aforando a 1 L con agua destilada-deionizada. Este búfer se ajustó al pH deseado y almacenó a 4 °C. Antes de su uso se diluyó cinco veces con agua destilada-deionizada]. Los valores de pH del búfer fueron 6.5 y 11, para el ensayo de fosfatasa ácida o alcalina, respectivamente.
Cada mezcla de reacción se incubó a 37 °C y después de 1 h de incubación, se le adicionó 1 mL de CaCl2 0.5 M y 4 mL de NaOH 0.5 M para terminar la reacción. Las mezclas del ensayo se filtraron y se registró su absorbancia a 410 nm en un espectrofotómetro manual Spectronic 21D (Milton Roy) para cuantificar la intensidad del color amarillo debido a la formación de p-nitrofenol (pNP). La cuantificación se realizó usando un estándar de pNP de concentración conocida y los resultados se expresaron en unidades de actividad (U), definiéndose 1 U como la cantidad de enzima requerida para liberar 1 μg de pNP en 1 mL de filtrado de cultivo a las condiciones del ensayo (Prasanna et al., 2011).
Ensayo de ACC-deaminasa
La actividad de la enzima de ACC-deaminasa se determinó por triplicado de acuerdo con el método desarrollado por Penrose y Glick (2003). Este ensayo determina la cantidad de (-cetobutirato producido cuando la enzima rompe la molécula de ácido 1-aminociclopropano-1-carboxílico (ACC). El número de µmoles de α-cetobutirato producido en la reacción es determinado por comparación de la absorbancia de una muestra a 540 nm en un espectrofotómetro manual Spectronic 21D (Milton Roy), contra una curva estándar de α-cetobutirato preparada en un rango de 0.1 y1 µmol.
Producción de ácido Indolacético (AIA)
Se realizó de acuerdo con el método de Loper y Scroth (1986) y se realizó tanto en ausencia como en presencia de 500 µg mL-1 de triptófano. Previamente los aislados bacterianos 0710 y 0711 se cultivaron en 3 mL de medio enriquecido por 24 h a 28 °C y 200 rpm. 20(L de ese cultivo se transfirieron a 3 tubos con 5 mL de medio enriquecido nuevo por cada aislado, sin suplementar o suplementado con 500 (g mL-1 de triptófano, se incubaron por 72 h a 28 °C y 200 rpm. Después de este tiempo, los cultivos se centrifugaron por 10 minutos a 10 000 xg, se tomó 1 mL de sobrenadante y se mezcló con 50 (L de ácido ortofosfórico y 2 mL del reactivo de Salkowsky (1 mL de 0.5 M FeCl3 en 50 mL de 35% HCIO4), incubándose a 28 °C por 30 min.
Al final de ese periodo, la aparición de un color rosa indicó la presencia de AIA. La cuantificación de AIA se realizó midiendo la absorbancia a 530 nm en un espectrofotómetro manual Spectronic 21D (Milton Roy) con la ayuda de una gráfica estándar de AIA (Sigma) obtenida en el rango de 0 a 40 μg mL-1 (Ahmad et al., 2008).
Producción de ácido giberélico (AG3)
Los aislados 0710 y 0711 se cultivaron por separado en tubos con 3 mL de medio líquido enriquecido, y se incubaron durante una noche a 28 °C y 200 rpm. 20 μL de cada cultivo se transfirieron a 3 matraces de 50 mL de medio enriquecido por aislado y se incubaron a las mismas condiciones durante 72 h. Las muestras se centrifugaron para eliminar la biomasa celular. La determinación se realizó de acuerdo a Berríos et al. (2004). 1 mL del sobrenadante se colocó en un matraz volumétrico de 10 mL y se acidificó aforando con HCl 3.75 M. Se agitó enérgicamente durante 10 s y se dejó reaccionar durante 45 min para convertir el ácido giberélico en ácido giberelénico.
Ese compuesto se extrajo una vez con 30 mL de acetato de etilo. La fase acuosa se descartó y la fase de acetato de etilo se midió mediante un espectrofotómetro Milton Roy Spectronic 21D (Milton Roy) a 254 nm. Para estimar la cantidad de ácido giberélico producido, se preparó una gráfica de calibración a partir de soluciones estándar de: 50, 75, 100, 120, 150, 200, 240, 300, 400, 500 y 600 μg mL-1, preparadas a partir de una solución madre de 100 mg AG3 en 250 mL de etanol absoluto. Las soluciones se acidificaron y se extrajeron con acetato de etilo, de forma similar a la muestra. Los valores de absorbancia contra concentración se graficaron y ajustaron mediante regresión lineal.
Producción de sideróforos
Para esta prueba, los cultivos 0710 y 0711 se diluyeron en agua peptonada y se sembraron en tres puntos equidistantes de tres cajas de Petri con agar-cromo azurol S (CAS) para cada cultivo. Las cajas se incubaron a 28 °C durante 48 h. Después de ese tiempo las bacterias productoras de sideróforos, capaces de fijar el hierro, producirán un halo naranja alrededor de las colonias en el medio azul (Schwyn y Neilands, 1988).
Producción de ácido cianhídrico (HCN)
Las bacterias 0710 y 0711 se cultivaron en el medio agar King B modificado con glicina (4.4 g L-1). Por dentro de la tapa de la caja Petri se colocó un disco de 8 cm de diámetro de papel de filtro Whatman no. 1, previamente empapado con una solución estéril de ácido pícrico al 1% en carbonato de sodio al 10% (el papel de filtro y el ácido pícrico se esterilizaron por separado). Las placas se sellaron con parafilm y se incubaron a 28 °C por 48 h Se sembraron tres cajas por bacteria. El desarrollo de un color café-rojizo en el papel de filtro indicaría que las muestras son positivas para la producción de HCN (Ahmad et al., 2008).
Ensayo de actividad antifúngica
Los aislamientos 0710 y 0711 se probaron para determinar el efecto inhibidor del crecimiento sobre el crecimiento del micelio de Ceratobasidium sp., Fusarium oxysporum, F. falciforme y F. brachygibbosum, todos ellos aislados previamente como causantes de pudrición radicular en plantas de sandía en Sonora, México (Rentería-Martínez et al., 2018). La prueba se llevó a cabo en el medio agar complejo (10 g de peptona, 40 g de D-glucosa, 10 g de extracto de levadura, 18 g de agar en 1000 mL de agua). Los hongos se cultivaron en agar papa dextrosa (PDA). Los cultivos bacterianos puros se cultivaron en medio líquido enriquecido a 28 °C por 24 h. Se extendieron 100 μL de cada cultivo bacteriano sobre la superficie del agar complejo.
Luego, se colocó un disco de PDA de 8 mm cubierto con micelio de cada hongo, en el centro de la placa de Petri. Al mismo tiempo, se realizaron experimentos de control, colocando un disco de cada hongo en medio del agar complejo sin bacterias. Se sembraron tres cajas por bacteria. El diámetro de cada colonia fúngica se midió después de un período de incubación de 7 días a 28 °C. El efecto inhibitorio se calculó como el porcentaje de la tasa de inhibición: IR%= (CB)(100)/C, donde C es el diámetro del micelio fúngico control y B el diámetro del micelio crecido en presencia de bacterias (Laslo et al., 2012).
Análisis estadístico
El análisis de los resultados se llevó a cabo utilizando la prueba t (para valores de dos variables independientes), con un nivel de significancia de 0.05%, utilizando el software IBM SPSS Statistics 24.0.0. La Figura 1 referente al efecto inhibitorio de los aislados bacterianos sobre los hongos patógenos también se realizó analizando los datos con el mismo software.
Resultados y discusión
El análisis al microscopio del aislado 0710 que creció en medio libre de nitrógeno mostró células móviles con forma de bastón típicas del género Pseudomonas. Las colonias, en cajas con agar de cuenta total fueron: lisas, redondas y de color amarillo cremoso. La tinción de Gram fue negativa y los resultados de las pruebas bioquímicas de este aislado fueron: arginina dihidrolasa (+), utilización de citrato (+), citocromo oxidasa (+) y metabolismo oxidativo de carbohidratos (-).
Las secuencias de los fragmentos del gen 16S rDNA presentaron 100% de homología con los registros: KM401858 y KF815702 del GenBank, ambas accesiones correspondientes a Pseudomonas monteilii. El aislado 0711 mostró 99% de homología con las accesiones KJ190166 y AF531766 del GenBank y se identificó como Candidatus Chryseobacterium massiliae. Sus colonias fueron amarillas, con células Gram negativas, frecuentemente en forma de bastones apareados, sin motilidad y sin formación de esporas. En las pruebas bioquímicas, esta especie resultó ureasa (+), gelatinasa (+), producción de indolacético (+) y fermentación de carbohidratos (-).
El aislado de P. monteilii se designó como Pm0710 y el de Chryseobacterium massiliae ca. como: Cm0711. Los resultados de las características de promoción vegetal potencial de dichos aislamientos se resumen en el Cuadro 1. Las dos cepas mostraron algunas propiedades de PGPR.
Cuadro 1 Características de promoción del crecimiento de plantas de aislados bacterianos.
| Características | Pm0710 | Cm0711 |
| FBN | 52 ±10.6 a | 49 ±5.3 a |
| SFI | 143.9 ±2.2 b | 262.51 ±6 a |
| ACF | - | - |
| ALF | 21.2 ±1.8 b | 32.3 ±3.3 a |
| Sideróforos | + | + |
| HCN | - | - |
| AIA (sin triptófano) | 2.4 ±0.1 b | 4.8 ±0.8 a |
| AIA (500 mg mL-1 de triptófano) | 14.5 ±1.1 b | 44.4 ±8.6 a |
| AG3 | 40.9 ±3.17 a | 45.1 ±2.4 a |
| ACC | 640.7 ±37.4 b | 974.3 ±15.2 a |
Media ±DE. Valores con diferente letra en la misma fila son significativamente diferentes (p<0.05); FBN= fijación biológica de nitrógeno in vitro (μg mL-1); SFI= solubilización de fosfato inorgánico μ(g mL-1); ACF= actividad de fosfatasa ácida (μg p-nitrofenol mL-1); ALF= actividad de fosfatasa alcalina (μg p-nitrofenol mL-1); AIA= producción de ácido indolacético (μg mL-1); AG3= producción de ácido giberélico (μg mL-1); ACC= actividad de ácido 1-aminociclopropano-1-carboxílico deaminasa (nmol α-cetobutirato mg-1 proteína h-1).
Penrose y Glick (2003) describieron que las PGPR pueden facilitar la proliferación de sus plantas hospederas a través de diversos mecanismos: 1) fijan nitrógeno atmosférico y lo suministran a las plantas; 2) sintetizan sideróforos, los cuales pueden proveer de hierro a las plantas; 3) sintetizan fitohormonas (auxinas, citoquininas y giberelinas); 4) solubilizan minerales por ejemplo fósforo y los hacen disponibles para las plantas; y 5) sintetizan enzimas capaces de modular el crecimiento y desarrollo de las plantas.
En este trabajo, Cm0711 y Pm0710 mostraron capacidad para fijar nitrógeno atmosférico durante su cultivo in vitro (alrededor de 50 (g de N mL-1). De acuerdo con Kim y Rees (1994), el complejo enzimático nitrogenasa, es el responsable de la fijación biológica del nitrógeno (FBN). Este complejo consta de dos metaloenzimas: la dinitrogenasa reductasa, que proporciona electrones con alto poder reductor y la dinitrogenasa, que utiliza esos electrones para reducir N2 a NH3.
El sistema enzimático para la fijación de N2 varía entre los diferentes géneros bacterianos. Se han identificado tres sistemas diferentes de acuerdo con su cofactor: a) Mo-nitrogenasa; b) V-nitrogenasa; y c) Fe-nitrogenasa. Las diferencias estructurales de estas enzimas son los principales factores responsables que controlan la eficiencia de la fijación de nitrógeno. Sin embargo, como el sistema Mo-nitrogenasa se encuentra en todos los microorganismos diazotróficos, puede decirse que es el complejo enzimático responsable de la mayor cantidad de nitrógeno atmosférico fijado biológicamente.
El nitrógeno fijado por microorganismos diazotróficos simbióticos de vida libre, asociados o en las proximidades de las raíces, representa el más importante aporte de nitrógeno en los ecosistemas naturales, que contribuyen hasta con 60 kg ha-1 año-1 de N al suelo. Aunque las bacterias fijadoras de nitrógeno asociadas de manera simbiótica proporcionan mayores cantidades del nitrógeno requerido por la planta huésped en algunos ecosistemas terrestres (Glick, 2012), la fijación no simbiótica de nitrógeno puede ser la forma dominante del aporte en plantas no leguminosas de zonas áridas (Cleveland et al., 1999). Este es el caso de C. dactylon en el área de estudio.
Hay dos mecanismos para la solubilización de fósforo por bacterias: mineral y enzimático. El proceso de solubilización de fosfato inorgánico (SFI) se asocia con la liberación de ácidos orgánicos de bajo peso molecular. Los grupos funcionales hidroxilo y carboxilo de estas moléculas quelatan a los elementos catiónicos unidos al fosfato, ionizando y liberando a los iones fosfato (Kim et al., 1998).
El mecanismo enzimático para la solubilización de los grupos fosfato ligados a compuestos orgánicos, implica la actividad de dos grupos de enzimas: fosfatasas alcalinas (que actúan a pH básico) y fosfatasas acidas (que actúan a pH ácido). En esta investigación, Cm0711 fue significativamente superior a Pm0710 en la capacidad para la solubilización fosfato inorgánico (SFI) y en la actividad de fosfatasa alcalina. Ninguno de ellos presentó actividad de fosfatasa ácida. Al respecto, se sabe que las raíces de las plantas pueden obtener fósforo del suelo debido a su capacidad para liberar fosfatasas ácidas y que rara vez producen cantidades apreciables de fosfatasas alcalinas.
Este hecho sugiere que la producción de fosfatasas alcalinas representa un nicho potencial para la asociación de las bacterias con la planta (Seema et al., 2013). Algunas bacterias asociadas con las raíces de las plantas pueden producir 1-amino ciclopropano-1-carboxilato (ACC) deaminasa. Esta enzima rompe la molécula liberando amoníaco y α-cetobutirato. El ACC que es exudado por semillas, raíces y hojas actúa como precursor de etileno. El etileno regula muchos procesos fisiológicos asociados con estrés, y su presencia a altas concentraciones puede provocar la inhibición del crecimiento o la muerte de la planta (Penrose y Glick, 2003; Glick, 2014).
El Cuadro 1 muestra que ambos aislados tuvieron altos niveles de actividad de ACC deaminasa, aunque Cm0711 fue significativamente superior que Pm0710. Esto sugiere que ambas cepas pueden disminuir los niveles de etileno en las plantas durante algún evento de estrés. El ácido indolacético (AIA) secretado por las bacterias al suelo puede modificar los procesos de desarrollo regulados por las auxinas propias de la planta. El AIA exógeno altera el contenido total de AIA bacteriano puede aumentar el área y la longitud de la raíz, proporcionando a la planta un mayor acceso a los nutrientes del suelo.
En cambio, las rizobacterias adquieren nutrientes que apoyan su crecimiento, ya que el crecimiento de la raíz afloja las paredes celulares de las plantas, permitiendo que exuden una mayor cantidad de nutrientes (Patten y Glick, 2002; Glick, 2012). En este trabajo, Cm0711 y Pm0710 mostraron capacidad para sintetizar AIA, aumentando sus niveles de producción en presencia de triptófano como precursor. La producción de AIA fue significativamente superior en Cm0711 que Pm0710.
Contrariamente a su efecto como promotor de crecimiento, el AIA puede inducir la síntesis de ACC sintasa, la cual cataliza la formación de ACC en la planta. En este caso, AIA estaría actuando como promotor de la síntesis de etileno. Sin embargo, en presencia de PGPR, que sintetiza AIA y ACC deaminasa, los niveles de etileno en la planta pueden ser menores que cuando las plantas interactúan con PGPR que secretan AIA, pero que no sintetizan la ACC deaminasa. El resultado neto de esta diafonía entre AIA y ACC deaminasa, es que la ACC deaminasa facilita la estimulación del crecimiento por efecto de AIA, al reducir los niveles de plantas de etileno en la planta. Esto puede resultar en una mayor adaptación a las condiciones de estrés (Glick, 2014).
Además de lo anterior, Cm0711 y Pm0710 mostraron la capacidad de sintetizar giberelinas, observándose niveles alrededor de 40 µg mL-1 de ácido giberélico (AG3). Las giberelinas microbianas son metabolitos secundarios típicos que pueden actuar como hormonas, participando en la regulación del crecimiento y desarrollo de las plantas, incluyendo el alargamiento del tallo, la germinación, la latencia, la expresión sexual y la senescencia de los frutos.
Ambos aislamientos mostraron también capacidad para producir sideróforos. Los sideróforos son moléculas pequeñas secretadas por numerosas bacterias, actinomicetos y hongos. Estos compuestos están especialmente diseñados para atrapar rastros de iones férricos (Fe3+). Los sideróforos se secretan en condiciones de limitación de hierro y forman los complejos con ese elemento para ser transportados a las células de la raíz. El fierro es un elemento poco disponible para las plantas, ya que forma complejos muy estables en el suelo. Varios compuestos (hidroxamatos, fenolatos, catecolatos y carboxilatos) pueden actuar como ligandos de Fe3+.
Uno de los mecanismos más estudiados en el control biológico de fitopatógenos, es la supresión de enfermedades mediada por sideróforos. (Miethke y Marahiel, 2007; Ángel et al., 2013). Otro compuesto bacteriano, que, debido a su toxicidad, en años atrás se suponía era un agente de control biológico es el HCN. Sin embargo, Rijavec y Lapanje (2016) demostraron que la principal contribución del HCN es en el secuestro de metales y fosfatos, con el consecuente aumento indirecto de la disponibilidad de nutrientes, lo que resulta beneficioso tanto para las rizobacterias como para sus plantas hospedantes. La propiedad de síntesis de HCN no existe en los dos aislamientos evaluados.
Capacidad antifúngica
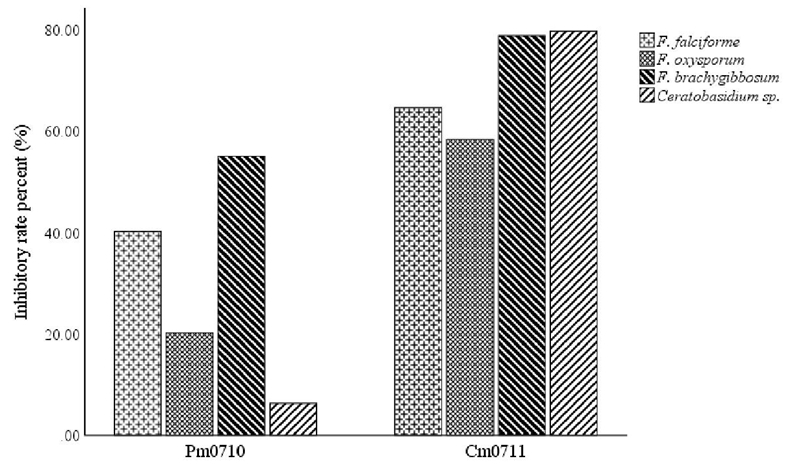
Cm0711 mostró niveles de inhibición significativamente mayores que Pm0710 en todos los patógenos probados. C. massiliae tuvo tasas de inhibición de alrededor de 60 a 80% en todos los hongos. P. monteilii tuvo efecto principalmente sobre Fusarium brachygibbosum y F. solani (55% y 40%, respectivamente) y menor sobre Ceratobasidium sp. y F. oxysporum, 6 y 20% respectivamente (Figura 1).
El control biológico de fitopatógenos es el principal mecanismo indirecto de promoción del crecimiento de las plantas por las rizobacterias. En general, la competencia por nutrientes, la exclusión de nichos, la resistencia sistémica inducida y la producción de metabolitos antifúngicos son los principales modos de actividad de control biológico de las PGPR. En los metabolitos antifúngicos se incluyen antibióticos, enzimas que degradan la pared celular, sideróforos quelantes de Fe y HCN (Sindhu y Dadarwal, 2001; Ahmad et al., 2008; Ravindra et al., 2008; Bhattacharyya y Jha, 2012; Glick, 2012).
En nuestro experimento, tanto Cm0711 como Pm0710 inhibieron el crecimiento de los cuatro fitopatógenos probados; sin embargo, el efecto inhibitorio de Cm0711 resultó significativamente mayor. Los mecanismos por los que estos aislados ejercen control sobre los hongos patógenos de plantas siguen siendo desconocidos y deben dilucidarse en trabajos posteriores. Aunque se sabe que algunas especies de Chryseobacterium pueden actuar como PGPR (Shin et al., 2007; Dardanelli et al., 2010; Montero-Calasanz et al., 2013), no hay reportes sobre las características potenciales como promotor de C. massiliae.
Con respecto a Pseudomonas monteilii, se ha observado que ciertos aislados pueden asociarse con plantas de arroz y promover su crecimiento debido a su capacidad para fijar nitrógeno. (Habibi et al., 2014), mientras que otros mejoran significativamente la longitud de la raíz primaria, el brote y el número de raíces laterales de los brotes de soya (Wahyudi y Astuti, 2011). La capacidad de solubilización de fosfatos de las cepas de P. monteilii se ha reportado anteriormente (Ravindra et al., 2008; Dharni et al., 2014). Pandya y Desai (2014), encontraron trece aislamientos capaces de sintetizar ácido giberélico, en otros trabajos P. monteilii causó la inhibición del crecimiento de Sclerotium rolfsii por la producción de antibióticos difusibles, metabolitos volátiles, cianuro de hidrógeno, sideróforos y proteasas (Rakh et al., 2011).
Otro aislado produce 2,4-di-terc-butilfenol, un compuesto orgánico volátil activo que actúa como inhibidor de la β-tubulina en Fusarium oxysporum (Dharni et al., 2014).
Conclusiones
Las dos especies de bacterias aisladas de la rizósfera de zacate bermuda identificadas como C. massiliae y P. monteilii, presentaron características de promoción del crecimiento vegetal que son evidencia de su contribución a la adaptación y desarrollo de esta planta. La capacidad de fijar nitrógeno atmosférico, la solubilización de fosfatos, la producción de fitohormonas y el control biológico de fitopatógenos son características deseables en microorganismos empleados en la formulación de bioinoculantes. Sin embargo, antes de considerar el uso de Cm0711 y Pm0710 como PGPR, se requiere la evaluación de su comportamiento in vivo. La selección y el uso de microorganismos nativos capaces de promover el crecimiento de las plantas es una acción necesaria para reducir el uso de fertilizantes químicos y para disminuir algunos de los impactos ambientales negativos de la agricultura convencional.











 texto en
texto en