Introducción
El tomate (Solanum lycopersicum L.) es un cultivo que en términos económicos representa 72% del valor de la producción de hortalizas frescas en todo el mundo (Hanssen et al., 2010). Es de las hortalizas más cultivadas y de mayor valor económico a nivel mundial ya que su demanda se incrementa de forma permanente (Ortega-Martínez et al., 2010). Sin embargo, el desarrollo de este cultivo se puede ver afectado por diferentes factores que pueden ser bióticos o abióticos. Entre los factores bióticos se encuentran virus, bacterias, hongos y nematodos que causan enfermedades devastadoras provocando grandes pérdidas económicas en el cultivo de tomate (Arshad et al., 2014).
Particularmente las enfermedades bacterianas son un problema de gran relevancia en la producción tanto en invernadero como a campo abierto (Balestra et al., 2009). La bacteria Clavibacter michiganensis subsp. michiganensis (Cmm) que causa el cáncer bacteriano afecta considerablemente el cultivo de tomate (Cooksey, 1990; Hadas et al., 2005; Yuliar et al., 2015), además que está presente en todas las zonas productoras del mundo, y es considerada como severa (Chang et al., 1991). Se han reportado epidemias de Cmm en el cultivo de tomate en diversos países como Israel, Japón, España y México, ocasionando pérdidas en la producción entre 80 a 100% (Borboa-Flores et al., 2009; EPPO, 2010; De León et al., 2011). Esto origina una necesidad de disminuir las afectaciones causadas por los patógenos que aunado al interés de aumentar la productividad y la calidad agrícola, ha llevado a un uso excesivo de productos químicos, creando problemas como la contaminación ambiental (Arredondo, 2017).
Por su parte, las plantas han generado mecanismos de defensa que les permitan tolerar los daños causados por patógenos (Harman et al., 2004; Nawrocka y Malolepsza, 2013). Uno de estos mecanismos es la defensa sistémica que incluye la generación de metabolitos secundarios, que son compuestos que no presentan una función aparente dentro del metabolismo primario, pero que poseen un papel importante en las interacciones bióticas como la defensa química contra herbívoros y patógenos (Neilson, 2013).
Los compuestos fenólicos son necesarios para la supervivencia de las plantas ante situaciones de estrés impuestas por factores tanto bióticos como abióticos (Broun, 2005; do Nascimento, 2010). Se sabe que los compuestos fenólicos tienen funciones protectoras contra los microorganismos patógenos (Osorio et al., 2010). Existen reportes sobre el uso de compuestos fenólicos como inhibidores de distintos patógenos; por ejemplo, Mendoza (2013) reporta el potencial de estos compuestos contra Botrytis cinerea. De la misma manera compuestos aislados de Veratrum álbum, se reportaron como compuestos activos contra los hongos Erysiphe necator, Plasmopara viticola y B. cinerea en el cultivo de la vid (Alonso-Villaverde et al., 2011; Adrian y Jeandet, 2012; Wu et al., 2013).
Esto demuestra que los compuestos fenólicos pueden ser una alternativa potencial al control químico para el manejo de las bacterias fitopatógenas, además de que el desarrollo de antibacterianos naturales ayudará a disminuir los efectos negativos del control químico (Riviera et al., 2014) lo que impactará positivamente al ambiente.
El objetivo del trabajo consistió en evaluar la aplicación foliar de ácidos fenólicos en el cultivo de tomate y su efecto sobre la tolerancia a Clavibacter michiganesis subsp. michiganensis, así como determinar los cambios en las características agronómicas, fisiológicas e histológicas.
Materiales y métodos
Establecimiento del cultivo
El cultivo se estableció en un invernadero tipo tunel con dimensiones de 20 x 8 m con 30% de sombreo del Departamento de Horticultura, de la Universidad Autónoma Agraria Antonio Narro. Se usó semilla de tomate de la variedad “Rio Grande” tipo saladete y de crecimiento determinado. Se trasplantó en bolsas de polietileno color negro con capacidad de 10 litros. Como sustrato se usó una mezcla de perlita:peat moss relación 1:1 (v:v). El cultivo se manejó a un solo tallo con la ayuda de tutoreo. La nutrición fue administrada a través de un sistema de riego dirigido usando la solución Steiner (Steiner, 1961), la cual fue aplicada a distintas concentraciones: 25% en etapa vegetativa, 50% en floración, 75% en amarre de frutos, y 100% en llenado y cosecha de fruto.
Aplicación de tratamientos
Los tratamientos consistieron en la aplicación de ácidos fenólicos usando como fuente el producto Defense Gr® (10 000 ppm ácidos fenólicos en forma de granulo soluble). Se aplicaron en total cuatro tratamientos que se describen a continuación: 1) un testigo absoluto (T0); 2) plantas inoculadas con Clavibacter michiganensis subsp. michiganensis (Cmm); 3) plantas inoculadas con Cmm y aplicación de ácidos fenólicos (Cmm+AF); y 4) plantas solo con aplicación de ácidos fenólicos (AF).
Las aplicaciones de los ácidos fenólicos fueron a una dosis de 1 kg ha-1, iniciando siete días después del trasplante (DDT), se realizaron un total de 10 aplicaciones durante el ciclo de cultivo cada siete días.
Inoculación de Clavibacter michiganensis subsp. michiganensis
La bacteria Clavibacter michiganensis subsp. michiganensis se aisló de plantas de tomate con síntomas atribuibles a ésta. Se obtuvo savia de las plantas colectadas mediante un macerado en mortero de porcelana. La savia fue sembrada en cajas Petri con medio de cultivo NBY y se incubaron a 29 °C por 48 h. Posteriormente la sabia fue resembrada para obtener su purificación. A las colonias obtenidas se les realizó pruebas morfológicas y bioquímicas para su identificación.
La bacteria se incrementó en cajas Petri con medio de cultivo NBY (Caldo nutritivo 0.8%, extracto de levadura 0.2%, K2HPO4 0.2 %, KH2PO4 0.025%, agar 1.5%) (Borboa, 2009). Las cajas Petri se incubaron a 28 °C por 48 h, posteriormente se realizó un lavado del crecimiento bacteriano ajustando a la concentración y volumen requerido, esto se realizó en el Laboratorio de Fisiología del Departamento de Horticultura.
Las plantas correspondientes a los tratamientos con estrés biótico fueron inoculadas con Clavibacter michiganensis subsp. michiganensis (Cmm) a los 21 DDT, y usando una concentración de 1X106 unidades formadoras de colonias (UFC) por mililitro. Para la inoculación de las plantas de tomate con Cmm se realizaron cortes en las hojas y fueron sumergidas en 30 mL de solución bacteriana por 5 min, el sobrante se asperjo al follaje.
Análisis agronómicos
Para determinar el efecto en el vigor de las plantas de tomate se estudiaron las siguientes variables agronómicas: altura de planta (AP), número de hojas (NH), diámetro de tallo (DT), número de hojas (NH), número de racimos (R) a los 75 días después del trasplante (DDT), peso fresco parte aérea (PFPA) y peso fresco raíz (PFR) a los 85 DDT. Después de secar en horno de secado a temperatura constante de 80 °C durante 72 h se obtuvo el peso seco parte aérea (PSPA) y el peso seco raíz (PSR). Además, se cuantificó el número de frutos cosechados (NFC) y peso de frutos cosechados (PFC) por planta.
Análisis en hojas y frutos
En las hojas se midieron las unidades SPAD (US) en tres ocasiones a lo largo del cultivo, a los 30, 75 y 105 DDT, para lo que se utilizó un medidor de clorofila SPAD (Minolta 502). La medición se realizó en la primera hoja fisiológicamente madura. Se determinó también el contenido de vitamina C (VC) por el método de titulación con 2,6 diclorofenolindofenol (Padayatt et al., 2001). Los resultados se expresan en mg/100 g peso fresco.
Para estas variables evaluadas en fruto se tomaron un total de cinco tomates por tratamiento, con un grado de madurez 5 (Light red): color rojo a rosado entre 60-90% del fruto, según la carta de colores propuesta por Boyette (1997) con escala de 1-6 (1) Green, 2) Breakers, 3) Turning, 4) Pink, 5) Light red y 5) Red). En estos frutos se determinaron los sólidos solubles totales (SST) con un refractómetro manual Atago (Master-T) y la acidez titulable (AT) se determinó de acuerdo a la metodología de la AOAC (2000). La conductividad eléctrica (CE) se obtuvo con un potenciómetro HI 98130 (Hanna Instruments) y la medición se realizó en 10 g de fruto completamente macerado.
La firmeza (F) (kg cm2) se determinó con un penetrómetro manual FDK-20 (Wagner Instruments), para esto se tomaron tres mediciones por fruto. El índice de madurez (IM) se calculó mediante la relación sólidos solubles totales/acidez titulable (Casierra-Posada, 2008). El contenido de Licopeno (L) se determinó mediante la metodología de Fish et al., (2002). El potencial de hidrógeno (pH) se determinó con un potenciómetro HI 98130 (Hanna Instruments) en 10 g de fruto completamente macerado. El contenido de vitamina C (VC) se determinó por el método de titulación con 2,6 diclorofenolindofenol (Padayatt et al., 2001). El diámetro ecuatorial (DE) y diámetro polar (DP) se determinaron con un vernier digital. Estas variables fueron determinadas en el Laboratorio de Fisiología del Departamento de Horticultura.
Incidencia y severidad de Clavibacter michiganensis subsp. michiganensis
La incidencia de Cmm se determinó a los 30, 45, 60, 75, 90 Días después de inoculación (DDI) y se expresó como el porcentaje de plantas que presentaron síntomas (Anfoka, 2000). Mientras que para medir la severidad se utilizó la escala visual de Baysal et al. (2003). Esta escala tiene valores de 0-5: (0: las hojas no muestran signos de marchitez; 1: 1-10% de las hojas presentan marchitez marginal leve; 2: 11-25% de las hojas marchitas; 3: 26-49% de las hojas presentan marchitez asociada con clorosis, el marchitamiento en forma sectorizada; 4: 50-74% de las hojas presentan marchitez, excesiva caída de hojas; y 5: todas las hojas marchitas). Por su parte, el índice de severidad se calculó mediante la fórmula descrita por Raupach et al., (1996) como sigue:
Donde: IS= índice de severidad; NC= número de clasificación; NPC= número de plantas en la clasificación; NTP= número total de plantas; CMA= clasificación más alta.
Análisis de estomas
Para determinar cambios en lo estomas se realizó un muestreo a los 75 DDT, donde se utilizaron seis plantas por tratamiento. Se tomó por planta una hoja madura totalmente expandida de la y con la misma orientación. De la parte media de esta hoja se tomó una impresión epidérmica del haz (adaxial) y otra del envés (abaxial) utilizando poliestireno-xilol en forma líquida, el cual se aplicó sobre la superficie foliar con un pincel. Una vez que la película secó, ésta fue removida con cinta adhesiva transparente y colocada sobre un portaobjetos. Para cada impresión se observaron al azar tres campos microscópicos a 100X, en los que se determinó el número de estomas y de células epidérmicas. Se tomaron por cada impresión tres microfotografías y de cada una de estas se midió el ancho y largo (μm) de las células oclusivas de dos estomas. La densidad estomática se obtuvo de la siguiente forma:
Donde: AC= 0.0254 mm2.
Mientras que para obtener el índice estomático se utilizó la siguiente fórmula (Wilkinson, 1979):
Para tomar las fotografías se utilizó un microscopio compuesto (Carl Zeiss) con cámara digital (PixeraWinder Pro) y se procesaron en el software de medición AxionVision Rel. 4.8.
Análisis histológico
Para verificar los cambios en las estructuras de las plantas de tomate se realizó adicionalmente un análisis histológico. Para esto se realizó un muestreo de tres plantas por tratamiento a los 90 DDT, de cada planta se tomaron las siguientes estructuras: a) segmentos de tallo de 1 cm de longitud tomado a 3 cm de la base del tallo; b) raíz de 1 cm de longitud tomado a 5 cm de la base de la raíz; y c) un fragmento de foliolo de 1 cm2 tomado de la parte media de la cuarta hoja. Para detener el metabolismo celular de los tejidos se realizó la fijación en FAA, el cual está compuesto como sigue: 5 ml de formaldehído al 36-40%, 90 ml de alcohol etílico al 70% y 5 ml de ácido acético glacial.
Después se deshidrataron a intervalos de una hora en alcohol al 60%, 70%, 85% y 96%, y en mezclas de alcohol absoluto-xilol en proporciones 3:1, 1:1 y 1:3. Posterior a esto las muestras se incluyeron en parafina, en moldes de aluminio con las siguientes dimensiones 8.2 x 9.4 de base y 5 cm de altura. Se realizaron cortes de 20 µm de grosor con un micrótomo de rotación y se adhirieron a un portaobjetos con adhesivo de Haupt. Los tejidos se tiñeron con safranina y verde rápido (Rivero et al., 2007). Para su observación se utilizó un microscopio compuesto (Carl Zeiss) con cámara digital (PixeraWinder Pro), y se tomaron microfotografías de tres campos por corte de tallo, raíz y hoja en aumentos de 10 X y 40 X. Las mediciones de las imágenes de los tejidos se realizaron con el software Axion Vision Rel 4.8.
Por su parte, la descripción de los caracteres anatómicos se hizo de acuerdo con la terminología de Evert (2006). Las variables que se determinaron fueron los siguientes: epidermis superior de hoja (ESH), epidermis inferior de hoja (EIH), parénquima empalizada de hoja (PEH), número de vasos de xilema en hoja (NVXH), córtex de raíz (CR), número de vasos de xilema en raíz (NVXR), área de vasos de xilema en raíz (AVXR), epidermis de tallo (ET), número de vasos de xilema en tallo (NVXT) y área de vasos de xilema en tallo (AVXT). Este trabajo se realizó en el Laboratorio de Citogenética del Departamento de Fitomejoramiento.
Análisis estadístico
El diseño experimental para el trabajo de campo fue de bloques completos al azar. Mientras que para el resto de los análisis se usó un diseño completamente al azar. Se realizó un análisis de varianza y una prueba de comparación de medias según la prueba LSD de Fisher (p≤ 0.05) con el programa InfoStat versión 2016.
Resultados y discusión
En el Cuadro 1 se observan los resultados obtenidos de las variables agronómicas evaluadas. La aplicación de ácidos fenólicos con o sin estrés no provoco cambios en las variables agronómicas, ya que no se encontraron diferencias estadísticas entre tratamientos. Sin embargo, se observa una tendencia de menores valores en el tratamiento con estrés biótico, lo que puede ser debido a que la planta activa los mecanismos de defensa ante el estrés (Conrath, 2006) y sintetiza metabolitos secundarios lo cual se traduce en un gasto energético (Brown, 2003; Cipollini, 2003; Lattanzio et al., 2013). Villanueva-Couoh (2009) observó en plantas de crisantemo asperjadas con compuestos fenólicos mayor altura, mayor diámetro de tallo y mayor producción de biomasa (San Miguel et al., 2003), resultados que se muestran diferentes a los observados en este trabajo.
Cuadro 1 Variables agronómicas evaluadas en las plantas de tomate.
| Trat | AP | NH | DT | R | PFPA | PFR | PSPA | PSR | NFC | PFC |
| T0 | 104 a | 17.6 a | 10.13 a | 14.67 a | 304.6 a | 51.4 a | 83.8 a | 12.3 a | 28 a | 1461.1 a |
| Cmm | 102.8 a | 19.27 a | 10.2 a | 11.03 a | 234 a | 55.6 a | 75.4 a | 12.1 a | 28.1 a | 1633.3 a |
| Cmm+AF | 100.4 a | 18.2 a | 9.87 a | 16.23 a | 294.7 a | 62 a | 82.9 a | 13.9 a | 27.4 a | 1542.7 a |
| AF | 98.53 a | 16.87 a | 10.13 a | 13.73 a | 275 a | 57.8 a | 66.9 a | 12.9 a | 28.6 a | 1692.8 a |
| CV (%) | 11.88 | 11.74 | 7.17 | 40.75 | 28.1 | 23.66 | 15.78 | 13.46 | 10.6 | 14.9 |
T0= testigo; Cmm= C. michiganensis; AF= ácidos fenólicos; AP= altura de planta (cm); NH= número de hojas; DT= diámetro de tallo (mm); R= racimos; PFPA= peso fresco parte aérea (g); PFR= peso fresco raíz (g); PSPA= peso seco parte aérea (g); PSR= peso seco raíz (g); NFC= número de frutos cosechados por planta; PFC= peso de frutos cosechados por planta (g). Letras diferentes por columna indican diferencias estadísticas de acuerdo a LSD Fisher (p≤ 0.05).
La aplicación foliar de compuestos fenólicos aumentó la biomasa de plantas de soya (Gutiérrez-Coronado et al., 1998) y el rendimiento de trigo (López-Tejeda et al., 1998). Además, extiende la vida de anaquel de plátano (Srivastava y Dwivedi, 2000). En el tomatillo casi todas las variables respondieron de forma negativa con la aplicación de ácido benzoico y salicílico por lo cual no muestran un patrón de respuesta (Valdez, 2015). Estos resultados muestran que el efecto de las aplicaciones de compuestos fenólicos no siempre será positivo.
Los resultados obtenidos de las mediciones realizadas en las hojas se encuentran en el Cuadro 2. En la medición de unidades SPAD que se realizó a los 30, 75 y 105 DDT no se encontró diferencia estadística por la aplicación de ácidos fenólicos. Sin embargo, el tratamiento con ácidos fenólicos (AF) indujo entre 1 a 5% más Unidades SPAD con respecto al T0, contrario a lo que pasa en el tratamiento AF+Cmm ya que presenta menores valores con respecto al T0 los cuales van de 1 a 9%.
Cuadro 2 Mediciones realizadas en las hojas de plantas de tomate.
| Tratamiento | US (30 ddt) | US (75 ddt) | US (105 ddt) | VC (90 ddt) |
| T0 | 49.25 a | 51.19 a | 44.51 a | 17.43 a |
| Cmm | 47.15 a | 47.43 a | 44.75 a | 17.3 a |
| Cmm+AF | 49.29 a | 46.75 a | 44.37 a | 15.83 a |
| AF | 48.80 a | 51.89 a | 46.74 a | 17.43 a |
| CV (%) | 8.19 | 18.3 | 13.47 | 11.08 |
T0= testigo; Cmm= C. michiganensis; AF= ácidos fenólicos; US= unidades SPAD; VC= vitamina C (mg 100 g-1). Letras diferentes por columna indican diferencias estadísticas de acuerdo a LSD Fisher (p≤ 0.05).
Los resultados de las variables evaluadas en los frutos de tomate se presentan en el Cuadro 3. Se encontró diferencia entre tratamientos en las variables de acidez titulable, licopeno y vitamina c. mientras que en las variables, conductividad eléctrica, firmeza, índice de madurez, potencial de Hidrogeno, Diámetro ecuatorial y polar no se observaron diferencias entre tratamientos.
Cuadro 3 Variables de calidad de fruto de plantas de tomate.
| Trat | SST | AT | CE | F | IM | L | pH | VC | DE | DP |
| T0 | 3.6 a | 0.12 ab | 2.2 a | 4.9 a | 30.9 a | 4.9 b | 4 a | 21.9 bc | 43.1 a | 52.7 a |
| Cmm | 4.1 a | 0.15 a | 2.7 a | 4.3 a | 28 a | 3.9 b | 3.9 a | 28.2 a | 46.6 a | 60.3 a |
| Cmm+AF | 3.7 a | 0.12 ab | 2.2 a | 4.8 a | 30.3 a | 5.3 b | 4 a | 23.2 b | 46.1 a | 59.9 a |
| AF | 3.8 a | 0.11 b | 2.8 a | 4.8 a | 34.8 a | 12.2 a | 4 a | 19.7 c | 47.4 a | 59.2 a |
| CV (%) | 8.87 | 13.35 | 30.78 | 8 | 16.05 | 48.31 | 6.8 | 5.93 | 6.37 | 6.62 |
T0= testigo; Cmm= C. michiganensis; AF= ácidos fenólicos; SST (°Brix)= solidos solubles totales; AT (%)= acidez titulable; CE (mS cm-1)= conductividad eléctrica; F (kg cm-1)= firmeza; IM= índice de madurez; L (mg kg-1)= licopeno; pH= potencial de hidrogeno; VC (mg 100 g-1)= vitamina C; DE (mm)= diámetro ecuatorial y DP (mm)= diámetro polar. Letras diferentes por columna indican diferencias estadísticas de acuerdo a LSD Fisher (p≤ 0.05).
En los resultados obtenidos se observa que el tratamiento con Cmm (plantas con estrés biótico) presentó la mayor concentración de solidos solubles totales, acidez titulable, conductividad eléctrica y vitamina c, siendo superiores al T0 por 13.8, 25, 22.7 y 28.7% respectivamente. Bajo condiciones de estrés biótico las plantas como mecanismo de defensa sintetizan una mayor cantidad de antioxidantes, en este sentido Muñoz (2007), reporta una mayor capacidad antioxidante en distintos frutos que contenían mayor cantidad de compuestos fenólicos. Los antioxidantes se incrementan ante condiciones de estrés debido al papel crucial que juegan para inactivar las especies reactivas de oxígeno, además de que influyen en la expresión génica asociada con las respuestas de estrés biótico y abiótico (Tokunaga et al., 2005).
Con relación a los resultados de incidencia y severidad de Cmm, éstos se presentan en las Figuras 1a y 1b. La incidencia de Cmm se puede ver en la Figura 1a, en las mediciones realizadas a los 50, 65 y 80 días el tratamiento AF+Cmm presentó menor incidencia en comparación al tratamiento Cmm, ya que redujo la incidencia de Cmm hasta 12%. En la Figura 1b se observan los resultados de severidad de Cmm, para esta variable el tratamiento AF+Cmm registró hasta 36% menor severidad de la enfermedad con respecto al tratamiento Cmm, esto a los 95 DDT. Se ha reportado que algunos compuestos fenólicos desempeñan un papel clave en las respuestas de las plantas ante los ataques de patógenos o insectos (Kutchan et al., 2005; Muthuswamy et al., 2007; Lattanzio et al., 2008), lo que corresponde al resultado obtenido en el presente estudio donde se observa claramente este efecto.
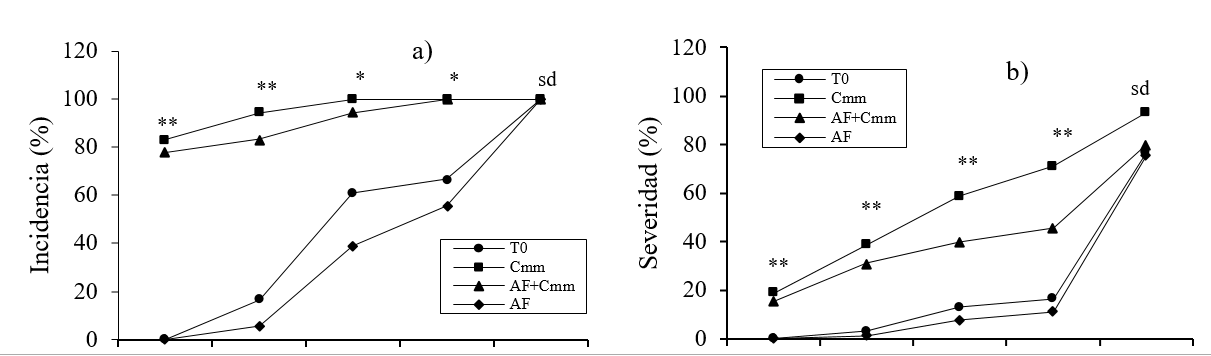
Figura 1 a) incidencia y b) severidad de Clavibacter michiganensis subsp. michiganensis en plantas de tomate. T0= testigo; Cmm= C. michiganensis; AF= ácidos fenólicos. Diferencias estadísticas de acuerdo a LSD Fisher, *= p< 0.05; **= p< 0.01.
Los resultados obtenidos demuestran que la aplicación de ácidos fenólicos de manera foliar reduce la incidencia y severidad de Cmm (Figura 1a y 1b), al igual que lo mencionado por Cornell (2003) y Bhattacharya (2010), quienes resaltan su función como agentes protectores. Además de que se ha recomendado el uso de ácidos fenólicos como agentes antimicrobianos naturales por mostrar un grado de inhibición del crecimiento de bacterias y hongos (Sivakamim, 2007).
En el Cuadro 4 se muestran los resultados de las variables evaluadas en el análisis de estomas. Se puede observar que en la densidad de estomas y células tabloides, así como en el índice estomático no se encontró diferencia estadística entre tratamientos. Sin embargo, la aplicación de ácidos fenólicos (AF) indujo en la superficie adaxial menor densidad de estomas e índice estomático en 13 y 28% con respecto al T0. Además, este mismo tratamiento, pero en la superficie abaxial provocó menor densidad celular 86% con respecto al T0.
Cuadro 4 Variables evaluadas relacionadas a los estomas.
| Trat | DEAd | DCAd | DEAb | DCAb | IEAd | IEAb | LEAd | AEAd | LEAb | AEAb |
| T0 | 118 a | 884.6 a | 263.3 a | 697.6 a | 11 a | 27.6 a | 32.3 a | 17.3 a | 35.6 a | 22.3 a |
| Cmm | 111.3 a | 859.6 a | 250.6 a | 681.3 a | 11.3 a | 27.3 a | 32 a | 16.6 a | 35.3 a | 21 a |
| Cmm+AF | 117.3 a | 940.3 a | 260.3 a | 684.6 a | 11.3 a | 27.6 a | 31.3 a | 17.3 a | 33.6 a | 21.6 a |
| AF | 85.3 a | 915.6 a | 289.6 a | 99.6 a | 9.6 a | 29.6 a | 33.6 a | 17.6 a | 37 a | 22.3 a |
| CV (%) | 29.43 | 27.01 | 16.78 | 10.76 | 19.15 | 13.16 | 11.77 | 7.91 | 9.28 | 7.20 |
T0= testigo; Cmm= C. michiganensis; AF= ácidos fenólicos; DEAd (Num mm-2)= densidad de estomas adaxial, DCAd (Num mm-2)= densidad celular adaxial; DEAb (Num mm-2)= densidad de estomas abaxial; DCAb (Num mm-2)= densidad celular abaxial; IEAd= índice estomático adaxial, IEAb= índice estomático abaxial; LEAd (µm)= largo de estomas adaxial; AEAd (µm)= ancho de estomas adaxial; LEAb (µm)= largo de estomas abaxial; AEAb (µm)= ancho de estomas abaxial. Letras diferentes por columna indican diferencias estadísticas de acuerdo a LSD Fisher (p≤ 0.05).
El tratamiento al que se le aplicaron ácidos fenólicos + Cmm presentó estomas de menor largo en ambas superficies. El tratamiento Cmm, presentó estomas de menor ancho en ambas superficies, sin presentar diferencia estadística con respecto a los demás tratamientos. Lo anterior, es una característica importante a destacar ya que la bacteria penetra a los tejidos vasculares a través de heridas, estomas, tricomas e hidátides de la hoja (Gleason et al., 1993; Ramírez y Sáinz, 2006). Particularmente el tamaño de los estomas influye en el ingreso de la bacteria a la planta, mayor tamaño facilitará el ingreso y viceversa. Los tratamientos Cmm y AF presentaron menor número de estomas lo que finalmente en menor probabilidad de acceso para las bacterias.
Conclusiones
La aplicación de ácidos fenólicos no tiene efectos sobre la morfología y fisiología del cultivo ya que no se observaron diferencias estadísticas significativas entre los tratamientos evaluados.
No obstante, los ácidos fenólicos disminuyen significativamente la incidencia y severidad de Cmm, por lo que el uso de éstos compuestos puede ser una alternativa para el manejo de Clavibacter michiganensis en el cultivo de tomate.
En variables histológicas se observó claramente que la aplicación de ácidos fenólicos induce cambios en las diferentes estructuras de la planta, lo cual puede aumentar la tolerancia al ataque de los patógenos como Clavibacter michiganensis.
Proponemos el estudio de los ácidos fenólicos en el control de otros patógenos en diferentes cultivos.











 texto en
texto en 


