Introducción
El creciente problema del incremento de sales en las áreas de cultivo aunado a las bajas precipitaciones y altas temperaturas de ambientes árido-salinos, exige soluciones integrales para su productividad (Ungar 1982). El frijol tepary (Phaseolus acutifolius A. Gray) es una leguminosa adaptada a las altas temperaturas y sequías del desierto de Sonora (Suroeste de los Estados Unidos de América y noroeste de México).
Las semillas de esta especie se caracterizan por un alto contenido de proteína dietética (21.1 a 32.49%) en comparación con otras especies de Phaseolus; por ejemplo P. vulgaris (19.1-29.7%), P. lunatus (19.7-24.9%), P. coccineus (20-27.4%), P. polyanthus (21.6-25.6%), P. filiformis (24.2%) y P. Angustissimus (25.9%) (Nabhan, 1985). En general, los rendimientos de tepary han sido estimados entre 200 y 900 kg ha-1. Se han reportado rendimientos de hasta 2000 kg ha-1 (Hamama y Bhardwaj, 2002; Ahmad et al., 2013) dependiendo de la temporada de siembra y de la suplementación apropiada de fertilizantes nitrogenados (N).
En el noroeste de México, se aplican grandes cantidades de fertilizantes químicos a los suelos para compensar la deficiencia de N y poder incrementar los rendimientos del frijol tepary, desafortunadamente, el uso excesivo y continuo de estos fertilizantes incrementa la salinidad, afectando las propiedades físicas y químicas del suelo, que en su conjunto alteran las actividades microbianas, que podrían ser benéficas para los cultivos (Rueda-Puente et al., 2003, 2007, 2010). Para reducir los aportes de fertilizantes nitrogenados con el fin de retardar o detener los aumentos adicionales en la salinidad del suelo y reducir los costos de fertilizantes, las rizobacterias que promueven el crecimiento de las plantas, en particular las bacterias fijadoras de N (RPCP-BFN), son una alternativa atractiva y sostenible para el cultivo de frijol tepary en suelos salinos de regiones semiáridas y áridas, como son aquellos situados en el estado de Sonora, México.
Los estudios sobre bacterias asociadas con los rendimientos de frijol tepary son escasos. Estudios relacionados con RPCP-BFN han demostrado el efecto biopromotor y bioprotector contra el estress ambiental en las plantas, por ejemplo, la sequía, el estrés osmótico e inundación (Mayak et al., 2004), temperaturas extremas (Terré et al., 2007), deficiencia de nutrientes (Cassan et al., 2009) y los metales tóxicos (Sandhya et al., 2010; Rokhzadi y Toashih, 2011).
Durante las últimas décadas las RPCP-BFN, han sido aisladas y cultivadas como una alternativa prometedora (Pathak y Keharia, 2013). Con base a lo anterior descrito, la hipótesis que se plantea consiste si la inoculación con RPCP-BFN, sobre todo aquellas del tipo halotolerante (HBFN) contribuyen a mejorar el efecto del estrés de salinidad en cultivos como el frijol tepary. Por lo tanto, los objetivos del presente estudio fueron: i) aislar una bacteria halotolerante fijadora de nitrógeno de rizosfera de P. acutifolius; y ii) identificar la contribución del aislado (Bacillus amyloliquefaciens RP22) sobre la tolerancia al estrés por salinidad en semillas y plántulas de P. acutifolius.
Materiales y métodos
Semillas
Las semillas evaluadas en el presente estudio fueron aquellos ecotipos de San Judas (SJ), Indio Yumi (IY) y Elena-Mora Property (EMP), los cuales fueron recolectadas de la sierra de Sonora- Chihuaha (29° 05’ latitud norte 110° 57’ longitud oeste) en el estado de Sonora.
Halobacterias fijadoras de nitrógeno
Aislamiento
Para el aislamiento de bacterias, se llevó a cabo la técnica de Rueda et al. (2003). Las semillas se trituraron con mortero y mortero para obtener el peso final de 4 g y las diluciones en serie (hasta 10-6) en solución salina estéril al 0.85%, se sembraron sobre medio de agar OAB libre de N acorde a (Bashan et al., 1993) con tres concentraciones distintas de NaCl (0, 0.25 y 0.5 M) (Rueda et al., 2003), se incubaron las placas de agar a 30 °C durante cuatro días, obteniéndose 24 colonias individuales en agar, basadas en el fenotipo (color, brillo, forma, elevación y margen) según Smibert y Krieg (1994), posteriormente los aislados purificados fueron almacenados a -80 ºC (glicerol al 15%).
Fijación de nitrógeno (técnica de reducción de acetileno)
El ensayo de reducción de acetileno (ERA) a las cepas seleccionadas se realizó según lo descrito por Reinhold et al. (1987). Los aislamientos halotolerantes se cultivaron en frascos de suero que contenían 25 ml de medio líquido OAB libre de N y NaCl 0.5 M. Los resultados se compararon con una halobacteria conocida (HBFN) Azospirillium halopraeferens AU10 (Reinhold et al., 1987). El aislamiento que mostró la mayor actividad de reducción de acetileno fue seleccionado para su identificación genética y para realizar una evaluación adicional con ensayos de inoculación.
Identificación
La bacteria halotolerante seleccionada se identificó a nivel de género mediante secuenciación parcial de genes de rRNA 16S por Acculab, Inc. (USA). La secuencia obtenida se comparó con secuencias en la base de datos GenBank del Centro Nacional de Información de Biotecnología (NCBI) utilizando el programa BLAST (http://blast.ncbi.nlm.nih.gov/; http://www.megasoftware.net/) y luego se depositó en el GenBank bajo el número de acceso KM652480. Además, un árbol filogenético fue construido usando MEGA6 freeware (http://www.megasoftware.net/).
Ensayos de inoculación-diseño del experimento
Los ensayos de inoculación se llevaron a cabo en una cámara de crecimiento y dentro de un invernadero. Ambos ensayos fueron asignados al azar en un diseño de bloque completo con un diseño trifaccional (3×3×3)= 27 tratamientos con n repeticiones; 3 ecotipos de frijol (San Judas= SJ=, Indio Yumi =IY= y Elena-Mora Property= EMP=; 3 niveles de NaCl (0, 0.25 y 0.5 M) y 3 niveles de bacterias (Ba= Bacillus amyloliquefaciens, Ah= Azospirillium halopraeferens AU10, U= los no inoculados. Una vez semillas esterilizadas las semillas, se inocularon con la HBFN aislada y caracterizada en este estudio, usando la técnica de bomba de vacío de aire descrita por Carrillo et al. (1998).
Ensayos en cámara de crecimiento
La germinación de 675 semillas (25 semillas por cada tratamiento) se realizó en placas Petri esterilizadas, se sellaron con cinta de parafina para mantener las condiciones de humedad y se colocaron en una cámara de crecimiento con un fotoperiodo de 16 h de luz (32 ±0.5 °C) y 8 h de noche (25 ±0.5 °C) con una humedad relativa de 36 ±1% (HR). Después de 7 días, se registraron las tasas de germinación de la semilla, el crecimiento (longitud de tallo y de la raíz) y los pesos secos.
Ensayos en invernadero
Para los ensayos en el interior del invernadero, el sustrato utilizado en las macetas de plástico fue vermiculita estéril sin nutrientes. Se sembraron 540 semillas (20 semillas por cada tratamiento) en macetas y se registraron las tasas de emergencia al día 9. Las plántulas se cultivaron bajo condiciones de control con un fotoperíodo 16 h día (32 ±0.5 ºC) y 8 h noche (25 ±0.5ºC) y con 36 ±1% de HR. Las plantas fueron regadas cada tercer día, considerando derramar el agua para prevenir un aumento en la salinidad con las correspondientes concentraciones de NaCl y mantenerse hasta los 21 días.
Variables evaluadas
Las tasas de germinación y semillas de emergencia se calcularon utilizando la fórmula descrita por Maguire (1962): M = n1/t1 + n2/t2 + ... n7/t7 ... n9/t9, donde n1, n2, ..., n7 ..., n9 son; 1 son el número de semillas germinadas; t1, t2, ..., t7 ..., t9 es el tiempo en días. El contenido de clorofila foliar se midió con un medidor de clorofila (SPAD-502, Minolta, Japón). Las longitudes de la raíz y del brote se midieron por separado con un calibrador digital (General No. 143, General Tools Manufacturing Co., Inc., Nueva York, EE. UU). Las plantas se secaron en una estufa a 110 ºC durante un tiempo de 36 h para estimar el peso en seco. El método de micro-kjeldahl se empleó para determinar el N total y la proteína cruda (N×6.25), mientras que la fibra cruda y los contenidos de cenizas fueron determinados gravimétricamente (Snedecor, 1956).
Análisis estadísticos
Los análisis estadísticos se realizaron mediante un análisis de varianza unidireccional (Andeva) seguido del ensayo de diferencia mínima significativa de Tukey cuando se observaron diferencias estadísticas. Los valores se expresan como medias ±error estándar y los valores significativos fueron con p≤ 0.05.
Resultados y discusión
Halobacteria fijadora de nitrógeno
Los recuentos totales de bacterias fijadoras de nitrógeno (BFN) se muestran en el Cuadro 1. Se pudo apreciar que los aislados en placas de agar de control (medio de agar OAB libre de N sin NaCl) fueron de 8.6 a 12.6x 106 unidades formadoras de colonias (UFC g-1 y de 7.6 a 10.6×106 UFC g-1 para semillas con y sin testa, respectivamente. Los aislados en los ecotipos SJ y EMP disminuyeron significativamente (p≤ 0.05) en placas de agar suplementadas con NaCl al 0.5 y 0.75 M. En el caso de las semillas de control en el ecotipo SJ (8.3-9.3×106 CFU g-1), los conteos mostraron una tolerancia a NaCl de 45-54% (3.7-5×106 CFU g-1 semillas) y 29 - 33% (2.4-3.1×106 CFU g-1 semillas) de BFN cultivable total al 0.50 y 0.75 M de NaCl, respectivamente.
Cuadro 1 Unidades formadoras de colonias de HBFN asociadas a semilla de diferentes ecotipos de Phaseolus acutifolius sobre agar OAB libre de N suplementado con diferentes concentraciones de NaCl.
| Semillas | Ecotipos | Conteo (×106 UFC g-1 semilla) | |||
| 0 M NaCl | 0.25 M NaCl | 0.5 M NaCl | 0.75 M NaCl | ||
| Con testa | SJ | 9.3 ±1.2a* | 8.3 ±0.6ab | 5 ±0.5bc | 3.1 ±0.5a |
| IY | 8.6 ±2.6a | 8 ±1.1a | 5 ±1.1ab | 2.6 ±0.8ab | |
| EMP | 12.6 ±2a | 8.6 ±0.6b | 3.6 ±0.3c | 2.3 ±0.3b | |
| Sin testa (endospermo) | SJ | 8.3 ±0.4a | 6.7 ±0.3b | 3.7 ±0.9c | 2.4 ±0.3b |
| IY | 7.6 ±1.2a | 7.4 ±1.2a | 5 ±0.6ab | 3.3 ±0.4a | |
| EMP | 10.6 ±0.9a | 7.6 ±0.4b | 4.4 ±0.3c | 2.3 ±0.7b | |
*= Valores representan una media ± error estandar (media de tres repeticiones). Diferente letra en la misma linea denota diferencia significativa (p≤ 0.05; prueba de Tukey). Ecotipos SJ= San Judas; IY= Indio Yumi; EMP= Elena-Mora Property.
De forma similar, los recuentos en el ecotipo de EMP mostraron una tolerancia a la sal 28-41% (3.6-4.4×106 CFU g-1 semillas) y 18-22% (2.3×106 CFU g-1 semillas) de BFN cultivable total a 0.5 y 0.75 M de NaCl, mientras que en el control los valores eran 10.6-12.6x106 CFU g-1.
Con relación a la capacidad de fijación de N (reducción de acetileno), la cepa codificada como RP22 tuvo la actividad de reducción de acetileno más alta (6.97 ±1.1 nmol cultivo-1 h-1), que es similar a la referencia A. halopraeferens AU10 (7.83 ±1.3 nmol de cultivo-1 h-1). Este resultado demuestra que el crecimiento mejoró en 28 y 43% con las bacterias aisladas a concentraciones de NaCl entre 0.5 M y 0.75 M NaCl.
Análogamente, Rueda et al. (2003) propusieron que 5% de las cepas halotolerantes de áreas salinas-planas redujeron el acetileno ~ 6.26 ±0.56 nmol de cultivo-1 h-1 (Klebsiella pneumoniae) con el control A. halopraeferens, lo que produjo un valor de 7.1 ±1.7 nmol-1 h-1. Esto podría atribuirse a la codependencia de otras bacterias, un fenómeno que es bastante común entre los microorganismos (Diby y Harshad, 2015). La identificación genética del aislado bacteriano en el presente estudio, basado en la secuencia de genes 16S rRNA, mostró una alta similitud (99%) con la bacteria promotora del crecimiento vegetal Bacillus amyloliquefaciens (Figura 1).
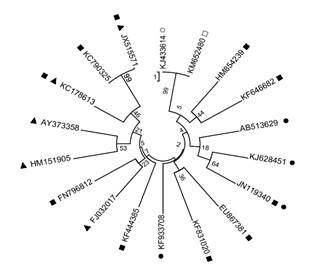
Figura 1 Árbol filogenético mostrando la similitud con el aislado Bacillus amyloliquefaciens RP22 (□) y la relación cercana con Bacillus amyloliquefaciens (○) y su relación con la halotolerante (●) fijadora de N (▲) y endófito (■) bacteria del desierto. La alineación y relación cercana con el árbol fue realizada utilizando MEGA6 (http://www.megasoftware.net/). Las barras indican 10% de divergencia; un análisis bootstrap fue desarrollado con 1000 ensayos. KJ433614, Bacillus amyloliquefaciens strain IARI-AR25; KM652480, Bacillus amyloliquefaciens strain RP22; HM854239, Bacillus safensis strain KLH-14; KF646682, Bacillus tequilensis strain DH-10; AB513629, Bacillus megaterium; KJ628451, Bacillus subtilis strain HPCAQRKSM106; JN119340, Halobacillus sp. KLBMP 2429; EU867381, Bacillus pumilus strain CCGE2028; KF831020, Bacillus firmus strain L-4; KF933708, Bacillus baekryungensis strain QD56; KF444385, Bacillus aryabhattai strain HYR8(1); FJ032017, Bacillus pumilus strain ES4; FN796812, Bacillus cereus strain GP17; HM151905, Bacillus subtilis strain DAZ26; AY373358.1, Bacillus megaterium strain c5; KC178613, Bacillus flexus strain DNEB39; KC790325, Bacillus methylotrophicus strain SY33; JX515571, Bacillus subtilis strain H171.
El análisis filogenético basado en el gen 16S rRNA aislado del halotolerante NFB exhibió 99% de similitud con una B. amyloliquefaciens (número de accesión KJ433614), una bacteria aislada del frío desierto del noroeste del Himalaya por los análisis PGPR. Hasta donde se conoce, la especie B. amyloliquefaciens nunca ha sido reportada para P. acutifolius, lo cual es indicativo de la asociación de bacterias benéficas y la planta en estudio. Otras especies del género Bacillus han sido aisladas e identificadas en otras legumnosas (B. pumilus, B. cepacia, B. japonicum, B. vallismortis, B. mojavensis, B. atrophaeus, B. megaterium y B. Stearothermophilus) (Bashan et al., 1993; Dobbelaere y Okon, 2007a b).
Ensayos de inoculación
Cuando las semillas fueron inoculadas con cepas bacterianas, los efectos negativos del NaOCl al 2% sobre la germinación de las semillas disminuyeron (Cuadro 2). Así, se obtuvieron mayores tasas de germinación en condiciones de cámara de crecimiento con semillas inoculadas (53.3-100%) que con semillas no inoculadas (46.7-86.7%) en los tres ecotipos de frijol tepary tratados con NaCl 0 M y 0.25 M. Además, la tasa de germinación fue fuertemente afectada cuando se aplicó NaCl 0.50 M mostrando rangos de 0-13.3% y 6.7-26.7% para las semillas no inoculadas e inoculadas, respectivamente (Cuadro 2).
Cuadro 2 Porcentajes de germinación y emergencia de semillas de tres ecotipos de Phaseolus acutifolius bajo cámaras de crecimiento y ensayos en invernadero.
| NaCl tratamiento | Núm. inoculado (control) | B. amyloliquefaciens | A. halopraeferens AU10 |
| Germinación cámara de crecimiento | |||
| 0 M | 46.7-86.7 | 93.3-100 | 86.7-100 |
| 0.25 M | 53.3-66.7 | 73.3-100 | 53.3-80 |
| 0.5 M | 0-13.3 | 20-26.7 | 6.7-20 |
| Emergencia en invernadero | |||
| 0 M | 55.6-66.7 | 100 | 100 |
| 0.25 M | 22.2-33.3 | 33.3-44.4 | 33.3-44.4 |
| 0.5 M | 11.1-22.2 | 11.1-33.3 | 11.1-33.3 |
En cuanto a los parámetros medidos en condiciones de cámara de crecimiento, los tratamientos de frijol tepary en las variables de brotes y raíces en plántulas, los efectos máximos de la inoculación bacteriana con B. amyloliquefaciens RP22, así como A. halopraeferens AU10 fueron para el ecotipo SJ, mostrando resultados significativos con p≤ 0.05 a 0 M de NaCl (8.9 y 10.5 cm de planta-1), entre 6.9 y 8.7cm planta-1 para B. amyloliquefaciens y A. halopraeferens al agregar 0.25 M NaCl, en comparación con las plántulas no inoculadas que fueron más bajos: (7.8 y 8.5 y 5.8 y 6.7 cm planta-1 para 0 y 0.25 M NaCl (Figura 2).
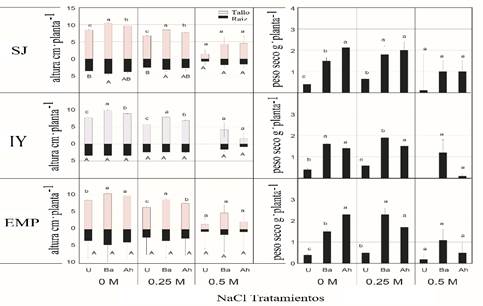
Figura 2 Efecto de las concentraciones de NaCl y la inoculación bacteriana en la altura y el peso seco de las plántulas de Phaseolus acutifolius en condiciones de cámara de crecimiento. Los valores representan la media ± error estándar (n= 3). Diferente letra indica diferencias significativas (p≤ 0.05, prueba de Tukey) de las plantas inoculadas (Ba= Bacillus amyloliquefaciens, Ah= Azospirillium halopraeferens AU10) en relación con los controles no inoculados (U). Ecotipos SJ= San Judas; IY= Indio Yumi; EMP= Elena-Mora Property.
Las longitudes de las raíces presentaron diferencias estadísticas significativas (p≤ 0.05) entre las plántulas inoculadas y no inoculadas en ecotipos IY y EMP, considerando todas las salinidades, excepto el ecotipo SJ donde las plantas se inocularon con B. amyloliquefaciens RP22, (4.4 y 2.7 cm planta -1 a 0 y 2.5 M NaCl (p≤ 0.05) (Figura 2).
La producción de biomasa seca según el efecto de los tratamientos fueron estadísticamente diferentes (p≤ 0.05); los incrementos en biomasa seca de las plantas inoculadas respecto a las no inoculadas fueron de 17 y 38%, respectivamente. Coincidentemente con el ensayo de cámara de crecimiento, los resultados del ensayo en invernadero (Figura 3) mostraron tasas de semilla de emergencia más bajas y valores de crecimiento y biomasa en plántulas de los tres ecotipos de frijoles tepary irrigados con NaCl al 0.25 y 0.5 M con NaCl a 0 M, este ensayo también confirma el efecto promotor del crecimiento de las plantas sobre semillas y plántulas de ambas cepas bacterianas inoculadas, lo cual reafirma la posibilidad de proponer a los microorganismos benéficos como prospectos biofertilizantes (Stefana et al., 2013; Diby y Harshad, 2015).
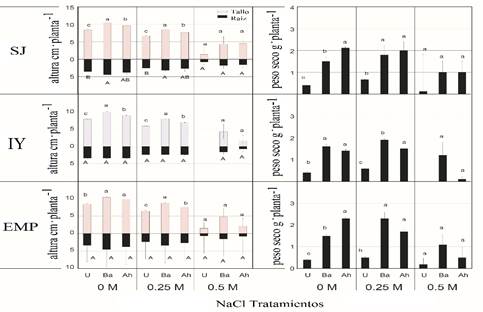
Figura 3 Efecto de las concentraciones de NaCl y la inoculación bacteriana sobre el crecimiento y el peso seco de plántulas de Phaseolus acutifolius bajo condiciones de invernadero. Los valores representan la media del ± error estándar (n= 3). Diferentes letras indican diferencias significativas (p≤ 0.05) de las plantas inoculadas (Ba = Bacillus amyloliquefaciens, Ah= Azospirillium halopraeferens AU10) en relación con los controles no inoculados (U). Ecotipos SJ= San Judas; IY= Indio Yumi; EMP= Elena-Mora Property.
Resultados similares indican que los efectos positivos de este tipo de bacterias aparentemente se deben a la producción de sustancias promotoras de crecimiento según lo reportado en otros estudios (Yadav, 2011; Rugheim et al., 2012).
Con relación a las variables de crecimiento y de biomasa en condiciones de invernadero, se observaron diferencias significativas (p≤ 0.05) en longitudes de brotes en el ecotipo SJ, considerando la inoculación con B. amyloliquefaciens RP22 (70 cm planta-1), así como A. halopraeferens AU10 (58 cm planta-1), en relación con los controles no inoculados (U) (35 cm planta-1) en NaCl M (Figura 3).
En cuanto al peso en seco, los valores máximos se registraron en plántulas inoculadas en los tres ecotipos a 0, 0.25 y 0.5 M de NaCl en relación a los controles no inoculados (U). Sin embargo, cabe mencionar que la salinidad reduce el peso seco, mientras que se incrementa en todos los tratamientos (Figura 3). En particular, los valores de germinación, emergencia, crecimiento y biomasa fueron mayores en las plántulas inoculadas con B. amyloliquefaciens RP22 que en las inoculadas con A. halopraeferens AU10, particularmente en el ecotipo IY tratado con NaCl 0 y 0.25 M (Figuras 2 y 3).
Asimismo, el análisis de la clorofila foliar y los contenidos de proteínas, cenizas y fibra bruta confirman el efecto de los tratamientos con NaCl y la inoculación bacteriana en relación con los controles (no inoculados) sobre el crecimiento y la biomasa de las plántulas (Cuadro 3).
Cuadro 3 Efecto de las concentraciones de NaCl y la inoculación bacteriana sobre el contenido total de clorofila, proteína, cenizas y fibra cruda en plántulas de Phaseolus acutifolius bajo condiciones de invernadero.
| Ecotipos | NaCl tratamientos | Inoculantes | Clorofila total | Proteína (%) | Cenizas (%) | Fibra cruda (%) |
| SJ | 0 M | U | 31.5 ±0.08b | 11.9 ±0.07b | 5.5 ±0.03b | 17.8 ±0.5b |
| Ba | 34.9 ±0.1a | 14.4 ±0.07a | 7.6 ±0.2a | 21.9 ±0.9a | ||
| Ah | 34.1 ±0.03a | 14 ±0.2a | 6.5 ±0.2a | 22.9 ±0.5a | ||
| 0.25 M | U | 8.9 ±8.9b | 3.1 ±3.1b | 1.4±1.4b | 4.7 ±4.7b | |
| Ba | 29.4 ±0.4a | 12.3 ±0.06a | 7.2 ±0.2a | 21.1 ±1a | ||
| Ah | 29 ±0.02a | 11.8 ±0.2a | 6.4 ±0.2a | 22.85 ±0.3a | ||
| 0.5 M | U | 4.9 ±4.9c | 2.3 ±2.3b | 1 ±1b | 4.1 ±4.1b | |
| Ba | 12.7 ±6.4a | 5.1 ±2.5a | 3.2 ±1.6a | 8.4 ±4.2a | ||
| Ah | 6.6 ±6.6b | 2.5 ±2.5b | 1.9±1.9b | 4.1 ±4.1b | ||
| IY | 0 M | U | 31.2 ±0.2b | 11.29 ±0.04c | 5.3 ±0.09b | 17.5±0.9b |
| Ba | 34.9 ±0.8a | 14.3 ±0.09a | 7.6 ±0.3a | 23.3 ±0.05a | ||
| Ah | 34.3 ±0.1a | 13.66 ±0.2b | 6 ±0.1b | 23.1 ±0.2a | ||
| 0.25 M | U | 8.9 ±8.9c | 2.6 ±2.6c | 1.3 ±1.3c | 5.2 ±5.2c | |
| Ba | 30.3 ±0.8a | 12.2 ±0.07a | 7 ±0.05a | 23.7 ±0.6a | ||
| Ah | 19.6 ±9.8b | 7.8 ±3.9b | 4.2 ±2.1b | 15.1 ±7.5b | ||
| 0.5 M | U | 4.5 ±4.5b | 2.5 ±2.5a | 1 ±1a | 3.7 ±3.7a | |
| Ba | 6.6 ±6.6a | 2.4 ±2.4a | 1.7 ±1.7a | 4.1 ±4.1a | ||
| Ah | 6 ±6a | 2.6 ±2.6a | 1.9 ±1.9a | 4.4±4.4a | ||
| EMP | 0 M | U | 32.5 ±0.06b | 11.5 ±0.01c | 5.6 ±0.03c | 22.4 ±0.03a |
| Ba | 35.2 ±0.4a | 15 ±0.2a | 8.6 ±0.4a | 23.6 ±0.03a | ||
| Ah | 34.1 ±0.03a | 14.6 ±0.4b | 6.2 ±0.06b | 23.5 ±0.19a | ||
| 0.25 M | U | 9.2 ±9.2b | 3.2 ±3.2b | 1.5 ±1.5b | 7.2 ±7.2b | |
| Ba | 29.9 ±0.2a | 12.7 ±0.2a | 7 ±0.06a | 21.8 ±0.2a | ||
| Ah | 29 ±0.02a | 12.1 ±0.03a | 6.2 ±0.2a | 22.1 ±0.1a | ||
| 0.5 M | U | 5.8 ±5.8b | 2.5 ±2.5b | 1 ±1b | 4.4 ±4.4b | |
| Ba | 18.6 ±0.61a | 7.9 ±0.03a | 5.8 ±0.4a | 13.2 ±0.6a | ||
| Ah | 19.3 ±0.6a | 7.7 ±0.1a | 5 ±0.5a | 12.6 ±0.3a |
Conclusiones
El presente estudio representa ser un primer informe de Bacillus amyloliquefaciens como una bacteria fijadora de nitrógeno asociada con la leguminosa Phaseolus acutifolius. Asimismo, es una primera aproximación en las primeras etapas bajo condiciones de salinidad, específicamente con frijol tepary, evaluando el microorganismo aislado y halotolerante comparado con un control biológico Azospirillum halopraeferens AU10.
La halobacteriae B. amyloliquefaciens, aislada a partir de semillas de ecotipos de tepary, es capaz de resistir altas concentraciones de sal (NaCl 0.75 M) y puede facilitar la promoción del crecimiento de la planta en presencia de niveles de inhibición del crecimiento de la salinidad del suelo que exceden 0.25 M NaCl.
La inoculación basada en bacterias benéficas como son las fijadoras de nitrógeno es un método biológico y confiable, para ayudar a mantener o mejorar la fertilidad de los suelos que sostienen los campos de tepary. Sin embargo, se sugiere desarrollar más evaluaciones en etapas fenológicas más avanzadas y en otros ecotipos para comprender mejor los mecanismos de acción y las reacciones particulares con cada ecotipo antes de recomendar la asociación de las bacterias a nivel de campo.











 texto en
texto en 


