Introducción
La producción de hortalizas constituye una actividad muy importante para el sector agrícola mundial y nacional, entre los cultivos hortícolas de interés económico y nutricional por su consumo fresco o procesado el pimiento morrón (Capsicum annuum L.) se ubica en el séptimo lugar a nivel mundial (FAO, 2015; Acevedo-Chávez y Sánchez-Chávez, 2017). En México, la producción de pimiento morrón ha mostrado un aumento debido principalmente por su exportación a los Estados Unidos y Canadá, lo que genera una importante cantidad de divisas, a nivel nacional la superficie cultivada de esta hortaliza es de 2 641.43 ha con un rendimiento promedio de 42.08 t ha-1, lo que representa un valor económico de 519 321.21 millones de pesos (SIAP-SAGARPA, 2015; Acevedo-Chávez y Sánchez-Chávez, 2017).
Debido a la implementación de esquemas de producción agrícola intensiva, como el utilizado en el cultivo de pimiento morrón para la obtención de mayores volúmenes de fruto, se ha impulsado el uso constante y desmedido de fertilizantes químicos, los cuales además de costosos son altamente contaminantes para el suelo, agua y salud humana (Sánchez et al., 2012; Schulz y Glaser, 2012).
Ante este escenario de una agricultura intensiva a base de insumos nutricionales químicos y costosos, el creciente aprovechamiento de rizobacterias promotoras del crecimiento en plantas (PGPR), es promovido por su habilidad para inducir de forma directa o indirecta la sanidad y crecimiento de la raíz y follaje de las plantas a través de la producción de reguladores del crecimiento como auxinas, giberelinas y citosinas (Lugtenberg y Kamilova, 2009; Belimov et al., 2015), fijación de N2 atmosférico, solubilización de fosforo insoluble (Naz y Bano, 2010; Zaidi et al., 2015; Pankievicz et al., 2015), síntesis de sideróforos, antibióticos, metabolitos antifúngicos, ácido salicílico, cianuro (Adhikari et al., 2013; Sunar et al., 2013; Kamou et al., 2015) e inducción de resistencia en las plantas (Bakker et al., 2013; Vacheron et al., 2013). Entre la diversidad de PGPR destacan un amplio número de especies agrupadas en los géneros Pseudomonas, Azospirillum, Burkholderia, Serratia, Azotobacter, Enterobacter, Streptomyces, Bacillus, Rhizobium, entre otros (Berg, 2009; Adhikari et al., 2013; Kamou et al., 2015).
La forma de inoculación de rizobacterias sobre las plantas es versátil y sencilla, ya que pueden ser aplicadas en la semilla, raíz o en el suelo (Shen et al., 2013; Cordero-Ramírez et al., 2013; Zaidi et al., 2015). La respuesta de las plantas ante la inoculación varía de forma considerable y está en función a la especie de rizobacteria, el hospedero, tipo de suelo, condiciones ambientales, concentración del inoculo y modo de inoculación (Becerra-Castro et al. 2011; Cabello-Conejo et al., 2014). Los métodos de inoculación de las PGPR son determinantes en el proceso de colonización, actividad y permanencia de las células bacterianas en la rizósfera de las plantas, además de influir de forma indirecta sobre los mecanismos de acción que promueven el crecimiento en las plantas (Krzyzanowska et al., 2012; He et al., 2016).
Entre los métodos de inoculación de las rizobacterias, destacan las microcápsulas, las cuales, han demostrado ser más eficientes que la forma líquida, debido a su cualidad de proveer protección y estabilidad a las células bacterianas, permitiéndoles sobrevivir por más tiempo en la rizósfera de las plantas (Bashan et al., 2014; Schoebitz Belchí, 2016). Al respecto, Sivakumar et al. (2014) al evaluar el efecto de microcápsulas de Bacillus megaterium suplementadas con ácidos húmicos en plantas de arroz, reportan resultados sobresalientes en el crecimiento de las plantas, destacando la acción de los ácidos húmicos en las microcápsulas al proporcionar estabilidad química y disponibilidad de C y N, generando mayor número de células bacterianas.
Mientras que Abo-Kora et al. (2016) al inocular plantas de tomate con microcápsulas y suspensión bacteriana de Pseudomonas fluorescens, Azotobacter chroorcoccum, Bacillus polymyxa y Azospirillum brasilense, encontraron que ambas formas de inoculación generaron efectos favorables en el crecimiento de las plantas, sobresaliendo las microcápsulas de P. fluorescens y A. Brasilense en la altura de planta y longitud radical, respectivamente. En tanto que Schoebitz et al. (2013) al evaluar en plantas de trigo inoculadas con microcápsulas a base de alginato de sodio y una combinación de almidón de papa con alginato de sodio, conteniendo en ambas formulaciones las cepas rizobacterianas P. fluorescens y Serratia sp. reportan que las rizobacterias en ambas presentaciones promovieron la altura de planta, biomasa seca y contenido foliar de P, por lo que señalan que el método de microcápsulas mejora el efecto de las rizobacterias al actuar como minireactores que confieren a las células bacterianas estabilización, protección, incremento poblacional y liberación progresiva entorno a la rizósfera de las plantas donde se aplican (Malusa et al., 2012; Schoebitz et al., 2013).
Por lo tanto, conocer los efectos de diferentes métodos de inoculación de especies rizobacterianas, puede ayudar en la elaboración de programas eficientes de biofertilización que faciliten a las células rizobacterianas la expresión de sus cualidades como agentes promotores del crecimiento y productividad en plantas. Por lo que, el objetivo del presente trabajo fue evaluar el efecto de la inoculación de microcápsulas y cultivo líquido de tres cepas de Pseudomonas putida sobre el crecimiento y rendimiento de pimiento morrón en invernadero.
Materiales y métodos
Sitio de estudio
El estudio se realizó de junio a octubre de 2015, en un invernadero de 160 m2 tipo túnel con ventilación lateral y bajo nivel de tecnología, ubicado en la Facultad de Ciencias Agrícolas Campus Xalapa de la Universidad Veracruzana en las coordenadas 19° 30’ latitud norte y 96° 55’ latitud oeste, a una altura de 1 450 msnm, en Xalapa, Veracruz, México.
Según la clasificación de Köeppen modificado por García (1981), el clima es templado-húmedo con lluvias todo el año C(fm)w”b(i’)g. La temperatura media anual es de 18 °C y precipitación pluvial de 1 509 mm, con lluvias abundantes en verano y principio de otoño.
Rizobacterias y medio de cultivo
Las cepas de Pseudomonas putida utilizadas en este estudio, están catalogadas como FA-8, FA-56 y FA-60, las cuales fueron proporcionadas por el Laboratorio de Química Agrícola de la Facultad de Ciencias Agrícolas Campus Xalapa de la Universidad Veracruzana. Las cepas fueron cultivadas en medio líquido B-King (glicerol 10 ml L-1, peptona 15 g L-1, sulfato de magnesio al 1 M 1 ml L-1 y fosfato de potasio dibásico 1.5 g L-1) por 48 h a 28 °C. La concentración de cada rizobacteria fue ajustada a 109 células mL-1 mediante un espectrofotómetro (Thermo Spectronic modelo 4001/1) a una longitud de onda de 660 nm y absorbancia de 1.
Elaboración de microcápsulas de alginato con Pseudomonas putida
De los cultivos rizobacterianos crecidos previamente en medio B-King se tomaron de cada cepa de P. putida 100 ml y se mezclaron con 2.5 g de alginato de sodio y se agitaron por 25 min a 350 rpm en un agitador magnético (IKA® modelo C-MAG). Las microcápsulas de alginato conteniendo las cepas de forma individual y combinadas, se elaboraron mediante formación de gota con una pipeta Pasteur de polietileno transparente de 5 ml de capacidad, con la cual se tomó la mezcla de alginato con cultivo bacteriano y se formaron gotas que fueron depositadas en solución estéril de CaCl2 al 0.1 M. Se agitaron por 30 min a 100 rpm en agitador magnético para favorecer la gelificación de las microcápsulas, se retiraron de la solución de CaCl2 y se lavaron tres veces con solución salina estéril de NaCl al 0.85% (p/v). Un grupo de microcápsulas denominado MIXmc consistió en la mezcla de las tres rizobacterias en volúmenes iguales hasta obtener 100 ml de cultivo. Finalmente, las microcápsulas de alginato de aproximadamente 4 mm de diámetro se conservaron en solución estéril de CaCl2 al 0.1 M a temperatura ambiente por 72 h hasta su inoculación en las plantas.
Producción de plántulas de pimiento morrón
Se utilizaron semillas de pimiento morrón (Capsicum annuum L.) var. California Wonder (Hortaflor), planta productiva con habito de crecimiento determinado y ciclo semi precoz con frutos cuadrados gruesos y dulces. Para la producción de plántulas se utilizó una bandeja de germinación de poliestireno de 200 cavidades (2.5 x 2.5 x 6 cm) desinfectada con solución de hipoclorito de sodio al 3%, se llenó con una mezcla de sustratos a base de lombricomposta, tepetzil y arena (2:1:1 v/v), esterilizada con una solución sanitizante y desinfectante líquido de Anibac 580® (i. a. cuaternario de amonio [1ra. generación] al 8.6% y cuaternario de amonio [doble cadena] al 3.7 %) en dosis de 5 ml L-1. Se colocó una semilla por cavidad a una profundidad de 1 cm, la bandeja germinadora se mantuvo en invernadero durante 35 días a temperatura media de 26 °C y humedad relativa de 60%, hasta obtener plántulas con altura promedio de 17 cm al momento del trasplante.
Trasplante y aplicación de microcápsulas y cultivo líquido de P. putida en pimiento morón
Previo al trasplante las raíces de las plántulas de pimiento fueron lavadas, posteriormente al momento del trasplante a un grupo de plántulas se les aplicó sobre la raíz 50 microcápsulas (mc) de alginato de sodio (equivalentes a 5 ml de cultivo líquido bacteriano en concentración de 109 células mL-1) y en otro grupo se les aplicó en la raíz 5 ml del cultivo líquido rizobacteriano (cl) de cada cepa. Para ambas formas de aplicación, un grupo de plántulas fue inoculado con la combinación de las tres cepas rizobacterianas denominado MIX. Se utilizó un diseño experimental de bloques al azar con nueve tratamientos: FA-8mc, FA-56mc, FA-60mc, MIXmc, FA-8cl, FA-56cl, FA-60cl, MIXcl y testigo (plantas sin inocular) con cuatro repeticiones y dos plantas por unidad experimental.
Las plantas se mantuvieron en invernadero durante 100 días en bolsas de polietileno negro de 8 kg de capacidad que contenían como sustrato 6 kg de tepetzil, previamente desinfectado con solución líquida de Anibac 580® en dosis de 5 ml L-1. Durante el experimento se registró una temperatura media de 26 °C y 60% de humedad relativa. Todas las plantas se fertilizaron desde el trasplante hasta el final del experimento con solución nutritiva (g L-1) compuesta por: Ca(NO3)2 4H2O (1.43), Mg(NO3)2 (0.95), KNO3 (0.38), KH2PO4 (0.35) y micronutrientes Tradecorp®AZ [Fe, Zn, Mg, B, Cu y Mo] (0.03), ajustando el pH de la solución en 6 Al final del experimento se cuantificó la altura, diámetro de tallo, volumen radical, longitud de raíz, biomasa fresca y seca y unidades formadoras de colonias en raíces frescas (UFC), para rendimiento de fruto y contenido de sólidos solubles totales (°Brix) en jugo de fruto maduro (dos frutos por planta) la cuantificación se realizó en seis cosechas durante las tres últimas semanas del ciclo de cultivo.
Población rizobacteriana en raíz
Para determinar las poblaciones rizobacterianas mediante unidades formadoras de colonias (UFC), al final del experimento se colectó una muestra de 3 g de raíz fresca de las plantas inoculadas con cada rizobacteria y testigo, las raíces se colocaron en caja Petri con solución salina estéril de NaCl al 0.85% (p/v). Posteriormente, de acuerdo a la metodología propuesta por Holguin y Bashan (1996) las raíces fueron maceradas mediante una varilla de vidrio estéril, se colectó 1 mL de la muestra y se depositó en un tubo de ensayo que contenía 9 mL de solución salina estéril al 0.85% (p/v) del cual se realizaron diluciones seriadas para cuenta en placa con medio de cultivo sólido B-King por triplicado y se incubaron por 72 h a 28 °C. La población de cada cepa rizobacteriana fue expresada como UFC 108 g-1 de raíz (Gamalero et al., 2002).
Resultados y discusión
Los resultados obtenidos indican que las plantas de pimiento morrón inoculadas con las microcápsulas y cultivo líquido de las tres cepas rizobacterianas en lo individual y combinadas mostraron diferencias significativas (p˂ 0.05) en las variables morfológicas de planta, rendimiento y contenido de solidos solubles totales de fruto (Cuadro 1). La cepa FA-56mc aplicada a las plantas de pimiento morrón mediante microcápsulas de alginato aumentó de manera significativa (p˂ 0.05) la altura, volumen radical, biomasa seca de planta y rendimiento de fruto en 31.50, 32.56, 71.06 y 45.10% respectivamente, en comparación con las plantas testigo. Las plantas inoculadas con la cepa FA-60mc y la combinación de las tres cepas (MIXmc) aplicadas en microcápsulas obtuvieron aumentos significativos (p˂ 0.05) para longitud radical y diámetro de tallo de 32.56 y 29.89% respectivamente, comparadas con las plantas sin inocular.
Cuadro 1 Efecto de microcápsulas e inoculación líquida de tres cepas de P. putida sobre el crecimiento y productividad de plantas de pimiento morrón var. California Wonder en invernadero.
| Tratamientos | Altura (cm) |
Diámetro de tallo (mm) |
Longitud radical (cm) |
Volumen radical (cm3) |
Biomasa fresca (g) |
Biomasa seca (g) |
Rendimiento de fruto (g) |
Sólidos solubles °Brix (%) |
| Cepa FA-8mc* | 116.25 ab | 13.16 ab | 38.75 ab | 102.38 ab | 340 ab | 100.75 ab | 363.35 ab | 8.6 bc |
| Cepa FA-56mc | 123.63 a | 13.99 a | 40.85 ab | 107.13 a | 334.13 ab | 113.5 a | 427.5 a | 9 a |
| Cepa FA-60mc | 112.13 ab | 12.64 ab | 44.25 a | 90.75 abc | 314.5 ab | 99.88 ab | 318.88 b | 8.5 cd |
| MIXmc † | 96.88 b | 14.08 a | 40 ab | 87.5 bc | 302.55 bc | 90.4 ab | 381.75 ab | 8.5 cd |
| Cepa FA-8cl ‡ | 112.63 ab | 13.58 ab | 37 ab | 88.5 bc | 280.5 cd | 74.5 bc | 309.68 b | 8.5 cd |
| Cepa FA-56cl | 104.38 ab | 12.25 ab | 41.88 ab | 96 abc | 288.75 cd | 80.8 bc | 336.63 ab | 9 a |
| Cepa FA-60cl | 110.88 ab | 13.42 ab | 38.13 ab | 89.75 bc | 343.35 a | 106 ab | 321.35 b | 8.6 bc |
| MIXcl | 99 ab | 12.32 ab | 35.88 ab | 84.63 cd | 259 d | 64.5 c | 326.8 ab | 8.5 cd |
| Testigo | 94 b | 10.84 b | 33.38 b | 74.5 d | 263.7 d | 66.35 c | 294.63 b | 8 d |
*= microcápsulas de alginato (mc); †= MIX= mezcla de las tres cepas rizobacterianas de P. putida; ‡= cultivo bacteriano líquido (cl). Valores promedio dentro de la misma columna con letras diferentes muestran diferencias significativas con la prueba de Duncan (p< 0.05).
En contraste, para la variable biomasa fresca de planta el tratamiento que mostró la mejor respuesta respecto al testigo fue la cepa FA-60cl en forma líquida, obteniendo un aumento significativo del 30.2% (p˂ 0.05). Respecto al contenido porcentual de solidos solubles totales (°Brix) en frutos maduros de pimiento morrón, se muestran diferencias significativas (p˂ 0.05) entre tratamientos, destacando la cepa FA-56 aplicada mediante microcápsulas de alginato y cultivo líquido con incrementos de 12.5% en ambos casos en relación a los frutos de plantas testigo.
El aprovechamiento de cepas rizobacterianas de diversos géneros como Pseudomonas, Bacillus, Azospirillum, Serratia, entre otros, han sido ampliamente estudiadas, particularmente por su cualidad para promover el crecimiento vegetativo y productividad en los cultivos de chile (Gupta et al., 2015), tomate (Agrawal y Agrawal, 2013), arroz (García et al. 2010), soya (Husen et al., 2011), maíz (Hungria et al., 2010) y papa (Arseneault et al., 2015).
Esta actividad estimuladora se relaciona con la capacidad de las rizobacterias para sintetizar reguladores del crecimiento vegetal como auxinas, giberelinas, citoquininas y vitaminas, metabolitos antagónicos como sideróforos y ácido cianhídrico, así como por su habilidad para facilitar la asimilación de nutrimentos mediante la solubilización de fósforo, fijación biológica de nitrógeno atmosférico y quelatización de iones (Aguado-Santacruz et al., 2012; Vacheron et al., 2013; Ahemad y Kibret, 2014; Bashan et al., 2014).
Al respecto Sivakumar et al. (2014) al evaluar el efecto de Bacillus megaterium mediante microcápsulas de alginato suplementadas con ácidos húmicos en plantas de arroz, indican haber obtenido diferencias en germinación de semillas, longitud de raíz y altura de tallo en relación a las plantas testigo, también mencionan que el crecimiento de las plantas de arroz fue estimulado por la actividad metabólica de la cepa de B. megaterium; sin embargo, el suplemento de los ácidos húmicos en las microcápsulas proporcionó estabilidad química y una fuente nutricional orgánica de C y N, que mantuvo un mayor número de células bacterianas vivas. Para Ahirwar et al. (2015) la inoculación de la cepa SS5 de Pseudomonas fluorescens en plantas de tomate mostró incrementos significativos en longitud radical, altura de planta y rendimiento de fruto, indicando que las plantas inoculadas con la cepa SS5 en maceta y campo superaron a las plantas testigo en 19 y 57% el rendimiento, respectivamente.
Por su parte, Abo-Kora et al. (2016) inocularon plantas de tomate con microcápsulas de alginato y suspensión bacteriana a base de Pseudomonas fluorescens, Azotobacter chroorcoccum, Bacillus polymyxa y Azospirillum brasilense, encontrando efectos favorables en el crecimiento de las plantas con ambas formas de inoculación de las cepas rizobacterianas, sobresaliendo las microcápsulas de P. fluorescens y A. brasilense. Al respecto Schoebitz et al. (2013) al inocular plantas de trigo con microcápsulas de alginato de sodio y almidón de papa combinado con alginato de sodio, ambas combinaciones con cepas de Pseudomonas fluorescens y Serratia sp., encontraron que estas promueven de forma significativa la altura de planta, biomasa seca y contenido foliar de P, atribuyendo que los encapsulados mejoran el efecto de las rizobacterias al actuar como minireactores que confieren a las células bacterianas estabilización, protección, incremento poblacional y liberación progresiva entorno a la rizósfera de las plantas donde se aplican.
En plantas de lechuga Rekha et al. (2007) aplicaron microcápsulas de alginato de sodio y suspensión líquida conteniendo las rizobacterias de las especies P. putida CC-FR2-4 y B. subtilis CC-pg104, en ambas formas de inoculación las plantas tratadas con las cepas mostraron incrementos significativos en longitud radical y altura de tallo con relación a las plantas testigo, concluyen que la inoculación de las plantas de lechuga con P. putida y B. subtilis por medio de encapsulados de alginato se promueve el crecimiento vegetativo de forma similar a la suspensión líquida, por lo cual la técnica de encapsulación de rizobacterias podría ser factible para su aprovechamiento en la industria agrícola de los biofertilizantes.
En cuanto al contenido de solidos totales solubles °Brix, algunos reportes atribuyen su aumento en frutos procedentes de plantas biofertilizadas debido a la capacidad de las rizobacterias para facilitar la asimilación de nutrimentos esenciales y la estimulación por medio de reguladores del crecimiento, tales actividades metabólicas propiciadas directamente por acción de las rizobacterias inducen la producción de etileno (Gamalero y Glick, 2015), el cual promueve la síntesis de enzimas reductoras de azúcares presentes en la pared celular del fruto, generando azúcares simples que incrementan la concentración de sólidos solubles totales (°Brix) en los frutos durante el proceso de maduración (Ordookhani y Zare, 2011; Vázquez-Ovando et al., 2012).
La presencia de poblaciones rizobacterianas (UFC) cuantificadas en raíces de plantas de pimiento morrón, inoculadas con microcápsulas de alginato y cultivo líquido con las cepas de P. putida mostraron diferencias significativas (p˂ 0.05) entre los tratamientos (Figura 1). Para las microcápsulas se tuvo la mayor población de UFC (108 g-1 de tejido fresco de raíz) en las tres cepas de forma individual y combinada, destacando la población obtenida de la cepa FA-56 con 590 UFC (108 g-1). Esta misma cepa también destacó en la condición de cultivo bacteriano líquido al obtener el mayor número poblacional con 492 UFC (108 g-1). Investigaciones realizadas en torno al aprovechamiento de rizobacterias, indican que la taza poblacional de células bacterianas presentes en la rizósfera de las plantas depende de los compuestos orgánicos producidos por los exudados radicales de estas, entre los que se encuentran aminoácidos, ácidos orgánicos, fenoles, fitohormonas (auxinas, giberelinas y citoquininas), azúcares, vitaminas y enzimas (Berg, 2009; Adhikari et al., 2013; Bashan et al., 2014).
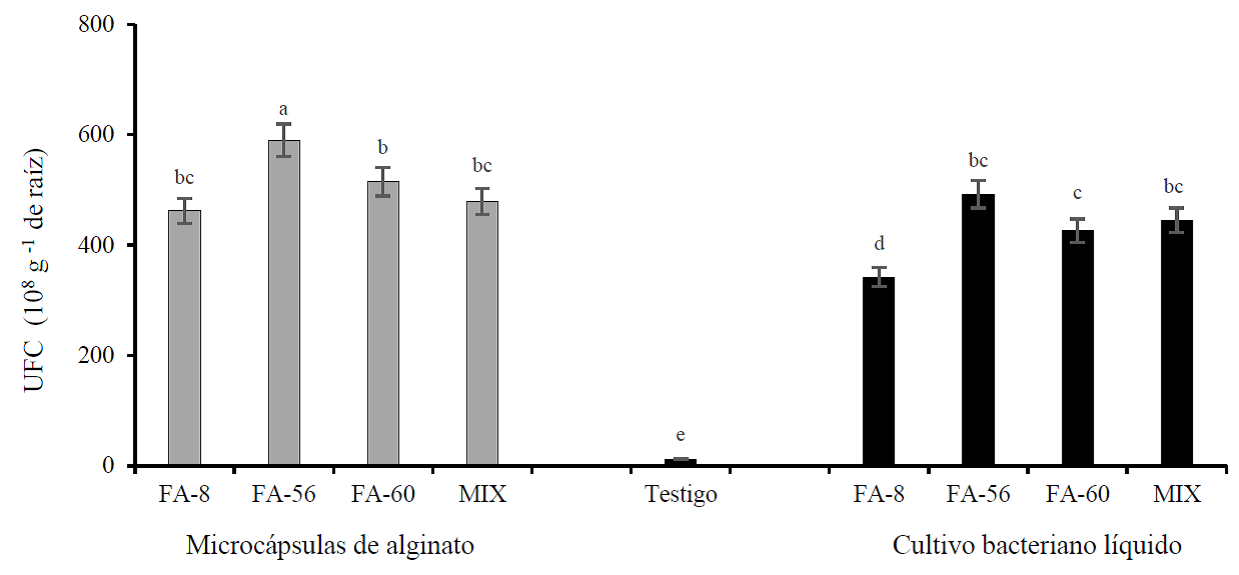
Figura 1 Unidades formadoras de colonias (UFC) cuantificadas en raíz de plantas de pimiento morrón var. California Wonder, inoculadas con microcápsulas de alginato y cultivo líquido a base de P. putida cepas FA-8, FA-56, FA-60, MIX (mezcla de las tres cepas) y control (plantas sin rizobacteria sólo fertilización inorgánica) a los 100 días después del transplante en invernadero. Letras distintas sobre las barras muestran diferencias significativas de acuerdo a la prueba de rango múltiple de Duncan (p˂ 0.05).
La cantidad y calidad de los exudados radicales promueve en las rizobacterias la competencia por estos metabolitos, así como por el sitio que ocupan sobre la raíz de la planta, siendo las uniones entre las células epidérmicas y el área donde emerge la raíz los sitios con mayor atracción, adhesión, actividad y población microbiana (Lugtenberg y Kamilova, 2009; Vacheron et al., 2013).
Conclusiones
La respuesta de las plantas de pimiento morrón inoculadas con la cepa FA-56 en forma de microcápsulas mostró los mayores incrementos de altura, volumen radical, biomasa seca, rendimiento y contenido de solidos solubles de fruto. La misma cepa encapsulada y en suspensión líquida tuvo la mayor población rizobacteriana en raíz (UFC).
Las poblaciones de UFC determinadas en los tratamientos con microcápsulas indican la posibilidad de que la aplicación de rizobacterias P. putida mediante la técnica de microencapsulación facilita la liberación paulatina de las células, mejorando su adhesión y colonización en las raíces, induciendo mejor efecto como agentes promotores del crecimiento vegetal, lo que puede ser una alternativa viable como biofertilizante para el cultivo de pimiento morrón y su producción sostenible.
Se requieren realizar más estudios para corroborar el potencial de las cepas de P. putida microencápsuladas para su aprovechamiento como agentes estimuladores del crecimiento y productividad de plantas de pimiento morrón.











 texto en
texto en 


