Introducción
El frijol caupí Vigna unguiculata (L.) Walp. Subsp. unguiculata es una leguminosa que se produce en las regiones tropicales y subtropicales, los seres humanos pueden consumir las hojas, raíces, granos y vainas inmaduras (Lim, 2012) además, constituye una fuente de proteínas, fibra dietética, carbohidratos, vitaminas, nutrimentos esenciales y fitoquímicos en la dieta humana (Awika y Duodu, 2017). El contenido de zinc (Zn) en la semilla con frecuencia es bajo (7.3 mg kg-1, Espinosa-Moreno et al., 2013), en especial al ser producida en suelos con deficiencias de microelementos (Alloway, 2008). Sin embargo, se han reportado valores 43 mg kg-1 hasta 65 mg kg-1 de Zn en frijol caupí biofortificado con hierro (Márquez-Quiroz et al., 2015). Por otra parte, el consumo per cápita a nivel mundial es de 3.89 kg año-1, en tanto que en México es de 1.89 kg año-1 (FAOSTAT, 2017).
El Zn es un componente esencial de diversas deshidrogenasas, proteasas y peptidasas (Fageria y Baligar, 2005). En este sentido, la deficiencia de este microelemento constituye un problema de salud pública (Pereira et al., 2014). Para corregirla se han implementado estrategias para incrementar el contenido de Zn en las legumbres (Praharaj et al., 2016). En este sentido, la biofortificación del cultivo con fertilizantes de Zn ha incrementado 74.6% el contenido de este elemento en leguminosas, ha incrementado la capacidad antioxidante del grano 60% (Sida-Arreola et al., 2017), y ha reducido el contenido de antinutrientes (Sharma et al., 2017); asimismo, se ha observado que al incrementar la dosis de Zn2+, el contenido de P tiende a disminuir (Cakmak et al., 2010). En las semillas de diversos cultivos, la mayor parte del Zn se encuentra asociado con proteínas, péptidos (Persson et al., 2016), enzimas (Broadley et al., 2007) y ácido fítico (Broadley et al., 2012).
Diversos estudios han demostrado que la biofortificación con fertilizantes de zinc incrementó el contenido del microelemento en papa Solanum tuberosum (L.) (White et al., 2017), arroz Oryza sativa (L.) (Tuyogon et al., 2016), trigo Triticum aestivum (L.) (Cakmak, 2008; Zhao et al., 2014), maíz Zea mays (L.) (Potarzycki et al., 2015), cebolla Allium cepa (L.) (Almendros et al., 2015; Manna y Maity, 2016), frijol común Phaseolus vulgaris (L.) (Ram et al., 2016) y cártamo Carthamus tinctorius (L.) (Movahhedy-Dehnavy et al., 2009). En general, existe escasa literatura sobre la biofortificación de leguminosas del género Vigna y los resultados obtenidos de otros trabajos se enfocan principalmente a la producción de cereales biofortificadas, por lo que el objetivo del presente trabajo de investigación fue estudiar el efecto de la biofortificación con Zn2+ sobre el contenido mineral y rendimiento de frijol caupí.
Materiales y métodos
Ciclos de producción
El trabajo fue realizado en la División Académica de Ciencias Agropecuarias de la Universidad Juárez Autónoma de Tabasco, geolocalizada a 17° 47’ latitud norte, 92° 57’ longitud oeste y a 29 msnm. Se utilizó la variedad de frijol caupí “De Castilla”, de hábito de crecimiento indeterminado.
Ciclo de producción otoño-invierno 2013 y primavera-verano 2014
Las semillas se sembraron en macetas de polietileno de color negro de 25 cm x 30 cm, utilizando como sustrato inerte tepetzil. Durante el ciclo otoño-invierno la temperatura promedio fue de 30 °C, con humedad relativa de 86 a 94%, en tanto que el ciclo primavera-verano se registró una temperatura promedio de 37 °C, con humedad relativa de 80 a 94%.
En ambos ciclos de producción, las macetas se establecieron en un sistema protegido tipo Megavent tropical de 200 m2, con cubierta lateral de malla antiáfidos y malla Grown Cover en el suelo. Las plantas se acomodaron en doble hilera, con una separación de 30 cm entre plantas y 90 cm entre hileras, para una densidad de siembra de 44 444 plantas por hectárea. Las plantas se guiaron de manera vertical con hilo rafia, y el manejo fitosanitario se realizó con aplicaciones de Karate® (lambda cyalotrina) y Sulfacob 25® (sulfato de cobre pentahidratado).
Fertilización y tratamientos
A la planta de cada maceta se le aplicó riego con solución nutritiva (Hoagland y Arnon, 1950), que contenía 14 mM de NO3 -, 1 mM de H2PO4 -, 2 mM de SO4 2-, 6 mM de K+, 4 mM de Ca2+ y 2 mM de Mg2+. Los microelementos de la solución nutritiva se suministraron con el producto TradeCorp AZ®. La solución nutritiva se adaptó según las etapas de desarrollo del cultivo al 50 y 100%, a los 10-30, 31-100 días después de la siembra (DDS), respectivamente, el pH de la solución se mantuvo entre 5.5 y 6, utilizando ácido sulfúrico. A los diez DDS se aplicó 0.25 L de solución por maceta día-1, a los 31 DDS se aumentó a 0.5 L día-1 y se llegó a aplicar 1 L día-1, después de 61 DDS.
Los tratamientos consistieron en la adición de Zn+2 en forma de sulfato de zinc (ZnSO4·7H2O, grado reactivo, 21% de Zn; 0 µM L-1, 25 µM L-1, 50 µM L-1 y 100 µM L-1) y como quelato de zinc (Zn-EDTA, TradeCorp Zn®, 14 % de Zn, 0 µM L-1, 25 µM L-1, 50 µM L-1 y 100 µM L-1) (Cuadro 1). Ambos compuestos se disolvieron en agua destilada, y se aplicaron desde el día 31 hasta el día 100 DS, cada tercer día. El total de tratamientos fue de ocho por cada ciclo de producción, con cuatro repeticiones. Se utilizó un diseño completamente al azar.
Variables evaluadas
Las variables evaluadas fueron: contenido mineral y rendimiento del frijol caupí obtenido. La cosecha de las vainas inició a los 70 DDS y finalizó a los 100 DDS. Las vainas cosechadas se colocaron en bolsas de papel de estraza etiquetadas, para posteriormente ser pesadas. Por otra parte, el contenido de nitrógeno (N) en la semilla se determinó con el método Dumas (1831), la proteína cruda total se calculó multiplicando el contenido de N por el factor 6.25, el fósforo (P), potasio (K), hierro (Fe) y zinc (Zn) de la semilla se determinó por espectrometría de emisión óptica con plasma acoplado inductivamente (ICP-OES ICAP® 7200 Duo, Thermo Fisher Scientific), acorde con el procedimiento 984.27 (Horwitz, 2002) y previa digestión húmeda.
Análisis estadístico
Los datos obtenidos fueron sometidos a un análisis de varianza. Para la diferencia entre medias de los tratamientos se utilizó la prueba de contrastes ortogonales (p≤ 0.05) (SAS Institute, 2013).
Resultados y discusión
Contenido mineral del frijol biofortificado
Los resultados del contenido mineral del frijol caupí biofortificado con diferentes dosis de fertilizantes de zinc en los dos ciclos de producción, se muestran en la Figura 1.
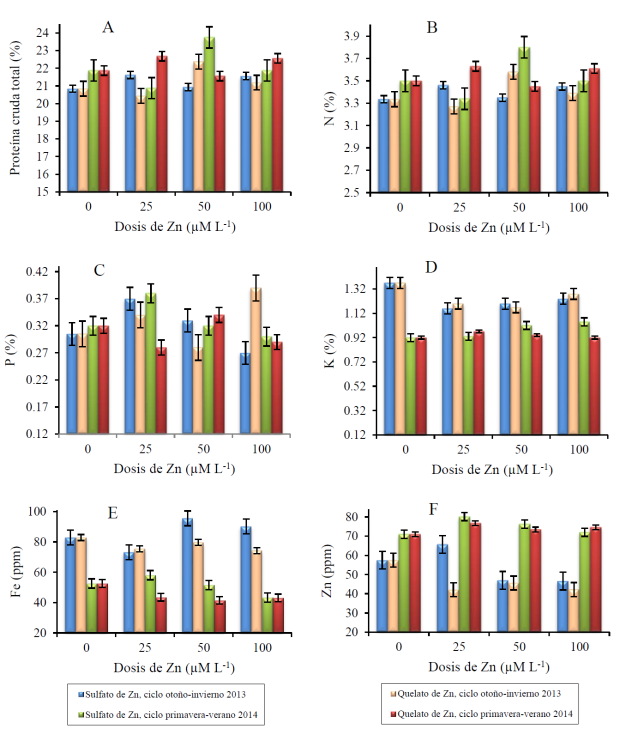
Figura 1 Contenido de proteína cruda total (A), nitrógeno (B) fósforo (C), potasio (D), hierro (E) y zinc (F) del frijol caupí biofortificado en dos ciclos de producción. Valores medios ± error estándar.
En el ciclo 1, la adición de 25 y 100 µM L-1 de ZnSO4, y 50 µM L-1 de Zn-EDTA incrementó el contenido de proteína cruda total y N en 3.7, 3.4 y 7.3%, respectivamente, en comparación con la adición de 0 µM L-1 del compuesto químico (Figura 1A y Figura 1B). En cambio, al adicionar 25 µM L-1 de Zn-EDTA, mermó el contenido de proteína cruda total y N en 1.9%, respectivamente, en comparación con la adición de 0 µM L-1 del compuesto químico. Por otra parte, la adición de 25 y 50 µM L-1 de ZnSO4, y 25 y 100 µM L-1 de Zn-EDTA se redujo el contenido de P en 21.3, 8.2, 11.5 7 27.9%, respectivamente, en comparación con la adición de 0 µM L-1 del compuesto químico (Figura 1C). El contenido de K se disminuyó 15.3, 12.4, 9.5, 12.4, 14.6 y 6.6% al adicionar 25, 50 y 100 µM L-1 de ZnSO4, y 25, 50 y 100 µM L-1 de Zn-EDTA, respectivamente (Figura 1D).
Al mismo tiempo, la aplicación de 25 µM L-1 de ZnSO4, y 25, 50 y 100 µM L-1 de Zn-EDTA decrementó el contenido de Fe en 11.8, 8.9, 3.9 y 10.4%, respectivamente, en comparación con la aplicación de 0 µM L-1 del compuesto químico (Figura 1E). De modo similar, la adición de 50 y 100 µM L-1 de ZnSO4 y 25, 50 y 100 µM L-1 de Zn-EDTA y un decremento en el contenido de Zn en 18.2, 18.9, 26.7, 20.6 y 26.5%, respectivamente, en comparación con la aplicación de 0 µM L-1 (Figura 1F).
En el ciclo 2, la adición de 25 µM L-1 de ZnSO4, y 50 µM L-1 de Zn-EDTA decremento el contenido de proteína cruda total y N en 4.6 y 1.4%, respectivamente, en comparación con la adición de 0 µM L-1 del compuesto químico (Figura 1A y Figura 1B). En cambio, al adicionar 50 µM L-1 de ZnSO4, y 25 y 100 µM L-1 de Zn-EDTA, descendió el contenido de proteína cruda total y N en 8.6, 3.7 y 3.1%, respectivamente, en comparación con la adición de 0 µM L-1 del compuesto químico. Por otra parte, la adición de 25 µM L-1 de ZnSO4 y 50 µM L-1 de Zn-EDTA incrementó el contenido de P en 18.88 y 6.3%, respectivamente, en comparación con la adición de 0 µM L-1 del compuesto químico (Figura 1C). No obstante, al adicionar 100 µM L-1 de ZnSO4 y 25 y 100 µM L-1 de Zn-EDTA se decremento el contenido de P en 6.3, 12.5 y 9.4%, respectivamente, en comparación con la aplicación de 0 µM L-1 del compuesto químico.
El contenido de K se incrementó en 1.1, 10.9, 14.1, 5.4 y 2.2% al adicionar 25, 50 y 100 µM L-1 de ZnSO4, y 25 y 50 M L-1 de Zn-EDTA, respectivamente (Figura 1D). Al mismo tiempo, la aplicación de 50 y 100 µM L-1 de ZnSO4 y 25, 50 y 100 µM L-1 de Zn-EDTA bajó el contenido de Fe en 1.9, 17.5, 17.3, 21.1 y 18.1%, respectivamente, en comparación con la aplicación de 0 µM L-1 del compuesto químico (Figura 1E). Sin embargo, la adición de 25, 50 y 100 µM L-1 de ZnSO4 y 25, 50 y 100 µM L-1 de Zn-EDTA incrementó el contenido de Zn en 13, 7.5, 1.4, 8.2, 3.5 y 5.1%, respectivamente, en comparación con la aplicación de 0 µM L-1 del compuesto químico (Figura 1F).
El valor obtenido en el contenido de proteína cruda total y N son similares a los reportados en la literatura, los cuales oscilan entre 16 y 30% y 2.5 y 4.8%, respectivamente (Carvalho et al., 2012). En el presente estudio, la concentración de macroelementos en la semilla contrastan con los resultados reportados por Espinosa-Moreno et al. (2013), quienes reportaron el contenido de proteína cruda total, N, P y K en la semilla de 21.9, 3.5, 0.35 y 1.52%, respectivamente. Por otra parte, el contenido de Fe y Zn mostró valores que son frecuentemente reportados en la literatura (Carvalho et al., 2012; Kalidass y Mohan, 2012). En consecuencia, el contenido de Zn en la semilla de frijol caupí biofortificado, no se considera como tóxico al no superar valores de 150 ppm de Zn (Mengel et al., 2001).
Aunado a lo anterior, el incremento en la dosis de Zn2+ no siempre va a permitir una mayor acumulación en la semilla, puesto que depende de la movilización que tenga el microelemento como ion libre o quelatado desde los tallos hacia la semilla (Olsen et al., 2016), lo que sugiere que la retranslocación, vía floema, de los microelementos depositados en los tallos tienen un papel importante en la acumulación de Fe y Zn en la semilla (Cakmak et al., 2010). En este sentido, las plantas de frijol caupí del presente experimento pudieron exhibir capacidades distintas para absorber y movilizar el nutrimento, debido a una menor o mayor tasa de transpiración durante los ciclos de producción (White, 2012).
De modo similar se ha reportado que la aplicación de dosis elevadas de Zn2+ interfiere en la absorción y translocación del P, calcio y Fe, además de provocar desórdenes citológicos en la planta (Cakmak, 2000; Khudsar et al., 2008). Asimismo, se ha reportado una disminución en el contenido de Fe en el grano de trigo (Shekari et al., 2015) y de proteína en la raíz en el frijol común al aplicar dosis elevadas de Zn2+ debido a un decremento en la actividad enzimática de la Nitrato Reductasa (Chaoui et al., 1997).
Rendimiento
En el ciclo 1, el peso de 100 semillas osciló entre 12. 1 y 20.5 g, lo cual es consistente con los datos reportados en la literatura (Giami, 2005). En el presente estudio, la aplicación de ZnSO4 tuvo un efecto negativo sobre el número de vainas por planta, número de semillas por planta y rendimiento de semilla por planta, con decrementos de hasta 37.4, 54.9 y 53.8%, respectivamente, en comparación con la adición de 0 µM L-1 de ZnSO4. Por otra parte, no todas las respuestas de las plantas fueron negativas, la adición 100 µM L-1 de Zn-EDTA incrementó el número de vainas por planta, el número de semillas por planta y el rendimiento por planta en 14.0, 20.3 y 17.2%, respectivamente, con respecto a la aplicación de 0 µM L-1 de Zn-EDTA.
En cambio, las plantas cultivadas con 50 µM L-1 de Zn-EDTA mostraron un incremento de 2.6 y 1.6% en el número de semillas por planta y rendimiento por planta, en comparación con la aplicación de 0 µM L-1 del compuesto químico (Cuadro 2). Como parte de la comparación, mediante contrastes ortogonales, entre los fertilizantes de Zn, se determinó que el uso de Zn-EDTA presentó diferencias significativas en las comparaciones del T3 versus T7, y T4 versus T8.
Cuadro 2 Componentes de rendimiento del frijol caupí biofortificado con zinc, ciclo agrícola otoño-invierno 2013.
| Tratamiento | Dosis (µM L-1) | Peso de 100 semillas (g) | Núm. vaina por planta | Núm. semillas por planta | Rendimiento de semilla (g planta-1) |
| T1) ZnSO4 | 0 | 13.2 | 9 | 144 | 16 |
| T2) ZnSO4 | 25 | 20.5 | 7 | 89 | 9.8 |
| T3) ZnSO4 | 50 | 16.2 | 6 | 65 | 7.4 |
| T4) ZnSO4 | 100 | 12.3 | 8 | 144 | 10.8 |
| T5) Zn-EDTA | 0 | 12.4 | 9 | 118 | 12.8 |
| T6) Zn-EDTA | 25 | 12.1 | 7 | 91 | 10.2 |
| T7) Zn-EDTA | 50 | 13.1 | 9 | 121 | 13 |
| T8) Zn-EDTA | 100 | 13.8 | 10 | 142 | 15 |
| Contrastes ortogonales (valores de p) | |||||
| T1 vs T2 + T3 + T4 | 0.3815 | 0.9607 | 0.9607 | 0.9216 | |
| T2 vs T3 + T4 | 0.0743 | 0.0162 | 0.0001 | 0.0001 | |
| T2 vs T6 | 0.0001 | 0.9165 | 0.0425 | 0.6309 | |
| T3 vs T7 | 0.0016 | 0.0027 | 0.0001 | 0.0001 | |
| T4 vs T8 | 0.0848 | 0.0677 | 0.1057 | 0.0001 | |
| T5 vs T6 + T7 + T8 | 0.0002 | 0.0076 | 0.0001 | 0.0001 | |
| T6 vs T7 + T8 | 0.0001 | 0.6273 | 0.0001 | 0.3369 | |
En el ciclo 2, la biofortificación con ZnSO4 y Zn-EDTA tuvo un efecto positivo sobre las variables número de vainas por planta, número de semillas por planta y rendimiento por planta. En este sentido, la adición de 25, 50 y 100 µM L-1 de ZnSO4 ocasionó un incremento en el número de vainas de 25, 5 y 21.6%, respectivamente, en el número de semillas por planta de 31.3, 35.3 y 58.4%, respectivamente, y en el rendimiento de 7.2, 16.7 y 33.3%, respectivamente, en comparación con la adición de 0 mM L-1 del compuesto químico (Cuadro 3). De modo similar, se registró un incremento el número de vainas de 28.3, 35.9 y 32.9%, al adicionar 25, 50 y 100 µM L-1 de Zn-EDTA, respectivamente, en comparación con la adición de 0 mM L-1 del compuesto químico.
Cuadro 3 Componentes de rendimiento del frijol caupí biofortificado con zinc, ciclo agrícola primavera-verano 2014.
| Tratamiento | Dosis (µM L-1) | Peso de 100 semillas (g) | Núm. vaina por planta | Núm. semillas por planta | Rendimiento de semilla (g planta-1) |
| T1) ZnSO4 | 0 | 13.4 | 6 | 62 | 9.6 |
| T2) ZnSO4 | 25 | 11.7 | 8 | 81 | 10.3 |
| T3) ZnSO4 | 50 | 13.5 | 6 | 84 | 11.2 |
| T4) ZnSO4 | 100 | 13.1 | 7 | 98 | 12.8 |
| T5) Zn-EDTA | 0 | 13.4 | 5 | 54 | 8.3 |
| T6) Zn-EDTA | 25 | 13 | 7 | 88 | 11.4 |
| T7) Zn-EDTA | 50 | 13.4 | 7 | 88 | 11.9 |
| T8) Zn-EDTA | 100 | 12 | 7 | 82 | 9.9 |
| Contrastes ortogonales (valores de p) | |||||
| T1 vs T2 + T3 + T4 | 0.3467 | 0.0346 | 0.0159 | 0.1602 | |
| T2 vs T3 + T4 | 0.6538 | 0.8408 | 0.7866 | 0.8332 | |
| T2 vs T6 | 0.0976 | 0.4897 | 0.6243 | 0.6543 | |
| T3 vs T7 | 0.8967 | 0.4897 | 0.7717 | 0.7472 | |
| T4 vs T8 | 0.1660 | 0.4897 | 0.3018 | 0.2326 | |
| T5 vs T6 + T7 + T8 | 0.3132 | 0.1025 | 0.048 | 0.3545 | |
| T6 vs T7 + T8 | 0.0242 | 0.5489 | 0.4658 | 0.4134 | |
Más aún, el número de semillas por planta y rendimiento por planta se incrementó en 65.1, 63.9 y 53.1% y 37.4, 43.4 y 19.3%, respectivamente, al adicionar 25, 50 y 100 µM L-1 de Zn-EDTA, en comparación con la adición de 0 mM L-1 del compuesto químico. Como parte de la comparación, mediante contrastes ortogonales, entre los fertilizantes de Zn, se determinó que el uso de ZnSO4 y Zn-EDTA no presentó diferencias significativas en las comparaciones del T2 versus T6, T3 versus T7, y T4 versus T8.
El rendimiento obtenido en el presente estudio es mayor a los 7 g de semilla por planta reportados por Apáez-Barrios et al. (2011), pero inferior a los 13 g de semilla por planta obtenido por los productores de frijol caupí del estado (SIAP, 2013). Al respecto, Cakmak et al. (2010), reportaron que la adición de ZnSO4 vía fertirriego incrementó significativamente el rendimiento y contenido de Zn en el grano de trigo; sin embargo, recomiendan que se combine la aplicación foliar con la aplicación vía fertirriego para incrementar 200% estas variables. Al respecto, Prasad et al. (2014), reportan un incremento de 69% en el contenido de Zn del arroz al realizar aplicaciones foliares en vez de la aplicación al suelo. Asimismo, Das y Green (2016), reportaron que la aplicación de Zn2+ mejoró el rendimiento y calidad nutracéutica de la papa.
Conclusiones
Las aplicaciones de 25 µM L-1 de ZnSO4 y 50 µM L-1 de Zn-EDTA para ambos ciclos de producción fueron las más efectivas en aumentar el contenido de este elemento en la semilla de frijol caupí, determinándose 1.14 y 0.93 veces más zinc, respectivamente, en comparación con el testigo. El rendimiento, en el ciclo 1, se redujo 53.8 y 20.3% al aplicar 50 µM L-1 de ZnSO4 y 25 µM L-1 de Zn-EDTA, respectivamente. La adición de 50 µM L-1 de ZnSO4 y 25 µM L-1 de Zn-EDTA, en el ciclo 2, incrementó el rendimiento en 16.7 y 37.3%, respectivamente, en comparación con el testigo. Considerando el conjunto de respuestas, los mejores tratamientos para biofortificar el frijol caupí con Zn2+ fueron 25 µM L-1 de ZnSO4 y 50 µM L-1 de Zn-EDTA para ambos ciclos de producción.











 texto en
texto en 


