La principal estrategia utilizada contra hongos que parasitan plantas cultivadas es el control químico; sin embargo, el uso indiscriminado de fungicidas convencionales contribuye en la contaminación ambiental, afecta la salud pública y disminuye la biodiversidad en los agroecosistemas (Zavaleta-Mejía, 1999) además, los actuales mercados de transacción de alimentos demandan productos agrícolas inocuos para los consumidores y provenientes de procesos nobles con el ambiente. Así, surge el interés por alternativas diferentes al control químico, una de ellas es el empleo de sales con la finalidad de conservar la sanidad en las plantas (Homma et al., 1981).
Al respecto, los fosfitos son sales derivadas del ácido fosforoso, aprovechados en la agricultura como fuentes de nutrición o como alternativa para el control de enfermedades en los cultivos (Deliopoulos et al., 2010). Los fosfitos como alternativa para el control de organismos parásitos han sido estudiados ampliamente y su eficacia se ha probado contra oomycetes (Monsalve et al., 2012; Pinto et al., 2012; Akinsanmi y Dreth, 2013), hongos (Amiri y Bompeix, 2011; Costa et al., 2014; Yáñez et al., 2014), bacterias (Lobato et al., 2011; Monchiero et al., 2015) y nematodos fitoparásitos (Oka et al., 2007; Quintero y Castaño, 2012).
Los mecanismos involucrados en los efectos profilácticos de los fosfitos son diversos y se incluye la estimulación de los mecanismos de defensa en las plantas (Pilbeam et al., 2011; Lim et al., 2013) y acción directa sobre los fitoparásitos al restringir el crecimiento y producción de esporas (Cerioni et al., 2013); sin embargo, existe diferencia interespecífica (Hofgaard et al., 2010) e intraespecífica (Wilkinson et al., 2001) en la susceptibilidad al ion fosfito, por todo lo anterior, el objetivo de esta investigación fue determinar el efecto in vitro de fosfito de potasio sobre el crecimiento radial del micelio, producción de biomasa, producción de esclerocios de Athelia rolfsii y de oosporas de Pythium aphanidermatum.
Durante el periodo comprendido de octubre de 2016 a febrero de 2017 y mediante bioensayos establecidos en condiciones de laboratorio, con diseño experimental completamente al azar y diez repeticiones (una caja Petri por repetición), se evaluó el efecto in vitro de fosfito de potasio (FP) sobre el crecimiento radial (CR), producción de biomasa (PBM), producción de esclorocios en Athelia rolfsii y producción de oosporas en Pythium aphanidermatum (organismos obtenidos de la colección de hongos del laboratorio de hongos fitopatógenos de la Facultad de Agronomía de la Universidad Autónoma de Sinaloa). De manera individual se adicionaron diferentes dosis de FP: 0.05, 0.1, 0.15, 0.2, 0.25 y 0.3 mL L-1 (Fosfimax 40.05%, Adama) al medio de cultivo papa dextrosa agar (PDA, Bioxon) después del proceso de esterilización.
Cada mezcla de PDA más FP se vació por separado en cajas Petri (20 mL por caja). Un cilindro (0.5 cm de diámetro) con crecimiento de cada organismo se depositó por separado al centro de las cajas Petri y se mantuvieron en condiciones de laboratorio (28 ±1.8 °C). El CR se determinó 36 horas después de la siembra (hds) para P. aphanidermatum y a las 72 hds para A. rolfsii. El efecto sobre la PBM se determinó haciendo crecer los organismos por 96 h, después de ese tiempo se separó del medio de cultivo, se depositó en papel filtro (Whatman, 1100) y se secó en estufa (80 °C) hasta obtener peso constante. El efecto sobre la producción de oosporas de P. aphanidermatum se determinó agregando los diferentes volúmenes de FP a agua destilada; cada dilución se vertió en cajas Petri, después se depositaron cuatro cilindros de PDA de 0.5 cm de diámetro con crecimiento del patógeno. Se realizaron observaciones al microscopio compuesto para determinar la formación de oosporas a 24, 48 y 72 h después de haber depositado el patógeno en las cajas.
El efecto sobre la producción de esclerocios de A. rolfsii se determinó haciendo crecer el organismo en PDA más FP y 22 días después de la siembra (dds) se contó la cantidad de esclerocios producidos. Cada ensayo se realizó en dos ocasiones y con los datos obtenidos de las variables estudiadas se hicieron análisis de varianza y comparación múltiple de medias con la prueba de Tukey (p≤ 0.05) y análisis de regresión lineal simple.
Ninguna de las concentraciones probadas de FP evitó el crecimiento de P. aphanidermatum y A. rolfsii; sin embargo, restringió de manera significativa (p≤ 0.05) el CR y la PBM de ambos organismos (Cuadro 1). La susceptibilidad de los microorganismos al ion fosfito fue reportada por Wong et al. (2009), quienes determinaron el efecto negativo del fosfito y el positivo del fosfato sobre el crecimiento de Phytophthora cinnamomi, cuando creció en medio de cultivo enriquecido con sales que contenían cada ion de manera individual.
Cuadro 1 Efecto de fosfito de potasio sobre el crecimiento radial de micelio y la producción de biomasa de Pythium aphanidermatum y Athelia rolfsii.
| Tratamientos | Crecimiento radial de micelio (cm) | Producción de biomasa (mg) | ||||
|---|---|---|---|---|---|---|
| Fosfito de potasio (mL L-1) | Pythium aphanidermatum | Athelia rolfsii | Pythium aphanidermatum | Athelia rolfsii | ||
| 0 (testigo) | 8 a1 | 8 a | 77 a | 235 a | ||
| 0.05 | 4.58 b | 6.8 b | 64 b | 98 b | ||
| 0.1 | 3.37 c | 6.3 c | 51 c | 90 b | ||
| 0.15 | 2.79 d | 6.3 c | 52 c | 88 b | ||
| 0.2 | 2.54 e | 6.3 c | 50 c | 88 b | ||
| 0.25 | 2.33 f | 6.3 c | 41 d | 88 b | ||
| 0.3 | 1.86 g | 6.3 c | 36 d | 86 b | ||
1= medias con diferente literal en la misma columna son estadísticamente diferentes (p≤ 0.05), según la prueba de Tukey. Cada cifra representa el promedio de diez repeticiones.
Con FP el CR de P. aphanidermatum (36 hds) fue inferior al observado en el medio de cultivo testigo, en 42.8, 57.9, 65.1, 68.3, 70.9 y 76.8% con 0.05, 0.1, 0.15, 0.2, 0.25 y 0.3 mL L-1, respectivamente. La PBM se restringió significativamente (p≤ 0.05) por efecto del FP, de tal manera que en relación a la biomasa producida en el testigo (77 mg), ésta fue menor en 16.9, 33.8, 32.5, 25, 46.8 y 53.2% con las respectivas dosis anteriormente mencionadas. Además, no se observó formación de oosporas en presencia de FP (72 hds), en tanto que 24 hds se detectó abundante formación de oosporas en el testigo (sin FP).
A las 72 hds, el FP originó decremento significativo (p≤ 0.05) en el CR de A. rolfsii. La disminución fluctuó entre 15 y 21.3%, en comparación con el CR del hongo en medio de cultivo sin FP. La PBM resultó significativamente restringida (p≤ 0.05) con FP, de tal manera que en relación a la biomasa producida en el testigo (235 mg), ésta fue menor en 98, 61.7, 62.6, 62.6, 62.6 y 63.4% con los respectivos 0.05, 0.1, 0.15, 0.2, 0.25 y 0.3 mL L-1 de FP. Además, con FP en el medio de cultivo no se observó formación de esclerocios maduros (22 dds); sin embargo, en el medio de cultivo PDA sin FP, A. rolfssi formó 30.2 esclerocios en promedio.
Los resultados obtenidos en esta investigación, en relación a la susceptibilidad interespecífica a FP, son semejantes a los descritos previamente por Hofgaard et al. (2010), quienes reportaron restricción de 60, 80 y 90% en el CR del micelio de Fusarium culmorum, F. graminearum y Microdochium majus, respectivamente. Asimismo, con los reportados por Lobato et al. (2010), ya que ellos reportaron que el grado de restricción del CR, como consecuencia del ion fosfito, lo determinó el organismo ensayado y la cantidad de fosfito agregado al medio de cultivo.
El análisis de regresión lineal simple entre las variables FP, CR y PBM en las dos especies de hongos indicó una relación negativa (Figura 1), de tal manera que las progresivas disminuciones del CR y PBM de P. aphanidermatum se explican en los respectivos 54.3 y 43.2% debido al efecto que ocasionaron los incrementos de las dosis de FP (Figura 1A y 1C). Mientras que para A. rolfsii se explican en 75.2 y 90.2%, respectivamente (Figura 1B y 1D). Estos resultados coinciden con Smillie et al. (1989), quienes determinaron que P. cinnamomi, P. palmivora y P. nicotiana son susceptibles a FP, explicando además que conforme se incrementó la concentración de fosfito en el medio de cultivo, disminuyó el peso de la biomasa producida por las tres especies de Phytophthora.
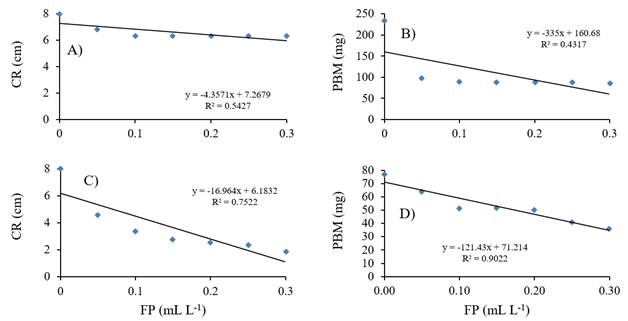
Figura 1 Asociación entre crecimiento radial de micelio (CR) y producción de biomasa (PBM) de Pythium aphanidermatum (A-B) o Athelia rolfsii (C-D) y concentración de fosfito de potasio (FP).
No obstante, que el crecimiento de P. aphanidermatum no fue inhibido por completo a las 24 hds, 0.05 mL L-1 de FP fueron suficientes para inhibir la formación de oosporas, en tanto que en el testigo se observó abundante formación de esas estructuras de reproducción. Estos resultados concuerdan con los reportados por Davis y Grant (1996) en cuanto a la producción de esporas en Fusarium oxysporum f sp. cubense; asimismo, con los publicados en relación a Mycosphaerella fijiensis (Mogollón y Castaño, 2012), Peronospora sparsa (Hukkanen et al., 2008), Phytophthora plurivora (Dalio et al., 2014) y P. cinnamomi (Wong et al., 2009). En la especie P. plurivora, Dalio et al. (2014) también registraron disminución significativa del CR del micelio y la producción de zoosporas cuando se le cultivó en medio de cultivo PDA enriquecido con el ion fosfito.
El FP también originó resultados de restricción en el CR, PBM y evitó la formación de esclerocios en A. rolfsii, los cuales también concuerdan con los reportados en Sclerotium cepivorum por Ortega et al. (2011), quienes agregaron bicarbonato de potasio en el medio de cultivo PDA y observaron que con 50 mM disminuyó significativamente el crecimiento del micelio y se evitó la formación de esclerocios.
De acuerdo con King et al. (2010), el FP agregado al medio de cultivo inhibe la expresión de genes relacionados con la síntesis de proteínas que constituyen la pared y el citoesqueleto de las células de P. cinnamomi, razón por la que la formación de micelio y estructuras reproductivas en los microorganismos se ven disminuidas cuando se hacen crecer en medios de cultivo mezclados con dicha sal.











 texto en
texto en 


