Introducción
La estevia (Stevia rebaudiana) es una planta utilizada como fuente de edulcorantes. De las más de 154 especies del género, S. rebaudiana es la única con propiedades edulcorantes gracias a la presencia de los glucósidos de esteviol (GsE) (Yadav et al., 2011; Herrera-Cedano et al., 2012). Se conocen al menos quince GsE, de los cuales el esteviósido y los rebaudiósido A (reb-A) y C (reb-C) son los más importantes; estos compuestos son hasta 300 veces más dulces que el azúcar, pero el esteviosido y el reb-A son amargos (Molina-Calle et al., 2017). La hoja de estevia también es consumida para reducir los niveles de glucosa en la sangre, proteger de daño renal y hepático y aumentar los niveles de insulina (Jeppesen et al., 2000; Momtazi-Borojeni et al., 2016). Además de los GsE, la estevia contiene compuestos fenólicos (CF) como flavonoides, antocianinas, taninos y ácidos fenólicos (Sytar et al., 2016; Molina-Calle et al., 2017).
Por otro lado, como el cuerpo humano genera especies reactivas (ER) de oxigeno (ROS) y nitrógeno (RNS), entre otras, se requiere un balance entre las ER y compuestos antioxidantes para asegurar una función fisiológica apropiada. Si las ER superan la capacidad del cuerpo humano para regularlas, se presenta el estrés oxidativo causando daños en lípidos, proteínas y ADN (Lobo et al., 2010). Para evitar estos daños es necesario contar y consumir fuentes externas con el mayor contenido posible de compuestos antioxidantes, como los CF (Tapas et al., 2008). Existen varios factores que permiten incrementar los metabolitos secundarios como la temperatura, la luz y el CO2. Otra estrategia es la aplicación de elicitores como el ácido jasmónico, el quitosano o los salicilatos los cuales inducen cambios fisiológicos en las plantas afectando su metabolismo y aumentando la síntesis de CF y otros metabolitos secundarios (Nieves-Baenas et al., 2014; García-Mier et al., 2015). Hao et al. (2015) usaron una mezcla de metil jasmonato y ácido salicílico (AS) para incrementar el contenido de tanshinona, un diterpeno activo presente en las raíces de Salvia miltiorrhiza, que es ampliamente utilizado en el tratamiento de enfermedades cardiovasculares. También fue reportado que la aplicación de AS incrementa la actividad anti-inflamatoria de Aloe vera por el incremento de antraquinonas (Lee et al., 2013).
Los elicitores reprograman la expresión de los genes relacionados con los metabolitos secundarios y se manifiestan como patrones diferenciales del nivel de compuestos químicos entre plantas elicitadas y no elicitadas (Lukens y Zhan, 2007; Chinnusamy y Zhu, 2009; Mejía-Teniente et al., 2013). Se puede medir la reprogramación de la expresión génica determinando el nivel epigenético; es decir, el nivel de metilación de la cromatina en la histona o en el ADN el cual puede o no ser hereditario (Eichten et al. 2014; Avramova, 2015). Se sabe que la metilación del ADN es la alteración epigenética más importante en eucariotas y consiste en la adición post síntesis de un grupo metilo en la posición 5’ del anillo pirimidínico de la citosina (5-mC) (Vanyushin y Ashapkin, 2011).
Según Razin y Cedar (1991) existe una relación inversa entre la metilación del ADN y la expresión de los genes, un genoma hipometilado expresará un mayor número de genes que uno hipermetilado. El objetivo del presente trabajo fue evaluar el efecto de la aplicación de elicitores sobre el nivel de la capacidad antioxidante, los GsE y CF, así como el nivel de metilación del ADN en estevia. Bajo nuestro conocimiento, esta es la primera vez que se aplican elicitores a plantas de estevia para evaluar su efecto sobre la metilación y la síntesis de metabolitos con actividad biológica.
Materiales y métodos
Plantas de estevia
El experimento se realizó en el invernadero de plantas medicinales del Campo Experimental Bajío y fue establecido el 5 de septiembre de 2017. Se sembraron 25 plantas de estevia en macetas individuales de un genotipo criollo de Paraguay. La fórmula de fertilización utilizada fue 40-30-10 y se complementó con aplicaciones foliares de Agro k-amino (3 g L-1). Para el control de plagas y enfermedades, se aplicaron productos a base de Neem, Ajo, soya, manzanilla, ruda y cobre (Ramírez-Jaramillo, 2011).
Aplicación de elicitores y material biológico
Se aplicaron dos elicitores comerciales: peróxido de hidrógeno (H2O2, 14 mM) y quitosano (670 µg mL-1) en la etapa vegetativa de las plantas. El quitosano se aplicó al suelo y el peróxido de hidrogeno a las hojas por aspersión. Los elicitores se aplicaron al tiempo 0 (inmediatamente después de cosechar hojas sin ningún tratamiento) y 15 días después. Se cosecharon hojas de cada una de las 25 plantas por separado, a los 7, 15 y 21 días después de la aplicación. La cosecha de hojas a los 15 días fue realizada antes de la segunda aplicación de los elicitores. Después de la cosecha, las hojas fueron congeladas a - 80 °C, liofilizadas y almacenadas a -20 °C hasta su análisis. Los análisis químicos se realizaron por planta de forma independiente (n= 25).
Determinación de los esteviosidos
El esteviosido y los reb-A y -C fueron determinados con cromatografía liquida de alta resolución y detector de diodos (HPLC-DAD) basándose en el método de (Giraldo et al., 2005). La identificación y cuantificación de los edulcorantes se determinó comparando el tiempo de retención y el espectro de los picos de la muestra con los picos de estándares comerciales (Sigma).
Ácidos fenólicos
Fueron determinados con un equipo HPLC-DAD de acuerdo con Ramamurthy et al. (1992). La identificación y cuantificación se realizó comparando los tiempos de retención y el espectro de absorción de los siguientes estándares comerciales (SIGMA, Ciudad de México): ácidos caféico, cinámico, clorogénico, elágico, ferúlico, gálico, 2-hidroxicinamico, p-hidroxibenzoico, protocateico y vanílico, así como la epicatequina, eriocitrina, catequina, hesperidina, kaemferol, miricetina, naringenina, naringina y quercetina.
Fenoles totales
La cuantificación de fenoles totales se llevó a cabo por la técnica propuesta por Singleton et al. (1999) con el reactivo de Folin-Ciocalteu. El contenido de fenoles totales se expresó como mg equivalentes de ácido gálico por 100 gramos de muestra seca (bs).
Flavonoides
El contenido de flavonoides se cuantificó según Dewanto et al. (2002) y se reportaron como mg equivalentes de rutina por 100 gramos de muestra seca (bs).
Antocianinas
Estos compuestos se determinaron de acuerdo a la técnica descrita por Lee et al. (2005) por diferencia de pH y se expresaron como mg equivalentes de cianidina 3-glucosido por 100 g de muestra seca.
Taninos
Los taninos condensados se cuantificaron de acuerdo a la metodología descrita por Deshpande y Cheryan (1985) y se reportaron como mg equivalentes de (+)-catequina por 100 g de muestra.
Análisis estadístico
Los resultados de todos los compuestos químicos se realizaron a través de una Anova multifactorial y un análisis de variables múltiples (n= 25) y una comparación de medias por el método de Tukey (0.05).
Obtención del ADN y análisis de metilación
De las 25 plantas bajo estudio, se formaron tres grupos al azar de ocho plantas cada uno. Se cosecharon hojas de los tres grupos de plantas, por separado, antes de aplicar los elicitores (tiempo 0) y a los 7 días después de la primera aplicación. No se cosecharon hojas a los 15 ó 21 días después de la aplicación de elicitores. Las hojas de cada grupo se mezclaron perfectamente por separado. El ADN de las seis muestras se obtuvo siguiendo el protocolo de extracción con CTAB (Doyle, 1987). La detección y cuantificación de los niveles de metilación del ADN se realizó con el paquete de reactivos 5-mC DNA ELISA kit (D5325 y D5326, Zymo Research Corp) que contiene un anticuerpo monoclonal específico para 5-mC. La lectura de la reacción se realizó una absorbancia de 405-450 nm en un espectrofotómetro (Thermo Scientific modelo Multiskan GO) y se cuantificó el 5-mC de acuerdo al protocolo del kit. A los datos se les realizó una prueba de Anova usando el programa GraphPad PRISM 6 para Windows 10. También se realizó una comparación múltiple de Dunett, con un nivel de significancia de 0.05%.
Resultados y discusión
Ácidos fenólicos
Se identificaron los ácidos clorogénico, caféico y ferúlico en las plantas de estevia no elicitadas (0 días) y elicitadas (Cuadro 1). Los ácidos clorogénico y ferúlico presentaron consistentemente las mayores concentraciones a los 21 días, observándose para el caso del ácido clorogénico un incremento de 16% a los siete y 15 días para luego presentar un nuevo aumento 22%, en comparación con el control (tiempo 0). Respecto al ácido ferúlico, este disminuyó en casi 1 µg a los siete días después de la elicitación. A los 15 días se detectó una recuperación en el contenido de este ácido y a los 21 días se presentó un crecimiento de 24% en comparación con las plantas sin elicitar (0 días). Con respecto al ácido caféico, las plantas mostraron una disminución 18% a los 21 días en comparación con las plantas no elicitadas (0 días). No se sabe si después de los 21 días, tanto el ácido colorgénico como el ferúlico continúan aumentando y el ácido caféico disminuyendo. Estos datos sugieren que, si se desea tener una mayor concentración de los ácidos clorogénico y ferúlico en la planta de estevia, se debe cosechar la hoja al menos a los 21 días después de las dos aplicaciones de los elicitores.
Cuadro 1 Contenido de ácidos fenólicos (µg g-1, bs) en estevia elicitada.
| Días& | Clorogénico | Caféico | Ferúlico |
|---|---|---|---|
| 0 | 3.91 ±0.18 c | 0.264 ±0.014 b | 4.72 ±0.09 b |
| 7 | 4.68 ±0.29 b | 0.305 ±0.023 a | 3.68 ±0.16 c |
| 15 | 4.59 ±0.27 b | 0.267 ±0.03 ab | 4.71 ±0.17 b |
| 21 | 5.03 ±0.28 a | 0.217 ±0.012 c | 6.23 ±0.13 a |
&= se cosechó hoja al día 0, sin elicitar (control) y a los 7, 15, 21 días después de la elicitación. La cosecha a los 15 días se realizó antes de la segunda aplicación de los elicitores. Promedios con letras similares no son estadísticamente diferentes (Tukey, 0.05).
Debido a la falta de reportes en la literatura sobre el efecto de la aplicación de elicitores en estevia, no es posible hacer una discusión comparativa de estos resultados. Sin embargo, reportes de la aplicación de jasmonato en chile morrón incrementa el contenido de compuestos fenólicos (García-Mier et al., 2015). Por otro lado, se sabe que cuando el ácido clorogénico y el ácido ferúlico están presentes en mayores concentraciones, son responsables de una alta capacidad antioxidante que redunda en la disminución de radicales libres dañinos (Kikuzaki et al., 2002; Lan, 2007; Jeszka-Skowron et al., 2016) y por lo tanto, se espera que la estevia elicitada contribuya en la prevención de diferentes enfermedades relacionadas con el estrés oxidativo (Yashin et al., 2017).
Compuestos fenólicos
En respuesta a la elicitación, la estevia incrementó el contenido de fenoles totales, flavonoides y taninos condensados 65%, 66% y 13%, respectivamente a los siete días después del tratamiento (Figura 1A, B y C). Sin embargo, a los 15 y los 21 días el contenido de fenoles totales y flavonoides no se incrementó, estadísticamente hablando; lo anterior a pesar de que el contenido de flavonoides a los 21 días, fue de 5393.1 mg 100 g-1, en comparación con los 4523.1 mg 100 g-1 que se detectaron a los siete días (Figura 1). Este comportamiento se puede explicar debido a la alta variabilidad en el contenido de este compuesto que se observó entre plantas (alta desviación estándar). Por el contrario, los taninos continuaron incrementándose a los 15 días, sin presentar diferencias estadísticas con el contenido a los siete días; sin embargo, a los 21 días posteriores a la aplicación de los elicitores, el contenido de taninos se había incrementado 25% si se compara con el contenido de las plantas, al inicio del experimento. Los datos aquí presentados sugieren que, si se desea tener un alto contenido de compuestos fenólicos, las hojas deben cosecharse a los 21 días después de la elicitación.
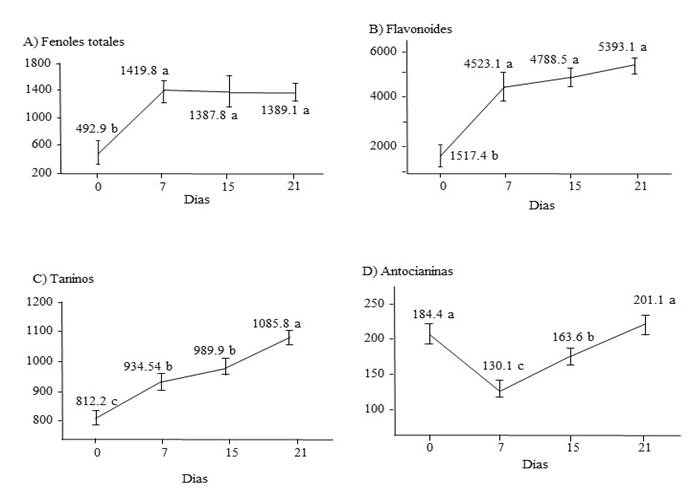
Figura 1 A) fenoles totales (mg EAG 100 g-1); B) flavonoides (mg EAG 100 g-1); C) taninos (mg EC 100 g-1); y D) antocianinas (EC3G 100 g-1) en estevia no elicitada (0 días) y a los 7, 15 y 21 días después de la elicitación. EAG= equivalentes de ácido gálico; EC= equivalentes de catequina; EC3G= equivalentes de cianidin 3-glicosido.
Reportes de aplicación de elicitores, como los utilizados en el presente trabajo, inducen estrés provocando que la planta genere una respuesta de defensa inmune que activa la expresión de diferentes genes de la expresión de metabolitos secundarios, incluidos los compuestos fenólicos (Jiménez-García et al., 2013). Por ejemplo, cuando se aplicó quitosano y peróxido de hidrogeno a plantas de chile morrón, el contenido de flavonoides se incrementó 37% (García-Mier et al., 2015), este resultado fue menor al aquí encontrado (66%) estos autores también reportaron 46% de incremento en el contenido de taninos condensados, mayor a 13% reportado en este trabajo. Las diferencias en los resultados de García-Mier et al. (2015) y los de este trabajo, se deben al metabolismo y respuesta genética de cada especie.
Con respecto al contenido de antocianinas, se observó un comportamiento diferencial; por ejemplo, a los siete días, el nivel de antocianinas disminuyó de 184 (tiempo 0) a 130.1 EC3G 100 g-1; posteriormente se presentó un incremento a 163.6 EC3G 100 g-1 a los 15 días a 201.1 EC3G 100 g-1 al final del experimento (Figura 1D). Sin embargo, el nivel de antocianinas detectado a los 21 días después de la aplicación, no fue estadísticamente diferente al encontrado en las plantas al tiempo 0 (antes de aplicar los elicitores). Aparentemente, el quitosano y el peróxido de hidrógeno no provocan ninguna respuesta que modifique la síntesis de antocianinas en la estevia.
Esteviosidos
En las plantas control (sin elicitación, 0 días), las proporciones detectadas del esteviosido y los reb-A y -C fueron de 5.29 mg g-1, 10.52 mg g-1 y 59.56 mg 100 g-1, respectivamente (Cuadro 2). Al aplicar los elicitores (siete y 15 días) las cantidades se elevaron significativamente en todos ellos en comparación con las plantas control; no obstante, a los 21 días de la aplicación, las diferencias entre las cantidades del esteviosido (49.49 mg g-1) y el reb-A 55.98 mg g-1) se acortaron, siendo únicamente 13%. En el caso del reb-C (198.61 mg g-1) este se potencializó detectándose una diferencia de 400% con respecto al esteviosido (Cuadro 2).
Cuadro 2 Contenido de compuestos edulcorantes (mg g-1, bs) en estevia elicitada.
| Días& | Esteviosido | Rebaudiosidos | |
|---|---|---|---|
| A | C | ||
| 0 | 5.29 ±2.31 c | 10.52 ±1.2 c | 59.56 ±2.07 d |
| 7 | 11.89 ±4.51 c | 15.15 ±3.02 b | 107.59 ±23.75 c |
| 15 | 27.17 ±3.86 b | 39.49 ±2.06 a | 145.35 ±10.87 b |
| 21 | 49.49 ±7.76 a | 55.98 ±2.71 a | 198.61 ±30.59 a |
&= se cosechó hoja al día 0, sin elicitar (control) y a los 7, 15, 21 días después de la elicitacion. La cosecha a los 15 días se realizó antes de la segunda aplicación de los elicitores. Promedios con letras similares no son estadísticamente diferentes (Tukey, 0.05).
Para el caso específico del esteviosido se detectó durante el experimento, un incremento significativo de casi 10 veces en comparación con las plantas no elicitadas (Cuadro 2). Los datos sugieren que muy probablemente el esteviosido continúe acumulándose después de los 21 días. Sin embargo, es necesario confirmar dicho comportamiento. Con respecto al reb-A, el contenido de este compuesto se incrementó 3.8 y 5.3 veces más a los 15 y 21 días después de la aplicación de los elicitores, respectivamente, si se compara con el tratamiento control (a los 0 días) (Cuadro 2). Por otro lado, el contenido del reb-C se duplicó a los siete días de la aplicación de los elicitores, comparado con el grupo control. A los 15 y 21 días se había incrementado casi dos y tres veces más que el grupo control (Cuadro 2).
Se ha reportado que el contenido de los GsE en la estevia es muy variable y que depende del genotipo y el ambiente de producción (Brandle y Telmer, 2007). La mezcla de esteviosidos en una muestra determinarán las características sensoriales del edulcorante. Se sabe que el esteviosido es 143 veces más dulce que la sacarosa, mientras que el reb-A es 242, pero que el sabor del reb-C es mejor por ser menos amargo que el esteviosido y el reb-A (Nicklasson et al., 2018). En este sentido, la baja concentración del esteviosido y del reb-A en comparación con el reb-C, sugieren que el lote de plantas aquí utilizadas producirá un edulcorante menos amargo y, en consecuencia, con un menor resabio característico de esta planta.
Por otro lado, Badran et al. (2015) demostró que la sequía, inducida con etilenglicol, en plantas de Stevia rebaudiana incrementa significativamente el contenido del esteviosido. Sin embargo, estos autores detectaron hasta 40 veces menos la concentración (12.6 mg g-1) que lo reportado en este trabajo ya que a los 21 días de tratamiento se detectaron 49.49 mg g-1 (Cuadro 2). Esta diferencia se puede explicar por el uso de elicitor y por el material vegetal utilizado. Estos autores no determinaron ningún rebaudiosido. Bayraktar et al. (2016) mediante la aplicación de elicitores en un modelo de cultivo in vitro de estevia, incrementaron los esteviosidos de 1.56 mg g-1 de peso seco a 14.69 mg g-1 peso seco.
Análisis de metilación
Este análisis se llevó a cabo una vez que se encontraron cambios estadísticamente significativos en la acumulación de GsE en las hojas de estevia a las que se les aplicaron los elicitores, en comparación con aquellas no elicitadas. Considerando que estos cambios en la concentración de GE reflejan cambios en el metabolismo de las plantas elicitadas y que este puede ser de origen epigenético, se midió el porcentaje de 5-mC presente en plantas elicitadas y las no elicitadas. Los resultados obtenidos indican diferencias estadísticamente significativas en %5-mC entre los tratamientos evaluados (Figura 2). En esta figura, se puede observar una tendencia clara de hipometilación en las plantas elicitadas en comparación de las plantas no elicitadas.
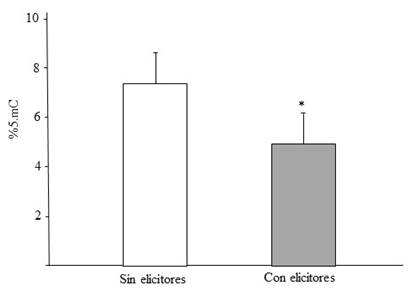
Figura 2 Porcentaje de 5-mC que presentan dos ADN genómicos de plantas de Stevia rebaudiana; SE= plantas de la variedad experimental del INIFAP sin aplicación de elicitores y CE= plantas de la variedad experimental del INIFAP con aplicación de elicitores; *= significativo al 0.05%.
Los niveles de %5-mC encontrado en este trabajo van desde 7.45% en plantas no elicitadas a 4.88% en las plantas elicitadas, valores que se consideran en los rangos bajos de metilación obtenidos en plantas, ya que los reportes de metilación hasta ahora publicados, van desde 6% a 14% dependiendo del método usado para su evaluación en Arabidopsis, hasta 25% en maíz (Kakutani et al., 1999; Papa et al., 2001; Capuano et al., 2014). Estas diferencias se pueden presentar si se considera que la metilación del ADN en las plantas es específica de especies, tejidos, organelos y edad, así como al efecto del elicitor y a la sensibilidad del método de medición usado (Vanyushin y Ashapkin, 2011).
El resultado más importante es la hipometilación de las plantas elicitadas con peróxido y quitosano, en comparación con las no elicitadas. Existen reportes de que la metilación del ADN puede ser alterada como respuesta a un estrés abiótico, provocando con esto una nueva regulación genética (Lukens y Zhan, 2007; Chinnusamy y Zhu, 2009), la cual se ve reflejada en cambios en los patrones de expresión provocados por un número diferente de genes que se están expresando y por lo tanto existiendo una relación inversa entre la metilación del ADN y la expresión de los genes, de modo que un genoma hipometilado comparativamente con otro hipermetilado tendrá una expresión de un número mayor de genes (Razin y Cedar, 1991). La consecuencia típica de la metilación en una región genómica es la represión de los genes cercanos, por lo tanto, un alto grado de metilación se asocia con el silenciamiento de genes (Bird, 2002). Los resultados de este trabajo sugieren una relación entre el estrés causado por la aplicación de elicitores y cambios epigenéticos en el genoma de la planta. La epigenética, es un área de oportunidad que puede ser utilizada para mejorar los sistemas actuales de producción.
Conclusiones
La aplicación de peróxido de hidrogeno y quitosano modifican los niveles de compuestos con actividad biológica presentes en estevia. La síntesis de esteviosidos y compuestos fenólicos difiere dentro de un mismo lote de plantas de estevia. Mientras que la aplicación de elicitores disminuye el contenido del esteviosido, pero incrementa los niveles de rebaudiosido A y de tres ácidos fenólicos evaluados (clorogénico, caféico y ferúlico). Es necesario, no suspender la aplicación de elicitores si se desea mantener el nivel alto del rebaudiosido A y muy probablemente de ácido ferúlico. La aplicación de elicitores parece ser una estrategia promisoria para incrementar metabolitos de interés para la salud humana. En las plantas de estevia a las que se aplicaron los elicitores, se detectó un incremento en la producción de GE y una disminución en la metilación del ADN. Al no existir factores que induzcan mutaciones en la secuencia del ADN, es muy probable que los cambios en el metabolismo sean debido a los cambios en la metilación del ADN.











 texto en
texto en 


