Introducción
La soya (Glycine max L.) Merr. también conocida como ‘frijol dorado’ o ‘frijol soya’ consiste en más de 40% de proteínas y 20% de aceite y por esta razón ha sido reconocida como una fuente potencial suplementaria de aceite comestible y alimento nutricional en todo el mundo. México importa prácticamente toda la soya que consume, desde el año 2000 a 2008, la producción anual promedio de soya fue de sólo 119 924 t, mientras que las importaciones fueron de 3 905 596 t (http://siap.sagarpa.gob.mx./ventana.php?idLiga=1592&tipo=0). En el estado de Sinaloa, la soya es una de las pocas alternativas de cultivo durante el verano (Martínez et al., 1998); por lo tanto, su reactivación está siendo reconsiderada. La mosca blanca (Bemisia tabaci Genn. Biotipo ‘B’) fue una de las principales causas de la reducción de las áreas de cultivo de soya en México, como resultado de daños directos en la producción de flores y rendimiento de la planta, así como de transmisión de geminivirus (Cortez et al., 2005).
Los geminivirus son un grupo diverso y ampliamente distribuido de patógenos de plantas que causan grandes pérdidas económicas en todo el mundo. Su genoma consiste en una o dos moléculas de ADN circular monocatenario con un tamaño de 2.5 a 3 Kb (Lazarowitz, 1992), conocido como ADN-A y ADN-B, que codifica todas las funciones de virus requeridas para la replicación del ADN, control de expresión génica, transmisión de insectos y movimiento en la planta (Hanley et al., 1999). Los ADN circulares monocatenarios del género Begomovirus, familia Geminiviridae, se encuentran entre los virus vegetales más importantes (Brown y Bird, 1992; Moriones y Navas, 2000). Este grupo de virus es conocido como uno de los factores económicos que limitan los cultivos en muchas partes del mundo, especialmente en regiones tropicales y subtropicales (Zerbini et al., 2005). Los Begomovirus solamente infectan especies de plantas dicotiledóneas y se transmiten exclusivamente por la mosca blanca Bemisia tabaci (Homoptera: Aleyrodidae) de forma no circulante (King et al., 2012; Briddon, 2015).
Estos virus son considerados virus de plantas emergentes, debido a su creciente incidencia y por la gravedad de las enfermedades que causan (Polston y Anderson, 1997). También se ha informado que estos virus infectan a nuevos huéspedes y se han extendido a más lugares geográficos (Mansoor et al., 2003; Varma y Malathi, 2003). La recombinación y la mutación pueden desempeñar un papel importante en el establecimiento y aparición de nuevas cepas/especies de begomovirus (Mansoor et al., 2006). Aunque sólo se ha descubierto un pequeño número de begomovirus monopartitos, se sabe que todas sus funciones esenciales están codificadas por un sólo componente en el ADN-A del genoma bipartito de begomovirus (Navot et al., 1991; Rojas et al., 2001).
Actualmente, el comité internacional de taxonomía de virus (ICTV) reconoce que cuatro géneros (mastrevirus, topocuvirus, curtovirus y begomovirus) pertenecen a la familia geminiviridae (Fauquet et al., 2008). Existen varios motivos por los cuales los géneros de begomovirus son el grupo más diversificado, incluyendo: alta distribución mundial, transmisión de mosca blanca, presencia de un genoma mono o bipartito y la capacidad de infectar plantas dicotiledóneas. Los componentes A y B de los begomovirus bipartitos comparten una región común, que oscila entre 160 y 230 pares de bases (pb), que contienen los elementos cis necesarios para la replicación viral (Argüello et al., 1994). El componente A produce las proteínas involucradas en la replicación y encapsidación del genoma viral (Gutiérrez et al., 2004), mientras que el componente B codifica dos proteínas que promueven el movimiento del virus a través de la planta (Gafni y Epel, 2002).
Actualmente, ICTV ha notado más de doscientas especies confirmadas y tentativas de los géneros Begomovirus (ICTV, King et al., 2012). Estos virus son transmitidos por insectos de la orden homóptera (moscas blancas y chicharritas) a una variedad de plantas mono y dicotiledóneas, produciendo síntomas tales como: mosaicos, motas, rayas, deformación de la hoja, enanismo, coloración amarillenta y clorosis. Desde un punto de vista económico, esto transforma al grupo de Begomovirus en uno de los grupos de patógenos de plantas más importantes, como resultado de su alta incidencia, distribución y severidad de los síntomas.
En México, este tipo de fitopatógeno ha causado una gran confusión sobre la etiología de diferentes enfermedades, que inicialmente se llamaron ‘relleno’, cuando se detectó su presencia en cultivos de tomate (Solanum lycopersicum L.) en el estado de Sinaloa (González y Cervantes, 1973). Aunado a ello, la infección por el virus se ha denominado ‘planta atigrada’ en Puebla (Garzón y Galindo, 1985) debido a los síntomas de amarillamiento causados en los cultivos de chile (Capsicum spp.).
Finalmente, en los cultivos de chile en el sur de Tamaulipas, se conoce como la enfermedad ‘amarilla rizada’ (Garzón et al., 1993). Se ha determinado que estas enfermedades son de etiología geminiviral y pueden ser causadas por el virus huasteco del chile (PHV) (Brown et al., 1989; Brown y Bird, 1992; Garzón et al., 1993; Torres et al., 1996, Garzón et al., 2002). Actualmente, se cree que el PHV está restringido a especies de la familia de las Solanáceas, especialmente los cultivos de tomate y chile. Recientemente, se detectó e identificó que el virus de la vena amarilla del chile huasteco (PHYVV) afecta al tomate (Lugo et al., 2011) y al chile en Culiacán, Sinaloa (Retes et al., 2016; Melendrez et al., 2016).
Materiales y métodos
Encuestas y colección de muestras
Durante el verano de 2013-2014, se evaluaron un total de 11 variedades de soya para la incidencia de enfermedades virales en campos experimentales operados por el Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP), en el Valle de Culiacán y el Valle del Fuerte, Sinaloa, México. La incidencia de la enfermedad en estas áreas varía de 25.2 a 39.8%. Las hojas recogidas se colocaron inmediatamente en bolsas de plástico y se transportaron al laboratorio y se mantuvieron a 4 °C. Para el almacenamiento a largo plazo, las muestras de hojas se secaron usando gel de sílice o un liofilizador y se almacenaron a -20 ºC. De estas, tres variedades (Cajeme, Nainari y Esperanza) mostraron distorsión de la hoja (Figura 1).
Extracción de ADN
El ADN total se extrajo de 0.05 g de tejido foliar seco utilizando el método previamente descrito (Velarde et al., 2015). El tejido se maceró en un mortero y pistilo de porcelana estéril y finalmente enfriados a -70 °C. Se añadieron tres mL de amortiguador de extracción que contenía: cloruro de sodio 30 mM (NaCl), ácido etilendinitrilo tetracético 30 mM (EDTA) (pH 8.5) y tris base 250 mM (pH 8.5). El producto de la maceración se colocó en tubos Eppendorf estériles de 1.5 mL. Posteriormente, se añadió un volumen de 100 (L de cetiltrimetilbromuro de amonio al 10% (CTAB) y se incubó a 95 °C durante 10 min.
Después se añadieron 250 μl de NaCl 5M y se incubaron a -20 ºC durante 5 min y luego se centrifugó. La solución acuosa fue añadida con un volumen de cloroformo absoluto frio (v/v) y se agitó con un equipo de vortex durante unos segundos, y posteriormente se centrifugó a 10 000 rpm durante 5 min, una vez transcurrido este tiempo, mediante pipeteo, la solución acuosa fue transferida a un tubo nuevo, agregándosele un volumen de isopropanol absoluto frio (v/v) y se homogenizó manualmente.
Posteriormente, las muestras fueron almacenadas en refrigeración a -20 °C durante una hora para permitir la precipitación del ADN. Ocurrido este tiempo, las muestras en tubos fueron centrifugadas a 13 000 rpm durante 10 min para obtener la pastilla de ADN, para ello se esperó 2 h para que el ADN se deshidratara y finalmente el ADN obtenido de los diferentes aislamientos se resuspendieron en 50 µL de agua libre de nucleasas (Promega) y almacenado a 4 ºC para su conservación.
Reacción en cadena de la polimerasa (PCR)
El ADN extraído de los tejidos se analizó mediante PCR utilizando los oligonucleótidos degenerados AV494 (directo; 5’- GCC(C/T)AT(G/A)TA(T/C)AG(A/G)AAGCC(A/C)AG-3’) y AC1048 (reverso; 5-‘GG(A/G)TT(A/G/T)GA(G/A)GCATG(T/A/C)GTACATG-3’ (Wyatt y Brown, 1996), correspondientes a los extremos 3’ y 5’ del gen de la proteína de la cápside (PC), respectivamente. El perfil cíclico consistió en 10 min de fusión a 95 °C, seguido de 30 ciclos de fusión, hibridación y polimerización de ADN de 1 min a 95 °C, 1 min a 55 °C y 1 min a 72 °C, respectivamente y una extensión final de 10 min a 72 °C. Se utilizó un termociclador (NyxTechnik Amplitronyx Series 6 A6 (ATC401). La mezcla de reacción final (15 μL) contenía 100 nanogramos de ADN, una mezcla equimolar de dATP, dCTP, dGTP y dTTP, cloruro de magnesio (25 mM), amortiguador de PCR (1X), ADN Taq polimerasa (5U) (Promega® PCR Master Mix, catálogo No. M7502) y 40 picomoles de cada oligonucleótido (Sigma®).
Los productos amplificados fueron analizados en geles de agarosa al 1%, teñidos con una solución de Gel Red (Biotium catálogo no. 41003), para ello 15 µL del ADN amplificado fueron depositados en cada pozo del gel, agregándosele 3 µL del colorante de azul de bromofenol 6X (Sambrook y Rusell, 2001) y como referencia los marcadores de peso molecular 1Kb HyperLadder e HyperLadder 1kb Plus (Bioline). La solución amortiguadora de corrida y preparación de los geles de agarosa fue NaOH-borato 1X (Brody y Scott, 2004). El tiempo de corrida fue de 30 min a 250 V (voltios) y para visualizar el ADN, el gel fue expuesto a un transiluminador de luz UV Las imágenes fueron capturadas mediante una cámara fotográfica y digitalizados con el programa Launch Doc-ItLS (UVP). La secuencia de oligonucleótidos para todas las cepas de geminivirus y las condiciones de PCR se proporcionan en el Cuadro 1.
Cuadro 1 Condiciones de temperaturas de alineamiento y secuencias de iniciadores degenerados AV494/AC1048 para el análisis de PCR de begomovirus.
| Iniciador | Secuencia (5’ → 3’) | Alineamiento °C/ciclos virus |
|---|---|---|
| F: AV494 | GCC(C/T)AT(G/A)TA(T/C)AG(A/G)AAGCC(A/C)AG | |
| R: AC1048 | GG(A/G)TT(A/G/T)GA(G/A)GCATG(T/A/C)GTACATG 55/30 | all geminivirus |
F= iniciador directo; R= iniciador reverso.
Secuenciación enzimática
Tres fragmentos del ADN de Geminivirus amplificados por PCR en gel de agarosa basados en columnas de sílice (EZ-10 Spin Column BS354 DNA Gel Extraction Kit, Bio Basic Inc.), fueron purificados, las muestras se enviaron para la secuenciación enzimática utilizando el método basado en ddNTPs (Sanger et al., 1977) al Laboratorio Nacional de Genómica para la Biodiversidad (LANGEBIO) del Centro de Investigación y Estudios Avanzados del Instituto Politécnico Nacional (CINVESTAV-IPN), Irapuato, Guanajuato, México. Un secuenciador de DNA 3730 XL (Applied Biosystems, Foster City, CA) y un kit Big Dye Terminator 3.1 (Applied Biosystems, Foster City, CA) fueron usados para este propósito. La búsqueda de similitud de secuencia de ADN se realizó utilizando el programa BLAST, comparando los valores que identifican la homología con la información encontrada en las bases de datos del Centro Nacional de Información Biotecnológica (NCBI) (http: //www.ncbi.nlm. nih.gov/BLAST/).
Análisis filogenético
Las secuencias de nucleótidos del amplicón CP representa la región de 668 pb coordinadas en el PHYVV, se compararon con el virus del mosaico dorado Rhynchosia (RhGMV) y el virus chino del tomate (CdTV), usando el método del dendrograma filogenético Neighbor-Joining (Saitou y Nei, 1987), basado en la alineación de secuencias de nucleótidos parciales. Las distancias evolutivas se calcularon utilizando el método Tajima-Nei (Tajima y Nei, 1984). Se realizaron análisis evolutivos en MEGA7 (Kumar et al., 2016).
Resultados y discusión
Identificación de geminivirus
El análisis genético mostró amplicones de 668 pb del gen CP obtenido con una PCR de tres aislados de geminivirus generados al azar (Figura 2). Una vez purificado, se envió el producto amplificado (Figura 3) para la secuenciación y posterior búsqueda de bases de datos utilizando el software BLASTn: la secuencia resultante de 668 pb tenía una coincidencia de identidad 100% con la secuencia de un gen correspondiente del virus de la vena amarilla del chile huasteco ‘HE967672’ en el depósito del Banco de Genes (GenBank) realizado por Rodelo et al. (2013). La secuencia obtenida se depositó en el GenBank del Centro Nacional de Información Biotecnológica (NCBI), con el número de accesión KT022087. PHYVV fue aislado de la variedad Esperanza de soya.
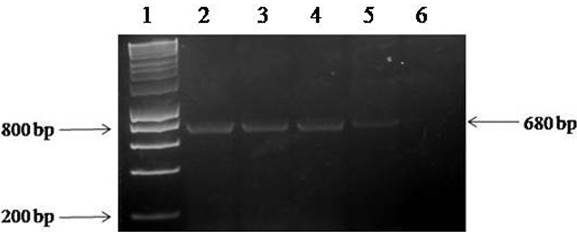
Figura 2 Fragmentos amplificados mediante PCR a partir del ADN extraído de diferentes plantas de soya con síntomas y sin síntomas de infección por begomovirus, usando los iniciadores AV494 y AC1048. Carril 1= HyperLadder 1Kb (Bioline); carril 2= ADN aislado de Begomovirus en plantas de soya sintomáticas (control positivo); carriles 3-5= ADN aislado de geminivirus en plantas de soya sintomáticas; carril 6= control negativo (sin ADN).
Análisis filogenético
Las relaciones filogenéticas del grupo de Begomovirus se investigaron con el método Neighbor-Joining, usando las secuencias del gen CP de RhGMV y CdTV. Este análisis filogenético se muestra en la Figura 4. El análisis de secuencia de KT022087 (PHYVV 1GMES) fue similar a los genes de begomovirus y se diferenciaba claramente de las otras cepas de Begomovirus encontradas en chile y diversos huéspedes (Figura 4). Múltiples alineamientos de secuencia usando el programa CLUSTAL W mostraron que la secuencia de nucleótidos de 1GMES era 100% idéntica a los aislados mexicanos del virus. Dentro de esta región, PHYVV1GMES aislado de soya en Sinaloa exhibió 100% de identidad con aislados de PHYVV en chile en diferentes estados de México. La soya es un refugio temporal para un virus que afecta a especies hortícolas que tienen una gran importancia económica para Sinaloa. Por tanto, es necesario usar variedades resistentes (como Guayparime S-10), así como cumplir con un programa adecuado de manejo de vectores de insectos. Este documento es el primer informe sobre la aparición de PHYVV en la soya en México.
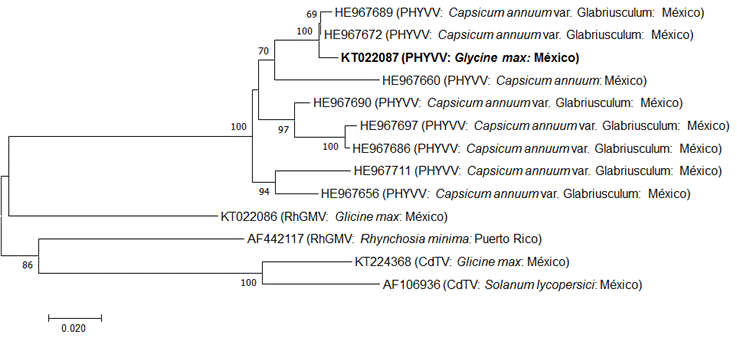
Figura 4 Dendrograma filogenético generado por el método Neighbor-Joining basado en la alineación parcial de secuencias nucleotídicas del gen de proteína de la cápside del PHYVV, con los que fueron seleccionados y aislados los PHYVV, RhGMV y CdTV. Los valores en los nodos representan el porcentaje de núcleos de arranque (1 000 réplicas), sólo se muestran valores ˃50.
Conclusiones
Con base en el análisis de la secuencia nucleotídica de los fragmentos amplificados por medio de la Reacción en Cadena de la Polimerasa, se identificó por primera vez al begomovirus virus de la vena amarilla del chile huasteco infectando plantas de soya en el estado de Sinaloa, México. Este nuevo conocimiento con respecto al PHYVV podría proporcionar información sobre su capacidad para infectar plantas de la familia Solanaceae.











 texto en
texto en 




