Introducción
La familia begoniácea comprende cinco géneros y 920 especies de las cuales la mayoría pertenecen al género Begonia (Mendi et al, 2009; Kabirnataj et al., 2012). El género begonia comprende aproximadamente 2000 variedades y alrededor de 200 especies que han sido introducidas por cultivadores comerciales, entre ellas Begonia tuberhybrida, B. rex, B. semperflorens, Begonia × hiemalis, Begonia × elatior, Begonia × cheimantha y Begonia × socotrana (Takayama, 1982). Las begonias forman parte de nuestras plantas de adorno más bonitas y variadas. La Begonia ha sido, durante años, la primera planta de flor en Europa Central y aunque en la actualidad ya no es tan vendida se mantiene una posición privilegiada entre las 10 primeras comerciales (Rout et al., 2006).
Las begonias son importantes como plantas ornamentales perennes que están distribuidas en las regiones tropicales y subtropicales del mundo. Se emplean en jardinería para la implantación de macizos y bordes y como plantas de maceta. En general, son propagadas por semilla o vegetativamente por esqueje de hoja, rizomas, tubérculos y principalmente por esqueje de hoja con peciolo (Mendi et al., 2009). No obstante, es posible que métodos convencionales de propagación sean problemáticos debido a la rápida aparición de enfermedades. Además, La producción de grandes cantidades de plantas genéticamente homogéneas es también muy difícil.
Begonia elatior, es el producto de la cruza de B. socotrana x B. tuberhybrida y se conoce como B. hiemalis y es considerada como una flor con gran potencial por la gran aceptación en el consumo local, pero con un buen manejo en su comercialización se puede considerar para el mercado internacional. En el mercado nacional es la predominante puesto que las ventas señalan que es de alrededor de 90% y posiblemente su demanda se incremente. Sin embargo, por ser un producto de importación, el costo por esqueje es de 0.45 €, un equivalente aproximado de $10.00 costo que resulta alto. La propagación de Begonia elatior, es importante desde el punto de vista comercial. Ante esta situación, se requiere de un método que permita la obtención de material vegetativo a un bajo costo de producción y con alta calidad.
Para el desarrollo de esta investigación se empleó la micropropagación como una herramienta para la propagación masiva de Begonia elatior. Para el desarrollo de la investigación se escogió como explante al pétalo porque a pesar que las begonias han sido estudiadas por diversos investigadores (Takayama and Misawa,1982; Simmonds y Werry, 1987; Bowes y Curtis, 1991; Nakano et al., 1999; Bouman and Klerk, 2001; Kishimoto et al., 2002; Burritt y Leung, 2003; Espino et al., 2004; Nhut et al., 2005; 2006; Shimada et al., 2007; Mendi et al., 2009; Romocea et al., 2010; Kabirnataj et al., 2012). Existe poca o nula información sobre el cultivo in vitro de pétalo de Begonia elatior como material madre por lo que pensamos que puede ser interesante y barato este tipo de explante sobre todo por la cantidad de flores y pétalos que se tiene en una planta. Además, mediante la micropropagación se puede obtener planta de alta calidad que es una condición necesaria y crítica para los productores (Chebet et al., 2003). Por lo anterior, el presente trabajo se orientó, como método alternativo de propagación masiva de Begonia elatior, el establecimiento de un protocolo para conocer, mediante la manipulación hormonal, el potencial organogenético del pétalo para la generación clonal de plántulas.
Materiales y métodos
La presente investigación se llevó a cabo en el laboratorio de biotecnología (sección de cultivo de tejidos) en el área de agronomía de la Universidad Autónoma Chapingo (UACH), Texcoco, Estado de México y en el laboratorio de embriogénesis perteneciente al área de fruticultura, Instituto de Recursos Genéticos y Productividad del Colegio de Postgraduados-Campus Montecillo.
Como material experimental se emplearon cuatro variedades de plantas de Begonia elatior (‘Heidi’, ‘Clara’, ‘Gloriosa’ y ‘Tacora gee’) que se compraron en el mercado ‘Madre Selva’ delegación Xochimilco, Cd. de México. Las variedades fueron ‘Tacora gel’ (pétalos amarillos), ‘Gloriosa’ (naranja), ‘Heidi’ (rojo) y ‘Clara’ (blanca).
Los pétalos utilizados se extrajeron de flores masculinas (2 a 3 cm) ubicadas en el segundo y tercer piso de la estructura de la planta. Pétalos completos de las cuatro variedades se lavaron, para eliminar el polvo, con agua jabonosa en agua corriente por 30 min y se sumergieron con alcohol al 70% por 20 s, se esterilizaron en hipoclorito de calcio al 4% con dos gotas de tween 20 por 15 min. Los explantes se enjuagaron tres veces con agua bidestilada esterilizada y sembraron en medio de cultivo Murashige y Skoog (1962) suplementado con glicina 0.2 mg L-1, ácido nicotínico 0.5 mg L-1, mío-inositol 100 mg L-1, piridoxina 0.5 mg L-1, tiamina-HCl 0.4 mg L-1, 30 gL-1 de sacarosa, 7.5 gL-1 de agar (sigma) y los reguladores del crecimiento el ácido naftalenacético (ANA) y bencilamino purina (BA) que se adicionaron en combinación y el testigo. El pH del medio de cultivo se ajustó a 5.7 o 5.8 con 0.1N de NaOH ó 0.1N de HCl. El medio de cultivo Murashige y Skoog (MS) se esterilizó en autoclave a 10 kg cm-2 a 120 °C por 15 min. y se sirvió en frascos tipo gerber (20 mL/frasco) con tapas de plástico. Los pétalos se incubaron a una temperatura de 26 °C ± 2 °C con un fotoperiodo de 16 h de luz y 8 h de oscuridad y una intensidad luminosa de 50 µM m-2 s-1 durante todo el experimento.
Establecimiento del inóculo
Pétalos de las cuatro variedades se inocularon en el medio de cultivo MS conteniendo concentraciones y combinaciones de BA y ANA en los tratamientos siguientes: 1) 0 mg L-1 de ANA + 0 mg L-1 de BA; 2) 1 mg L-1 de ANA + 1 mg L-1 de BA; 3) 0.5 mg L-1 de ANA + 2 mg L-1 de BA; 4) 1 mg L-1 de ANA + 2 mg L-1 de BA; y 5) 0.5 mg L-1 de ANA) + 3 mg L-1 de BA.
Multiplicación
Para la micropropagación se emplearon las plántulas regeneradas que se subcultivaron en medio de establecimiento fresco adicionado con las mismas concentraciones de ANA y BA usadas para el establecimiento del explante.
Inducción de la raíz
Para la inducción de la raíz, las plántulas se transfirieron a un medio con el tratamiento 2 (1 mg L-1 ANA+ 1 mg L-1 BA).
Diseño experimental
Se utilizó un diseño experimental completamente al azar, con factorial 45 donde los factores a evaluar fueron: variedad y concentración de reguladores de crecimiento, generándose 20 tratamientos con 10 repeticiones dando como resultado 200 unidades experimentales. Se sembraron dos pétalos por frasco. Los análisis estadísticos para la variable número de brotes, se llevó a cabo con el programa Infostat (Cuadro 1).
Cuadro 1 Muestra factorial: variedad de begonia y concentración de ANA +BA.
| Factor 1 Variedad | Factor 2 concentración de ANA y BA |
|---|---|
| MI = 0 mg L-1 (ANA) + 0 mg L-1 (BA) | |
| C1= Clara | MII = 1 mg L-1 (ANA) + 1 mg L-1 (BA) |
| C2= Heidi | MIII = 0.5 mg L-1 (ANA) + 2 mg L-1 (BA) |
| C3= Gloriosa | MIV = 1 mg L-1 (ANA) + 2 mg L-1 (BA) |
| C4 = Tacora geel | MV = 0.5 mg L-1 (ANA) + 3 mg L-1 (BA) |
Letra C corresponde a las variedades de la flor y la M a la concentración de las hormonas ANA y BA.
Las variables a estudiar fueron las siguientes: tiempo de formación y el porcentaje de callos, número promedio de pétalos con brotes por variedad, número de brotes promedio por pétalo, días para formación de raíces. Todas las evaluaciones se realizaron cada 15 días
Resultados y discusión
Formación de callo
La formación de callo se presentó en la base del pétalo a los 120 días después de la siembra. Los tratamientos que dieron positivo para la formación de callo fueron el 2 (1 mg L-1 (ANA + 1 mg L-1 de BA) y el tratamiento 4 (1 mg L-1 de ANA) + 2 mg L-1 de BA). En la variedad ‘Heidi’ el valor fue, en promedio, de 57.2% y en el tratamiento 4 un 22%; en ‘Gloriosa’, en el tratamiento 4 (1 mg L-1 (ANA) + 2 mg L-1 de BA), se obtuvo un porcentaje promedio de 46 (Figura 1). El tratamiento 2 concuerda con Datta (2002) quien reportó, en estudios llevados a cabo en Rosa sp., que el desarrollo de callos a partir de explantes de pétalo en siete cultivares (Contempo, America’s Junior Miss, Manasi, Mrinalini, Preyasi, Sylvia y Queen Elizabeth), fue satisfactorio, para la formación de callos, en medio MS con 1 mg L-1 de ANA y 1 mg L-1 de BA.
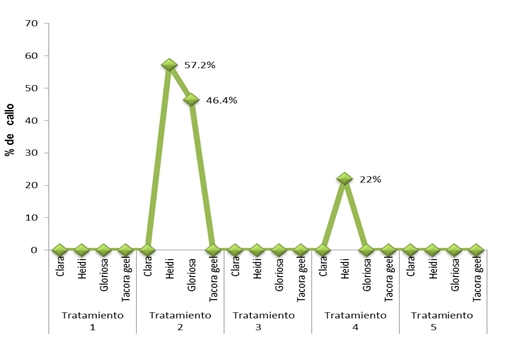
Figura 1 Formación de callo de pétalos expresado en porcentaje de cuatro variedades de Begonia elatior cultivadas en los tratamientos 2 y 4 de BA/ANA en medio MS.
Los resultados indican que no se tuvo éxito con las variedades ‘Tacora geel’ y ‘Clara’ en ningún tratamiento. Esta variación de no formación de callo, de acuerdo con Bonga (1987), puede atribuirse a la distinta capacidad de regeneración o sensibilidad de los pétalos y que ello está dependiendo de la madurez del explante (pétalo) en relación a las concentraciones de ANA y BA.
Número de pétalos con brote
La Figura 2 muestra las variedades que generaron brotes adventicios. Se observó, que en las variedades ‘Clara’ y ‘Tacora gel’ no hubo algún tipo de respuesta organogénica. En contraste, en la variedad ‘Heidi’ en el tratamiento 2 (1 mg L-1 de ANA+ 1 mg L-1 de BA), 20 pétalos mostraron respuesta, además, la misma variedad en el tratamiento 4 (1 mg L-1 ANA + 2 mg L-1 BA) presentó 12 pétalos con brotes adventicios. La variedad ‘Gloriosa’, en el tratamiento 2 (1 mg L-1 de ANA+ 1 mg L-1 de BA), 16 pétalos mostraron respuesta organogénica.
Número de brotes por pétalo
La obtención de brotes, mediante organogénesis indirecta, se inició en la zona de inserción de los pétalos con el receptáculo entre los 60 y 65 días después de la siembra. En la variedad ‘Heidi’, la formación de brotes empezó a los 65 días en el tratamiento 2 (1 mg L-1 ANA+ 1 mg L-1 BA) obteniéndose un promedio de 13.2/pétalo y 105 días en el tratamiento 4 (1 mg L-1 ANA + 2 mg L-1 BA) generando un promedio de 1.63/pétalo (Figura 3). Por lo tanto, existe una diferencia significativa entre ambos tratamientos. En el caso de la variedad ‘Gloriosa’, la brotación se observó a los 60 días únicamente en el tratamiento de 1 mg L-1 ANA+ 1 mg L-1 BA con un promedio de 8.4/pétalo (Figura 3). De acuerdo a los resultados obtenidos, la multiplicación se logró en el tratamiento 2 con la concentración de 1:1 en la relación BA/ANA.
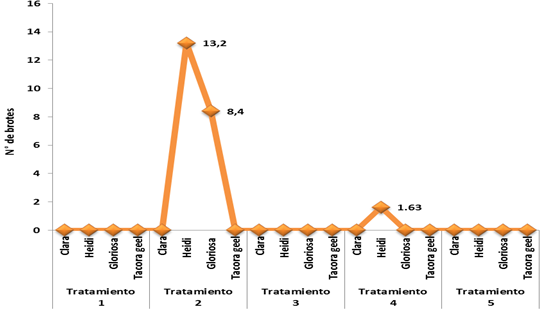
Figura 3 Efecto de combinación del ácido α-naftaleno-acético (ANA) y benciladenina (BA) sobre el número de brotes/pétalo de las cuatro variedades. Los datos están expresados en porcentaje promedio de diez repeticiones.
Teóricamente esa proporción debiere de ser formación de callo, pero en esta investigación, además de producir callo, se indujo la generación de brotes, se puede suponer que la respuesta está directamente relacionada con una concentración endógena de la citocinina en el explante. Usualmente se requiere una concentración alta de citocininas que combinadas con una auxina se tiene resultados más efectivos en el caso del genero Begonia (Takayama y Misawa, 1982). Mendi (2009) considera que la combinación 1 mg L-1 ANA+ 1 mg L-1 BA produce una baja regeneración y que pudiese ser causada por un efecto antagónico del ANA sobre la BA pues considera que 1 mg L-1 de ANA es alto para hoja y pedicelo.
En contraste, Pierik y Tetteroo, (1987) indujeron brotación en inflorescencias (yemas florales), no pétalos, empleando la concentración de 0.5 mg L-1 tanto para BA como para ANA (1:1). Rosna et al. (2009) en peciolo y Asmah Awal et al. (2013), empleando inflorescencias jóvenes y pedúnculos como material experimental, promovieron la formación de brotes con el tratamiento de 1 mg L-1 ANA+ 1 mg L-1 BA con la adición al medio MS de 40 mg L-1 de adenina. Estos resultados con sacarosa avalan que la combinación 1 mg L-1 ANA+ 1 mg L-1 BA (1:1) es apropiada para la inducción de la organogénesis indirecta de brotes adventicios y por consecuencia para la multiplicación en pétalos de Begonia elatior.
Se debe consignar, que durante el desarrollo de la investigación se observó un aspecto que se considera conveniente mencionar. Se refiere a los brotes provenientes de pétalos de las variedades ‘Heidi’ y ‘Gloriosa’ sembrados en el tratamiento 2, en los cuales se obtuvo la formación de yemas florales que en algunos casos se desarrollaron hasta la formación de la flor (Figura 4a y 4b). En este sentido se hace necesario señalar que el pétalo es susceptible de generar, a través de la organogénesis, yemas florales. Al respecto, Awal et al. (2013) obtuvo la formación de flores al cultivar yemas florales y pedúnculos plantas de Begonia elatior en medio MS complementado ANA y BA en concentración con 1 mg L-1 ANA+ 1 mg L-1 BA (1:1), pero agregó adenina (40 mgL-1). Considera que es posible que la concentración de la sacarosa pueda inducir el proceso de la formación del brote floral, sin definir la concentración óptima. Nguyen et al. (2006) determinaron que el proceso de formación de yemas florales se debe a la relación sacarosa y citocininas lo cual permite la inducción de la floración en el sistema Begonia.

Figura 4 a) generación de brote yema floral de la var. ‘Gloriosa’ en medio MS suplementado con ANA y BA (flecha); y b) desarrollo del botón floral de la var. ‘Heidi’ in vitro.
En general, la sacarosa se utiliza con frecuencia como fuente de carbono para estudios in vitro con flores. Takimoto (1960) afirmó que las plantas que producen pequeñas cantidades de clorofila podían tener la capacidad para generar la formación de brotes florales con independencia de las condiciones de luz y que la sacarosa exógena puede sustituir el requisito de alta intensidad de la luz. Se presupone, que la iniciación floral in vitro puede requerir de un período de incubación largo de oscuridad y la presencia de sacarosa, además de las hormonas. Jumin and Nito (1996) en Fortunella hindsii y Kachonpadungkitti et al. (2001) en Fagopyrum esculentum, concluyeron que la sacarosa tiene efecto sobre la inducción de brotes florales. Zhang et al. (2008) mencionó que en, Perilla frutescens, la presencia de sacarosa, a partir de cultivos de inflorescencia, induce la formación de yemas florales. Cabe mencionar que esta es la primera vez que se hace mención que a partir de pétalos de Begonia elatior se puede obtener, por un lado, plántulas y por otro, la posibilidad de inducir la formación de yemas florales y la floración in vitro.
Formación de raíz
La rizogénesis fue inducida solamente en la variedad ‘Heidi’ (Figura 5) a los 90 días después de la siembra, en el medio MS en el tratamiento 2 (1 mg L-1 ANA+ 1 mg L-1 BA). Las plántulas de la var. ‘Heidi’ desarrollaron raíces de aproximadamente, en promedio, 1.5 cm de longitud.
Conclusiones
Se cumplió con el objetivo principal de conocer si los pétalos son capaces de desdiferenciarse y sufrir una rediferenciación al lograr la obtención de plántulas.
La organogénesis o la obtención de brotes adventicios es factible a partir de callo derivado del pétalo en las dos concentraciones de BA y ANA usadas en el experimento (1 mg L-1 ANA+ 1 mg L-1 BA y 1 mg L-1 ANA + 2 mg L-1 BA).
Para la inducción del callo se requieren de BA y NAA en una concentración de 1 mg L-1 ANA+ 1 mg L-1 BA.
El cultivo de tejidos mediante cultivo de pétalos de Begonia elatior, puede mejorar la propagación ornamental para lograr una producción de bajo costo.
El enraizamiento de las plántulas se obtiene en el medio de multiplicación con 1 mg L-1 ANA+ 1 mg L-1 BA.
El factor color de pétalo debe ser estudiado para conocer si afecta la organogénesis puesto que no todas las variedades produjeron plántulas. Aparentemente la organogénesis se produce en colores intensos como el rojo y naranja. Los colores claros (amarillo y blanco) no mostraron indicios de organogénesis.
Otro factor que requiere de estudio es determinar si las citocininas y la sacarosa son o no inductores de la formación de yemas florales en el cultivo in vitro de pétalos de Begonia elatior.











 texto em
texto em 




