Introducción
El chile piquín se reconoce como el ancestro más cercano de la variedad cultivada, es de ocurrencia natural y amplia distribución en México. El fruto se recolecta y genera ingresos importantes durante el acopio. El aprovechamiento comercial de chile piquín se ha explorado bajo diversos criterios agronómicos con poco éxito, debido a la variación fenotípica y genotípica, lo que reduce el establecimiento ecológico y cultivo de la planta (Vázquez-Dávila, 1996; Ramírez-Meraz et al., 2003; Rodríguez del Bosque et al., 2003).
En México existe gran variabilidad de chiles en forma, tamaño, color, sabor y picor, con una distribución desde el nivel del mar hasta los 2 500 m de altura (Hernández-Verdugo et al., 1999). El chile piquín silvestre [Capsicum annuum L. var. glabriusculum (Dunal) Heiser y Pickersgill], se distribuye desde el sur de EE. UA hasta casi todo México, Centro y Sudamérica. En México se encuentra desde Sonora hasta Chiapas por el litoral del Pacífico y de Tamaulipas a Yucatán por la franja costera del Golfo de México, aunque desarrolla en mayor grado desde la Huasteca Tamaulipeca, localizada al sur de Tamaulipas, hacia el centro-norte del mismo estado, así como hacia San Luis Potosí y Nuevo León, en altitudes desde nivel del mar a los 600 m de altura. Esta localización geográfica variacional, le ha conferido al chile piquín una amplitud genética y usos diversos, aunque destaca como recurso natural de gran importancia para las comunidades rurales del noreste de México (Laborde y Pozo, 1982; Hernández-Verdugo et al., 2001; Medina et al., 2001; Villalón et al., 2002; Rodríguez del Bosque et al., 2004).
Los parientes silvestres de las plantas cultivadas son un recurso genético importante que constituye un acervo de genes primario, lo cual puede ayudar a resolver problemas de la agricultura actual, tales como tolerancia o resistencia a plagas y enfermedades y aumentar la calidad y cantidad de la producción (Hernández-Verdugo et al., 1998). En este sentido, el conocimiento de la variación morfológica y sus patrones de distribución geográfica es de interés para comprender la evolución de las especies vegetales locales, su fenotipo, posible utilización y trabajar en su conservación (Solís-Neffa, 2010).
Entre los factores geográficos que influyen en la diferenciación de las poblaciones están el clima, latitud y altitud. El clima es uno de los principales factores que afectan la distribución y variación de las especies vegetales, debido a que puede actuar directamente en los procesos fisiológicos del crecimiento y reproducción o indirectamente; a través, de interacciones ecológicas, como la competencia por recursos (Shao y Halpin, 1995).
Para localizar los lugares con posibilidad de encontrar el chile piquín, se deben tener algunas referencias sobre las características del entorno donde habitan. Las plantas de chile silvestre (C. annuum var. glabriusculum), conocidas comúnmente como chiles ‘chiltepines’ o ‘piquines’ son perennes, herbáceas o trepadoras, los frutos son pequeños, rojos al madurar y picantes. Las plantas de chile piquín generalmente se asocian a vegetación nativa, desde plantas arbustivas en submontañas y bosque de montaña, hasta matorrales y cactáceas de zonas áridas.
En ambientes áridos también se localizan sobre cauces secos de ríos o arroyos, sitios no alterado de selva baja caducifolia, orillas de los caminos, huertos, potreros y bajo vegetación remanente a orillas de campos agrícolas (Hernández-Verdugo et al., 1999; Medina et al., 2001; Medina et al., 2002; Villalón et al., 2002; Medina et al., 2006). Aunque se han llevado a cabo algunos esfuerzos, el chile piquín es el único chile que no ha podido ser domesticado (Bañuelos et al., 2008). De este modo, la especie silvestre es una fuente importante de genes para el fitomejoramiento a través de la ingeniería genética (González-Cortés et al., 2015).
En base a lo anterior, el objetivo de este estudio fue caracterizar morfológicamente 11 poblaciones de chile piquín de la Sierra Gorda de los estados de Querétaro y Guanajuato.
Materiales y métodos
Colecta de poblaciones
Se recolectaron muestras de fruto de 11 poblaciones de chile piquín de cuatro municipios de Querétaro y uno de Guanajuato (Cuadro 1) pertenecientes a la sierra gorda de Querétaro y Guanajuato (Figura 1). Se realizaron recorridos por los diferentes puntos con antecedentes de existencia de estas plantas. En cada población se seleccionaron plantas sanas y de buen porte, con frutos maduros y tratando que fueran uniformes en su tamaño, se registró la ubicación geográfica del lugar de recolección por medio de sistema de posicionamiento global (GPS). Además, se realizó una encuesta a algunos recolectores y habitantes de la región, sobre las características distintivas e importantes para ellos de los frutos que utilizan.
Cuadro 1 Poblaciones de chile piquín utilizadas en el estudio y su lugar de procedencia.
| Población | Estado | Altitud (m) | Lugar de colecta | Municipio | |
|---|---|---|---|---|---|
| 1 | Q1 | Qro. | 912 | El Refugio (El Chilar) | Arroyo Seco |
| 2 | Q2 | Qro. | 1024 | El Refugio (solar-huerta) | Arroyo Seco |
| 3 | Q3 | Qro. | 870 | Tancoyol (carretera a Tancoyol) | Jalpan de Serra |
| 4 | Q4 | Qro. | 1120 | San Antonio Tancoyol | Jalpan de Serra |
| 5 | Q5 | Qro. | 680 | Presa Jalpan | Jalpan de Serra |
| 6 | Q6 | Qro. | 1588 | Higuerillas (El Shote) | Cadereyta de Montes |
| 7 | Q7 | Qro. | 1833 | El Patol | Tolimán |
| 8 | Q8 | Qro. | 1504 | Higuerillas (arroyo) | Cadereyta de Montes |
| 9 | G1 | Gto. | 1300 | El Tanque | Xichú |
| 10 | G2 | Gto. | 1300 | Palmitas (El Tanque) | Xichú |
| 11 | G3 | Gto. | 1460 | Rosa de Castilla | Xichú |
Establecimiento de plantas en invernadero
La caracterización morfológica se llevó a cabo en las instalaciones de Instituto Tecnológico de Roque (ITR) ubicado en Celaya, Guanajuato, México que de acuerdo con datos del Google Earth se localiza a los 20° 32’ 05’’ de latitud norte y 100° 50’ 00’’ de longitud oeste a una altitud de 1 752 m. El clima de esta región es semi cálido con una precipitación media anual de 400 a 700 mm. El régimen térmico es de 18 a 20 °C. Los suelos son de tipo vertisol pelico, que se caracterizan por ser arcillosos de coloración oscura (García, 1973).
Una vez obtenidas las colectas en el campo, se extrajo de los frutos la semilla y se acondicionaron para realizar la producción de plántulas en invernadero, para ello se hizo una siembra en charolas de unicel de 200 cavidades y como sustrato se utilizó ‘Peat Moss Turba de Sphagnum’ PREMIER®. Cuando las plántulas alcanzaron una altura promedio de 10 a 15 cm se trasplantaron en bolsas plásticas de 40 x 40 cm con capacidad de 15.14 litros, usando como sustrato suelo agrícola común (textura: arena 17.48%, arcilla 25.8% y limo 56.72%) y se ubicaron dentro de un invernadero de plástico de mediana tecnología. La aplicación de fertilizantes fue en el agua de riego, diluyendo 20 g de N, 10 g de P y 20 g de K por cada 100 litros de agua, como fuente de N se usó urea; MAP para el P y nitrato de potasio para K (Rodríguez del Bosque et al., 2004). Aplicándose una vez por mes para maximizar el desarrollo de la planta.
Caracterización morfológica
En las etapas de plántula, floración y madurez de fruto se registraron los datos morfológicos; una vez que los frutos alcanzaron la madurez fueron cosechados y se extrajo la semilla para posteriormente caracterizarlas. La caracterizacion se realizó de acuerdo con los descriptores recomendados por el Instituto Internacional de Recursos Fitogenéticos (IPGRI, AVRDC y CATIE, 1995). Se realizó la descripción para cada población de chile piquín considerando los siguientes caracteres:
En plántula se determinó, color de hipocótilo (CDH), pubescencia de hipocótilo (PDH), color de hoja cotiledónea (CHC), forma de hoja cotiledónea (FHC), longitud de hoja cotiledónea (LHC) y ancho de hoja cotiledónea (AHC). En planta se registró: ciclo de vida (CV), color del tallo (CT), antocianina del tallo (AT), forma del tallo (FT), pubescencia de tallo (PT), altura de planta (A), habito de crecimiento (HC), ancho de la planta (AP), macollamiento (M), densidad de hojas (DH), color de hoja (CH), forma de hoja (FH), pubescencia de hoja (PH), longitud de hoja madura (LHM), ancho de la hoja (AH). En inflorescencia se midió; número de días a floración (NDF), numero de flores por axila (NFA), posición de la flor (PDLF), color de las anteras (CA), color del filamento (CF). En fruto; días a fructificación (DF), manchas o rayas antocianínicas (MRA), periodo de fructificación (PDF), forma del fruto (FF), color del fruto maduro (CFM), longitud de fruto (LF), ancho de fruto (AF), peso de fruto (PF), longitud del pedicelo (LP), forma del fruto en la unión con el pedicelo (FFUP), cuello en la base del fruto (CBF), forma del ápice del fruto (FAF) y finalmente, en semilla se registraron las siguientes características; color de la semilla (CS), superficie de la semilla (SS), tamaño de la semilla (TS), diámetro de semilla (DS), peso de mil semillas (PMS) y numero de semillas por fruto (NSF).
Análisis de los datos
Los datos morfológicos se sometieron a un análisis multivariado, el cual incluyó el uso de componentes principales (ACP) y análisis de conglomerados (AC), para ello se utilizó el paquete estadístico SAS® Ver. 9.0 (SAS Institute, 2002).
Resultados y discusión
Análisis de componentes principales (ACP)
En el Cuadro 2 se muestran los resultados del análisis de componentes principales (ACP) para la caracterización morfológica de 11 poblaciones de chile piquín de los estados de Querétaro y Guanajuato, en donde se muestra que tres componentes principales (CP) explican 56.6% de la variabilidad total que existe entre las poblaciones de chile piquín; en este sentido, el CP1 explica el 25.6%, el CP2, 17.5% y CP3, 13.4% de esta variabilidad total. En este contexto, el CP1 es explicado por las características de peso (0.326), ancho (0.301) y longitud de fruto (0.271), densidad de hoja (0.277) y diámetro de semilla (0.297). En el CP2, las variables que más contribuyeron para la expresión de la variación fueron el ancho (0.329) y pubescencia de hoja (0.317) y finalmente, en el CP3 las variables que más importantes fueron la forma del fruto (0.344) y color de las anteras (-0.308).
Cuadro 2 Vectores característicos de las variables de mayor valor descriptivo, respecto a su componente principal en 11 poblaciones de C. annuum de Querétaro y Guanajuato.
| Variable | Vector característico | ||
|---|---|---|---|
| CP1 | CP2 | CP3 | |
| Peso de fruto | 0.326* | 0.058 | -0.051 |
| Ancho de fruto | 0.301* | 0.128 | -0.089 |
| Diámetro de semilla | 0.297* | 0.113 | 0.063 |
| Densidad de hojas | 0.277* | 0.052 | 0.157 |
| Longitud de fruto | 0.271* | 0.048 | -0.203 |
| Ancho de hoja | 0.1 | 0.329* | 0.114 |
| Pubescencia de hoja | -0.038 | 0.317* | 0.046 |
| Forma del fruto | -0.018 | 0.03 | 0.344* |
| Color de las anteras | 0.058 | -0.05 | -0.308* |
| Valor característico | 8.73 | 5.96 | 4.57 |
| Proporción de la varianza (%) | 25.6 | 17.5 | 13.4 |
| Proporción de la varianza acumulada (%) | 25.6 | 43.2 | 56.6 |
*= mayor valor descriptivo.
En la Figura 2 se presenta la diversidad de las variables entre las poblaciones de chile piquín estudiadas, en donde se aprecia que el peso de fruto (PF), ancho de fruto (AF), diámetro de semilla (DS), densidad de hojas (DH), longitud de frutos (LF), peso de mil semillas (PMS), ancho de hoja (AH), pubescencia de hoja (PH), color de hipocotilo (CH), forma del fruto (FF) y color de las anteras (CA), son las características que más contribuyen en la variabilidad entre las poblaciones. Estos resultados son similares a los obtenidos por Kadri et al. (2009) quienes realizaron un estudio con 48 poblaciones de Capsicum annuum en Turquía, donde obtuvieron que los primeros seis componentes principales (CP) explicaron 54.3% del total de la variación, además concluyeron que el CP1 se conformó por las variables de fruto y el CP2 por variables de longitud de fruto y pedicelo.
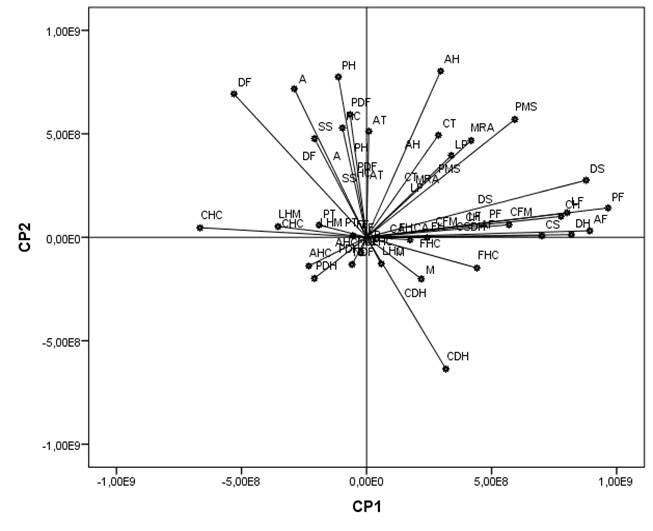
Figura 2 Distribución de la variabilidad morfológica basada en 44 características en 11 poblaciones de chile piquín de Querétaro y Guanajuato.
De la misma manera, Toledo (2010) en un estudio de diversidad morfológica en variedades nativas de chile poblano, concluyó que el peso y color de fruto son características importantes en la diversidad fenotípica. En este tópico, Narez-Jiménez et al. (2014) en su estudio de diversidad morfológica in situ de chiles silvestres en el estado de Tabasco encontró que CP1 explicó 43.61% de la variación total y es explicado por variables de fruto. Otro estudio reportado por Pardey et al. (2006) afirman que la variabilidad entre poblaciones de chile es dada por características del fruto, de arquitectura de planta, estructura de flores y número de flores por axila.
Otras investigaciones afirman que el color y forma del fruto en estado maduro han mostrado importancia en la clasificación de diversas colectas de C. annuum en varias regiones del país (Corona, 2000; Hernández, 2000; Martínez, 2000; Pérez, 2000; Morán-Bañuelos, 2003), además se ha concluido que la variación en estas características es distintiva de esta especie (Hernández et al., 1999; De, 2003). Del mismo modo, Toledo (2010) señala que en variedades nativas de chile poblano la variación total fue explicado por variables con relación a calidad del fruto; asimismo, Moreno-Pérez et al. (2007) en estudios de diversidad morfológica en chile guajillo halló variación en características de longitud y ancho de hoja, así como longitud del peciolo; mientras que Morán (2008) en un estudio de 43 poblaciones de chiles criollos del sur de Puebla concluyó que existe fuerte variabilidad en caracteres vegetativos, como el hábito de crecimiento y tamaño de hojas.
Observando las medias resultantes de cada una de las características que más aportaron a la variabilidad en todas las poblaciones, se obtuvo que el mayor peso de fruto (0.211 g) fue para G1 (El Tanque) y la de menor peso (0.072 g) resulto la población Q2 (El Refugio solar- huerta), para ancho de fruto la población G1 (El Tanque) obtuvo el mayor valor (0.70 cm) y Q3 (Tancoyol carretera a Tancoyol) el menor (0.45 cm); en diámetro de semilla, el genotipo G1 (El Tanque) obtuvo el mayor diámetro (3.18 mm) y Q6 (Higuerillas El Shote) obtuvo el menor valor (2.52 mm); en la densidad de hojas, la mayoría de las poblaciones de Querétaro [Q2 (El Refugio solar-huerta), Q4 (San Antonio Tancoyol), Q5 (Presa Jalpan), Q6 (Higuerillas El Shote), Q8 (Higuerillas arroyo)] estuvieron en el rango de densidad intermedio (5), mientras que las poblaciones de Guanajuato [G1 (El Tanque), G2 (Palmitas El Tanque), G3 (Rosa de Castilla)] y la población Q7 (El Patol, Qro.) para el rango denso (7) y las poblaciones Q1 (El Refugio El Chilar) y Q3 (Tancoyol carr. a Tancoyol) resultaron en el rango de densidad escasa (3).
Para longitud de fruto, destacó nuevamente la población G1 (El Tanque) con la mayor longitud (1.22 cm) y Q2 (El Refugio solar- huerta) con el valor más bajo (0.64 cm); en ancho de hoja Q7 (El Patol) obtuvo el mayor resultado (3 cm) y Q2 (El Refugio solar-huerta) la menor respuesta (1.3 cm); por otro lado, la mayoría de las poblaciones [Q1 (El Refugio El Chilar), Q3 (Tancoyol carr. a Tancoyol), Q6 (Higuerillas El Shote), Q7 (El Patol), G1 (El Tanque) y G2 (Palmitas El Tanque)] presentaron una pubescencia de hoja en el rango intermedio (5), mientras que Q2 (El Refugio solar-huerta), Q4 (San Antonio Tancoyol), Q8 (Higuerillas arroyo) y G3 (Rosa de Castilla) mostraron pubescencia escasa (3) y únicamente Q5 (Presa Jalpan) fue consistente con pubescencia densa (7); para la forma de fruto, todas las poblaciones resultaron casi redondo (2) excepto Q4 (San Antonio Tancoyol) que presentó forma de fruto elongado (1), para el color de las anteras las poblaciones de Guanajuato G1 (El Tanque), G2 (Palmitas el Tanque), G3 (Rosa de Castilla) y algunas de Querétaro [Q1(El Refugio El Chilar), Q2 (El Refugio solar-huerta), Q3 (Tancoyol carretera a Tancoyol), Q4 (San Antonio Tancoyol), Q5 (Presa Jalpan) presentaron anteras de color morado (5), mientras que las poblaciones Q6 (Higuerillas El Shote), Q7 (El Patol) y Q8 (Higuerillas arroyo) anteras color azul.
Los resultados de esta investigación son similares a los de Hernández-Verdugo et al. (2012) quienes estudiaron 19 poblaciones de C. annuum silvestre y encontraron diferencias significativas en todas las características registradas (altura de planta, longitud de rama, diámetro de tallo y longitud de pedúnculo). También, Murillo-Amador et al. (2015) en su estudio muestran una alta variabilidad morfométrica entre las poblaciones de C. annuum silvestre en tres sitios cerca de dos reservas de la biosfera en Baja California Sur, México y comentan que la diversidad fenotípica y sin duda la diversidad genética del Capsicum silvestre en cada una de estas poblaciones se ven afectadas por la geografía, el clima, la ecología y la intervención humana.
Análisis de correlación
Al correlacionar el peso de fruto (PF) con las variables morfológicas destacadas y con los componentes principales (Cuadro 3) se observan correlaciones positivas y significativas con el ancho de fruto (0.94), diámetro de semilla (0.79), densidad de hojas (0.74), longitud de fruto (0.87) y color de Hoja (0.8), para el ancho de hoja (0.46) y pubescencia de hoja (0.12) se mostró una correlación positiva pero baja. Por otro lado, el CP1 presentó una correlación fuerte y positiva con el peso de fruto (0.96), ancho de fruto (0.89), diámetro de semilla (0.87), densidad de hojas (0.81) y longitud de fruto (0.8). El CP2 se correlacionó fuerte y positivamente con el ancho de hoja (0.8) y pubescencia de hoja (0.77); mientras que el CP3 mostró baja correlación y negativa en la longitud de fruto (-0.43) y color de hoja (-0.31) pero baja y positiva en la densidad de hojas (0.33).
Cuadro 3 Correlación de variables con componentes principales de 11 poblaciones de C. annuum de Querétaro y Guanajuato.
| PF | AF | DS | DH | LF | CH | AH | PH | |
|---|---|---|---|---|---|---|---|---|
| PF | 1 | 0.94 | 0.79 | 0.74 | 0.87 | 0.8 | 0.46 | 0.12 |
| CP1 | 0.96 | 0.89 | 0.87 | 0.81 | 0.8 | 0.77 | 0.29 | -0.11 |
| CP2 | 0.14 | 0.31 | 0.27 | 0.12 | 0.11 | 0.1 | 0.8 | 0.77 |
| CP3 | -0.1 | -0.19 | 0.13 | 0.33 | -0.43 | -0.31 | 0.24 | 0.09 |
CP1= componente principal 1; CP2= componente principal 2; CP3= componente principal 3; PF= peso de fruto; AF= ancho de fruto; DS= diámetro de semilla; DH= densidad de hojas; LF= longitud de fruto; CH= color de hoja; AH= ancho de hoja; PH= pubescencia de hoja.
En este sentido, García (2006) reportó correlaciones en caracteres de ancho, peso y longitud de fruto, como aquellas variables que más contribuyen en el primer componente. El alto valor de correlación puede indicar redundancia en la información; es decir, que evaluando solo uno de los caracteres altamente correlacionados no se pierde información global sobre la variación presente en el grupo, economizando tiempo y dinero. Sin embargo, el alto índice de correlación entre caracteres también se puede asociar con elevado grado de relación dentro del grupo (Roa, 1997).
Análisis de conglomerados
El análisis de conglomerados (AC) se presenta en la Figura 3, en donde se observa la formación de cuatro grupos, el grupo I incluyo las poblaciones G3 (Rosa de Castilla), G2 (Palmitas El Tanque), G1 (El Tanque), todas poblaciones pertenecen a la región de la Sierra Gorda en Guanajuato. El grupo II, solo se conformó de la población Q7 (El Patol, Querétaro). El grupo III lo constituyó sólo la población Q5 (Presa Jalpan, Querétaro) y finalmente, el grupo IV se integró por seis poblaciones del Estado de Querétaro Q4 (San Antonio Tancoyol), Q8 (Higuerillas arroyo), Q6 (Higuerillas El Shote), Q2 (El Refugio solar-huerta), Q3 (Tancoyol carretera a Tancoyol) y Q1 (El Refugio El Chilar.
Por otro lado, en la relación entre los grupos generados se puede observar la asociación del grupo I y grupo II; que son poblaciones de Guanajuato (G1), (G2) y (G3) y Querétaro (Q7) estas poblaciones se localizan cerca geográficamente. Otra asociación entre grupos resulto el grupo III y grupo IV, en donde la población Q5 se asoció con las poblaciones Q4, Q8, Q6, Q2, Q3 y Q1. Además, se observó la formación de dos grandes asociaciones, la primera con poblaciones exclusivamente de Querétaro y otra con poblaciones de Guanajuato y una población de Querétaro. Por otro lado, las poblaciones que integran al grupo I presentan características de longitud de hoja cotiledonea (LHC) en el grupo II, lo distinguen el color de tallo (CT) y pubescencia de tallo (PT); en el grupo III las poblaciones presentaron menor ancho de planta (AP), mayores días a floración (DF) y mayor periodo de fructificación (PDF) y en el grupo IV destacaron poblaciones con características de antocianina del tallo (AT) y manchas o rayas antocianinicas (MRA) menores.
Las poblaciones Q6 (Higuerillas El Shote) y Q8 (Higuerillas arroyo) fueron muy similares en sus características, pero las características de fruto fueron las más importantes, además provienen de comunidades cercanas geográficamente. Resultados similares fueron reportados por Pardey (2008) quien realizó una caracterización de accesiones de Capsicum y el análisis de conglomerados agrupó poblaciones con características asociadas con el fruto. El mismo autor afirma la conformación de los diversos grupos con materiales provenientes de una misma área geográfica. Por otro lado, las poblaciones Q7 (El Patol) y Q5 (Presa Jalpan), presentaron la mayor divergencia, debido probablemente a que son la mayor (1833) y la menor (680) altitud (msnm) de todas las poblaciones.
Los grupos generados permiten observar que las poblaciones de Guanajuato (1 300- 1 460 msnm) tienen relación y/o cercanía a una sola de las poblaciones de Querétaro, el Patol (1 833 msnm), la cual se caracteriza por tener la mayor altitud de todas las poblaciones observadas. En este sentido, Hernández-Verdugo et al. (2012) mencionan que en poblaciones de C. annuum var. glabriusculum, la correlación entre la variación morfológica y los factores climatológicos como la temperatura y la cantidad de agua disponible por las plantas permiten diferenciar las poblaciones.
Conclusiones
Se encontró variabilidad morfológica entre y dentro de las poblaciones de chile piquín de Querétaro y Guanajuato; por lo que existe diversidad en estas poblaciones, lo cual puede servir de guía para posteriores estudios.
El análisis de componentes principales permitió explicar 56.6% de la diversidad morfológica entre las poblaciones estudiadas con base en tres de ellos.
Las características que influyeron en mayor proporción en la explicación de la variación total entre las poblaciones fueron las relativas al fruto y a la hoja.
Con base a las variables registradas es posible diferenciar las poblaciones dependiendo de su origen geográfico.











 texto en
texto en 




